Introducción
Se estima que solo un número reducido de plantas vasculares (2 %) forman ectomicorriza (Dickie et al., 2013), con aproximadamente 20-25 mil especies de hongos de diversos clados fúngicos (Comandini et al., 2012; van der Heijden et al., 2015). La simbiosis ectomicorrízica, es un componente esencial en la mayoría de las comunidades vegetales que conforman los bosques templados, boreales, tropicales y subtropicales, dado que realizan un importante papel en el crecimiento y supervivencia de plantas hospederas, a través de una mayor absorción de nutrimentos y agua (Smith y Read, 2008), a cambio, el hongo ectomicorrízico (EcM) recibe carbono fotosintéticamente fijado por la planta hospedera (Treseder y Lennon, 2015; van der Heijden et al., 2017). Mucha de la sucesión vegetal forestal, establecimiento y rehabilitación de ecosistemas forestales, han sido ligados a la disponibilidad de esporas y esclerocios producidos por una amplia gama de hongos EcM (Garibay-Orijel et al., 2013). Las especies fúngicas responden al estrés ambiental ocasionado por periodos secos y temperaturas extremas, a través de la formación de esclerocios, los cuales contienen sustancias de reserva y agua (Amasya et al., 2015; Matsuda et al., 2015). Cenococcum geophilum Fr. es un complejo de especies crípticas (especies estrechamente relacionadas con una variación genética significativa, inclusive dentro de comunidades forestales análogas), la cual se caracteriza por producir estas estructuras de resistencia (Jany et al., 2002; Chen et al., 2007; Douhan et al., 2007). Cenococcum geophilum es el hongo EcM dentro de la clase Dothideomycetes, cuyo genoma fúngico se considera el de mayor tamaño (178 Mb), resultado de su alto contenido en secuencias repetidas (81 %) compuestas principalmente de elementos transponibles; secuencias de ADN que podrían explicar el éxito de C. geophilum para colonizar un amplio rango de hospederos y hábitats, debido a que estos elementos contribuyen a la plasticidad y adaptación de los hongos a su entorno (Peter et al., 2016); de tal forma que este simbionte fúngico se ha reportado como abundante bajo condiciones de estrés hídrico y suelos erosionados (Chen et al., 2007; Herzog et al., 2012; Obase et al., 2016; Peter et al., 2016). Por lo que, se ha sugerido que genera resiliencia con más de 200 especies vegetales con las que se asocia (40 géneros entre angiospermas y gimnospermas), las cuales se desarrollan bajo condiciones restrictivas de agua (LoBuglio, 1999; Douhan et al., 2007; Tedersoo et al., 2010), tal es el caso de especies del género Pinus (Jany et al., 2002; Matsuda et al., 2009). Se ha mencionado, que la producción de melanina, pigmento que le da el color oscuro a C. geophilum, es un importante rasgo funcional que contribuye a la tolerancia al estrés hídrico de este hongo, incluso se ha sugerido que la melanina puede ser utilizada por otros micobiontes y otros hongos asociados a las raíces para tolerar tanto el estrés osmótico como la desecación (Fernández y Koide, 2013). Sin embargo, los rasgos fisiológicos específicos responsables del éxito frente al estrés hídrico y su biología en general son poco conocidos (Spatafora et al., 2012; Fernández y Koide, 2013; Peter et al., 2016). Debido a su morfología distintiva, C. geophilum es una de las pocas especies de hongos ectomicorrízicos que se pueden identificar de manera confiable con características morfológicas de las raíces colonizadas (Obase et al., 2017). Es una especie poco estudiada en México, en particular su asociación con especies de zonas semiáridas, tal es el caso de Pinus maximartinezii Rzed., especie endémica y de distribución restringida, que se ha reportado para el sur de Durango (González-Elizondo et al., 2011) y sur de Zacatecas (Sierra de Morones, Juchipila), México (Rzedowski, 1964). Donde ocupa una superficie total de 376 km2, no obstante, se estima una superficie real de 35 km2 (Farjon, 2013). De acuerdo a la Lista Roja de especies amenazadas de la IUCN, 2018 y a la NOM-059-SEMARNAT-2010, esta especie se encuentra en peligro de extinción, debido a la recolecta no controlada de semilla, que afecta la regeneración natural de la especie, ganado itinerante dentro del área de distribución e incendios inducidos, que han destruido gran parte de la población localizada en el sur de Zacatecas (López-Mata et al., 2013). Se desarrolla en suelos muy delgados y pedregosos, que en ocasiones presentan afloramiento de la roca madre y además es frecuentemente colonizador de lugares que han sido afectados por incendios forestales. Adicionalmente es abundante en laderas, llegando a formar pequeños rodales fragmentados de una hectárea y raramente rodales más grandes (López-Mata y Galván-Escobedo, 2011). Pinus maximartinezii, conocido como pino azul, piñón azul o piñón real se caracteriza por el gran tamaño de sus semillas (Rzedowski, 1964) y de alto valor nutritivo (López-Mata, 2013). López-Mata y Galván-Escobedo (2011), reportaron la venta de semilla, en el mercado nacional (Pueblo Viejo y Juchipila, Zacatecas) e internacional (Nuevo México, Estados Unidos y Japón), para el año 2005 cotizada en $ 260.00 m.n. por kg de semilla fresca (equivalente a $ 21.60 USD). Asimismo, es considerada una especie de interés ornamental. Con base en lo anterior, la descripción e identificación de especies ectomicorrízicas que proporcionen nutrimentos y agua, que aminoren los efectos negativos de la sequía y de altas temperaturas son de gran relevancia, para el diseño de estrategias de conservación del pino azul. El objetivo del presente trabajo fue realizar una descripción morfoanatómica del morfotipo de Cenococcum geophilum en asociación con Pinus maximartinezii creciendo en su área de distribución natural.
Materiales y métodos
Localización del área de estudio
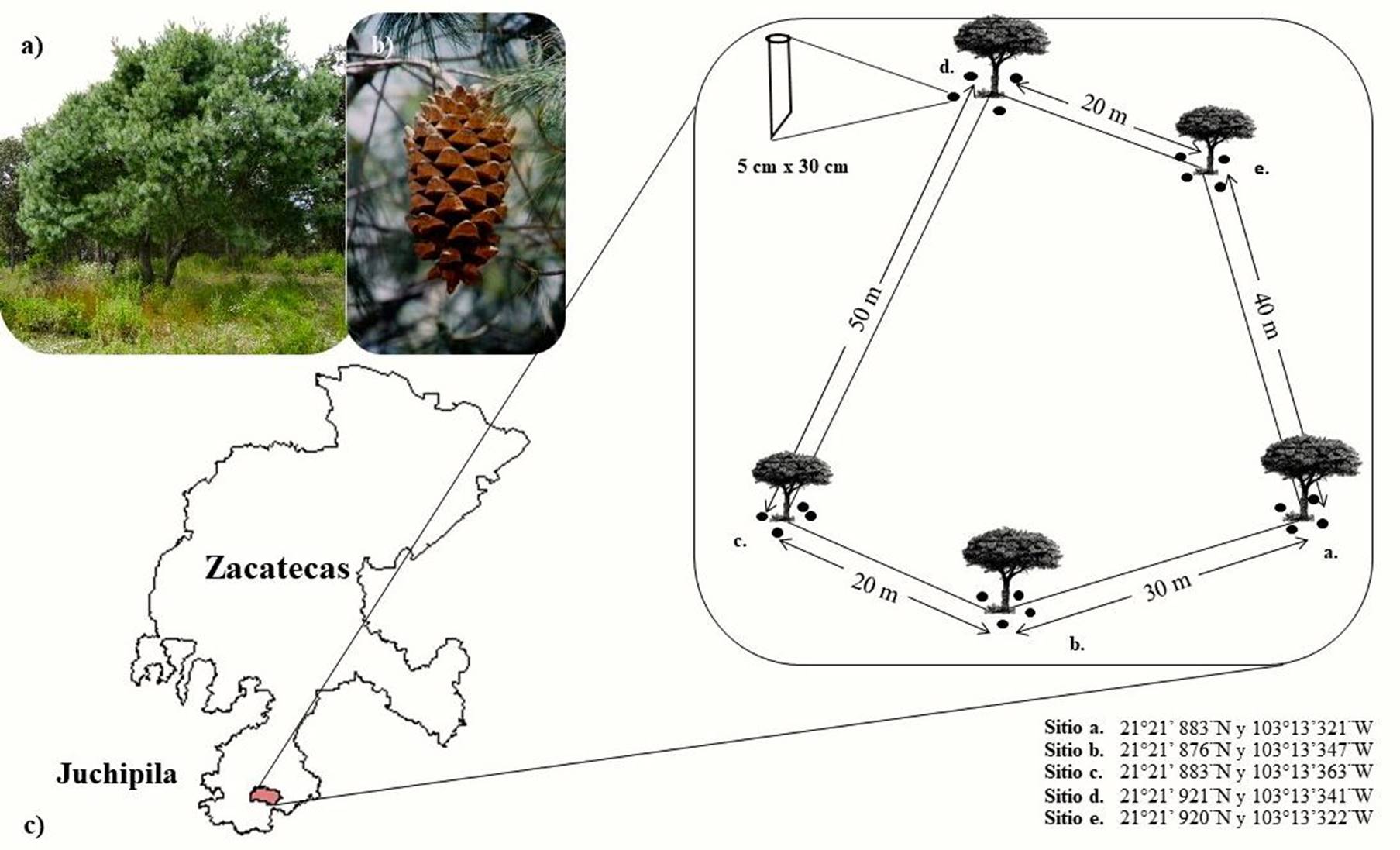
La población de P. maximartinezii que se estudió se ubica en el Cerro de Piñones, el cual forma parte de la Sierra Morones, perteneciente a la Sierra Madre Occidental, a una altitud entre 1650 a 2500 m s.n.m. Esta población se localiza al sur de Zacatecas y al oeste de la comunidad Pueblo Viejo, perteneciente al municipio de Juchipila (21° 20’ a 21° 22’ N y 103° 12’ a 103° 15’ O). La precipitación y temperatura máxima anual es de 691 mm y 21.7 °C (Campos-Aranda, 2016). La época seca comprende los meses de enero a mayo, mientras que la mayor precipitación se presenta durante los meses de junio a septiembre (Medina et al., 2016, 2017). El clima del área de estudio se clasifica como semicálido, semiárido a templado (Ruiz-Garduño et al., 2011). El pino azul crece escasamente en terrenos planos y de manera más densa sobre pendientes empinadas (70.02 - 142.81 %); el tipo de suelo es calcáreo, rocoso y muy seco (López-Mata y Galván-Escobedo, 2011; López-Mata, 2013). Dentro del ecosistema natural del pino azul, es posible encontrar especies como Quercus macrophilla Nee, Pinus lumholtzii Robins & Ferns y algunas especies arbustivas o semiarbustivas como Arctostaphylos pungens, Arbutus sp., Dodonea vizcosa, etc. (Rzedowski, 1964), la vegetación dominante es matorral subtropical (Acacia sp., Acasia farnesiana, Acasia gregii, etc).
Recolecta del material biológico
Se establecieron un total de 5 sitios de muestreo (Figura 1). Con el fin de descartar la presencia de otros hospederos ectomicorrízicos pertenecientes a las especies forestales circundantes, se seleccionaron rodales puros de árboles adultos de P. maximartinezii (N= 8/1000 m2). Se escogieron 5 árboles al azar con una distancia entre cada árbol de entre 30 a 50 m (Figura 1). Se tomaron cuatro muestras de suelo a una distancia aproximada de 1.5 m del tronco del árbol (área de goteo) y en cada uno de los puntos cardinales. Para esto se removió la hojarasca hasta dejar el suelo al descubierto y se tomaron las muestras con un tubo de policloruro de vinilo (PVC) de 5 x 30 cm para la extracción de las muestras. Cada muestra fue etiquetada y mantenida en los tubos de PVC para su transporte al laboratorio. Las muestras se conservaron a 4 °C hasta su procesamiento de acuerdo a la metodología propuesta por Argüelles et al. (2016), modificada para las condiciones de bosque de P. maximartinezii. Se llevaron a cabo dos muestreos, el primero se realizó en época seca (mayo del 2017) y el segundo en la época de lluvia (septiembre del mismo año), en total se obtuvieron 10 muestras por época de muestreo.
Caracterización morfológica de Cenococcum geophilum
La separación de raíces se llevó a cabo en el laboratorio de Micorrizas del Colegio de Postgraduados, Campus Montecillo. Cada muestra fue colocada en recipientes con agua destilada durante un periodo de 24 horas, con la finalidad de eliminar las partículas de suelo adherido a las raíces, posteriormente, se realizó un tamizado (de malla 16, abertura 1.18 mm) y con la ayuda de pinzas de disección se recolectaron las raíces (las cuales fueron conservadas en alcohol 70%). Enseguida, con la ayuda de un microscopio estereoscópico marca LEICA (mismo con el que se tomaron las fotografías) se realizó la descripción macroscópica y microscópica, para la que se efectuaron cortes histológicos transversales del morfotipo Cenococcum geophilum, en lo que se observó bajo microscopio los tejidos: manto fúngico, manto interno y red de hartig, realizándose la caracterización e identificación de acuerdo a las características distintivas propuestas para esta especie (LoBuglio, 1999; Goodman et al., 2000).
Resultados
Se identificó a C. geophilum asociado con árboles adultos de P. maximartinezii. De un total de 18 morfotipos, C. geophilum fue el más abundante, dado que se encontró en el 42.5% del total de raíces ectomicorrizadas vivas analizadas (18.3 época seca y 24.2 % para época de lluvia).
Características morfoanatómicas
El morfotipo presenta un color negro carbonizado y una superficie brillante con una ramificación dicotómica o simple, cuya longitud varia de 4 a 5 mm; desde la superficie del manto de aspecto granuloso se desarrollan abundantes hifas gruesas de color café oscuro a negras (Figura 2a), no ramificadas, frecuentemente curvas y con presencia de septos a distancia irregular; esta red de filamentos de exploración corta conforma un micelio extraradical bien desarrollado y concentrado principalmente en el ápice de los morfotipos evaluados. La disposición y organización del manto es plectenquimatoso, con hifas dispuestas radialmente (Figura 2d), y un patrón tipo estrella corresponde al tipo G, es decir, con hifas distribuidas de forma compacta y sin espacio entre ellas (DEEMY 2018). No se registraron estructuras como rizomorfos o cistidios. Respecto a la red de Hartig, interface entre la planta hospedera y su micosimbionte, solo ocupó de una a dos capas de células corticales cercanas a la epidermis (Figura 2e). Así mismo, los esclerocios presentaron una consistencia dura, color negro, en su mayoría de forma esférica con cuantiosas hifas emanantes, encontrándose en abundancia, pero no se detectaron en asociación directa o cercanos a los morfotipos de C. geophilum. El diámetro estimado osciló entre los 0.04 a 4 mm en P. maximartinezii.
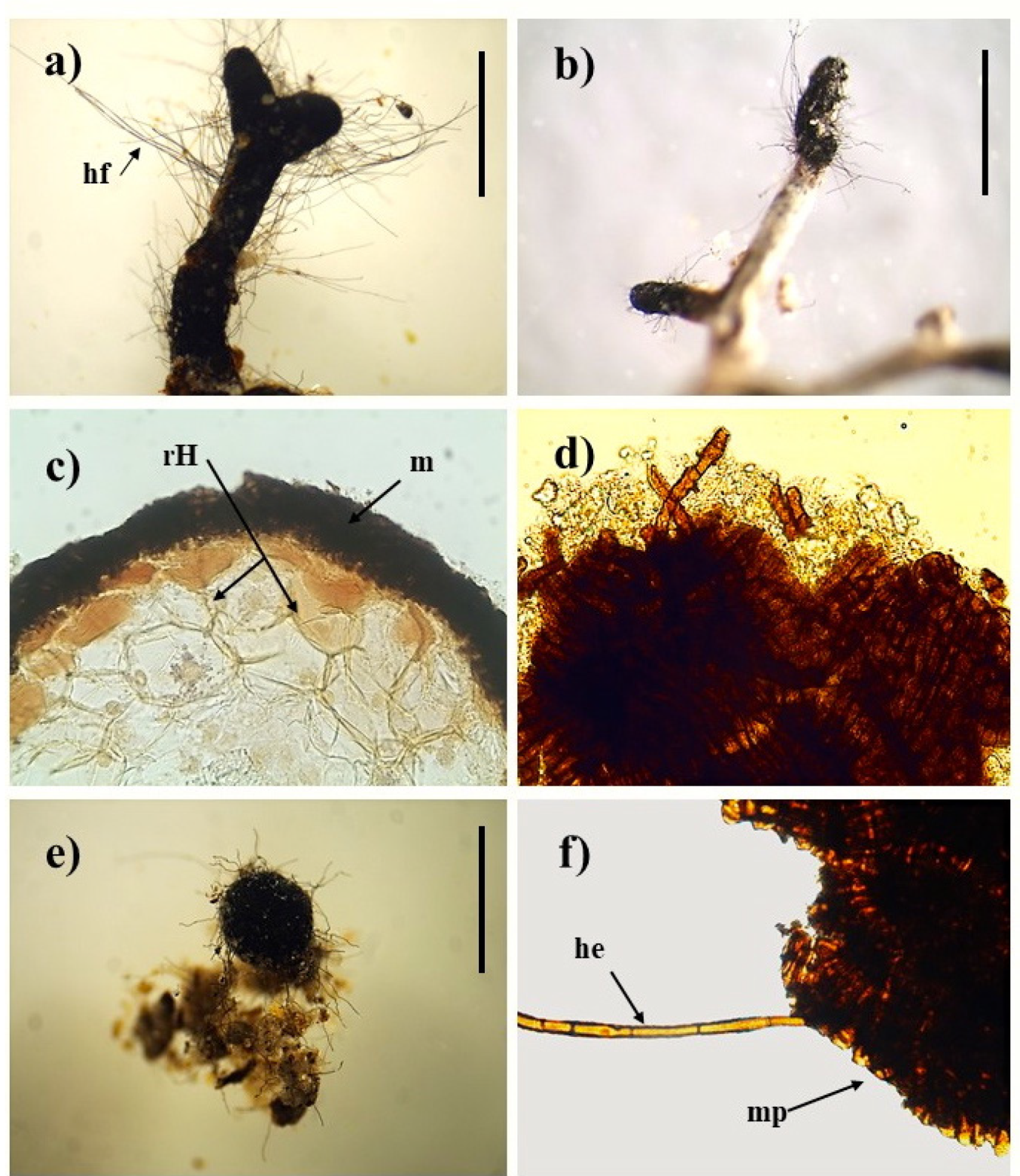
Figura 2. Ectomicorriza de Cenococcum geophilum con Pinus maximartinezii. a) Morfotipo ectomicorrizico dicotómico (4X). b) Morfotipo ectomicorrizico simple (2.1X). c) Corte transversal: manto (m) y red de Hartig (rH) (40X). d) Manto plectenquimatoso melanizado tipo G. e) esclerocio característico de C. geophilum (4.5X). f) Manto plectenquimatoso (mp) con hifa emanante (he) (40X) (Barra = 0.5mm).
Discusión
Es importante señalar que en el área de estudio la precipitación promedio que se ha reportado es de 691 mm (Campos-Aranda, 2016) y durante el año de los muestreos fue de 390 mm (Medina et al., 2017), por lo cual se considera que el pino azul estuvo sometido a condiciones de estrés hídrico y altas temperaturas (35.8 °C promedio anual), posterior al muestreo del mes de mayo (época de lluvia), se presentó un incendio forestal, que afectó gran parte de la población natural del pino azul. No obstante, a dicha condición C. geophilum fue el morfotipo más abundante, aún después del incendio forestal, inclusive aumentando su frecuencia en relación a la época de sequía, indicando su resistencia al fuego y tal vez su capacidad de rápida recuperación frente a factores antropogénicos como el fuego (Kipfer et al., 2011), de manera que se infiere la importancia que juega este simbionte en la conservación del pino azul, el cual se desarrolla bajo condiciones de estrés hídrico, altas temperaturas y suelos erosionados. Se ha demostrado que a pesar de que su tipo de exploración a corta distancia, este simbionte fúngico puede proporcionar ventajas al sistema radical de su hospedero (Jany et al., 2002), mejorando el estatus de agua bajo condiciones de sequía, aumentando la superficie de absorción, mediante una conducción más eficiente a través del micelio extraradical, obteniendo efectos nutrimentales y hormonales mayores que modifican la regulación de la conductividad hidráulica en la interfase suelo-raíz, contribuyendo así en la conservación y supervivencia de múltiples especies forestales (Mohatt et al., 2008; Nedelin, 2014). Además, los taxones cosmopolitas como C. geophilum son dominantes en ambientes secos, lo cual es explicado a través de la hipótesis de representar un menor costo de carbono para sus hospederos, debido a un micelio extraradical más delgado y tipo de exploración, para este caso de corta distancia (Defrenne et al., 2019). Asimismo, la producción de melanina en la pared celular fúngica de C. geophilum es un rasgo funcional clave para la tolerancia al estrés hídrico (Fernández y Koide, 2014). Previamente, C. geophilum se ha reportado asociado a árboles adultos de Pinus sylvestris en Francia (Ponge et al., 1990); en Pinus thunbergii en Korea (Obase et al., 2010); Pinus densiflora en China (Ma et al., 2012), asimismo, para la sierra de México (Sierra de Chichinauhtzin) asociado a Pinus montezumae (Reverchon et al., 2010); considerándose, por lo tanto un simbionte dominante en bosques de pinos, tanto en árboles maduros como en plántulas que se regeneran naturalmente (Obase et al., 2010; Peter et al. 2016; Garay-Serrano et al. 2018). Al respecto, se ha reportado a C. geophilum como el hongo ECM más frecuente (64 %) y abundante (51 %) en plántulas de Pinus albicaulis, debajo del área de goteo de árboles adultos y menos abundante en plántulas más alejadas de los árboles (Mohatt et al., 2008), así como en plántulas y juveniles de Abies lasiocarpa (Hook.) Nutt. y Picea engelmannii Parry (Hasselquist et al., 2005). Mientras que, en Pinus mugo subsp. turra y Pinus densiflora Sieb. et Zucc., C. geophilum se registró en una abundancia relativa dos veces mayor en plántulas que en árboles adultos en la región costera de Lituania y al este de China (Aučina et al., 2011; Ma et al., 2012), lo que se puede atribuir al papel vital que desempeña C. geophilum en la regeneración de los rodales (Ma et al., 2012). Cabe mencionar que existen otros mecanismos diferentes a la simbiosis EcM que contribuyen a la supervivencia de las plántulas, como son: tolerancia al sombreo, resistencia a patógenos, herbívoros y predadores de semillas (Mc Guire, 2007). El papel ecológico que llevan a cabo simbiontes generalistas, como C. geophilum en comparación con simbiontes específicos (Rhizopogon y Suillus spp.) en el establecimiento de plántulas, es poco conocido (Mohatt et al., 2008). Sin embargo, no queda duda del importante papel de C. geophilum para incrementar la tolerancia a la sequía, por lo que esta asociación podría beneficiar a especies forestales que habiten bajo condiciones de estrés hídrico, suelos erosionados y en la supervivencia de múltiples especies de coníferas (Mohatt et al., 2008; Nedelin, 2014).
Descripción del morfotipo Cenococcum geophilum con Pinus maximartinezii
Las características morfoanatómicas de C. geophilum reportadas en el presente trabajo coinciden con las registradas en Pinus sylvestris y Pinus montezumae (Ponge, 1990; Garay-Serrano, et al., 2018), así como en Picea sitchensis (Ingleby et al., 1990) en los cuales la ramificación fue simple y dicotómica; mientras que en especies como Pinus resinosa y Pinus densiflora solo forman ramificación simple (LoBuglio, 1999; Ma et al., 2010). La coloración negra y superficie brillante se ha reportado como característica principal en dicho simbionte EcM por Trappe (1964), Ponge (1990), LoBuglio (1999) y Spatafora et al. (2012). Se ha registrado un espesor del manto externo para Pinus resinosa entre 20-30 µm (LoBuglio, 1999) y de 10 a 25 µm de espesor para Picea sitchensis (Ingleby et al., 1990); no se registra en el presente estudio. La profundidad de penetración de la red de Hartig es similar a lo reportado para Pinus ayacahuite (Arteaga-León, 2014). Así mismo, las características que presentaron las estructuras de resistencia son similares a las descritas en la literatura (Amasya et al., 2015), reportándose como abundantes, pero no en asociación directa con las raíces, lo cual contrasta con lo reportado por Trappe (1969), quién encontró abundantes esclerocios en la micorrizosfera de C. geophilum y su planta hospedera. El diámetro oscilo entre los 0.04 a 4 mm en P. maximartinezii, mientras que Arteaga-León (2014), reportó un diámetro para estas estructuras en P. ayacahuite de 0.5 a 1.5 mm, así como mayores diámetros que van de 0.4-2.6 mm y 0.8-4.4 mm (Amasya et al., 2015).
Conclusiones
De un total de 18 morfotipos registrados en P. maximartinezii, C. geophilum fue el más abundante, con el 42.5 % del total de raíces ectomicorrizadas vivas analizadas en dos épocas (18.3 y 24.2 % seca y de lluvia, respectivamente). Es importante enfatizar que el morfotipo de Cenococcum geophilum no había sido caracterizado en Pinus maximartinezii. Las características morfológicas y anatómicas del morfotipo de C. geophilum + P. maximartinezii creciendo en su área de distribución natural son similares a las descritas por diversos autores en otras especies forestales. Sin embargo, se requiere realizar trabajos de fisiología que nos permitan elucidar el papel que juega este simbionte y los otros morfotipos ectomicorrízicos en la conservación de esta especie forestal en peligro de extinción y de distribución restringida, la cual se desarrolla bajo condiciones de estrés hídrico, altas temperaturas y suelos erosionados.











 text new page (beta)
text new page (beta)