Introducción
Los sarcomas uterinos cubren alrededor del 1% de todas las neoplasias malignas del tracto genital femenino, y el 3-7% de todos los tipos de cáncer del cuerpo uterino, siendo por tanto considerados como poco comunes (Fig. 1). Estas neoplasias pueden originarse: a) del músculo liso en miometrio (leiomiosarcoma), b) de estroma endometrial (sarcoma estromal endometrial y sarcoma endometrial no diferenciado), o c) de los dos anteriores (adenosarcoma)1,2.
Figura 1 El adenosarcoma uterino y el adenosarcoma con sobrecrecimiento sarcomatoso (ASSO) son neoplasias malignas uterinas poco comunes.
Los sarcomas uterinos muestran una alta variedad histológica, por lo que no ha sido fácil establecer su clasificación. Desde el año 2009, se ha recomendado el sistema de estatificación de la Federación Internacional de Ginecología y Obstetricia (FIGO) para sarcomas uterinos, la cual establece dos divisiones: a) leiomiosarcoma y sarcoma estromal endometrial, y b) adenosarcomas3,4. Los sarcomas uterinos no deben confundirse con los carcinosarcomas (tumor mülleriano mixto maligno), los cuales actualmente son estadificados usando el sistema de carcinoma endometrial, considerando que son una forma desdiferenciada o de metaplasia del carcinoma de endometrio. Los sarcomas uterinos tampoco deben confundirse con los subtipos del cáncer de endometrio, los cuales son carcinomas del epitelio endometrial5-7.
Adenosarcomas uterinos
Los adenosarcomas uterinos son también referidos como «adenosarcomas müllerianos», que es un término utilizado por primera vez en 1974, para designar a tumores mixtos generalmente benignos y poco comunes del útero, caracterizados por un componente epitelial glandular y otro sarcomatoso generalmente de bajo grado tipo estromal8,9. De acuerdo con la clasificación FIGO (2018), se distinguen cuatro diferentes etapas de este cáncer3 (Tabla 1).
Tabla 1 Clasificación del adenosarcoma de acuerdo con la Federación Internacional de Ginecología y Obstetricia
| Estado | Definición |
|---|---|
| I Tumor limitado a útero | |
| I-A | Tumor limitado a endometrio/endocérvix, no invasión a miometrio |
| I-B | Menos o igual a la mitad de invasión a miometrio |
| I-C | Más de la mitad de la invasión a miometrio |
| II Tumor extendido a pelvis | |
| II-A | Afección a anexos |
| II-B | Tumor extendido a tejido pélvico extrauterino |
| III Tumor con invasión a tejido abdominal | |
| III-A | Un sitio |
| III-B | Más de un sitio |
| III-C | Metástasis a nodos linfáticos paraaórticos y/o pélvicos |
| IV | |
| IV-A | Tumor que invade vejiga y/o recto |
| IV-B | Metástasis distante |
Adaptada de Mbatani, et al., 20183.
La palabra adenosarcoma se conforma de dos términos: adenoma y sarcoma. Adenoma indica que el tumor se origina en células epiteliales tipo glandular, y sarcoma se refiere a que un tumor tiene un origen no epitelial de tipo óseo, graso, muscular, de vasos sanguíneos o, más comúnmente, del tejido conjuntivo o conectivo, como el estroma1,6,7,10-14. El adenosarcoma mülleriano constituye aproximadamente hasta el 10% de todos los sarcomas uterinos, por lo que son tumores poco comunes del tracto genitourinario femenino (Fig. 1).
El adenosarcoma uterino comúnmente se presenta en mujeres posmenopáusicas, aunque llegan a detectarse casos atípicos en mujeres más jóvenes. La mayoría de los casos de adenosarcoma inician en el endometrio, y en menor proporción en cérvix y endocérvix. El sangrado vaginal anormal, y el dolor pélvico y/o abdominal son síntomas descritos para los adenosarcomas, pero también para otros tipos de sarcomas uterinos y subtipos de cáncer de endometrio6,15,16, lo que dificulta su diagnóstico. El adenosarcoma uterino puede ser altamente agresivo cuando existe un «sobrecrecimiento sarcomatoso», principalmente de tipo estromal, denominándose entonces adenosarcoma con sobrecrecimiento sarcomatoso (ASSO)15,17 (Fig. 1).
Adenosarcoma vs. adenosarcoma con sobrecrecimiento sarcomatoso
El adenosarcoma mülleriano con sobrecrecimiento sarcomatoso (ASSO) es una rara variante del adenosarcoma uterino. Se ha reportado que el ASSO se presenta en un rango variado, del 8 al 65% de los casos con adenosarcoma uterino4,18,19. El ASSO consiste en tumores bifásicos, presentando el componente epitelial benigno y el componente sarcomatoso maligno20. El sobrecrecimiento sarcomatoso es definido como la presencia de sarcoma puro, usualmente de alto grado y sin componente glandular, ocupando al menos el 25% del tumor3. Por otra parte, el componente sarcomatoso maligno de tipo estromal puede ser de tipo homólogo o heterólogo. El componente homólogo se refiere a fibroblastos y músculo liso, mientras que el componente heterólogo incluye a cartílago, hueso y componente estriado/esquelético muscular19. La presencia de sobrecrecimiento sarcomatoso y elementos heterólogos parece agravar el pronóstico de esta enfermedad21.
El adenosarcoma y el ASSO se caracterizan por la cavidad uterina llena con una masa polipoide, que puede proyectarse a través del cuello uterino. Sin embargo, el adenosarcoma es mejor diferenciado y puede exhibir solamente la mitad de la atipia nuclear, muy poco o nula mitosis en el componente estromal, y el tamaño promedio del polipoide es de hasta 6 cm de diámetro3,22. En contraste, el ASSO se relaciona con tumores mayores a 6 cm con una superficie de corte necrótica, hemorrágica y carnosa, y mayor capacidad de invadir el miometrio y el sistema linfovascular. En el ASSO también se presenta un sarcoma pobremente diferenciado, atipia citológica y actividad mitótica. Las células de las lesiones del ASSO son pleomórficas con núcleos alargados y frecuentemente diferenciación heteróloga. Morfológicamente los ASSO tienen una arquitectura tipo hoja y condensación periglandular, en la que el estroma se concentra alrededor de las glándulas formando puños periglandulares3,20.
En suma, el crecimiento sarcomatoso es el factor más desfavorable para los casos de adenosarcomas uterinos, dado que es detectado junto con un alto índice mitótico, necrosis, invasión miometrial profunda, invasión linfovascular y diferenciación heteróloga. Estas características podrían explicar por qué el ASSO se vincula con una frecuente recurrencia del tumor, un avance clínico agresivo, metástasis y desenlace fatal, mientras que el adenosarcoma sin sobrecrecimiento sarcomatoso tiene mejor pronóstico19,20.
Categorizando el adenosarcoma uterino y el adenosarcoma con sobrecrecimiento sarcomatoso
Desde un punto de vista molecular, se proponen dos categorías para el adenosarcoma uterino, considerando la desregulación del gen TP53 (el cual codifica para el supresor tumoral p53). Estas categorías son: a) tumores altamente malignos con alto índice mitótico, de 10-22/10 HPF (campos de alta frecuencia, high power fields) y baja relación de supervivencia, y b) tumores con bajo índice mitótico, de 5/10 HPF, con características bien diferenciadas y supervivencia prolongada, hasta 18 meses después de una histerectomía. Los HPF se refieren al número de campos evaluados bajo el microscopio (conteo de células tumorales en mitosis). En esta categorización, los adenosarcoma de bajo grado se caracteriza por un tumor pequeño con carencia de alteraciones en la expresión del gen TP53 (expresión normal). En contraste, el adenosarcoma de alto grado consiste en tumores frecuentemente de tamaño igual o mayor a 10 cm, asociados con recurrencia local y/o metástasis distante, además de tener alteraciones del gen TP53 (expresión anormal). De manera importante, el ASSO se caracteriza como un adenosarcoma de alto grado, y solo una pequeña fracción de adenosarcomas de bajo grado podrían presentar un sobrecrecimiento estromal de acuerdo con esta categorización20 (Fig. 2).
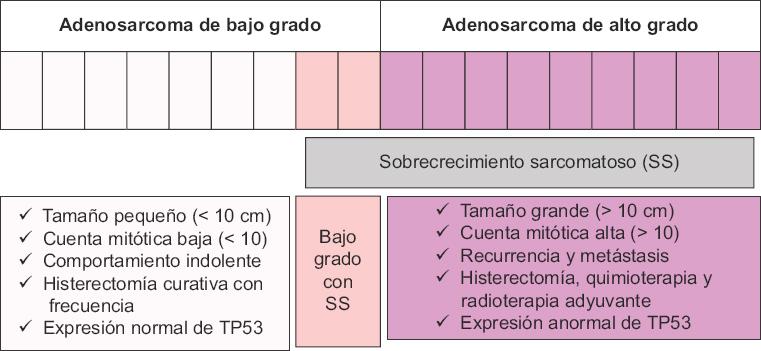
Figura 2 Categorización del adenosarcoma uterino en bajo grado y alto grado (adaptada de Hodgson, et al., 201720).
Sitio de origen y metástasis del adenosarcoma con sobrecrecimiento sarcomatoso uterino
Se estima que más del 70% de los adenosarcomas, incluyendo el ASSO, se desarrollan en el endometrio de mujeres posmenopáusicas. Sin embargo, los casos reportados en cérvix corresponden a ASSO con elementos heterólogos, y al parecer se presentan en mujeres más jóvenes4,19,21,23,24. De manera interesante, la metástasis se considera rara en los casos de adenosarcoma debido a que el componente epitelial usualmente es benigno y el componente estromal es de bajo grado. En contraste, los tumores de ASSO son más agresivos, con rápido crecimiento, invasión vascular y extensión extrauterina local o cercana al origen del tumor21. Además, la metástasis a través de los ganglios linfáticos es frecuente en pacientes con ASSO, incrementando el riesgo de muerte de estas pacientes17,25,26. La invasión linfovascular de los tumores ASSO sugiere que estos tumores invaden otros tejidos distantes. Al respecto, recientemente se evidenció un caso inusual de metástasis de ASSO al cerebro, indicando su potencial metastásico27.
Caracterización molecular del adenosarcoma y el adenosarcoma con sobrecrecimiento sarcomatoso
La caracterización molecular del adenosarcoma, y en particular del ASSO, es limitada en comparación con otras neoplasias uterinas. En un estudio se utilizó la secuenciación del exoma completo para identificar alteraciones genéticas en común en 19 muestras de adenosarcoma uterino y 22 muestras de tumores filoides mamarios (originados en el estroma), considerando que ambas alteraciones poseen una similitud morfológica que incluye la generación de proyecciones estromales en forma de hojas revestidas por células epiteliales. Como resultado se identificó un enriquecimiento de alteraciones genéticas somáticas asociadas con genes vinculados a la vía de Wnt28. Además, algunas diferencias han sido reportadas en adenosarcomas en comparación con el ASSO, particularmente variaciones en el número de copias, cromotripsis y mutaciones en el gen ATRX. Las mutaciones del gen TP53 se han reportado solamente en casos de ASSO hasta ahora20.
Adicionalmente, amplificaciones de los genes MDM2, CDK, TERT y MYLB1, así como posibles afectaciones en las vías de señalización de PI3K/AKT/PTEN, FGFR2, y la metiltransferasa de lisinas KMT2C se han reportado en el ASSO. Las mutaciones en los genes MYLB1 y ATRX resultaron evidentes en el 50% de los casos de ASSO estudiados, siendo MYLB1 un factor de transcripción que regula la proliferación celular, y ATRX un factor asociado con la remodelación de la cromatina29. La expresión anormal de los genes p53, MDM2, CDK, PTEN, AKT y PTEN también se asocia con la progresión del adenosarcoma uterino. En conjunto estos datos sugieren una alta heterogeneidad molecular entre el adenosarcoma con sobrecrecimiento sarcomatoso vs. sin sobrecrecimiento sarcomatoso.
En la actualidad no existen marcadores inmunohistoquímicos que sean específicos para definir el adenosarcoma, por lo que el diagnóstico de estos tumores depende de las características morfológicas. No obstante, se ha reportado la frecuente expresión multifocal o difusa de CD10 en el compartimento estromal del adenosarcoma. También se ha evaluado la inmunorreactividad para el receptor de estrógenos alfa (ERa) y el receptor de progesterona (PR), los cuales son detectados en la mayoría de los casos de adenosarcoma en el componente glandular y estromal. En contraste, tanto el ERa como el PR son débil o nulamente detectados en los casos de ASSO, siendo por lo tanto factores diferenciales con el adenosarcoma sin crecimiento sarcomatoso. La detección de estos receptores nucleares podría indicar un mejor pronóstico en pacientes con adenosarcoma. Algunos otros marcadores con positividad variable son mesenquimales, como la actina muscular lisa, la desmina y el CD34, mientras que las citoqueratinas AE1/AE3 son raramente positivas para el ASSO17,30-33 (Tabla 2).
Tabla 2 Patrón de tinción de inmunohistoquímica en adenosarcoma uterino
| Tinción | Epitelio | Estroma sin crecimiento sarcomatoso | Estroma con crecimiento sarcomatoso |
|---|---|---|---|
| Citoqueratina AE1/AE3 | + | +/- | - |
| Receptor de estrógenos alfa | + | + | - |
| Receptor de progesterona | + | + | - |
| Receptor de andrógenos | - | + | - |
| CD10 | +/- | + | +/- |
| p53 | - | - | +/- |
Adaptada de Pinto, et al., 201632.
Además, en un estudio de tumores de pacientes con esta enfermedad sin recurrencia local se determinaron altas densidades de células T CD3 y CD8 en comparación con aquellos que tuvieron una recurrencia local, sugiriendo que la densidad de las células T CD3+ CD8+ podría ser útil como un marcador pronóstico. De manera interesante, la presencia de un infiltrado inmunitario y PD-1/PD-L1 (proteína de muerte programada 1/ligando de PD-1) se detecta en el adenosarcoma uterino34.
Síntomas y factores de riesgo para el adenosarcoma uterino y el adenosarcoma con sobrecrecimiento sarcomatoso
Una dificultad para distinguir entre los diferentes tipos de cáncer en el cuerpo uterino, incluyendo el adenosarcoma y el ASSO, es que todos se caracterizan principalmente por un sangrado vaginal anormal. En la mayoría de los casos este síntoma se presenta en mujeres posmenopáusicas y se diagnostica como un «sangrado posmenopáusico». En particular, para el ASSO se reportan sangrados vaginales que pueden ser intermitentes, además de dolor pélvico y/o abdominal cuya intensidad puede aumentar, con presencia de pólipos endometriales y/o masa pélvica28,35. Hasta ahora no existe algún síntoma clave que distinga el adenosarcoma uterino del ASSO y estos de otras neoplasias malignas uterinas.
Los factores de riesgo para desarrollar adenosarcoma y el ASSO aún no se conocen con exactitud. Cabe resaltar que, aunque se ha considerado que la nuliparidad podría ser un factor de riesgo para neoplasias malignas uterinas, se han reportado varios casos clínicos de mujeres con múltiples partos que llegan a diagnosticarse con adenosarcoma y ASSO, sugiriendo que la nuliparidad no es un factor directo de riesgo. No obstante, factores como uso del tamoxifeno, el uso de reemplazo hormonal, diabetes mellitus tipo 2 y la obesidad podrían predisponer para los adenosarcomas y el ASSO2,4,17,26,32.
Diagnóstico y tratamiento para el adenosarcoma uterino y el adenosarcoma con sobrecrecimiento sarcomatoso
La rareza histológica del adenosarcoma y principalmente del ASSO dificulta el reconocimiento de estas patologías y su diagnóstico. El ASSO puede confundirse histológicamente con el carcinosarcoma uterino (tumores müllerianos mixtos malignos), adenofibromas y sarcoma estromal endometrial. Por lo tanto, las biopsias pueden no aportar un resultado valioso si no existe el adecuado conocimiento histopatológico de esta enfermedad. Además, hasta ahora no existe un biomarcador para el adenosarcoma y el ASSO. Al respecto, la tomografía computarizada es una técnica de apoyo para analizar la presencia de masas en la cavidad uterina y la posible diseminación a otros tejidos4,5,18,32.
Muchos estudios sugieren que la histerectomía es la estrategia más adecuada para analizar, diagnosticar y tratar este tipo de sarcomas, siendo un factor importante su realización en etapas tempranas de la enfermedad. En ocasiones, la histerectomía puede estar acompañada de una linfadenectomía para retirar ganglios linfáticos sospechosos implicados en metástasis. Sin embargo, el porcentaje de casos con metástasis a ganglios linfáticos se estima que oscila de 0 al 6%, por lo tanto, la extirpación de estos ganglios podría no tener un beneficio para todos los casos de adenosarcoma25.
El análisis transoperatorio resulta importante para definir el alcance del cáncer, definiendo el tamaño y las características del tumor, mientras que el análisis histopatológico de la pieza quirúrgica extraída ayuda a evaluar la invasión a miometrio, la invasión linfovascular, la mitosis y la necrosis, entre otros. Estos datos son útiles para determinar la extensión del tumor, las medidas terapéuticas que seguir y el pronóstico del paciente. Por lo tanto, la histerectomía, en una etapa temprana de la enfermedad, es una modalidad de diagnóstico y tratamiento para evitar el adenosarcoma uterino recurrente o metastásico30-33.
Las estrategias de quimioterapia y radioterapia son controvertidas y no han sido bien definidas para el adenosarcoma uterino y el ASSO16,17,26,35. En mujeres con ASSO en una etapa inicial, la terapia adyuvante podría mejorar el pronóstico de las pacientes y reducir la recurrencia, sin embargo estos tratamientos no tienen ventajas en etapas avanzadas18,36. Hasta ahora, los quimioterapéuticos que parecen ser más efectivos son las asociaciones doxorubicina/ifosfamida y gemcitabina/docetaxel. Recientemente, se reportó un caso exitoso en una paciente de 49 años con ASSO, a quien se administró un tratamiento de tres ciclos de epirubicina con ifosfamida como terapia adyuvante después de una histerectomía, sugiriendo que el ASSO es sensible a estos quimioterapéuticos, y que podrían integrarse a las estrategias médicas y quirúrgicas de este padecimiento37.
Retos en el estudio, detección y tratamiento del adenosarcoma con sobrecrecimiento sarcomatoso
Los problemas de salud asociados al envejecimiento se han incrementado debido a la mayor expectativa de vida de las personas. De manera importante, en las mujeres se presenta mayor riesgo de desarrollar diferentes tipos de cáncer genitourinarios mientras se incrementa la edad. Muchas investigaciones y estrategias de detección y terapia se han centrado en el cáncer de mama y el cáncer cervicouterino, dado el grave problema de salud que representan a nivel mundial. No obstante, existen otros tipos de cáncer, como el adenosarcoma uterino, que empiezan a tener una creciente necesitad de atención, de conocimiento y de divulgación ante el aumento de los casos, y la carencia de protocolos rápidos y efectivos de detección y de acción.
El adenosarcoma uterino ocurre generalmente en mujeres posmenopáusicas, aunque se han reportado casos atípicos en mujeres premenopáusicas e incluso mucho más jóvenes. El adenosarcoma uterino se considera como un tumor de bajo grado, pero cuando presenta un sobrecrecimiento sarcomatoso de tipo estromal se relaciona con una mayor agresividad asociada con recurrencia, metástasis y una progresión muy rápida que puede conducir a la muerte. Las estrategias terapéuticas parecen no ser efectivas para el ASSO, pero podrían tener más posibilidades en etapas tempranas de la enfermedad.
El problema al que se enfrentan las pacientes con adenosarcoma y ASSO es que la sintomatología de sangrado vaginal anormal es común para una serie de patologías, incluyendo otros tipos de cáncer del tracto urogenital femenino. Enfrentarse a un servicio médico deficiente en estrategias para este tipo de padecimientos podría favorecer el progreso de la enfermedad, por no tomar acciones adecuadas. Los médicos generales y/o los ginecólogos son los primeros en ser visitados por las pacientes que presentan un sangrado después de la menopausia, por lo que estos profesionales no deben minimizar este síntoma, y no deben basarse únicamente en la historia clínica, dado que los factores asociados al adenosarcoma y al ASSO no han sido bien establecidos hasta ahora. Un ejemplo de ello es que cualquier mujer posmenopáusica sin o con múltiples hijos está expuesta a padecer este tipo de adenosarcoma. No obstante, el factor edad, la posmenopausia y el sobrepeso podrían ser indicadores para considerar.
La identificación de los primeros síntomas del adenosarcoma y el ASSO, como el sangrado vaginal anormal, podría no resultar de utilidad, si los médicos generales y ginecólogos no toman medidas rápidas de redireccionamiento a especialistas en el campo oncológico. Es necesario que los servicios médicos tengan más rigor en la evaluación del sangrado de pacientes de mayor edad y dar un seguimiento adecuado. Los oncólogos enfrentan retos fuertes ante este padecimiento, porque pueden recibir pacientes con un crítico avance de la enfermedad que fueron previamente mal diagnosticadas. Por otra parte, también se enfrentan a la dificultad de dar un diagnóstico sin un dato claro a partir de las biopsias endometriales, que en el caso de adenosarcoma y ASSO por su rareza histológica pueden conducir a una inadecuada interpretación si los patólogos no cuentan con una sólida experiencia teórica y práctica en este tipo de afecciones.
El manejo inadecuado del adenosarcoma y el ASSO podría provocar que se utilicen indistintamente los términos de cáncer de endometrio a cualquier neoplasia maligna que se desarrolle en esa capa del cuerpo uterino, o bien confundir el término de carcinosarcoma uterino con los sarcomas uterinos, generando confusión en el diagnóstico, tratamiento e incluso afectando el seguimiento y el estudio de neoplasias uterinas, sobre todo tratándose de enfermedades poco comunes como el adenosarcoma y el ASSO. Desde el ámbito científico, el adenosarcoma y el ASSO son todo un campo abierto de estudio que es importante e interesante evaluar y comprender. Desde el punto de vista de los familiares que han perdido a un paciente por este padecimiento, se requiere una mejor preparación científica, profesional y técnica para la detección, atención temprana y terapia de esta enfermedad.
Conclusión
El adenosarcoma y el ASSO son dos enfermedades poco frecuentes, que afectan principalmente a mujeres posmenopáusicas. En particular, el ASSO se asocia a metástasis y muerte en corto tiempo si es tratado tardíamente.
Es necesaria la identificación de biomarcadores de detección temprana para este tipo de cáncer. La detección por parte de la paciente no es el problema, debido a que el síntoma más característico es el sangrado vaginal anormal y el dolor pélvico y/o abdominal. Por lo tanto, se requieren estrategias efectivas de médicos generales, ginecólogos, patólogos y oncólogos, para identificar, abordar y tratar el ASSO. Hasta ahora no existe un protocolo terapéutico completamente establecido para el ASSO. La histerectomía junto con la terapia adyuvante podría mejorar el pronóstico de esta enfermedad si se realiza oportunamente.











 text new page (beta)
text new page (beta)


