Antecedentes
Las reacciones de alergia perioperatorias (AP) constituyen un problema de salud mundial debido a su alta morbimortalidad, incidencia subestimada, riesgo de sensibilización previa e incluso sensibilización desde una primera exposición a fármacos y, sobre todo, por la imposibilidad en el quirófano de determinarlas por ausencia de síntomas prodrómicos al efecto farmacodinámico de los mismos y a la ausencia de consensos para su diagnóstico y tratamiento.
Durante el periodo perioperatorio, los pacientes están expuestos a un sinnúmero de fármacos que pueden inducir una reacción de hipersensibilidad, con incidencia estimada de uno en cada 100 000 procedimientos, encontrando una tasa de mortalidad variable en los distintos países, con un rango de 0.1 a 9 %; en México no existe ningún registro bibliográfico sobre incidencia o prevalencia de reacciones de AP.1,2
En los distintos reportes y estudios acerca de los fármacos más asociados, existe amplia variabilidad, sin embargo, de forma general podemos considerar que más de 90 % de los cuadros de AP es secundario al uso de tres agentes: bloqueadores neuromusculares, látex y antibióticos.3,4,5
Los fármacos son considerados antígenos extraños, reconocidos por la unión del HLA de una célula presentadora que contiene un péptido activador de una célula T, que dispara los mecanismos inmunológicos para su procesamiento antigénico. Existen cuatro principales teorías para explicar cómo un pequeño antígeno (fármaco) puede desarrollar una reacción de hipersensibilidad:
La teoría del hapteno: aunque el fármaco responsable o su metabolito reactivo sea muy pequeño para ser potencialmente inmunogénico por su cuenta (< 800 dalton), su unión por medio de enlaces covalentes a péptidos endógenos para formar un complejo hapteno-acarreador permite su posterior reconocimiento por receptores de células T.
La interacción farmacológica con el receptor inmune: se postula que el fármaco y su metabolito reactivo pueden unirse de forma directa, reversible y por medio de enlaces no covalentes a la proteína del receptor de células T (RCT) o al antígeno leucocitario humano (HLA), y eludir la vía clásica de procesamiento antigénico en las células presentadoras de antígenos (como el caso de carbamazepina y el oxipurinol).
El modelo de repertorio de péptido alterado: postula que el fármaco responsable de la reacción alérgica ocupa la posición en la unión peptídica de la proteína HLA cambiando la hendidura de la unión y la especificidad del péptido de la unión a HLA (como con abacavir).
El modelo de repertorio de RCT: sugiere que algunos fármacos interactúan directamente con el TCR, pero sin interactuar con otros péptidos o con las moléculas del HLA (como ocurre con el sulfametoxazol).6,7
Las reacciones adversas a medicamento (RAM) perioperatorias pueden dividirse en reacciones inmunológicas mediadas por inmunoglobulina E (IgE), reacciones inmunológicas no mediadas por IgE y mecanismos no inmunológicos. En las reacciones mediadas por IgE (reacciones inmediatas) existe sensibilización primaria al fármaco o a una sustancias de estructura molecular similar (reactividad cruzada), con la posterior formación de IgE específica del fármaco, liberada por células plasmáticas. En una subsecuente exposición al fármaco se presenta la unión del alérgeno específico a los receptores de alta afinidad de IgE en la superficie de mastocitos, basófilos y eosinófilos, causando la degranulación de los mismos y la subsecuente liberación de mediadores preformados como histamina, triptasa, carboxipeptidasa, mediadores de membrana fosfolipídica como prostaglandinas, leucotrienos y liberación de citocinas de novo.8
En las reacciones inmunológicas no mediadas por IgE, los mecanismos son regulados por la activación del complemento o por medio de la Inmunoglobulina G (IgG). La activación final del complemento se ha demostrado que posiblemente es mediada IgE o IgG y, por último, en ausencia de IgE o IgG. Los fármacos solubilizados y basados en lípidos excipientes )Cremophor®, BASF, utilizado como diluyente en el propofol o paclitaxel), que forman micelas con lípidos séricos y colesterol que estimulan de forma directa el complemento, causan la liberación de anafilotoxinas (C3a y C5a) y estimulan la activación de mastocitos y basófilos, ocasionando su posterior degranulación y liberación de mediadores inflamatorios.
Por último, en las reacciones no inmunológicas se puede generar una reacción de hipersensibilidad mediante la inhibición en la síntesis de prostaglandinas y el aumento de síntesis de leucotrienos, como sucede con los antiinflamatorios no esteroideos (AINE) mediante la inhibición de la cicloxigenasa. Otro mecanismo es la activación directa de células mastocitarias o basófilos, como se ha observado con la vancomicina, por medio de la activación de fosfolipasa C y fosfolipasa A2, por un mecanismo calciodependiente. En los últimos tiempos se ha estudiado el mecanismo mediado por el receptor X2 acoplado a proteína G (MRGPRX2) en el caso de algunos fármacos específicos (opiáceos y quinolonas), que hidrolizan guanosín trifosfato (GTP), modulan positivamente los canales de calcio y causan degranulación mastocitaria y la consecuente liberación de TNF-A y prostaglandina D2, provocando una reacción anafiláctica no inmunológica.8
La presentación clínica de un cuadro de AP es similar a cualquier otro cuadro de alergia, sin embargo, goza de ciertas características particulares. Tomando en cuenta el estado de inconciencia inducido en procedimientos de anestesia general, no existe la posibilidad de que el paciente pueda referir la presencia de síntomas prodrómicos (prurito, disnea, opresión torácica, malestar faríngeo), por lo cual la primera manifestación detectada es un signo avanzado de alergia (hipotensión, hipercapnia, disociación mecánica-ventilatoria o arritmias cardiacas). Por lo anterior, las reacciones alérgicas reportadas en el transoperatorio (80%) normalmente son severas, mientras que las reacciones alérgicas en el posoperatorio (20%) tienden a ser leves. Los signos más comunes (70 a 80%) en un cuadro de alergia perioperatoria tienden a ser las manifestaciones cutáneas como eritema, rash urticariforme y angioedema, seguidas de las respiratorias (50%) como hipoxemia y disociación mecánico-ventilatoria y las alteraciones cardiovasculares, que pueden ser incluso la primera manifestación clínica de AP, como bradicardia, hipotensión o arritmias cardiacas.9,10,11
El diagnóstico de AP es prácticamente clínico. Los estudios de laboratorio para el apoyo diagnóstico no están recomendados, ya que generalmente requieren tiempo para su procesamiento y pueden indicar una gran cantidad de resultados falsos-positivos y falsos-negativos, por ejemplo, la elevación sérica de triptasa es un marcador propio de degranulación mastocitaria y no de reacción anafiláctica por sí misma, motivo por el cual puede generar falsos-positivos en el caso de fármacos que causan degranulación mastocitaria.12,13,14
El diagnóstico deberá ser sospechado ante cualquier síntoma (si el paciente no está bajo sedación) o signo cutáneo de aparición en el periodo perioperatorio, transoperatorio o posoperatorio (figura 1). El diagnóstico de anafilaxia deberá ser sospechado ante cualquier manifestación sistémica asociada, como hipotensión refractaria a vasopresores, disociación ventilatoria, hipoxemia, broncoespasmo, bradicardia.12,13,14
Ante cualquier sospecha diagnostica de AP, el tratamiento no debe hacerse esperar, encaminándose principalmente al retiro del fármaco sospechoso, la administración inmediata de un adecuado soporte vital básico (vía aérea, respiración, circulación) y la administración precoz y temprana de epinefrina en caso de reacción severa (anafilaxia); posteriormente deberán contrarrestarse los efectos de los mediadores preformados liberados en respuesta al fármaco causal con la administración de antihistamínicos H1 (difenhidramina), H2 (ranitidina) y uso de corticoides (hidrocortisona).15,16
El diagnóstico específico del fármaco que provoca el cuadro de AP se realiza mediante la historia clínica detallada del paciente, haciendo hincapié en el tiempo y secuencia de exposición a fármacos en el perioperatorio y al comienzo de los síntomas, en la determinación de estudios in vitro durante el episodio agudo y las pruebas cutáneas posterior a la remisión del cuadro (cuatro a seis semanas después).17,18
Por otro lado, el diagnóstico y tratamiento inicial de la AP en el quirófano corresponde fundamentalmente al médico anestesiólogo; de forma secundaria, su tratamiento deberá ser de forma multidisciplinaria (terapia intensiva, medicina interna, anestesiología) y el diagnóstico alérgeno específico del fármaco potencialmente causal de AP corresponde al alergólogo. El tratamiento ulterior deberá ser un esfuerzo conjunto entre el servicio de anestesia y el servicio de alergia, con el objetivo de ofrecer una adecuada alternativa terapéutica y disminuir potencialmente el riesgo de una futura reacción alérgica.
Método
Se realizó un estudio retrospectivo, transversal, descriptivo de alergia perioperatoria de pacientes del Hospital General de México Dr. Eduardo Liceaga.
Previo consentimiento informado, los pacientes enviados o referidos mediante interconsulta al Servicio de Alergia e Inmunología Clínica fueron evaluados con estudios de hipersensibilidad inmediata cuatro a seis semanas después de la intervención quirúrgica y la reacción de hipersensibilidad, realizando el estudio de todos los agentes perioperatorios a los que se expuso a cada paciente, que incluyeron anestésicos locales, látex, antibióticos, bloqueadores neuromusculares (BN), benzodiazepinas, opiáceos, antisépticos e hipnóticos sedantes, mediante punción cutánea en la cara anterior del antebrazo con una lanceta estéril con punta de 1 mm, sobre la cual se colocó previamente cada uno de los medicamentos señalados en las dosis dispuestas en los consensos internacionales (European Academy of Allergy and Clinical Immunology y American Academy of Allergy, Asthma & Immunology) (cuadro 1), con control positivo con histamina y control negativo con solución salina fenolada, y su posterior lectura a los 15 minutos, considerando una interpretación positiva ante una pápula mayor a 3 mm de diámetro, comparada con el control negativo.
Cuadro 1 Concentraciones no irritativas de fármacos para pruebas cutáneas de alergia perioperatoria
Fármaco |
Grupo |
Presentación |
Pruebas cutáneas |
Pruebas intradérmicas |
||
Dilución |
Dilución |
|||||
Cisatracurio |
2 mg/mL |
Sin diluir |
2 mg/mL |
1/100 |
0.02 mg/mL |
|
Rocuronio |
10 mg/mL |
Sin diluir |
10 mg/mL |
1/200 |
0.05 mg/mL |
|
Vecuronio |
4 mg/mL |
Sin diluir |
4 mg/mL |
1/10 |
0.4 mg/mL |
|
Succinilcolina |
50 mg/mL |
1/5 |
10 mg/mL |
1/500 |
0.1 mg/mL |
|
Látex (ext. Com.) |
Mixto |
1 mg/mL |
Sin diluir |
1 mg/mL |
No |
No |
Propofol |
Hipnótico |
10 mg/mL |
1/10 o sin diluir |
1-10 mg/mL |
1/10 |
1 mg/mL |
Ketamina |
Hipnótico |
10 mg/mL |
1/10 o sin diluir |
1-10 mg/mL |
1/10 |
1 mg/mL |
Tiopental |
Hipnótico |
25 mg/mL |
Sin diluir |
25 mg/mL |
1/10 |
2.5 mg/mL |
Midazolam |
Hipnótico |
5 mg/mL |
1/10 o sin diluir |
0.5-5 mg/mL |
1/10 |
0.5 mg/mL |
Etomidato |
Hipnótico |
2 mg/mL |
Sin diluir |
2 mg/mL |
1/10 |
0.2 mg/mL |
Fentanilo |
Opioides |
0.05 mg/mL |
Sin diluir |
0.05 mg/mL |
1/10 |
0.005 mg/mL |
Morfina |
Opioides |
10 mg/mL |
1/10 |
1 mg/mL |
1/1000 |
0.01 mg/mL |
Pirazolonas |
Metamizol 500 mg/mL |
1/500 |
1 mg/mL |
1/5000 |
0.1 mg/mL |
|
Clorhexidina |
Antiséptico |
5 % |
1/1000 |
5 mg/mL |
1/1000,000 |
0.005 mg/mL |
Yodopovidona |
Antiséptico |
7.5 % |
1/1000 |
7.5 mg/mL |
1/1000,000 |
0.0075 mg/mL |
Lidocaína |
Amino-amida |
20 mg/mL |
1/10 |
2 mg/mL |
1/100 |
0.2 mg/mL |
Bupivacaína |
Amino-amida |
5 mg/mL |
1/10 |
0.5 mg/mL |
1/100 |
0.05 mg/mL |
Mepivacaína 3 % |
3 mg/mL |
1/10 |
0.3 mg/mL |
1/100 |
0.03 mg/mL |
|
C. máx. = concentración máxima, BN = bloqueadores neuromusculares, AINE = antiinflamatorios no esteroideos, Amino-amida = antisépticos, anestésicos locales
Ante resultados negativos de la prueba anterior se procedió a la realización de pruebas intradérmicas mediante la inoculación de 0.1 mL del concentrado alergénico diluido conforme lo dispuesto en consensos y revisiones internacionales (cuadro 1), con una jeringa de 1 mL (tipo insulina) y agujas calibre 26 o 27, en un ángulo de 45 grados en la cara anterior del antebrazo, con un con control positivo de histamina y control negativo con solución salina fenolada; la lectura se realizó a los 15 minutos y se consideró resultado positivo ante una pápula mayor de 5mm en el diámetro longitudinal máximo comparado con el control negativo.
Se excluyó a los pacientes con dermatosis generalizada, uso de antihistamínicos o corticoides antes de las pruebas cutáneas, aquellos que no firmaron el consentimiento informado y los programados para un nuevo procedimiento quirúrgico de urgencia.
Se realizó un análisis descriptivo, para lo cual se obtuvieron promedios y desviaciones estándar en variables cuantitativas y frecuencia para variables cualitativas. El análisis de los datos se realizó en el programa estadístico SPSS versión 26.0.
Resultados
En el periodo de estudio se registraron 32 casos de alergia perioperatoria; fueron eliminados dos pacientes por no aceptar los procedimientos de pruebas cutáneas y dos al no acudir a la realización de las mismas,. En total se incluyendo solo 28 pacientes, en los cuales se realizaron 168 pruebas cutáneas y 60 pruebas intradérmicas (cuadro 2).
Cuadro 2 Características generales población estudiada
Edad promedio |
Media ± DE |
|
Hombres |
49.75 ± 7.681 |
|
Mujeres |
49.5 ± 7.58 |
|
n |
% |
|
Participantes |
28 |
100 |
Hombres |
8 |
28.57 |
Mujeres |
20 |
71.42 |
Antecedente de cirugía previa |
||
Sí |
25 |
89.28 |
No |
3 |
10.71 |
Antecedente de alergia a fármacos |
||
Sí |
4 |
14.28 |
No |
24 |
85.71 |
Periodo de reacción alérgica | ||
Preoperatorio |
1 |
3.57 |
Transoperatorio |
10 |
35.17 |
Posoperatorio |
17 |
60.71 |
DE = desviación estándar
De los pacientes con alergia perioperatoria, en 67.8 % (19 pacientes) fue posible determinar el agente causal únicamente mediante prueba de punción cutánea y en 32.1% (9 pacientes) fue necesario la realización de pruebas intradérmicas (figura 2).
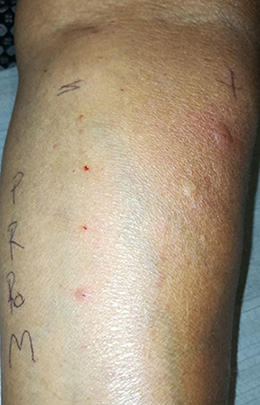
Figura 2 Punción cutánea + histamina (control positivo), solución salina (control negativo), P = propofol, M = midazolam, RO = rocuronio, R = rupivacaína.
42.8 % (12 pacientes) se encontró polisensibilizado y el resto monosensibilizado (57.2%). Los alérgenos asociados con mayor frecuencia fueron los BN (46.4 % de los pacientes sensibilizados), seguidos por el látex (28.5%) y el propofol (14.2%) (cuadro 3).
Cuadro 3 Agentes causales de alergia perioperatoria
Característica |
n |
% |
Pacientes |
28 |
100 |
Bloqueadores neuromusculares |
13 |
46.42 |
Rocuronio |
6 |
21.42 |
Vecuronio |
6 |
21.42 |
Cisatracurio |
1 |
9 |
Antibióticos |
0 |
0 |
Cefalosporinas |
0 |
0 |
Clindamicina |
0 |
0 |
Penicilina |
0 |
0 |
Látex |
8 |
28.52 |
Benzodiazepinas |
2 |
7.14 |
Midazolam |
2 |
7.14 |
Opiáceos |
3 |
10.71 |
Fentanilo |
1 |
3.57 |
Buprenorfina |
1 |
3.57 |
Morfina |
1 |
3.57 |
Tramadol |
0 |
0 |
Amino-amidas (anestésicos locales) |
3 |
10.71 |
Lidocaína |
3 |
10.71 |
Antisépticos |
0 |
0 |
Clorhexidina |
0 |
0 |
Yodopovidona |
0 |
0 |
Hipnóticos |
4 |
14.28 |
Propofol |
4 |
14.28 |
Ketamina |
0 |
0 |
AINE |
1 |
9 |
Metamizol |
1 |
9 |
Ácido acetilsalicílico |
0 |
0 |
Respecto al tipo de reacciones alérgicas en los 32 pacientes con interconsulta al Servicio de Alergia e Inmunología Clínica del Hospital General de México Dr. Eduardo Liceaga, la muestra preliminar reportó que 30 presentaron AP inmediata y dos retardada (exantema maculopapular y síndrome DRESS); ningún paciente con respuesta retardada acudió al protocolo de diagnóstico subsecuente.
Los 28 pacientes (100 %) de la muestra final presentaron AP. Respecto a la severidad y síntomas, 24 (85.7%) presentaron manifestaciones cutáneas, tres (10.7%) síntomas respiratorios y cinco (17.8%) anafilaxia, de tal forma que 20 (71.4%) presentaron síntomas leves, tres (10.7%) síntomas moderados y 15 (17.8%) síntomas severos (cuadro 4).
Cuadro 4 Características de alergia perioperatoria
Característica |
n |
% |
Número participantes |
28 |
100 |
Síntomas y signos compatibles alergia perioperatoria |
28 |
100 |
Síntomas cutáneos |
24 |
85.71 |
Rash urticariforme |
22 |
78.57 |
Angioedema |
4 |
14.28 |
Eritema |
20 |
71.42 |
Síntomas respiratorios |
3 |
10.71 |
Broncoespasmo |
2 |
7.14 |
Hipoxemia |
1 |
3.5 |
Síntomas cardiovasculares |
5 |
17.85 |
Bradicardia |
2 |
7.14 % |
Hipotensión |
4 |
14.28 |
Paro cardiorrespiratorio |
0 |
0 |
Síntomas gastrointestinales |
0 |
0 |
Síntomas neurológicos |
0 |
0 |
Severidad de reacciones de hipersensibilidad | ||
Reacción hipersensibilidad leve |
20 |
71.42 |
Reacción hipersensibilidad moderada |
3 |
10.71 |
Reacción hipersensibilidad severa (anafilaxia) |
5 |
17.85 |
Discusión
Las reacciones de hipersensibilidad perioperatorias constituyen un problema de salud en el mundo debido a su alta morbimortalidad, la incapacidad para prevenirlos, el riesgo de sensibilización por la administración necesaria de medicamentos en múltiples ocasiones e incluso en una primera exposición, la alternancia en la presentación clínica, el difícil diagnóstico precoz y la dificultad para determinar el fármaco o agente causal debido a la administración de diferentes fármacos durante la cirugía y, por último, a la ausencia de consensos de diagnóstico y tratamiento de AP.
La tasa de incidencia de anafilaxia durante anestesia varía conforme a cada población y país, por ejemplo, se ha registrado 1:2000 a 1:20 000 de prevalencia mundial, 1:3500 en Canadá, 1:6000 en Noruega, 1:10 000 a 1:20 000 en Australia y 1:34 000 en Estados Unidos.4 En México no existe registro bibliográfico sobre incidencia o prevalencia de reacciones de hipersensibilidad perioperatorias, sin embargo, en los resultados de nuestro estudio la severidad de estas reacciones no difirieron de lo observado en otros países.
Los factores de riesgo y pronósticos más importantes para el desarrollo de alergia perioperatoria reportados son edad, presencia de atopia, alergia a fármacos, antecedente de cirugía previa, tratamiento con inhibidores de enzima convertidora angiotensina, betabloqueadores y antidepresivos tricíclicos. Los principales factores pronósticos de severidad en la alergia perioperatoria son retraso en el diagnóstico y antecedente de alergia previa a fármacos.
En nuestro estudio, el principal factor de riesgo fue el antecedente de cirugía previa (89%), por lo que consideramos que en la mayoría de las reacciones de AP en el Hospital General de México se tuvo una primera sensibilización al agente casual en un evento quirúrgico previo.
Respectos a análisis de mayor escala, un estudio francés reportó que los agentes causales de alergia perioperatoria fueron los bloqueadores neuromusculares (69% ) el látex (12%), los antibióticos (8% ), los hipnóticos (3% ), los coloides (2% ), los anestésicos tipo amino-amidas y los antisépticos.1 Por otro lado, en Estados Unidos se reporta a los antibióticos como la primera causa de AP (50 %). Existen reportes especiales de mayor incidencia de AP a antisépticos en Noruega y Suecia.4 En nuestra investigación, la AP fue secundaria en mayor parte al uso de bloqueadores neuromusculares. Llaman la atención dos aspectos: la ausencia del uso de reversores de relajantes musculares, que probablemente podrían disminuir la incidencia y mejorar el pronóstico de las AP, así como la ausencia de reacciones alérgicas a antibióticos, que pudiera explicarse por el uso frecuente de cefalosporinas de tercera generación como agente profiláctico en los cirugías, el cual tiene un menor grado de reactividad cruzada en pacientes con alergia a penicilinas (< 3%) y, por ende, menor potencial alergénico a los antibióticos usados en otros países.
En cuanto a la presentación clínica, en la literatura se reportan las manifestaciones cutáneas (80%) y las respiratorias (50%).6 En nuestro estudio, las manifestaciones cutáneas se observaron en 84% de los pacientes y en mucho menor medida las respiratorias (10%), probablemente debido a la gran cantidad de reacciones posoperatorias reportadas en nuestro estudio en el periodo posoperatorio (60.71%) y al menor número en el transoperatorio.
El diagnóstico de AP es prácticamente clínico, por lo que deberá ser sospechado por el médico anestesiólogo o el cirujano ante cualquier síntoma o signo cutáneo o respiratorio de aparición en el periodo transoperatorio o posoperatorio, mientras que el diagnóstico de anafilaxia deberá ser sospechado ante cualquier manifestación sistémica asociada (hipotensión refractaria a vasopresores, disociación ventilatoria, hipoxemia, broncoespasmo, bradicardia). En nuestra experiencia, el diagnóstico de sospecha siempre fue realizado por el medico anestesiólogo y el contacto con el servicio de alergia fue realizado por el servicio tratante (cirugía general, ginecobstetricia, urología, etcétera). En nuestra unidad hospitalaria no contamos con la medición de triptasa sérica, por lo cual el diagnóstico fue fundamentalmente clínico, lo cual podría generar cierto sesgo.
El diagnóstico y tratamiento específico fue realizado por el Servicio de Inmunología Clínica y Alergia mediante pruebas cutáneas y pruebas intradérmicas (considerando su simplicidad, rapidez, bajo costo y alta especificidad), debido a la falta de disponibilidad de pruebas in vitro. Después de la determinación del agente causal específico de AP se ofreció tratamiento alternativo y se indicó evitar fármacos que pudieran tener algún tipo de reactividad cruzada. En nuestra experiencia se sugirió como tratamiento alternativo en AP a bloqueadores neuromusculares, el cisatracurio, con menor grado de reactividad cruzada, y como segunda opción la inducción anestésica con agentes inhalados o con combinaciones de opioides y agentes hipnóticos (como midazolam, propofol, fentanilo). En el caso de AP a látex, el uso de un quirófano libre de látex y el uso de guantes de nitrilo o polivinilo fueron la indicación prescrita. En el caso de AP a hipnóticos (propofol) se recomendó el uso de etomidato o ketamina para los pacientes con riesgo cardiovascular o inestabilidad hemodinámica. En el caso de alergia a anestésicos locales se recomendó un anestésico local del grupo amidas, el cual previamente haya demostrado negatividad en las pruebas cutáneas. En el caso de AP a AINE se recomendó el uso de COX selectivos (celecoxib, etorixocib o parecoxib).
Conclusiones
En el Hospital General de México y en la población mexicana que se atiende en el área de quirúrgica, las reacciones alérgicas perioperatorias más frecuentes fueron las de hipersensibilidad inmediata. Los signos cutáneos fueron los más encontrados (85.71 %). La mayoría de las reacciones de AP fueron leves (71.42% ). El factor de riesgo más común fue la sensibilización a un alérgeno en una cirugía previa (89.28% ). Los alérgenos más frecuentes de alergia perioperatoria fueron los bloqueadores neuromusculares (46.42 %), el látex (28.52%) y el propofol (14.28%).
Es importante conocer la frecuencia de los medicamentos y sustancias asociados con AP en México, por la alta morbimortalidad e impacto de este evento en la medicina legal y porque su pronóstico depende principalmente de un diagnóstico y tratamiento tempranos. El diagnóstico y tratamiento iniciales siempre deberán efectuarse por el médico anestesiólogo o cirujano encargado, orientados al retiro de los posibles agentes causales, al adecuado soporte vital y a la administración temprana de adrenalina. Después de la remisión del cuadro, el abordaje diagnóstico específico de las sustancias responsables de dicho cuadro deberá realizarlo el medico alergólogo, para fundamentar un tratamiento alternativo en cualquier futura exposición o cirugía.











 nueva página del texto (beta)
nueva página del texto (beta)