Services on Demand
Journal
Article
Indicators
Related links
Share
Revista mexicana de ciencias agrícolas
Print version ISSN 2007-0934
Rev. Mex. Cienc. Agríc vol.4 n.spe6 Texcoco Aug./Sep. 2013
Artículos
Patogenicidad de Metarhizium anisopliae y Beauveria bassiana sobre mosca blanca (Bemisia tabaci)*
Pathogenicity of Metarhizium anisopliae and Beauveria bassiana on whitefly (Bemisia tabaci)
Emilio García Ramírez1,2,3§, Rafael Pérez Pacheco1, Bernardino Leonardo León Enríquez2 y Lina Pliego Marín2
1 Centro Interdisciplinario de Investigación para el Desarrollo Integral Regional Unidad Oaxaca (CIIDIR-IPN-Oaxaca), Calle Hornos # 1003, Colonia Indeco, Santa Cruz Xoxocotlán, Oaxaca. C. P. 71230. (951) 5170610, 51704 00 y 5171199. (rafaelperezpacheco@yahoo.com; linapliego@hotmail.com; ciidiroaxaca@ipn.mx).
2 Instituto Tecnológico del Valle de Oaxaca (ITVO), ex-hacienda de Nazareno, Xoxocotlán, Oaxaca. C. P. 71230. Tel. (951) 5170788 y Fax. 5170444. (bernardino.leonardo@gmail.com).
3 Laboratorio Reproductor de Organismos Benéficos del Sureste, S. A. Calle Lázaro Cárdenas # 10 Reyes, Etla, Oaxaca. Tel. (951) 52159913. § Autor para correspondencia: gare17@hotmail.com.
* Recibido: septiembre de 2013.
Aceptado: marzo de 2013.
Resumen
Las alternativas para el control de Bemisia tabaci son insuficientes. El uso de hongos entomopatógenos es una de estas alternativas, pero falta información de patogenicidad en cuanto a concentración de conidios y su almacenamiento. Por otro lado, los protocolos para la evaluación de mortalidad presentan fallas que deben corregirse. La investigación se hizo en el Instituto Tecnológico del Valle de Oaxaca, durante 2010. Se evaluaron dos hongos entomopatógenos (Metarhizium anisopliae y Beauveria bassiana) con distintas concentraciones de conidios para el control de B. tabaci en Solanum lycopersicum en invernadero, usando el protocolo de Ortega et al. (1998) modificada en esta investigación. La mortalidad de B. tabaci disminuyó al reducir el tiempo de ayuno y adaptando una puntilla y tela en la micropipeta. Por su parte, la mortalidad de B. tabaci en todas las concentraciones de conidios de los dos hongos entomopatógenos sin almacenar, fue igual que el insecticida químico. Cuando los conidios se almacenaron en refrigerador, la mortalidad fue mayor con los tratamientos B. bassiana con una concentración de 2.1 x 106 conidios mL-1 y el insecticida químico, lo que indica que el almacenamiento de los conidios disminuye su patogenicidad, principalmente en Metarhizium anisopliae.
Palabras clave: Bemisia tabaci, Metarhizium anisopliae, Beauveria bassiana, virulencia.
Abstract
The alternatives for the control of Bemisia tabaci are insufficient. The use of entomopathogenic fungus is one of these alternatives, but lack information regarding pathogenicity of conidia concentration and storage. Furthermore, protocols for assessing mortality have flaws that must be corrected. The research was done at the Technological Institute of Oaxaca Valley, in 2010. It were assessed two entomopathogenic fungus (Metarhizium anisopliae and Beauveria bassiana) with different concentrations of conidia for controlling B. tabaci in Solanum lycopersicum under greenhouse, using the protocol from Ortega et al. (1998) modified in this research; mortality of B. tabaci decreased by reducing the time of fasting and adapting a lace and fabric in the micropipette. For its part, the mortality of B. tabaci at all concentrations of conidia of the two entomopathogenic fungus without storage was the same as the chemical insecticide. When conidia were stored in a refrigerator, mortality was higher with treatment B. bassiana with a concentration of 2.1 x 106 conidia mL-1 and the chemical insecticide, which indicates that storage of conidia decreases pathogenicity mainly in Metarhizium anisopliae.
Key words: Bemisia tabaci, Metarhizium anisopliae, Beauveria bassiana, virulence.
Introducción
La mosca blanca es considerada una de las plagas de mayor importancia económica a nivel mundial por causar daños a diversos cultivos como tomate, algodón, calabacitas y a más de 500 especies de plantas ornamentales. El daño más importante de la mosca es como vector de virus (Ortega et al., 1998). El uso irracional de productos químicos sintéticos para su control ha traído diversas consecuencias, como: acumulación de residuos químicos en alimentos, desequilibrio ecológico por la eliminación de organismos benéficos, contaminación del ambiente, intoxicación de operadores y desarrollo de resistencia a productos químicos (Rodgers, 1993; Shah y Pell, 2003). Esta problemática ha desencadenado estrategias alternativas de control de esta plaga; una de ellas y, la cual se vislumbra como más viable, es el control biológico, en el cual están los hongos entomopatógenos.
Se reportan más de 20 especies de hongos entomopatógenos que infectan moscas blancas, entre los que destacan Aschersonia spp., Lecanicillium lecanii, Beauveria bassiana, Paecilomyces farinosus, P. fumosoroseusy P. javanicus. Estos entomopatógenos ocasionan epizootias sobre poblaciones de mosca blanca representando una alterativa viable para su control y demuestra su potencial como bioinsecticidas (Rodríguez y Bernal, 20 07). Metarhizium anisopliae y Beauveria bassiana son los hongos más estudiados y utilizados debido a la eficiencia y facilidad de multiplicación en laboratorio, constituyendo uno de los principales grupos de entomopatógenos utilizados en el control microbiano (Ibarra, 2006).
El presente trabajo se realizó con el fin de determinar la patogenicidad de los hongos entomopatógenos Metarhizium anisopliae y Beauveria bassiana en poblaciones de adultos de mosca blanca (Bemisia tabaci) en el cultivo de tomate (Solanum lycopersicum) bajo condiciones de invernadero y sometiendo los conidios a distintos tiempos de almacenamiento en frío.
Materiales y métodos
El trabajo de investigación se llevó a cabo durante 2010, en tres instituciones: en las instalaciones de horticultura protegida del Instituto Tecnológico del Valle de Oaxaca (ITVO); en el laboratorio del Centro Interdisciplinario de Investigación para el Desarrollo Integral Regional unidad Oaxaca del Instituto Politécnico Nacional (IPN) y en el Laboratorio Reproductor de Organismos Benéficos del Sureste S. A.
Para el establecimiento del experimento, fue necesario colectar y reproducir las poblaciones del material biológico. La cría masiva de la mosca blanca (B. tabaci) se estableció con adultos colectados sobre plantas silvestres de Santa Cruz Xoxocotlan, Oaxaca; los insectos fueron confinados en jaulas entomológicas (60 x 60 x 60 cm) cubiertas con malla antiáfidos, en cuyo interior se colocaron plantas de frijol (Phaseolus vulgaris) y de tomate (Solanum lycopersicum) como alimento, colocadas en bolsas de plástico negro que contenían una mezcla de suelo y vermiculita como medio de soporte. Los conidios de los hongos entomopatógenos Metarhizium anisopliae y Beauveria bassiana fueron obtenidos de cepas del Laboratorio Reproductor de Organismos Benéficos del Sureste S.A. La multiplicación de conidios se llevó a cabo en el mismo laboratorio, utilizando la metodología de Monzon (2001), modificada (arroz comercial como sustrato y cepas nativas).
Se utilizó un diseño completamente al azar de ocho tratamientos y tres repeticiones; tratamiento 1 B.bassiana 2.1 x 104 conidios mL-1; tratamiento 2 B.bassiana 2.1 x 106 conidios mL-1; tratamiento 3 B.bassiana 2.1 x 108 conidios mL-1; tratamiento 4 M.anisopliae 3.1 x 1010 conidios mL-1; tratamiento 5 M. Anisopliae 3.1 x 1011 conidios mL1; tratamiento 6M. anisopliae 3.1 x 1012 conidios mL1 y dos testigos: uno aplicando sólo agua y el otro donde se aplicó un insecticida químico en su dosis recomendada (2. 5 mL/5 0 mL de agua). Como unidad experimental se tomaron tres foliolos de tomate y diez adultos de mosca blanca.
El procedimiento incluyó dos fases: la de trasplante y el experimento. En el invernadero seestablecieron las plántulas de tomate (Solanum lycopersicum) cv. SXT 7705 en bolsas de plástico negras, utilizando arena de rio desinfectada como sustrato; el manejo del cultivo (tutoreo, poda de chupones, eliminación de arvenses, fertirrigación) se realizó con técnicas comunes para los Valles Centrales de Oaxaca. Ya establecidas las plántulas se inició el experimento que consistió en: almacenamiento de conidios, preparación de las soluciones (tratamientos), aplicación de soluciones, captura de adultos de mosca blanca de la cría masiva y toma de datos.
Almacenamiento de conidios. Con el objetivo de conocer que tanto le afecta el tiempo (almacenaje) a la patogenicidad de los hongos entomopatógenos, sus esporas se sometieron a tres lapsos de tiempo de refrigeración, que fueron: cero, seis y doce días después de su formulación.
Preparación de las soluciones. Se tomaron 20 mL de conidios y se disolvieron en 40 mL de agua, adicionándole 0.25 mL de adherente agrícola y se asperjaron con atomizadores de 60 mL. Para el insecticida químico se tomaron 2.5 mL y se disolvió en 50 mL de agua.
Aplicación. En una hoja cotiledonal, con la lámina completamente extendida de tomate, se asperjaron cada uno de los tratamientos correspondientes hasta el punto de escurrimiento y se dejó secar a temperatura ambiente. Posteriormente se sujetó una jaula entomológica pequeña (prototipo de Ortega, 2008a) a la hoja tratada y por un orificio lateral de la jaula se introdujeron los 10 adultos de mosca blanca (una a la vez) capturados previamente.
Captura. Mediante el método de inmersión de hoja (Ortega et al, 1998), con modificaciones propuestas para esta investigación. Con el fin de mantener vivos a los individuos durante su manejo, se adaptó un tubo de plástico haciendo la función de coplee para sujetar una pequeña tela de organza en la puntilla de micropipeta; para evitar la muerte de los individuos por las altas temperaturas se les dejó en ayuno sólo por media hora; y para mantener viables a las esporas de los hongos se dejó escurrir el producto asperjado en la hoja, sólo por 20 min.
Toma de datos. Los muestreos de mortalidad de adultos se realizaron a las 24, 48 y 72 h después de la aplicación de los tratamientos. Con la ayuda de una lupa se contaron los individuos muertos.
Análisis estadístico
Para cumplir los supuestos de normalidad de errores y homogeneidad de varianza los datos fueron transformados a raíz cuadrada (V(x+1)); se les aplicó un ANVA y una prueba de comparación múltiple de medias mediante la prueba de Tukey (0.05) mediante el programa Statistical Análisis System (SAS, Institute, 2005).
Resultados y discusión
Conidios sin almacenar
Todos los tratamientos donde se aplicaron conidios de hongos entomopatógenos sin almacenar causaron una mortalidad igual al insecticida químico, como se aprecia en la Figura 1 y fueron superiores al testigo donde sólo se asperjó agua. Beauveria bassiana con una concentración de 2.1 x 106 conidios mL-1 fue el que mayor mortalidad provocó en B. tabaci, seguido por el tratamiento químico y por Metarhizium anisopliae con una concentración de 1.3 x 1010 conidios mL-1 y 1.3 x 1012 conidios mL-1 (Figura 1).
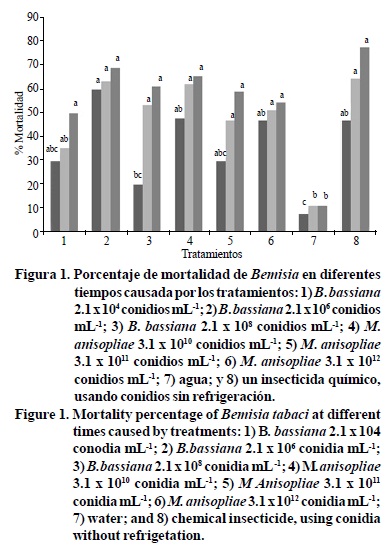
A las 48 h de aplicación, la mortalidad de B. tabaci fue igual para el insecticida químico y B. bassiana con una concentración de 2.1 x 106 conidios mL-1yM anisopliae con una concentración de 1.3 x 1010 conidios mL-1. A las 72 h, al comparar el efecto del insecticida químico en la mortalidad de B. tabaci con la mortalidad provocada por las esporas de B. bassiana y M. anisopliae en todas su concentraciones de conidios, sus efectos son iguales y superiores al testigo donde sólo se aplicó agua.
Evaluación de la patogenicidad de los conidios sometidos a refrigeración
En los muestreos hechos a las 24 h, se analizó que la efectividad de los conidios se ve disminuida por el almacenamiento bajo refrigeración. No se ve diferencia cuando los conidios se usan sin almacenar y al almacenarlos por seis días. Sin embargo, cuando los conidios se almacenan por 12 días su efecto se ve reducido.
Por otro lado, se puede notar (Cuadro 2) que el almacenamiento de conidios durante seis días afectó más a M anisopliae que a B. bassiana lo anterior demuestra la diferencia en resistencia de ambas especies.
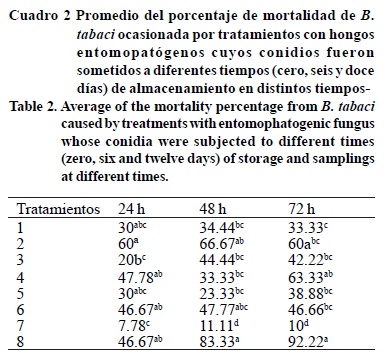
La mortalidad de B. tabaci en general, esto es, considerando conidios almacenados o sin almacenar en refrigeración, a las 24 h se observó que no hay diferencia entre la mortalidad (Cuadro 2) provocada por el insecticida químico y la mortalidad provocada por la patogenicidad de los hongos entomopatógenos. B. bassiana con una concentración de 2.1 x 106 conidios mL-1 fue el más cercano al tratamiento químico.
A las 48 h de aplicación al igual que en el muestreo a las 24 h se sigue observando que el almacenamiento de conidios bajo refrigeración afectó su patogenicidad causada a B. tabaci. El efecto del almacenamiento durante seis y 12 días en refrigeración se ve menos drástico en B. bassiana que en M. anisopliae. Los mejores tratamientos fueron: el insecticida químico y B. bassiana con una concentración de 2.1 x 106 conidios mL-1 este último tratamiento ligeramente por debajo del químico (Figura 2), así como lo encontrado por Wraightet al. (2000), quienes evaluaron el control microbiano de B. bassiana y P. fumosoroseusy contra B. argentifolii, los ensayos de laboratorio demostraron la capacidad de los agentes patógenos que infectan ninfas en hojas de hibisco aproximadamente 35% de infección, aplicando 0.6 a 1.4 X 103 conidiasmm-2 de la superficie de la hoja.
A las 72 h se observa que los tratamientos han ejercido un efecto semejante (Figura 2) sobre las poblaciones de B. tabaci. Se obtuvo una superioridad en la mortalidad de B. tabaci provocada por el insecticida químico aplicado en su dosis recomendada y B. bassiana con una concentración de 2.1 x 106 conidios mL-1. En éste resultado hay que considerar que este tratamiento tiene un buen resultado cuando sus conidios se usan sin almacenar y e almacenados hasta por 12 días. Quesada-Moraga et al. (2006), evaluaron la infectividad de 25 aislamientos nativos de B. bassiana y un micoinsecticida comercial contra ninfas de IV instar de B. tabaci y Trialeurodes vaporariorum a una concentración de 1 x 107conidios mL_1en condiciones de laboratorio. Todos los aislamientos fueron patogénicos para ambas especies de moscas blancas con tasas de mortalidad que varían de 3 a 85%.
También se puede notar que los dos hongos evaluados en este experimento y en sus distintas dosis de esporas tuvieron un efecto en la mortalidad de B. tabaci, siendo estos superiores en todos los casos (concentraciones de conidios y almacenamiento bajo refrigeración por diferentes lapsos de tiempo) a la simple aplicación de agua y adherente. Éste resultado confirma que los hongos entomopatógenos son una alternativa real en el control de esta plaga tan conflictiva (denominada así por la resistencia cruzada qua ha logrado, resultando en una baja mortalidad a diferentes insecticidas químicos aplicados en altas concentraciones) y que ha sido considerada devastadora en el campo agrícola oaxaqueño.
La investigación no debe dejar de considerar otras cepas de estos hongos ni dejar de probar otros entomopatógenos. B. tabaci puede ser controlada con otros hongos diferentes a B. bassiana y M. anisopliae y en concentraciones diferentes a las probadas en esta investigación. Como lo mencionan Hernández et al. (2008) quienes encontraron que el formulado en emulsión del hongo entomopatógeno Paecilomyces fumosoroseus presentó mayor mortalidad con una concentración de 1x107 conidios mL-1 sobre B. tabaci.
Por su parte ya se ha comprobado el efecto entomopatógeno de Beauveria bassiana tanto en Bemisia tabaci como en otros insectos plaga. Maldonado et al. (2005) mencionan que el hongo B. bassiana a una concentración de 1.2 x 1012 esporas/ ha controló de 60 a 85% de las siguientes plagas: picudo del chile (Anthonomus eugenii), gusano elotero (Heliothis zea) en el cultivo de chile; mayate dorado (Acalymma vittatum), mosca blanca (Bemisia tabaci) en el cultivo de calabacita, al gusano falso medidor (Trichoplusia ni), paloma blanca de la col (Pieris rapae) y a la palomilla dorso diamante (Plutella xylostella) en el cultivo de repollo. Por su parteM. anisopliae sólo controló de 20 a 40% de las plagas antes mencionadas.
En lo que respecta a M. anisopliae se han tenido ya algunas experiencias que denotan si efecto entomopatógeno. La mortalidad causada por M anisopliae en esta investigación tiene cierta semejanza con la mortalidad reportada por Mancebo et al. (2008) los autores localizaron que M. anisopliae causó mortalidades en cepas de Boophilus microplus con una concentración de 1 x 104 conidios/ml, esta concentración está por debajo de las concentraciones que se usaron en la presente investigación (1.3 x 1010, 1.3 x 1011 y 1.3 x 1012 conidios mL-1), lo que nos indica que M. anisopliae tiene un rango amplio de patogenicidad desde concentraciones bajas hasta concentraciones altas de esporas hacia diversos insectos considerados plagas.
Se observó que el insecticida químico presentó una mortalidad de 35 a 90% durante los tres días de muestreos, manteniendo un alto porcentaje de mortalidad sobre adultos de B. tabaci durante las tres evaluaciones. En cambio los hongos B. bassiana y M. anisopliae disminuyeron sus porcentajes de mortalidad en cuanto al tiempo de evaluación, lo que muy probablemente se debe a diversos factores, como mencionan Ignoffo (1992); Tanada y Kaya (1993) determinaron que la humedad y temperatura influyen en la capacidad de los hongos para infectar a sus insectos hospederos.
Conclusiones
Los tratamientos con entomopatógenos cuyos conidios no se almacenaron, provocaron una mortalidad sobre Bemisia tabaci igual a la causada por el insecticida químico. A las 24 h tres tratamientos con entomopatógenos no sobresalieron en su patogenicidad, pero a las 72 h la mortalidad de todos los tratamientos se igualó, con excepción del testigo donde sólo se aplicó agua.
Beauveria bassiana 2.1 x 106 conidiosmL-1 no tuvo reducción en la mortalidad (que fue superior a 60%) al ser almacenada hasta por 12 días en refrigeración (7° C aproximadamente), contrario a Metarhizium anisopliae que disminuyó su patogenicidad al ser refrigerado por seis y doce días.
Al usar conidios almacenados, los tratamientos más efectivos para el control de poblaciones de adultos de mosca blanca fueron: el Insecticida químico y las esporas del hongo entomopatógeno B. bassiana con una concentración de 2.1 x 106 conidiosmL-1.
De acuerdo a los resultados de mortalidad provocados por conidios almacenados bajo refrigeración por lapsos de tiempo diferentes, Metarhizium anisopliae disminuyó su patogenicidad en mayor grado que Beauveria bassiana.
Literatura citada
Claire, V.; Lance, S.; Osborne, L.; Lacey, A. and Fargues, J.1998. Effect of host plant on the potential of Paecilomyces fumosoroseus y (Deuteromycotina: Hyphomycetes) for Controlling the Silver leaf Whitefly, Bemisia argentifolii (Homoptera: Aleyrodidae) in Greenhouses. Biol. Control. 12:191-199. [ Links ]
Hernández, V. V.; Peña C. G.; Treyo, L.A.; Toriello, C. y Lina-García, L. P. 2008. Evaluación in vitro de formulados a base de Paecilomyces fumosoroseus para el control de Bemisia tabaci. In : Sociedad Mexicana de Control Biológico. 2008. XXXI. Congreso Nacional de Control Biológico. Memorias. 12-14 pp. [ Links ]
Ibarra, J.E.; Del Rincón, C. M .C.; Galindo, E.; Patiño, M.; Serrano, L.; García, R.; Carrillo, J.A.; Pereyra, A.B.; Alcázar, P.A.; Luna, O.H.; Galán, W.L.; Pardo, L.; Muñoz, G.C.; Gómez, I.; Soberón, M. y Bravo, A. 2006. Los microorganismos en el control biológico de insectos y fitopatógenos. Rev. Latinoam. Microbiol. 48(2): 113-120. [ Links ]
Ignoffo, C. M. 1992. Enviromental factors affecting persistence of entomopathogens. Florida Entomologist. 75:516-525. [ Links ]
Monzon, A. 2001. Producción, uso y control de calidad de hongos entomopatógenos en Nicaragua. Manejo Integrado de Plagas. 63:95-103. [ Links ]
Maldonado, G. M. B.; García, G. C. y Rivas,A. S. 2005. Evaluación del uso de Beauveria bassiana (Vuill) y Metarthizium anisopliae (Metschi) para el control de plagas de hortalizas en unidades de producción rural. In: Sociedad Mexicana de Control Biológico. 2005. XXVIII. Congreso Nacional de Control Biológico. Memorias. 196-197 pp. [ Links ]
Mancebo, A. M.; Fernández, R. M.; Peña, C. G. y Hernández, V. V. 2008. Virulencia de Metarhizium anisopliae sobre cepas de Boophilus microplus triple resistente a ixodicidas. In: Sociedad Mexicana de Control Biológico. 2008. XXXI. Congreso Nacional de Control Biológico. Memorias. 6-9 pp. [ Links ]
Ortega, A. L. D. 2008a. Bioecología de las moscas blancas. In: moscas blancas: temas selectos sobre su manejo. Infante, G. S. (Ed.). Editorial Colegio de Postgraduados- Mundi Prensa. México, D. F. 146 p. [ Links ]
Ortega, A. L. D. 2008b. Moscas blancas. Temas selectos sobre su manejo. Infante, G. S. (Ed.). Editorial Colegio de Postgraduados- Mundi Prensa. México, D. F. 146 p. [ Links ]
Ortega, A. L. D.; Lagunes, A.; Rodríguez, J. C.; Rodríguez, C.; Alatorre, R. y Barcenas N. M. 1998. Susceptibilidad a insecticidas en adultos de mosquita blanca Trialeurodes vaporariorum (West.) (Homóptera: Aleyrodidae) de Tepoztlán, Morelos, México. Agrociencia 32(3):249-254. [ Links ]
Quesada-Moraga, E.; Maranhao E. A. A.; Valverde-García, P. and Santiago-Álvarez C. 2006. Selection of Beauveria bassiana isolates for control of the whiteflyes Bemisia tabaci and Trialeurodes vaporariorum on the basis of their virulence, thermal requirements, and toxicogenic activity. Biological Control 36:274-287. [ Links ]
Rodríguez,A. y Del Pozo, E. 2003.Aislamiento de hongos entomopatógenos en Uruguay y su virulencia sobre Trialeurodes vaporariorum West. Agrociencia. 7(2):71-78. [ Links ]
Rodríguez, B. L. A. y Bernal, H. C. A. 2007. Teoría y aplicación del control biológico. Sociedad Mexicana de Control Biológico, México. 128-129 pp. [ Links ]
Rodgers, P. B. 1993. Potential of biopesticides in agriculture. Pestic. Sci. 39:117-129. [ Links ]
Ruíz, V. J. y Medina, Z. J. 2001. Avances en el manejo integrado de Bemisia tabaci en tomate y chile en Oaxaca, México. 34- 40 pp. [ Links ]
Ruiz, V. J.; Aquino, B. T.; Ibarra, R. J.; Arce, G, F. y García, G. J. 1998. Barreras de maíz envenenadas y hongos entomopatógenos para el control de mosca blanca. Horticultura Mexicana. 6(1):8-14. [ Links ]
Salas, J. y Mendoza, P. 1994. Manejo integrado de la mosca blanca en Venezuela. Rev. Fonalap. Divulgada Núm. 45. [ Links ]
Statistical Analysis System (SAS) Institute. 2005. SAS user's guide. Statistics. Version 9.01. SAS Inst., Cary, NC. USA. [ Links ]
Shah, P. A. and Pell, J. K. 2003. Entomopathogenic fungi as biological control agents. Appl. Microbiol. Biotecnol. 61:413-423. [ Links ]
Tanada, Y. and Kaya, H. 1993. Insect pathology. Academic Press. San Diego, California. USA. 666 p. [ Links ]
Wraight S. P.; Carruthers, R. I.; Jaronskis, T.; Bradley, C. A.; Garza, C. J. and Galaini-Wraight, S. 2000. Evaluation of the entomopathogenic fungi Beauveria bassiana and Paecilomyces fumosoroseus for microbial control of the silver leaf whitefly, Bemisia argentifolii. Biological Control 17:203-217. [ Links ]














