El tiburón azul Prionace glauca (Linnaeus, 1758), es una especie pelágica que se distribuye en las aguas templadas y tropicales del mundo (Compagno, Dando y Fowler, 2005). El reclutamiento y abundancia de una especie depende principalmente de las características de su reproducción; en los elasmobranquios se producen diversas estrategias reproductivas como la madurez tardía, la fecundidad baja y los largos periodos de gestación (Cortés, 2000). El tiburón azul P. glauca presenta una fecundidad promedio de 30 crías, con periodos de gestación de 9 a 12 meses (Snelson, Burgess y Roman, 2008), es una especie relativamente grande, alcanzando los 400 cm de longitud total (Martínez-Ortiz y García-Domínguez, 2013).
En el Pacífico ecuatoriano esta especie es capturada incidentalmente con artes de pesca espinel o palangre de superficie por la flota artesanal, y representa la segunda especie de tiburón de mayor captura, y constituye entre el 13.85% y el 19.36% en peso del total de tiburones capturados en aguas de Ecuador (Martínez-Ortiz y García-Domínguez, 2013). Tomando en cuenta que los aspectos de la biología reproductiva de una especie juegan un papel importante para el manejo de las pesquerías (Trindade-Santos y Freire, 2015), el principal objetivo de este estudio es dar a conocer resultados importantes de varios aspectos reproductivos del tiburón azul P. glauca en aguas ecuatorianas, sobre la base principal de las características sexuales externas de la especie.
Se realizaron muestreos en la localidad de Playita Mía, Manta, Ecuador (0°56′59′′ S, 80°42′34″ O), entre septiembre de 2011 y agosto de 2012. La localidad de Playita Mía, Manta, es representativa respecto a la presencia de tiburones debido al alto número de desembarque de especies de elasmobranquios en el área (Martínez-Ortiz et al., 2007). Los organismos fueron medidos en centímetros (cm) en su longitud total (LT), precaudal (LP) y sexados. El órgano copulador de los machos (clasper) fue medido desde el punto de rotación hasta la punta del mismo; además la madurez sexual fue determinada mediante el grado de calcificación de acuerdo con 3 categorías: 0 no calcificado; 1 semi-calcificado; 2 calcificado: 2 corresponde a machos maduros.
Para graficar la composición de las tallas se utilizó un histograma; las comparaciones entre las medias de las tallas de machos y hembras se realizaron mediante una prueba de t-student. La proporción sexual se analizó mediante la hipótesis nula de igualdad de 1:1, para lo que se utilizó la prueba χ2. La relación morfométrica entre LT y LP se realizó mediante un análisis de regresión lineal y se utilizó un análisis de covarianza (Ancova) para evaluar las diferencias entre sexos.
La madurez sexual en los machos se estableció sobre dos criterios: 1) mediante el ajuste de una curva logística modificada con datos crudos para conocer el punto de inflexión de la curva y 2) con el ajuste de un modelo logístico (P=1/1+eα+( b × LT )) a los datos binomiales de madurez del clasper para estimar la talla media de madurez (LT50). Todos los análisis estadísticos se realizaron en R (R Development Core Team, 2012) y se utilizó el paquete FSA (Ogle, 2014).
Se registraron un total de 577 individuos, con tallas de 130 a 307 cm de LT, de los cuales 298 eran machos y 279 hembras, con una proporción similar de ambos sexos: de 1.06 machos: 1 hembras (χ2 = 0.03, p =0.43), las tallas de los machos oscilaron de 137 a 307 (media =217.2 ± 39.47) cm de LT y las hembras de 136 a 297.4 (media =214.1 ± 25.90) cm de LT (fig. 1). Los machos presentaron tallas mayores a las hembras, pero no hubo diferencias significativas en las tallas entre machos y hembras (t =1.1, p =0.26). Se encontró una correlación positiva entre LT y LP del tiburón azul (R 2 =0.94) (fig. 2) y no se registraron diferencias entre sexos (Ancova =0.71, p =0.39).

Figura 1 Composición de tallas de machos y hembras del tiburón azul Prionace glauca desembarcados en la localidad de Playita Mía, Manta, Ecuador.

Figura 2 Relación entre la longitud precaudal y total del tiburón azul Prionace glauca. Se ajustó una regresión lineal por y=6.74+0.72 x, coeficiente de correlación r=0.95, p<0.001.
En los machos del tiburón azul P. glauca se registraron 49 organismos con clasper no calcificados, 26 semicalcificados y 222 con clasper totalmente calcificados (fig. 3A). Los machos con claspers inmaduros (no calcificados) presentaron tallas de 136.0 a 191.8 cm de LT con una longitud de clasper (LC) de 4 a 12.6 cm, mientras los organismos con clasper en etapa de maduración (semicalcificados) presentaron tallas de 156.8 a 210.0 cm de LT y LC de 8.6 a 13.8 cm. Los machos con claspers maduros (calcificados) tuvieron tallas de 168.4 a 307.0 cm de LT y LC de 9.8 a 21.2 cm. El punto de inflexión del clasper se estimó en 189.7 cm. La talla media de madurez en los machos fue de 187.1 cm de LT (fig. 3B).
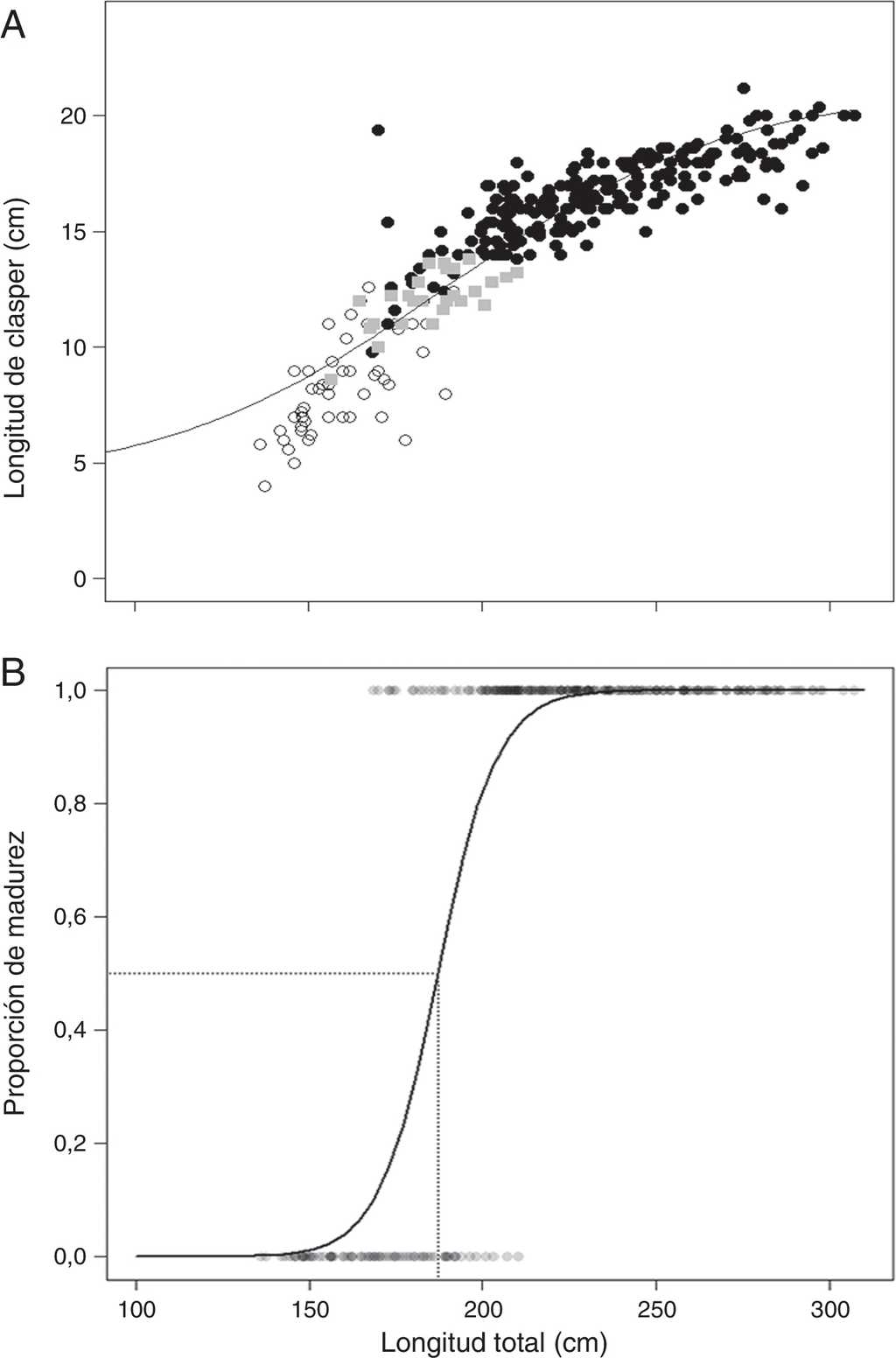
Figura 3 Relación entre la longitud del clasper y la longitud total (A) de acuerdo con la calcificación del clasper en machos; la curva se ajustó mediante una curva logística modificada por y=4+{(21.2-4) [1+e0.02(189.7−LT)]-1}, p<0.001. Talla de media de madurez LT50 (B) en machos del tiburón azul Prionace glauca.
Nuestros resultados muestran que el tiburón azul presentó tallas de 130 a 307 cm de LT, resultados que difieren a los registrados en otras áreas como Chile, donde la talla menor fue la de un juvenil de 52 cm de LT (Bustamante y Bennett, 2013); de igual manera sucedió en aguas mexicanas donde la talla menor registrada por Carrera-Fernández, Galván-Magaña y Ceballos-Vázquez (2010) para el área de Baja California Sur fue de 81 cm de LT, mientras que Cruz-Ramírez, Soriano-Velásquez, Santana-Hernández, Ramírez-Santiago y Acal-Sánchez (2012) documentaron para la región de Puerto Manzanillo, México, la talla menor en 77 cm de LT. El reporte de tallas menores para ciertas regiones del Pacífico mexicano se podría deber a que, de acuerdo con Salomón-Aguilar, Villavicencio-Garayzar y Reyes-Bonilla (2009), estas representan importantes áreas de reproducción, nacimiento y crianza para varias especies de tiburones.
La proporción de sexos registrada en este estudio difiere a lo encontrado en otros trabajos para México, donde de acuerdo con Carrera-Fernández et al. (2010), en la región de Baja California Sur, los machos presentaron una abundancia mayor que las hembras, mientras que en el área de Puerto Manzanillo, de acuerdo con Cruz-Ramírez et al. (2012), las hembras fueron más abundantes. Para un estudio realizado en aguas abiertas en el sureste del Pacífico, Zhu, Dai, Xu, Chen y Chen (2011) también registraron un mayor número de machos. Estas diferencias muestran una posible segregación sexual aunque estos resultados pueden estar influenciados por el esfuerzo de muestreo en cada investigación.
El conocimiento de aspectos biológicos de una especie juega un papel importante para el manejo de las pesquerías (Trindade-Santos y Freire, 2015); en nuestro estudio se presenta información sobre aspectos reproductivos basados en características externas en machos del tiburón azul en aguas ecuatorianas; así también se estimó que los órganos copuladores en los machos alcanzan su madurez a los 168.4 cm de LT, resultados que difieren del estudio realizado en Chile donde el clasper de los machos alcanza su madurez en organismos de 195 cm de LT hacia arriba (Bustamante y Bennett, 2013).
De igual manera como se realiza en otros estudios con especies de elasmobranquios diferentes a P. glauca, se utilizó la longitud y calcificación del clasper para estimar la madurez en machos (Mejía-Falla, Navia y Cortés, 2012; Romero-Caicedo, Galván-Magaña y Martínez-Ortiz, 2014). En el presente estudio se estimó un punto de inflexión del clasper de 189.7 cm de LT y una talla media de madurez en machos de 187.1 cm de LT; estas representan tallas similares a las que se han reportado anteriormente en otras áreas del océano Pacífico oriental (Bustamante y Bennett, 2013; Carrera-Fernández et al., 2010; Cruz-Ramírez et al., 2012).
Sugerimos que se debería realizar un estudio en profundidad y presentar, sobre todo, la biología reproductiva del tiburón azul P. glauca como principal factor para conocer el estado de conservación y para ampliar el conocimiento sobre la biología de la especie en aguas ecuatorianas.
Los autores agradecen a la Universidad Laica “Eloy Alfaro” de Manabí, a los comerciantes, pescadores y evisceradores de la localidad pesquera de Playita Mía, Manta, Ecuador, por permitir la colecta de información para llevar a cabo el presente estudio.











 text new page (beta)
text new page (beta)


