Abreviaturas:
Unidades | |
Logaritmo de base 10 = |
log |
Microlitros = |
μL |
Mililitros = |
mL |
Picogramos = |
pg |
Porcentaje = |
% |
Revoluciones por minuto = |
rpm |
Segundos = |
seg |
Siglas
APC = |
células presentadoras de antígeno. |
BANA = |
Nα-benzoyl-DL-arginine β-naphtilamide. |
BMPs = |
proteínas morfogénicas óseas |
Ep = |
células epiteliales gingivales. |
FGC = |
fluido gingival crevicular. |
IFNγ = |
interferón gamma. |
IL = |
interleuquina. |
IL -1α = |
interleuquina 1 alfa. |
IL -1β = |
interleuquina 1 beta. |
IL -1AcP = |
proteína accesoria del receptor a IL-1. |
IL -1Rα = |
IL-1 receptor antagonista. |
IL -1RI = |
receptor a IL-1 tipo I. |
IL -1RII = |
receptor a IL-1 tipo II. |
iNOS = |
oxidasa del óxido nítrico. |
LB = |
linfocito B. |
LT = |
linfocito T. |
LPS = |
lipopolisacárido bacteriano. |
MCH = |
complejo principal de histocompatibilidad. |
MMPs = |
metaloproteinasas de matriz. |
NK = |
leucocitos asesinos naturales o natural killers. |
PAMPs = |
patrones moleculares asociados con patógenos. |
PGE2 = |
prostaglandina E2. |
PGI2 = |
prostaglandina I2. |
PMN = |
leucocitos polimorfonucleares. |
RAR = |
raspado y alisado radicular. |
TCR = |
receptor de células T. |
TH0 = |
linfocito T cooperador. |
TH1 = |
linfocito T cooperador 1. |
TH2 = |
linfocito T cooperador 2. |
TIMPs = |
inhibidores de metaloproteinasas de matriz. |
TNFα = |
factor de necrosis tumoral alfa. |
TNFβ = |
factor de necrosis tumoral beta. |
UFC = |
unidades formadoras de colonias. |
VCAM = |
molécula de adhesión a célula vascular. |
INTRODUCCIÓN
Dentro del ámbito de la enfermedad periodontal existen dos entidades que son distintivas y poseen claramente fenotipos definidos: gingivitis (G) y periodontitis (P). Estas condiciones pueden ser observadas clínicamente a través de un proceso inflamatorio crónico, aunque en un caso (periodontitis) este proceso involucra la destrucción del aparato de inserción periodontal y en el otro caso (gingivitis) el proceso inflamatorio se mantiene sin evolucionar hacia la destrucción.1-6Esta respuesta inflamatoria e inmunitaria está determinada por la presencia de patógenos periodontales que son bacterias Gram negativas involucradas en la biopelícula subgingival1,7,8,9,10,11 tales como Porphyromonas gingivalis , Aggregatibacter actinomycetemcomitans (Ac), Tannerella forsythia (Tf), Prevotella intermedia (Pi), Fusobacterium nucleatum (Fn), Parvimonas micra (Pm), Campylobacter rectus (Cr) y Actinomyces sp. ,11,12,13,14,15,16,17,18 así como los factores biológicos tales como la higiene bucal, tabaquismo y estrés.19 En el tejido de inserción periodontal, la respuesta inflamatoria se caracteriza por grandes cantidades de leucocitos neutrófilos polimorfonucleares (PMNs) y macrófagos con funciones destructivas y fagocitosis en el sitio de interacción con el tejido superficial, ocasionando la presencia de un infiltrado inflamatorio, la activación del sistema inmune de la cascada del complemento y la producción y liberación del sistema citocinas.10,20,21 Muchas de las sustancias son liberadas por el proceso inflamatorio y por las células inflamatorias concentradas en el exudado. Durante el proceso inflamatorio observado en gingivitis (G) y en periodontitis moderada (MCP), estas sustancias se encuentran en el fluido denominado fluido gingival crevicular (FGC). En este fluido se pueden identificar las siguientes citocinas proinflamatorias: interleucina 1-beta (IL-1β) así como el factor de necrosis tumoral alfa (TNFα). Ambas citocinas son mediadores del proceso inflamatorio porque estas moléculas modulan el componente extracelular del hueso y del tejido conectivo. En la enfermedad periodontal aparecen en altas concentraciones en el FGC, de aquí que pueda tener interés diagnóstico en G y en MCP y pueda ser asociado con la fase activa de estas condiciones.22,23,24,25
El objetivo de este estudio es contribuir al conocimiento de la flora microbiana de una muestra de la población mexicana y evaluar la relación que existe entre los microorganismos presentes con la respuesta inmune en gingivitis y periodontitis crónica moderada. Se realizó un estudio de cohorte prospectivo para encontrar aspectos diferenciales con respecto a los factores etiológicos y la respuesta del hospedero. Para lo cual se cuantificaron los niveles de IL-1β en el FGC utilizándose como marcador inmunológico y para examinar el efecto del tratamiento periodontal no quirúrgico (raspado y alisado radicular) en las fases de pretratamiento, postratamiento y mantenimiento.
MATERIAL Y MÉTODOS
Selección de pacientes
Dieciocho pacientes fueron seleccionados mediante diagnóstico clínico y radiológico de gingivitis (evidencia de inflamación gingival, aumento de volumen de las encías, enrojecimiento y hemorragia al sondeo sin pérdida de inserción epitelial) y 17 pacientes con periodontitis crónica moderada (pérdida de inserción en tres o más sitios en todos los cuadrantes, con profundidad de bolsa de 5-7 mm en tres o más sitios, evidencia radiográfica de pérdida de hueso ósea en un medio de la longitud de la raíz en tres o más sitios de todos los cuadrantes, sangrado al sondeo en tres o más sitios de cada cuadrante). Estos pacientes fueron atendidos en la Clínica Estomatológica de Tepepan de la Universidad Autónoma Metropolitana, Unidad Xochimilco de la Ciudad de México. Todos los pacientes firmaron una carta de consentimiento informado, no habían recibido tratamiento previo periodontal y participaron voluntariamente en este estudio. El tiempo promedio del muestreo fue de 12 meses.
Diseño del estudio
Después de una visita de selección inicial para el reclutamiento, durante las primeras ocho semanas, se registraron las mediciones de referencia y se tomaron muestras. Posteriormente, se llevó a cabo la instrucción de higiene y se realizó NSPT (raspado y alisado radicular) (SRP). Los pacientes fueron reevaluados dos meses después del procedimiento SRP. En la siguiente visita postratamiento se registraron mediciones clínicas y se tomaron muestras de FGC de los mismos sitios para los análisis microbiológicos e inmunológicos. Seis meses después, los pacientes fueron reevaluados; se consideró la visita fase de mantenimiento. En este punto, se registraron mediciones clínicas y se tomaron muestras de FGC de los mismos sitios para la cuantificación de los marcadores microbiológicos e inmunológicos.
Mediciones clínicas y muestreo
Se seleccionaron cuatro sitios en cada paciente con Gy MCP, siempre que fue posible, se seleccionó un sitio en cada cuadrante. Se realizaron y registraron las siguientes pruebas: Quigley y Hein índice de placa (IP) modificada por Turesky, índice gingival (IIG) Lööe y SSilness, el sondeo de profundidad del surco (PSD), el sondeo de la profundidad de la bolsa (PPD) y la pérdida de inserción clínica (CAL).26,27 En cada diente se evaluó PI determinado, GI; profundidad de la bolsa y la pérdida de inserción se midieron en cada sitio utilizando la sonda f-6 pgf Hu-Friedy. Después se registraron las mediciones clínicas, se obtuvo una muestra de placa supragingival de cada sitio utilizando curetas estériles. Cada diente fue aislado con una gasa estéril y después se secó al aire. Se obtuvo una muestra de placa subgingival con dos puntas de papel, introducidas durante 10 segundos cada una, siguiendo la técnica de Mombelli.
Cada muestra se colocó inmediatamente en un tubo Eppendorf estéril que contenía medio líquido de transporte (RTF) (Herrera GD, Stijine van-NA, Bosch TCJ, Dentokom MCE, Boersme H, Zeiler G, Winkelhoff AJ. ENT#91;1998ENT#93;). Cada muestra fue procesada dentro de las dos horas después de la recolección siguiendo los procedimientos microbiológicos para bacterias anaerobias periodontales de acuerdo con el protocolo de trabajo. Laboratorio de Microbiología, Facultad de Odontología, UCM, España.28 Por último, se recogió FGC mediante tiras de papel, colocadas en su lugar durante 10 segundos cada una.22,29,30 Cada muestra se colocó inmediatamente en un tubo Eppendorf estéril y se mantuvo a -70o C hasta su análisis. El volumen del fluido se determinó usando un Periotron(r) 8000 y una curva de calibración construida previamente.
Procesamiento de la muestra microbiológica
La muestra subgingival se dispersó durante 30 segundos por vortex. Se realizaron diluciones decimales a partir de la muestra inicial. Se efectuaron cuatro diluciones sucesivas con solución de amortiguación fosfato (PBS) a pH neutro. Se inocularon 0.1 mL de la muestra diluida sobre las placas que contenían agar-sangre (no selectivo). La incubación se realizó a 37o C. Las bacterias de crecimiento lento consideradas como fastidiosas tales como P. gingivalis, P. intermedia , P. micra , F. nucleatum , T. forsythia , C. rectus y Actinomyces sp . fueron cultivadas en agar anaerobio fastidioso, y se cosecharon al cabo de siete días. Se observó un periodo de quince días para las especies de crecimiento lento agar de soya/bacitracina vancomicina (TSBV) (medios selectivos). La incubación se llevó a cabo a 37o C. A. actinomycetemcomitans se cultivó en atmósfera de 5% de dióxido de carbono, y se cosechó después de cinco días (Herrera GD, Stijine-van NA, Bosch TCJ, Dentokom MCE, Boersme H, Zeiler G, Winkelhoff AJ. ENT#91;1998ENT#93;). Se siguió el protocolo de trabajo de acuerdo con los procedimientos microbiológicos con bacterias anaeroobiias periodontales del Laboratorio de Microbiología, Facultad de Odontología, UCM, España.28 Para la identificación de bacterias a partir de su crecimiento colonial se les realizó la descripción de la morfología colonial, microscopia óptica, tinción de Gram y los ensayos de actividad bioquímica BIG, y APY-ZYM.30-32
Análisis de las muestras del FGC
Las muestras de FGC fueron eluidas de las tiras mediante el uso de buffer (PBS) a pH 7.4 con el uso del vortex. Las tiras de papel fueron descartadas y se tomó una alícuota de 50 μL de FGC para la cuantificación de IL-1β utilizando el ensayo inmunoenzimático de ELISA siguiendo las instrucciones del fabricante. Se calculó la regresión cuadrática y se graficó por unidades de capacitancia para lecturas de cada tira de papel a partir de las mediciones del Periotron(r) 8000 indicando el volumen en μL.
Para los ensayos clínicos se siguieron las guías éticas para estudios de cohorte de población mexicana de acuerdo con la Norma Oficial Mexicana-Ensayos Clínicos NOM-013-SSA2-1994 y el Comité de Bioética de la UAM, Xochimilco.
ANÁLISIS ESTADÍSTICO
Para realizar el análisis de las diferencias encontradas entre los grupos de pacientes con G cuando se compararon con los de MCP para las variables continuas, se calculó la t de Student. Para las variables categóricas se utilizó la prueba de Tukey-Kramer con una p < 0.0001 entre las fases de pretratamiento, tratamiento y mantenimiento de cada padecimiento estudiado. Para analizar las diferencias entre los grupos G independientes de MCP se aplicó la prueba de Pearson con una p α 0.05 para las tres fases.
RESULTADOS
Respuestas de las variables clínicas
Los parámetros clínicos en las fases de pretratamiento, postratamiento y mantenimiento en el SRP para gingivitis (G) y periodontitis crónica moderada (MCP) se muestran en los cuadros I y II. NSPT resultó en una reducción significativa en PSD en el grupo de G y PPD en el grupo de MCP con un valor de p < 0.0001, la diferencia encontrada entre los grupos fue p α 0.03 y CAL en el grupo MCP p < 0.0001. El PI en los grupos G y MCP con p < 0.0001 y con diferencia entre grupos de p α 0.03.
Cuadro I. Variables clínicas en gingivitis
| Parámetro clínico p < | Pretratamiento | Postratamiento | Mantenimiento |
|---|---|---|---|
| PI | 55.7 (± 10.4) | 33.5 (± 15.0) | 13.7 (± 4.9) |
| 0.0001 | |||
| GI | 1.8 (± 0.2) | 1.2 (± 0.5) | 0.4 (± 0.1) |
| 0.0001 | |||
| PSD | 2.1 (± 0.5) | 1.7 (± 0.4) | 1.6 (± 0.3) |
| 0.0024 |
Variables clínicas después del tratamiento periodontal no quirúrgico en G. Para las variables clínicas se consideraron: índice de placa (PI), índice gingival (GI), profundidad al sondeo del surco (PSD) en tres fases del tratamiento no quirúrgico en sujetos con gingivitis.
Cuadro II. Variables clínicas en periodontitis crónica moderada
| Parámetro clínico p < | Pretratamiento | Postratamiento | Mantenimiento |
|---|---|---|---|
| PI | 63.4 (± 20.0) | 29.2 (± 19.1) | 18.4 (± 9.5) |
| 0.0001 | |||
| GI | 1.8 (± 0.4) | 1.1 (± 0.2) | 0.6 (± 0.3) |
| 0.0001 | |||
| PPD | 4.6 (± 0.7) | 2.6 (± 0.6) | 2.5 (± 0.9) |
| 0.0001 | |||
| CAL | 2.6 (± 0.4) | 1.7 (± 0.3) | 1.7 (± 0.2) |
| 0.0001 |
Variables clínicas después del tratamiento periodontal no quirúrgico en MCP. Para las variables clínicas se consideraron: índice de placa (PI), índice gingival (GI), profundidad al sondeo del surco (PSD) en tres fases del tratamiento no quirúrgico en sujetos con gingivitis.
Respuestas de las variables microbiológicas
En ambos grupos se observó que todas las especies analizadas presentaron una disminución de la cuenta bacteriana total (UFC/mL x 103). Se observó diferencia estadísticamente significativa entre las fases de tratamiento con una p < 0.0001 con una diferencia intergrupal de p α 0.02 (Figura 1y Cuadro III).
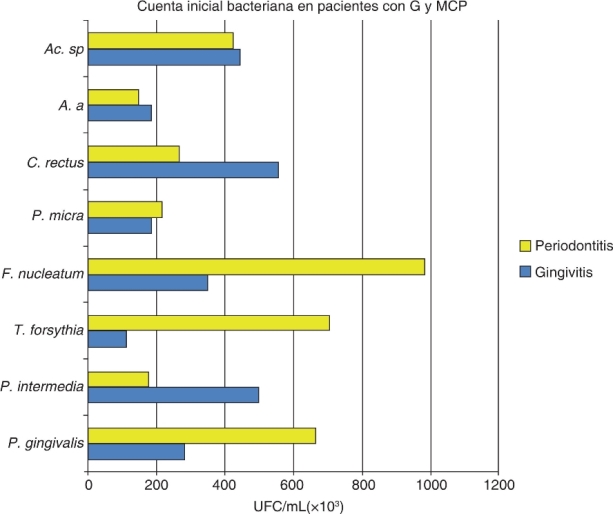
Figura 1. Recuento total de bacterias en UFC/mL de ocho especies bacterianas de muestras tomadas de 18 pacientes con gingivitis y 17 pacientes con periodontitis crónica moderada. Se debe notar que el recuento de bacterias más elevado para gingivitis fue en P. intermedia, C. rectus y Actinomyces sp. En la periodontitis fue P. gingivalis, T. forsythia y F. nucleatum.
Cuadro III. Datos microbiológicos de cada especie
| G/MCP | Pretratamiento | Postratamiento | Mantenimiento | p < |
|---|---|---|---|---|
| Pg | 283.3 ± 266.2 | 611.0 ± 119.5 | 555.5 ± 175.4 | 0.00 |
| 664.7 ± 757.4 | 223.5 ± 420.6 | 141.1 ± 234.6 | 0.01 | |
| pα | 0.54 | 0.10 | 0.35 | |
| Pi | 500.0 ± 104.3 | 111.1 ± 0.3 | 222.2 ± 548.3 | 0.24 |
| 174.1 ± 262.4 | 447.0 ± 100.1 | 235.2 ± 0.9 | 28.5 | |
| pα | 0.99 | 0.06 | 0.89 | |
| Tf | 111.1 ± 171.1 | 0.0 ± 0.0 | 111.1 ± 471.4 | 0.00 |
| 705.8 ± 168.8 | 294.1 ± 985.1 | 0.00 ± 0.0 | 0.19 | |
| pα | 0.01 | 0.00 | 0.00 | |
| Fn | 350.0 ± 297.3 | 150.0 ± 194.8 | 100.6 ± 190.8 | 0.00 |
| 982.5 ± 642.9 | 194.1 ± 213.1 | 211.6 ± 161.6 | 0.00 | |
| pα | 0.34 | 0.22 | 0.01 | |
| Pm | 183.3 ± 212.3 | 138.8 ± 232.8 | 216.6 ± 277.6 | 0.62 |
| 217.4 ± 283.6 | 223.2 ± 167.1 | 252.4 ± 267.0 | 0.90 | |
| pα | 0.07 | 0.79 | 0.98 | |
| Cr | 555.5 ± 783.8 | 333.3 ± 766.9 | 722.2 ± 184.8 | 0.64 |
| 264.7 ± 492.4 | 105.9 ± 248.7 | 824.0 ± 255.5 | 0.11 | |
| pa | 0.24 | 0.76 | 0.67 | |
| Aa | 183.3 ± 200.3 | 388.8 ± 103.9 | 0.00 ± 0.0 | 0.00 |
| 147.5 ± 200.6 | 764.7 ± 139.2 | 58.8 ± 24.2 | 0.02 | |
| pα | 0.54 | 0.09 | 0.00 | |
| Ac. sp. | 444.4 ± 222.7 | 133.3 ± 244.4 | 600.0 ± 108.9 | 0.39 |
| 423.2 ± 347.6 | 647.0 ± 122.7 | 105.8 ± 210.6 | 0.00 | |
| pα | 0.77 | 0.00 | 0.01 |
Datos microbiológicos que consisten en la concentración de UFC/mL (x 103) para cada especie obtenida durante las tres fases del tratamiento periodontal no quirúrgico en 18 sujetos con gingivitis y 17 sujetos con periodontitis crónica moderada. P. gingivalis (Pg), P. intermedia (Pi), T. forsythia (Tf), F. nucleatum (Fn), Parvimonas micra (Pm), A. actinomycetemcomitans (Aa) y Actinomyces sp. (Ac. sp.).
El comportamiento estudiado de las especies Porphyromonas gingivalis (Pg), Tannerella forsythia (Tf) y Fusobacterium nucleatum (Fn) demostró conteos bacterianos mayores que en sujetos en la fase inicial de la periodontitis.
Para las bacterias Prevotella intermedia (Pi) y Campylobacter rectus (Cr), se presentaron conteos mayores en sujetos con gingivitis en la misma fase.
Después del tratamiento se registró reducción significativa en Porphyromonas gingivalis (Pg), Tannerella forsythia (Tf), Fusobacterium nucleatum (Fn), Aggregatibacter actinomycetemcomitans (Aa) y Actinomyces sp. (A. sp.) en la fase de mantenimiento en pacientes con MCP.
En el caso de pacientes con gingivitis, después de doce meses de tratamiento durante la fase de mantenimiento se presentó una reducción en la cuenta en Prevotella intermedia (Pi), Fusobacterium nucleatum (Fn) y Aggregatibacter actinomycetemcomitans (Aa).
Después de NSPT en pacientes con gingivitis aparece Porphyromonas gingivalis sin una manifestación de disminución significativa y, sin embargo, se manifiesta un aumento del 49% en el número de UFC/mL como se muestra en las figuras 1 - 3, 2.
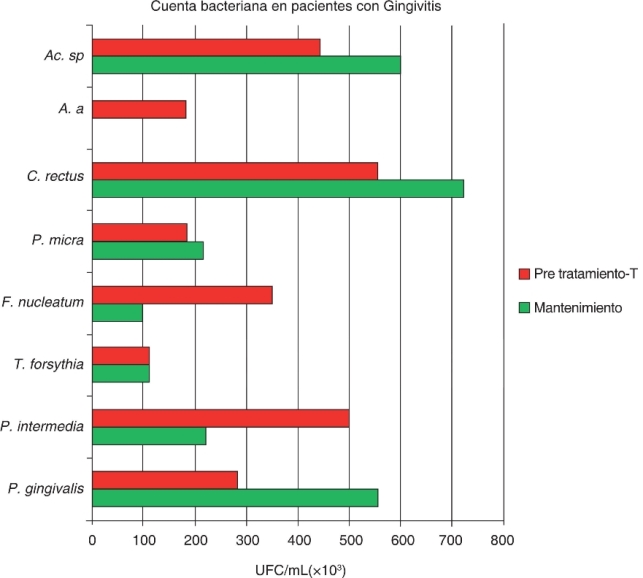
Figura 2. Recuento total de bacterias de UFC/mL de ocho especies bacterianas en muestras tomadas de18 sujetos con gingivitis. Las muestras fueron obtenidas en las fases iniciales y de mantenimiento del tratamiento periodontal. Debe observarse que el recuento superior de bacterias en gingivitis corresponden a P. gingivalis, C. rectus y Actinomyces sp. durante la fase de mantenimiento.
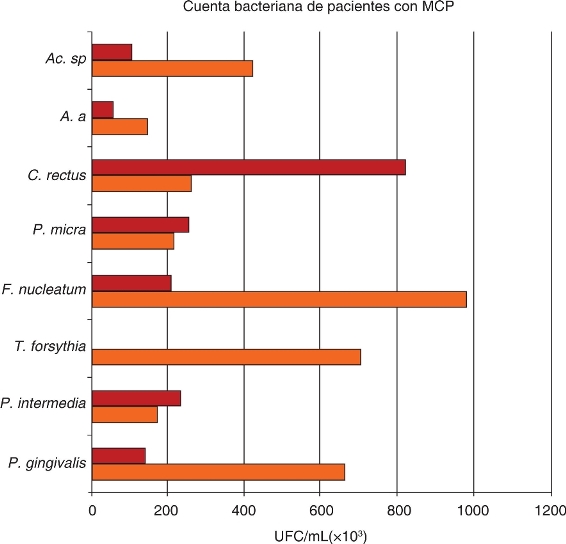
Figura 3. Recuento total de bacterias de UFC/mL en ocho muestras de bacterias tomadas de 17 sujetos con periodontitis crónica moderada media. Las muestras se obtuvieron en la fase inicial y de mantenimiento del tratamiento periodontal. Los valores bacterianos máximos en periodontitis crónica moderada corresponden a P. intermedia y C. rectus durante la fase de mantenimiento.
Respuesta de las variables inmunológicas
Los resultados del volumen en microlitros (μL) del fluido gingival crevicular (FGC) demostraron que fue más abundante en los pacientes con MCP comparados con pacientes con G (Cuadro IV ). Los valores obtenidos de la fase de pretratamiento hasta la fase de mantenimiento revelaron que el volumen FGC experimentó una reducción estadísticamente significativa con una p < 0.0001 en G y p < 0.0005 en MCP. El cuadro IV muestra la cuantificación de la concentración en picogramos por microlitro (pg/μL) de la interleucina 1β donde se puede apreciar mayor reducción entre la fase inicial y de mantenimiento en el grupo de pacientes MCP, con una p = 0.000 estadísticamente significativa. Esta situación no ocurrió en el grupo de pacientes que presentó G p > 0.17. La cuantificación total de la IL-1β en picogramos para cada grupo de la enfermedad determinada por fase de tratamiento mostró en los pacientes del grupo G un valor de p > 0.06 y en el grupo MCP p < 0.00, por lo que únicamente fue estadísticamente significativo sólo para el grupo de MCP.
Cuadro IV. Concentración total y en picogramos de IL-1β en FGC.
| G/MCP | Pretratamiento | Postratamiento | Mantenimiento | p < |
|---|---|---|---|---|
| FGC | 0.53 ± 0.22 | 0.33 ± 0.16 | 0.31 ± 0.11 | 0.0001 |
| 0.81 ± 0.33 | 0.52 ± 0.24 | 0.36 ± 0.16 | 0.0005 | |
| pα | 0.26 | 0.24 | 0.28 | |
| Conc. IL-1β (pg/μL) | 0.224 ± 0.36 | 0.177 ± 0.21 | 0.073 ± 0.08 | > 0.17 |
| 0.256 ± 0.15 | 0.212 ± 0.14 | 0.084 ± 0.09 | 0.00 | |
| pα | 0.24 | 0.24 | 0.24 | |
| Picogramos totales | 0.112 ± 0.01 | 0.053 ± 0.06 | 0.033 ± 0.03 | > 0.06 |
| 0.247 ± 0.18 | 0.180 ± 0.17 | 0.034 ± 0.05 | 0.0005 | |
| pα | 0.24 | 0.24 | 0.24 |
Comparación de la concentración total y en pg/μL en el volumen del fluido gingival crevicular (FGC) de muestras de sujetos con G y MCP durante las tres fases del procedimiento no quirúrgico. pα = 0.05.
DISCUSIÓN
Respuesta al tratamiento
En este estudio, la enfermedad de periodontitis crónica moderada (MPC) se logró controlar con tratamiento periodontal no quirúrgico (NSPT). Hubo una relación inequívoca de NSPT en todos los casos con la reducción de todos los parámetros clínicos. La profundidad de sondaje mostró una reducción promedio de 2.02 mm. Esta cifra es superior a la normalmente reportada en la literatura científica.33,34 En promedio, la cantidad ganada del aparato de inserción fue superior a la presentada en los informes anteriores, la cual fue en promedio 0.9 mm. En los casos de MCP, 12 meses después del tratamiento hubo una disminución en la cantidad de bacterias patógenas periodontales P. gingivalis , T. forsythia , F nucleatum , A. actinobacillus , y Actinomyces sp . Esto está en concordancia con otros informes.35,36 En este estudio, el tratamiento periodontal no quirúrgico logró una disminución de la concentración de la citocina proinflamatoria IL-1β en FGC, esto está en relación directa con los parámetros clínicos en los que GI de 1.8 ± 0.5 se redujo a 0.6 ± 0.3 (p < 0.0001). Estos hechos están de acuerdo con la investigación llevada a cabo por Engebretson,23 y Lein-Tuan.37
Factores etiológicos
Nuestros resultados presentan que hubo diferencias entre la flora subgingival de sujetos mexicanos con gingivitis (G) y periodontitis crónica moderada (MCP), lo que confirma en términos generales las descripciones previas de la literatura científica. La microbiota periodonto-patógena mostró diferencias significativas entre ambos grupos de estudio. Esto concuerda con los estudios dirigidos por Sanz11 y la población mexicana y coincide con la frecuencia de P. gingivalis y F. nucleatum .14 Sin embargo, éste no fue el caso para las otras seis especies estudiadas. La diferencia de estos resultados puede ser el reflejo de las pruebas microbiológicas utilizadas o las diferencias en los grupos de pacientes examinados.
El tratamiento periodontal no quirúrgico fue efectivo para la reducción de ocho bacterias periodonto-patógenas en MCP, con una diferencia estadísticamente significativa, la cual se asocia con la reducción de los parámetros clínicos comparados con los estudios realizados por Rawlinson,38 Haffajee,33 y Mombelli.39 Esta reducción se consolidó en la fase de mantenimiento de individuos con MCP; y fue debido al contrrol de la biopelícula subgingival. En el grupo de pacientes con G, después de NSPT, se presentó un aumento en la cuenta bacteriana de P. gingivalis , en la fase de mantenimiento comparada con la fase de pretratamiento. Esto puede estar relacionado con la mala respuesta al tratamiento de pacientes con sitios que son positivos a esta bacteria así como a los factores de virulencia específicos de esta bacteria periodonto-patógena. Sin embargo, nosotros no encontramos estudios que apoyen estos hallazgos.
No obstante, hay estudios en los que P. gingivalis induce mediadores de la inflamación en la sangre.40 En MCP, NSPT se asoció con la disminución de los niveles de IL-1β, así como la reducción de P. gingivalis , T. forsythia , F. nucleatum , A. actinomycetemcomitans , Actinomyces sp. a los 12 meses, en la fase de mantenimiento. Este dato es estadísticamente significativo cuando se compara con los estudios realizados por Mogi.41 En estos estudios, la prevalencia de bacterias patógenas periodontales se asocia con la concentración de IL-1β, debido al hecho de que el volumen de FGC se correlaciona con el proceso distintivo de periodontitis.25,42
Factores del hospedero
Nuestros resultados muestran que la concentración de IL-1β en el FGC pg/μL así como su concentración total en pg en G no tienen una diferencia estadísticamente significativa entre las fases con el tratamiento cuando se compararon con MCP en donde si hay diferencias cuando se comparan las fases de tratamiento en este último padecimiento clínica.
Por las razones anteriormente mencionadas, esta investigación apoya el hecho de que las bacterias patógenas periodontales son ubicuas en la cavidad oral, y en muchos casos la infección individual y la enfermedad son limitadas o ausentes. Podemos inferir que a partir de este hecho se deriva la importancia de la respuesta del huésped como una determinante hacia la susceptibilidad potencial.43 Igualmente se puede deducir que el equilibrio o desequilibrio entre la biopelícula y el proceso inflamatorio es el factor determinante para la gravedad de la lesión en las lesiones de MCP. Esto es debido al hecho de que los niveles de enzimas, anticuerpos, factores de complemento, las interleucinas y otros factores antibacterianos contenidos en la FGC aumentan en cantidad. Este aumento indica la gravedad de la inflamación periodontal-gingival, que el surco progrese a profundidad de la bolsa es un signo inequívoco de estas condiciones.44 También está en concordancia con la evidencia clínica y experimental que apoya la idea de que la MCP no es una infección bacteriana convencional, más bien es una condición inflamatoria desencadenada por respuesta inmune del hospedero hacia la infección-polimicrobiana de la biopelícula asociada.45 Nuestros resultados en esta investigación muestran que la cantidad o concentración de IL-1β en el FGC son marcadores útiles para la asociación de severidad y progresión en los casos de gingivitis y periodontitis. Esto concuerda con investigadores, como Eley,22 Goutodi,46 Orozco47 y Castrillón,25ya que, para determinar el volumen de FGC y citocinas proinflamatorias son marcadores útiles para predecir y asociar la pérdida de inserción progresiva. Éste es el caso de la IL-1β, que se libera por macrófagos, leucocitos polimorfonucleares, linfocitos y fibroblastos gingivales. Esta molécula se considera como un marcador molecular involucrado en procesos inflamatorios, destrucción de la matriz y cicatrización. A lo anterior, hay que añadir el hecho de que existe una fuerte relación con el proceso de resorción ósea, que a su vez sugiere etapas destructivas de la afección. Por tanto, podemos afirmar que la IL-1β es la principal citocina proinflamatoria producida en las encías y asociada con la periodontitis.
CONCLUSIÓN
La muestra de población mexicana de este estudio demostró en relación con los factores etiológicos que el número de especies de bacterias periodonto-patógenas en la fase inicial fue mayor en la periodontitis crónica moderada que en los casos de gingivitis.
En gingivitis hubo una reducción en la proporción de especies de P. intermedia , F. nucleatum , A. actinomycetemcomitans . En los casos de periodontitis hubo una reducción de P. gingivalis , F. nucleatum y T. forsythia , esta reducción se asoció con la disminución de los parámetros clínicos, así como con la reducción de IL-1β de concentración por unidad de volumen y pg totales.
Con respecto a los factores del huésped, se confirmó que el volumen de FGC y los niveles de IL-β son marcadores sensibles para el diagnóstico y evaluación de la severidad de la enfermedad periodontal. Este estudio mostró que en respuesta NSPT, la fase de mantenimiento es muy importante para consolidar la mejoría clínica, microbiológica y bioquímica del tratamiento. Se puede inferir que, el tratamiento periodontal no quirúrgico ejerció mayor impacto sobre el control de la enfermedad periodontal de la periodontitis crónica moderada.











 text in
text in 


