Introducción
Existe una relación entre la obesidad y el incremento del riesgo de enfermedades cardiovasculares y alteraciones cardiometabólicas1,2. Se han postulado diversos mecanismos fisiopatológicos acerca de la adaptación y la alteración de la estructura y función cardíacas en relación al depósito graso corporal, aun en pacientes normotensos sin otra enfermedad aparente1-5. Sin embargo, hay información contradictoria al respecto. Horwich, et al. denominaron «la paradoja de la obesidad» al reportar una relación entre el aumento del índice de masa corporal (IMC) y un mejor pronóstico en pacientes con insuficiencia cardíaca3,6,7. El IMC y la circunferencia abdominal han sido utilizados durante años como marcadores del volumen de grasa corporal. Diversos estudios han fallado en demostrar de manera fehaciente una relación entre dichos marcadores y modificaciones en la estructura cardíaca8-15. Esto se presume que es debido a que la causa de dichas alteraciones son los depósitos regionales (mayormente visceral y pericárdico), más que el volumen total de grasa corporal16,17.
Durante años se ha aceptado la dilatación de la aurícula izquierda (AI) como indicador de sobrecarga tanto de volumen como de presión. Además, estudios recientes han demostrado mediante distintas metodologías diagnósticas que existe una relación entre la extensión de la grasa epicárdica que rodea a la AI y la fibrilación auricular18,19. Sin embargo, en la práctica clínica diaria no es infrecuente encontrar pacientes con dimensiones auriculares normales en presencia de deterioro de la función sistólica y/o dilatación del ventrículo izquierdo20.
Actualmente, la medición de los depósitos grasos globales y regionales, así como la estimación de las dimensiones auriculares, pueden realizarse en una única sesión mediante una angiotomografía computarizada (angioTC) toracoabdominal gatillada con el electrocardiograma (ECG). Sin embargo, según nuestro mejor conocimiento, ningún estudio ha explorado estas relaciones de forma integral en una única sesión.
Por lo tanto, el objetivo de nuestro trabajo fue evaluar la relación entre los depósitos regionales y globales de grasa corporal y las dimensiones de la AI.
Métodos
Población de estudio
Estudio observacional, que incluyó pacientes consecutivos remitidos a nuestra institución entre enero de 2016 y septiembre de 2017 para la realización de angioTC toracoabdominal por diversas indicaciones clínicas, incluyendo dilatación aórtica, guía de reemplazo valvular aórtico transcatéter, enfermedad aterosclerótica o sospecha de síndrome aórtico agudo, entre otras. Entre los pacientes con adquisiciones repetidas dentro del periodo de enrolamiento, solo se incluyó el primer examen. Fueron excluidos los pacientes con antecedentes de tratamiento endovascular con endoprótesis aórtica, cirugía de bypass aortobifemoral, cirugía valvular, cirugía de revascularización coronaria o con confirmación de síndrome aórtico agudo. Un médico radiólogo con experiencia en estudios cardiovasculares, ciego a las imágenes de angioTC, recogió datos sobre las características demográficas y factores de riesgo cardiovasculares. El antecedente documentado en la historia clínica y/o el tratamiento específico para la patología definió la presencia de diabetes mellitus, hipercolesterolemia e hipertensión arterial. El objetivo principal del estudio fue evaluar la relación entre las dimensiones de la AI y los distintos depósitos de grasa corporal globales y regionales.
Todos los estudios se realizaron de acuerdo con los estándares éticos establecidos en la Declaración de Helsinki de 1964 y sus enmiendas posteriores. Todos los pacientes firmaron el habeas data.
Adquisición de la imagen
Las imágenes fueron adquiridas en tres sedes distintas utilizando tomógrafos de 64 y 128 filas de detectores (Brilliance ICT, Philips Healthcare, Cleveland, EE.UU.) y un tomógrafo de alta definición de 64 filas de detectores (Discovery HD 750, GE Healthcare, Milwaukee, EE.UU.). Se realizó una adquisición en apnea inspiratoria que abarcó desde los troncos supraaórticos hasta la sínfisis del pubis.
En nuestra institución, las angioTC de la aorta torácica se adquieren gatilladas con el ECG a fin de evitar los artefactos por el movimiento cardíaco21. Entre los pacientes adquiridos con el tomógrafo de alta definición, únicamente la angioTC de la aorta torácica se gatilló con el ECG; mientras que la angioTC abdominal fue adquirida sin gatillado inmediatamente después.
Los parámetros de adquisición fueron: 100-120 kV (según el IMC), 150-400 mA (se usó la modulación del eje z), pitch variable, tiempo de rotación de 0.5-0.75, DFOV ajustado al tamaño del paciente, reconstrucciones de 1-2.5 mm de espesor de corte y 0.5-2.5 mm de intervalo. Se tuvo especial cuidado en adquirir imágenes con un campo de visión lo suficientemente amplio como para evitar datos faltantes (grasa subcutánea).
Se administraron entre 80-100 ml de contraste yodado (iobitridol, Xenetix 350TM, Guerbet, Francia) de acuerdo al peso del paciente y el tomógrafo utilizado; mediante un protocolo bifásico, que consistió en un bolo de contraste al 100% inyectado a una velocidad de 4-4.5 ml/s, seguido de un bolo de 30 ml de solución fisiológica a 3-4 ml/s.
Análisis de la imagen
Las imágenes fueron transferidas a una estación de trabajo (Brilliance Workspace, Philips Healthcare, Cleveland, Ohio, EE.UU.) y los análisis fueron realizados por un observador ciego a los datos clínicos.
Dos fases del ciclo cardíaco fueron almacenadas para su análisis, una sistólica (37.5-40% del intervalo R-R) y una mesodiastólica (75-78% del intervalo R-R). Se utilizaron las imágenes sistólicas para la evaluación de las dimensiones auriculares. Se usaron planos axiales y reconstrucciones multiplanares (1-5 mm de espesor) para evaluar las dimensiones de la AI y los depósitos de grasa corporal.
Para evaluar las dimensiones auriculares se realizaron mediciones en las vistas de dos y cuatro cámaras, obtenidas mediante ajuste de reconstrucciones multiplanares. Se determinó por planimetría manual el área máxima (sistólica) de la AI en ambas vistas y la longitud anteroposterior en la vista de cuatro cámaras (Fig. 1). De este modo se calculó el volumen auricular mediante la técnica biplanar de área/longitud basada en siguiente formula (0.85 x Área 4c x Área 2c/Longitud eje perpendicular desde el anillo mitral hasta la pared posterior de la AI). Tanto la orejuela izquierda como los ostium de las venas pulmonares fueron excluidos del análisis22,23. Las medidas fueron posteriormente indexadas a la superficie corporal (Dubois&Dubois).
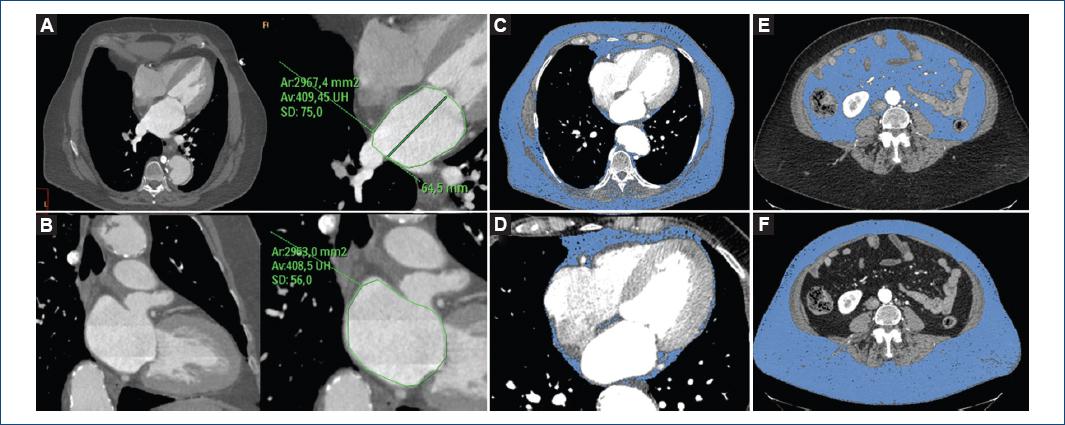
Figura 1 Mujer de 70 años, con hipertensión y tabaquismo como factores de riesgo coronario, e IMC de 33 kg/m2. Evaluación de las dimensiones de la aurícula izquierda en vistas de cuatro cámaras (A) y dos cámaras (B) mediante reconstrucciones multiplanares obtenidas en la fase del 40% del ciclo cardíaco. En las vistas axiales (C, E y F) se observan las determinaciones de la grasa corporal total (C), visceral (D) y subcutánea (E) resaltando solo el tejido con una densidad de entre —190 y —30 unidades Hounsfield. En el panel D se presenta una vista de cuatro cámaras con el volumen de grasa pericárdica. Grasa corporal total: 10,682 cm3/m2; grasa torácica: 3,047 cm3/m2; grasa pericárdica: 104 cm3/m2 (3.4%); grasa abdominal: 7,634 cm3/m2; grasa visceral: 2,148 cm3/m2 (28% de la grasa abdominal); grasa subcutánea: 5,486 cm3/m2 (72% de la grasa abdominal); espesor de grasa subcutánea: 110.4 mm; circunferencia abdominal: 118.6 cm.
El IMC se definió como el peso en kilogramos dividido por el cuadrado de la altura en metros y la obesidad se definió como IMC ≥ 30 kg/m2. El tejido graso se calculó utilizando un software dedicado de módulo volumétrico semiautomatizado (Brilliance Workspace, Philips Healthcare, Cleveland, Ohio, EE.UU.); el tejido graso se definió como aquel tejido entre —190 y —30 unidades Hounsfield24.
El volumen total de grasa corporal se evaluó desde el opérculo torácico hasta la región craneal de las cabezas femorales utilizando una técnica de reproducción de volumen y todas las mediciones se indexaron a la superficie corporal (cm3/m2). Para las mediciones del volumen de grasa se verificó la exactitud de todos los tejidos detectados automáticamente y se realizaron ajustes de forma manual y secuencial en vistas sagital, coronal, axial y utilizando el revestimiento de grasa tridimensional (Fig. 1). El volumen de grasa visceral se definió como la grasa incluida en la cavidad visceral, mientras que el volumen de grasa subcutánea abdominal se definió como el volumen de grasa abdominal menos el visceral (Fig. 1). El volumen de grasa pericárdico se evaluó desde 15 mm por encima del borde craneal del tronco coronario izquierdo hasta el diafragma. La pared torácica delimitó el borde anterior, y la aorta y los bronquios delimitaron el borde posterior (se excluyó el mediastino posterior). Se incluyeron la grasa epicárdica y la paracardíaca, con el fin de evitar errores en la discriminación del pericardio especialmente en pacientes delgados. Siguiendo esta línea, el estudio MESA demostró una muy elevada correlación entre la grasa pericárdica y la epicárdica25.
Finalmente, se midió el espesor del tejido adiposo subcutáneo (suma del espesor anterior con el posterolateral) al mismo nivel de la medición de la circunferencia abdominal (extremo craneal de las crestas ilíacas).
Análisis estadístico
Las variables discretas se presentan como cuentas y porcentajes. Las variables continuas se presentan como media ± desvío estándar. Las comparaciones entre grupos se realizaron mediante el test de Student para muestras independientes, análisis de varianza de una vía y pruebas de diferencias mínimas LSD (comparaciones post hoc), según lo indicado. Las correlaciones entre las variables continuas se evaluaron utilizando los coeficientes de correlación de Pearson. El análisis estadístico se realizó utilizando el software SPSS®, versión 22 (Chicago, Illinois, EE.UU.). Un valor de p menor de 0.05 indicó significancia estadística.
Resultados
Noventa pacientes fueron enrolados entre enero 2016 y septiembre 2017. Tres de ellos fueron excluidos por no disponer de la fase sistólica para la evaluación de la AI. Por lo tanto, un total de 87 pacientes constituyó la población del estudio. La edad media fue de 66.4 ± 12.5 años. Cincuenta y ocho (67%) pacientes eran varones, con un IMC medio de 29.1 ± 5.6 kg/m2 (Tabla 1). En el 36% de los pacientes, la angioTC confirmó la presencia de aneurisma de aorta. Dentro de las indicaciones, más de la mitad de los estudios fueron solicitados por dilatación aórtica; un 21% previo a implante de válvula aórtica percutáneo, un 10% por enfermedad aterosclerótica o por sospecha de aneurisma de aorta abdominal, un 5% como seguimiento por disección aórtica y un 6% por otras causas (Tabla 1).
Tabla 1 Características demográficas. Indicaciones de angioTC toracoabdominal gatillada
| n = 87 | |
|---|---|
| Edad | 66.4 ± 12.5 |
| Sexo masculino | 58 (67%) |
| Hipertensión arterial | 60 (69%) |
| Hipercolesterolemia | 29 (33%) |
| Tabaquismo | 44 (51%) |
| Diabetes mellitus | 14 (16%) |
| Indicación | |
| Dilatación aórtica | 51 (59%) |
| Previo a TAVI | 18 (21%) |
| Enfermedad aterosclerótica o sospecha AAA | 9 (10%) |
| Disección aórtica | 4 (5%) |
| Otros | 5 (6%) |
| Aneurisma aórtico | 31 (36%) |
AAA: aneurisma de aorta abdominal; angioTC: angiotomografía computarizada; TAVI: implante percutáneo transcatéter de válvula aórtica.
Relación entre las dimensiones auriculares y los depósitos globales y regionales de grasa corporal
Las dimensiones de la AI fueron evaluadas utilizando diversos parámetros, con una media del área en vista de cuatro cámaras de 24.9 ± 7.2 cm2 y en dos cámaras de 25.2 ± 6.2 cm2. La media del volumen indexado fue de 48.0 ± 16.6 cm3/m2. No se registraron diferencias significativas entre sexos con respecto a las dimensiones de la AI (hombres 47.4 ± 16.6 cm3/m2 vs. mujeres 49.4 ± 16.4 cm3/m2; p = 0.61).
En lo referido a las correlaciones de las dimensiones de la AI con distintas variables demográficas y morfológicas, únicamente se registraron relaciones significativas (si bien débiles) con la edad (con el área indexada en cuatro cámaras [r = 0.37, p < 0.0001] y en dos cámaras [r = 0.37, p < 0.0001]) y con el volumen indexado (r = 0.33, p = 0.002). Los pacientes con hipertensión presentaron un mayor volumen AI indexado que los pacientes sin hipertensión (51.3 ± 17.3 vs. 40.8 ± 12.4 cm3/m2; p = 0.006).
No se identificaron correlaciones significativas entre el volumen auricular indexado y los marcadores globales de depósito de grasa (IMC: r = —0.11, p = 0.32; y volumen de grasa corporal total: r = —0.08, p = 0.48. respectivamente) ni con el volumen de grasa visceral (r = —0.13, p = 0.24).
Se identificaron muy débiles correlaciones entre el volumen auricular y tanto el volumen de grasa pericárdica como la circunferencia abdominal (r = 0.23, p = 0.035; y r = 0.24, p = 0.03, respectivamente); si bien perdieron significancia estadística luego de la indexación por la superficie corporal (r = 0.05, p = 0.65; y r = —0.03, p = 0.78, respectivamente).
Al discriminar las dimensiones de la AI en tres grupos iguales (tertilos), se identificó una relación significativa incremental con la edad (p = 0.001). No se identificaron relaciones significativas entre dichos grupos (tertilos de volumen AI) y los parámetros de grasa corporal global ni regional tanto en la población total (Tabla 2), como en el análisis discriminado según la presencia de hipertensión (Tabla material suplementario).
Tabla 2 Cuantificación de los depósitos de grasa corporales generales y regionales discriminados en grupos (tertilos) de volumen auricular izquierdo (cm3/m2).
| Volumen auricular izquierdo | p | T1 vs. T3 | |||
|---|---|---|---|---|---|
| Tertil inferior | Tertil medio | Tertil superior | |||
| n = 29 | n = 29 | n = 29 | |||
| Índice de masa corporal (kg/m2) | 30.7 ± 6.6 | 27.7 ± 4.9 | 28.8 ± 4.9 | 0.12 | 0.20 |
| Circunferencia abdominal | 103.2 ± 10.4 | 100.0 ± 12.3 | 103.3 ± 11.1 | 0.46 | 0.98 |
| Grasa total (cm3/m2) | 8,569.6 ± 2,576.0 | 7,534.3 ± 2,874.2 | 8,209.3 ± 2,705.7 | 0.34 | 0.61 |
| Grasa abdominal (cm3/m2) | 6,160.7 ± 1,744.1 | 5,376.2 ± 2,180.5 | 5,758.7 ± 1,933.4 | 0.32 | 0.44 |
| Grasa pericárdica (cm3/m2) | 109.0 ± 50.3 | 91.7 ± 41.6 | 118.4 ± 73.4 | 0.20 | 0.53 |
| Grasa visceral (cm3/m2) | 2,845.4 ± 906.2 | 2,178.3 ± 1,250.0 | 2,499.9 ± 1,342.9 | 0.11 | 0.26 |
| Grasa subcutánea (cm3/m2) | 3,318.3 ± 1,386.1 | 3,199.5 ± 1,276.8 | 3,258.8 ± 1,174.4 | 0.94 | 0.86 |
| Espesor grasa subcutánea (mm) | 90.4 ± 27.6 | 89.1 ± 29.0 | 81.2 ± 19.1 | 0.33 | 0.17 |
*Pruebas post hoc de diferencias mínima.
Discusión
Con el paso de los años, la distensibilidad ventricular se va reduciendo de forma gradual, llevando en consecuencia al incremento de presiones de llenado y de las dimensiones auriculares. En nuestro trabajo, esto se encuentra reflejado (ofreciendo en cierta medida un parámetro de validación interna de las mediciones auriculares realizadas) en la identificación de una relación significativa, si bien débil, entre la edad y las dimensiones de la AI.
En ese contexto, no encontramos una asociación entre diversos marcadores de obesidad general o regional (incluidos la grasa pericárdica y la grasa visceral) y las dimensiones de la AI. Si bien esto podría atribuirse en parte a una elevada prevalencia de factores de riesgo con potencial influencia sobre las dimensiones auriculares, también podría postularse que los cambios hemodinámicos no siempre se traducen en cambios en la morfología de la AI. De hecho, como fue mencionado con anterioridad, en la práctica clínica diaria no es infrecuente encontrar pacientes con dimensiones auriculares normales en presencia de deterioro de la función sistólica y/o dilatación del ventrículo izquierdo20. En la misma línea, un estudio de resonancia magnética demostró una relación significativa entre la grasa visceral y el deterioro de la fracción de eyección de la AI, con volúmenes auriculares conservados26.
La paradoja de la obesidad es otro claro ejemplo. La obesidad constituye una epidemia de gran impacto en la morbimortalidad a nivel global. Sin embargo, la paradoja de la obesidad, es decir, la relación inconsistente y a veces divergente entre la obesidad y el pronóstico, sitúa al médico ante un dilema, particularmente cuando se utiliza el IMC como marcador de adiposidad16,27-29.
Distintos estudios han demostrado que la obesidad se asocia con un aumento del riesgo cardiovascular del paciente. De hecho, se postulan dos posibles mecanismos, uno indirecto y otro directo, por los cuales los depósitos grasos efectuarían su acción tóxica5. En lo referido al mecanismo indirecto, la obesidad genera un aumento del metabolismo basal, un incremento del volumen sanguíneo corporal total y del volumen/minuto, y una disminución en las resistencias vasculares periféricas1. Dentro de los mecanismos fisiopatológicos postulados en los cambios morfológicos y funcionales cardiovasculares, se admite que por el mecanismo de Frank-Starling la sobrecarga de volumen conduciría a la dilatación ventricular, con el consiguiente aumento del estrés parietal seguido de hipertrofia excéntrica y dilatación de la AI1,30-33.
Con respecto a los mecanismos directos, si bien es discutido, se sugiere que la grasa pericárdica podría comprimir mecánicamente a las aurículas y los ventrículos, disminuyendo la complacencia ventricular, afectando así las propiedades diastólicas del ventrículo izquierdo3,30,34-36. Esto determinaría una hipertrofia ventricular, con dilatación auricular y alteración del llenado ventricular. Por otro lado, está bien establecido el rol del tejido adiposo como órgano metabólico activo, capaz de secretar distintas citocinas proinflamatorias asociadas a un incremento del riesgo cardiovascular5. Es de destacar que esta actividad se adjudica especialmente a la grasa visceral y pericárdica; lo cual explicaría en parte la «paradoja de la obesidad», con falta de correlación entre la afección cardiovascular y los clásicos marcadores de obesidad (peso, IMC, circunferencia abdominal, etc.)12,17,27-29,37.
Enfocándonos ahora en los cambios morfológicos de la AI y los depósitos de grasa globales y regionales, distintos estudios han intentado demostrar asociaciones.
Numerosos ensayos clínicos han reportado una relación significativa entre la grasa epicárdica que rodea la AI y el desarrollo de fibrilación auricular, si bien su relación con las dimensiones auriculares no es concluyente19,38. Debe destacarse que, en general, estos trabajos evaluaron específicamente la grasa epicárdica que rodea la AI, mientras que en nuestra investigación evaluamos el volumen de grasa pericárdica incluyendo tanto la grasa epicárdica como la paracardíaca desde 15 mm por encima del tronco coronario izquierdo hasta el diafragma. Si bien esta estrategia mejora la reproducibilidad de las mediciones y existe una elevada correlación entre la grasa pericárdica y la epicárdica, un estudio reciente demostró diferencias inmunohistoquímicas significativas entre el tejido adiposo epicárdico y paracardíaco38. Esto podría explicar al menos parcialmente los diferentes hallazgos encontrados en nuestro estudio.
Poirier, et al. reportaron una asociación significativa entre la grasa pericárdica y el diámetro de la AI, si bien la misma se observó únicamente en mujeres, y con una menor correlación que las observadas con el IMC y la circunferencia abdominal1. Además, Iacobellis, et al. demostraron una asociación significativa entre el incremento de la grasa epicárdica y tanto la dilatación auricular como las alteraciones en la relajación ventricular en pacientes con obesidad mórbida4.
Como fue mencionado, en el presente estudio no encontramos una relación significativa entre los clásicos marcadores de obesidad y las dimensiones de la AI, así como tampoco con los depósitos de grasa pericárdicos y/o viscerales. Uno de los posibles fundamentos de la falta de correlación podría vincularse al hecho de que las dimensiones auriculares no siempre son un indicador sensible de sobrecarga. De hecho, actualmente se evalúan de manera conjunta diversos parámetros en la valoración del compromiso auricular (dimensiones auriculares, strain longitudinal, fibrosis y velocidad pico de la orejuela izquierda, entre otros)39. Alternativamente, los depósitos de grasa viscerales y/o pericárdicos podrían efectivamente no encontrarse relacionados con modificaciones hemodinámicas significativas. Estudios futuros deberán llevarse a cabo para corroborar las diferentes hipótesis.
Algunas limitaciones deben ser reconocidas, incluyendo el pequeño tamaño de la muestra. La particularidad del presente estudio se asocia asimismo a cierto sesgo de selección, al evaluar todos los depósitos grasos globales y regionales en una única sesión (angioTC toracoabdominal). Debe destacarse que la población incluida en nuestro estudio fue relativamente añosa en comparación con otros estudios, y con elevada prevalencia de factores de riesgo coronario. Estas condiciones previas podrían influir en las dimensiones auriculares, no disponiendo de un grupo control sin factores de riesgo ni enfermedad cardiovascular conocida para evaluar de forma no sesgada las respectivas asociaciones, ni del tamaño de muestra suficiente para realizar análisis de regresión logística. Asimismo, no se dispuso de información completa acerca de comorbilidades que podrían afectar las dimensiones auriculares, incluyendo la presencia de arritmia supraventricular y valvulopatías, entre otras. Además, dadas las características anatómicas derivadas de las imágenes de TC, los lectores no estaban cegados al hábito corporal del paciente. Es de destacar que las mediciones de la circunferencia abdominal no se pueden extrapolar directamente a la medición antropométrica convencional, ya que la última se realiza al final de la espiración y con el sujeto en pie.
Conclusión
En este estudio, el primero según nuestro conocimiento dedicado a evaluar la relación entre los depósitos grasos globales y regionales y las dimensiones de la AI en una única sesión, no encontramos una relación significativa entre ambos. Estudios futuros de mayor tamaño y preferentemente incluyendo técnicas de evaluación funcional como el strain auricular deberán explorar si nuestros hallazgos podrían atribuirse (o no) a que los depósitos grasos corporales no siempre se relacionan con los cambios hemodinámicos esperados.
Financiamiento
La presente investigación no ha recibido ayudas específicas provenientes de agencias del sector público, sector comercial o entidades sin ánimo de lucro.
Responsabilidades éticas
Protección de personas y animales
Los autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.











 text in
text in 


