Services on Demand
Journal
Article
Indicators
Related links
Share
Madera y bosques
On-line version ISSN 2448-7597Print version ISSN 1405-0471
Madera bosques vol.17 n.1 Xalapa Mar. 2011
Artículos de investigación
Germinación y supervivencia de seis especies nativas de un bosque tropical de Tabasco, México
Germination and survival of six native species in a tropical forest of Tabasco, México
Isidro Pérez-Hernández1, Susana Ochoa-Gaona1, Georgina Vargas-Simón2, Manuel Mendoza-Carranza1 y Noel Antonio González-Valdivia1
1 Área de Sistemas de Producción Alternativos. El Colegio de la Frontera Sur. Apdo. Postal 1042, Admón. de Correos de Tabasco 2000, 86031 Villahermosa, Tabasco, México. Tel/Fax +52 (993) 3136110. C.e.: sochoa@ecosur.mx.
2 División de Ciencias Biológicas. Universidad Juárez Autónoma de Tabasco. Carretera Villahermosa-Cárdenas Km. 0.5 s/n. 86150 Villahermosa, Tabasco, México. Tel +52 (993) 3391264.
Manuscrito recibido el 28 de mayo de 2009
Aceptado el 04 de mayo de 2010
Resumen
Se evaluó la germinación y supervivencia in situ y ex situ de plántulas de Aspidosperma megalocarpon, Eugenia sp., Lonchocarpus castilloi, Manilkara zapota, Ormosia macrocalyx y Rollinia mucosa. En campo se sembraron 2 160 semillas en nueve bloques de 5 m x 20 m distribuidos en bosque tropical, acahual maduro y acahual joven. El experimento se replicó en condiciones de vivero bajo sombra de 40, 60 y 80%. Los tipos de cobertura vegetal no mostraron diferencias significativas en las tasas de germinación y de crecimiento; sin embargo, estos sí influyeron en la capacidad de germinación de A. megalocarpon y O. macrocalyx, y en las tasas de depredación de M. zapota y L. castilloi. En el acahual joven se presentó la mayor depredación de semillas, sin embargo, las plántulas remanentes presentaron mayor supervivencia que en las otras coberturas vegetales. En el vivero no se encontró diferencia en la proporción de semillas germinadas, ni en las tasas de germinación y de crecimiento. R. mucosa, fue la única especie que presentó menor supervivencia (42%). Las condiciones ambientales de las diferentes clases de cobertura vegetal en el área de estudio mantienen condiciones adecuadas para el proceso de germinación, crecimiento y establecimiento de plántulas de las especies estudiadas, lo cual permite sugerir su utilización en la rehabilitación de áreas degradadas del bosque original sembrando de manera directa, siempre y cuando se realice de manera inmediata después de la recolecta. Es necesario continuar con estos estudios para promover el uso de especies nativas en la rehabilitación y restauración de bosques tropicales.
Palabras clave: Condiciones ambientales, depredación, establecimiento, semillas de árboles, tasa de crecimiento, tasas de germinación.
Abstract
We evaluated the germination and survival in situ and ex situ of seedlings of Aspidosperma megalocarpon, Eugenia sp., Lonchocarpus castilloi, Manilkara zapota, Ormosia macrocalyx and Rollinia mucosa. We established nine blocks of 5 m x 20 m in the field, in which 360 seeds of each species were established in three successional conditions with three repetitions: mature tropical forest, advanced fallows and young fallows. The experiment was replied in a tree nursery using 40, 60 and 80% shade. We found no significant differences in the rates of germination and neither in growth due to variation in the natural cover. However, the rates of germination of A. megalocarpon and O. macrocalyx, and the rates of depredation of M. zapota and L. castilloi were affected by the coverage. Seeds sown in young fallows showed higher depredation, whereas seedling survival was higher here than in the other succes-sional stages. In the tree nursery, no significant difference was found in the proportion of germinated seeds, the rates of germination and in growth. However, R. mucosa showed low survival (42%). The environmental conditions of the forests in Tabasco are under various stages of degradation and it is appropriate to start a rehabilitation program by introducing native species. This study indicates that this could be done by sowing the seeds directly in the forests without first producing seedlings in nurseries, which in turn would reduce the costs. It is recommend continuing research on the seed and seedling performance of other species that could be used to rehabilitate and restore the tropical forest.
Keywords: Environmental conditions, depredation, establishment, seeds of trees, rate of growth, rate of germination.
INTRODUCCIÓN
El éxito de la germinación y establecimiento de plántulas en el medio natural está determinado por factores bióticos como la densidad, depredadores y patógenos (especialmente hongos), y por factores abióticos como la disponibilidad de luz, agua, temperatura y nutrientes del suelo (Willan, 1991; Camacho-Cruz et al., 2000; Harms y Paine, 2003). Sólo cuando las condiciones abióticas son adecuadas, se inicia el proceso de germinación como parte de sus estrategias adaptativas (Vázquez-Yanes y Orozco-Segovia, 1992; Figueroa, 2000). Actualmente estos factores se han visto gravemente afectados debido a la transformación de los bosques nativos en áreas ganaderas, agrícolas y urbanas, lo que ha contribuido en la simplificación, degradación y desaparición del bosque y del ecosistema en su conjunto (Vázquez-Yanes y Orozco-Segovia, 1992; Lanly, 2003). Debido a esto, se hace necesaria la propagación de especies nativas para el enriquecimiento, la reforestación y la restauración de las áreas afectadas. Sin embargo, los planes de reforestación implementados en los trópicos americanos aún son limitados en el uso de especies nativas, y con mayor frecuencia usan especies exóticas como eucaliptos, teca o melina, promoviendo la creación de bosques monoespecíficos de rápido crecimiento para la producción de madera y celulosa. Estos bosques manejados desplazan a las plantas y animales nativos y a menudo son pobres en biodiversidad (Vázquez-Yanes y Orozco-Segovia, 1992; Arriaga et al., 1994).
La siembra directa de semillas es una opción para diversificar las áreas forestales ya que puede dar buenos resultados en la propagación de especies nativas. Además, en comunidades con escasos recursos económicos, este método permite evitar las dificultades técnicas y los gastos inherentes a otras formas de propagación de plántulas más elaboradas (Vázquez-Yanes et al., 1997).
OBJETIVO
Analizar la germinación, depredación de semillas, crecimiento y supervivencia de plántulas de seis especies forestales sembradas en vegetación natural y en condiciones de vivero.
MÉTODOS
Área de estudio
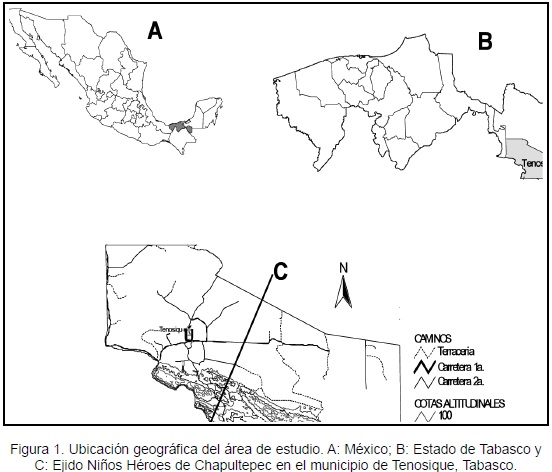
El estudio se realizó en el sureste de México, en el área de protección de flora y fauna conocida como Cañón del Usumacinta, en el ejido Niños Héroes de Chapultepec, localizado en la sierra del municipio de Tenosique a 17º16´27´´ N y 91º24´02´´ O, a 450 m de altitud (INEGI, 2006; Figura 1). Los suelos son de tipo litosol, con poca profundidad, limitados por estratos duros y coherentes dentro de los primeros diez centímetros. El clima es cálido-húmedo con lluvias todo el año (Af), las cuales decrecen ligeramente en invierno. La temperatura media anual oscila entre 25,4 °C y 26,9 °C. El régimen de precipitación alcanza 3 286 mm anuales, con un promedio máximo mensual de 400 mm en el mes de septiembre y un mínimo mensual de 50 mm en el mes de abril (Enciclopedia de los Municipios de México, 2005). Esta zona montañosa, está cubierta por fragmentos de bosque tropical lluvioso inmersos en un mosaico de vegetación secundaria de diferente edad derivada de la actividad agrícola y pastizales inducidos para la ganadería, localizados en las partes planas u onduladas (Ochoa-Gaona et al., 2008).
Selección de especies y obtención de semillas
Para el área de estudio se reportan 34 especies arbóreas que fructifican entre enero y mayo (Ochoa-Gaona et al., 2008), de éstas, se seleccionaron seis con base en su importancia local y estado sucesional (Tabla 1).
Para la obtención de las semillas se recolectaron frutos directamente del árbol y en menor cantidad del suelo. La recolecta se realizó entre el 25 de febrero y el 11 de marzo de 2008 en remanentes de bosque de la zona de estudio, para lo cual se siguieron las recomendaciones de la FAO-DANINA (Willan, 1991). Las semillas vanas o que presentaban daño visible se desecharon, además se aplicó una prueba de flotación para aumentar la posibilidad de usar semillas viables (Mulawarman et al., 2003). Las semillas fueron almacenadas a temperatura ambiente de uno a siete días, mientras se colectaba la cantidad necesaria para iniciar el experimento. A las semillas no se les aplicó ningún pretratamiento germinativo.
Diseño experimental en campo y vivero
Se seleccionaron sitios con tres repeticiones en remanentes de bosque tropical (Bt), en acahual maduro (25 años, Am) y en acahual joven (8 años, Aj). En cada sitio se delimitó un rectángulo de 5 m x 20 m, donde se establecieron geométricamente 120 puntos de siembra (separación de 1 m entre puntos); de cada especie se establecieron 20 puntos de siembra (dos semillas por punto). La especie sembrada en cada punto se seleccionó al azar, por lo que no hubo una distribución determinada. En cada punto de siembra se colocó un popote de plástico donde se anotó la especie y la fecha de siembra. En total se sembraron 2 160 semillas de las seis especies en los tres tipos de cobertura vegetal; las semillas fueron cubiertas aproximadamente por un centímetro de suelo. Para evitar el efecto de borde (Harper et al., 2005) en el Bt los sitios se ubicaron al centro de la vegetación (Newmark, 2001) y para el Aj y Am a 184 m del límite de la vegetación adyacente (Didham y Lawton, 1999).
El vivero se estableció cerca del poblado (ejido Niños Héroes de Chapultepec) en un área comunal destinada para el cultivo de plantas, donde se armaron tres estructuras de metal las cuales se cubrieron totalmente con malla sombra de 40% (S-40), 60% (S-60) y 80% (S-80). Se sembró la misma cantidad de semillas que en el experimento en campo, las semillas se distribuyeron equitativamente en las tres clases de sombra. Se usaron charolas de germinación COPPER BLOCK 60/220 ml (60 cavidades de 220 ml cada uno) y sustrato comercial CRECIROOT. Dado que la lluvia fue suficiente para mantener húmedas las semillas, sólo en mayo que fue el periodo más seco, estas se regaron manualmente cada dos días.
Variables evaluadas
Con base en Arriaga et al., 1994 y Martínez-Sánchez, 2004, para cada especie en cada tipo de cobertura vegetal y tipo de sombra se evaluaron las siguientes variables: a) tiempo de inicio de germinación (número de días transcurridos a partir de la siembra hasta el registro de la primera semilla germinada); b) capacidad de germinación, la cual se define como el número de semillas que germinan bajo algún tratamiento o en condiciones definidas, se expresó en porcentaje (%) (Arriaga et al., 1994), c) tasa media de germinación (sg sem-1 semillas germinadas por semana), se consideró una semilla germinada cuando se observó la emergencia de la plúmula (Vázquez-Yanes et al., 1997), d) porcentaje de supervivencia de plántulas, e) tasa media de crecimiento de plántulas (cm sem-1, centímetros por semana). Sólo en el experimento en campo se registró la depredación de semillas (porcentaje de semillas depredadas y la tasa media depredación (sd sem-1, semillas depredadas por semana), se consideró una semilla depredada cuando se observó daño total o parcial en la testa, endos-permo o cotiledones por hongos o fauna (Guariguata y Ostertag, 2002) o cuando la semilla ya no se localizaba. En el vivero la depredación no fue un factor evaluado, ya que por el sustrato utilizado no favoreció el desarrollo de hongos y se evitó el efecto de la fauna depredadora de semillas; sin embargo hubo un ataque de hormigas en una noche sólo para A. megalocarpon.
El experimento se evaluó por seis meses (marzo-agosto de 2008). Después de la siembra de cada especie se registraron datos diariamente durante los primeros veinte días; posteriormente, cada ocho días y los últimos cuatro registros se realizaron cada quince días. Semanalmente se midió al centro de cada bloque de muestreo la humedad del suelo, utilizando un tensiómetro marca "QUICK DRAW Soilmosture probe" modelo 2900 FI (valor de 0 a 10 centibares indica un suelo saturado de agua, de 10 a 30 es óptimo para las plantas; 30 a 60 margen normal para iniciar el riego excepto en los suelos muy arcillosos; 60 a 80 margen normal para iniciar el riego en los suelos muy arcillosos, > 80 entra en estrés hídrico; Myers y Harrison, 1975; Soilmoisture, 1998). La temperatura y humedad ambiental, se midieron con un HOBO (Onset, Computer Corporation), el cual se programó (software BOXCAR 3.6) para que registrara datos cada hora después de iniciado el experimento. Para calcular la radiación total bajo el dosel se tomaron tres fotografías hemisféricas en cada tipo de cobertura vegetal (Roxburgh y Kelly, 1995) a 1 m de altura sobre el nivel del suelo con una cámara digital marca Nikon COOL PIX 8400 con 8,0 Mega pixel, con convertidor de ojo de pescado (Fisheye) FCE9 0,2X. Las fotografías obtenidas se procesaron y analizaron con el software Hemiview Canopy Versión 2.1 SR1 (HemiView, 1999).
Análisis estadístico
Una vez probada la normalidad y homogeneidad de varianza de los datos, se aplicó ANDEVA unifactorial a las variables medidas para comparar la respuesta entre especies en cada cobertura vegetal y clases de sombra. Se aplicó la prueba de Ji-cuadrada para evaluar el comportamiento individual de las especies en los tipos de cobertura vegetal y clases de sombra. Para comparar el comportamiento de las especies en campo y vivero se utilizó ANDEVA unifactorial. A los datos en porcentaje que no fueron normales se les aplicó arcoseno para normalizarlos y a las tasas se les aplicó logaritmo natural (Zar, 1999).
RESULTADOS
Diferencias microclimáticas
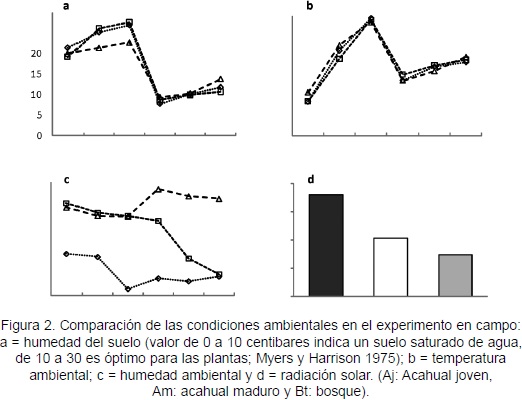
La humedad del suelo y la temperatura ambiental no presentaron diferencias significativas entre las tres coberturas de vegetación (F = 0,214; p = 0,807; F = 0,008; p = 0,991; Figuras 2a y 2b). La humedad ambiental fue diferente en las tres coberturas vegetales (F = 19,03; p = 0,001). Se presentó mayor humedad ambiental promedio en el Bt durante todo el estudio (> 80 %), mientras que el Aj mostró los valores más bajos (<62 %; Figura 2c). La radiación solar fue diferente para cada cobertura vegetal (F = 10,91; p < 0,01). En el Aj se presentó el mayor valor y en Bt el menor valor (Figura 2d).
Germinación
Tiempo de inicio de la germinación
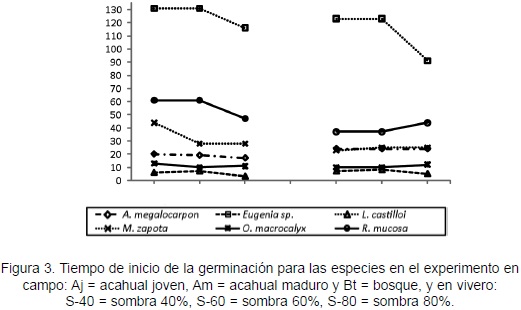
En el campo, las clases de cobertura vegetal no influyeron en el tiempo de inicio de germinación de las semillas evaluadas. En vivero, la diferencia de sombra sólo ejerció influencia en Eugenia sp.; ésta mostró menor tiempo en S-80 (X2 = 4,78; p = < 0,028) y mayor tiempo en S-40 y S-60. Al comparar la respuesta entre campo y vivero, se encontró que Eugenia sp., L. castilloi, M. zapota y O. macrocalyx mostraron similar tiempo de inicio de germinación, mientras que A. megalocarpon y R. mucosa, fueron diferentes (F = 36,57; p < 0,0037 y F = 10,61; p < 0,031; respectivamente). Los menores tiempos lo presentaron L. castilloi (3 días en campo y 5 días en vivero) y O. macrocalyx (10 días en ambos experimentos); M. zapota mostró tiempos intermedios (33 días en campo y 24 en vivero), mientras que Eugenia sp. requirió el mayor tiempo para iniciar la germinación (131 días en campo y 123 días en vivero; Figura 3).
Capacidad de germinación
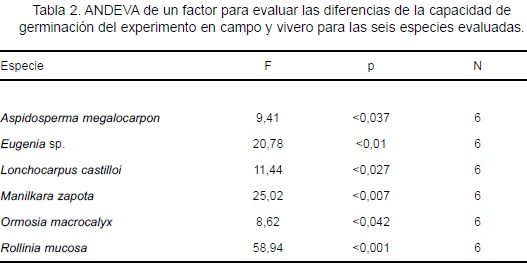
En campo, el tipo de cobertura vegetal influyó en la capacidad de germinación de A. megalocarpon y O. macrocalyx. En Bt A. megalocarpon presentó el mayor valor (65%), cantidad que fue diferente al de Am (32%, X2 = 11,29; p < 0,001) y al de Aj (20%, X2 = 23,59; p < 0,001), no se encontraron diferencias entre los valores del Am y Aj. O. macrocalyx mostró mayor capacidad de germinación en Am (82%) siendo diferente al valor del Aj (X2 = 4,2; p < 0,04). No se encontró diferencia entre los valores del Bt y el Aj (Figura 4a). La mayor capacidad de germinación promedio en campo fue de 82% (O. macrocalyx) y el menor valor fue de 8% (Eugenia sp.).

En el vivero no se encontró diferencia en la proporción de semillas germinadas para cada especie en las tres clases de sombra. Cinco especies mostraron capacidad de germinación ³76%; R. mucosa presentó el mayor valor (98%) y Eugenia sp. mostró el valor más bajo (11%; Figura 4b).
La capacidad de germinación de las seis especies fue mayor en vivero comparado con el campo (Tabla 2). A. megalocarpon y R. mucosa alcanzaron poco más del doble de germinación en vivero. O. macrocalyx y L. castilloi mostraron los valores más altos en los dos experimentos. Eugenia sp. presentó menor germinación en ambos experimentos.
Tasa de germinación
Los tipos de cobertura vegetal y las clases de sombra no mostraron diferencias significativas en las tasas de germinación de todas las especies. Los valores de las seis especies fueron más altos en el vivero. Para cinco especies, las diferencias en las tasas de germinación fueron significativas entre el campo y el vivero: A. megalocarpon (F = 91,12; p < 0,001), L. castilloi (F = 26,86; p < 0,006), M. zapota (F = 102,3; p < 0,001), O. macrocalyx (F = 17,64; p < 0,013) y R. mucosa (F = 29,18; p < 0,001).
En campo y vivero los patrones de las tasas de germinación mostrados por las especies fueron similares. L. castilloi mostró las mayores tasas de germinación promedio (campo: 13,2 sg sem-1, vivero: 41,7 sg sem-1), mientras que las menores tasas las presentó Eugenia sp. (campo: 2,8 sg sem-1, vivero: 3,4 sg sem-1; Figura 5).
Depredación de semillas
La cantidad de semillas depredadas para las seis especies estuvo influenciada por al menos una de las clases de cobertura vegetal. L. castilloi presentó diferente cantidad de semillas depredadas en los tres tipos de cobertura vegetal, R. mucosa fue depredada en igual proporción en Aj y Bt y presentó diferencias significativas con el valor del Am. A. megalocarpon. Eugenia sp., M. zapota y O. macrocalyx presentaron diferentes valores en el Aj y Am; la depredación de semillas en el Bt fue similar a los de Aj y Am (Tabla 3).
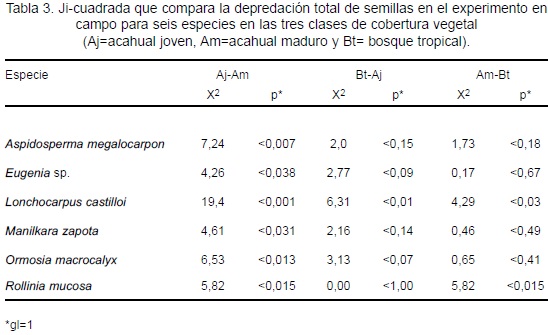
La cantidad promedio de semillas depredadas entre las especies no mostró diferencias significativas (F = 2,26; p < 0,114). En el Aj se registró la mayor depredación para A. megalocarpon (30%), L. castilloi (42%), M. zapota (54%) y O. macrocalyx (36%). La menor depredación para L. castilloi y M. zapota se presentó en Bt (22% y 33%, respectivamente). A. megalocarpon y O. macrocalyx fueron menos depredados en Am (13% y 17%, respectivamente); sólo Eugenia sp. mostró menor depredación en Aj (8%; Figura 6a).
Tasa de depredación de semillas
Las tasas de depredación de A. megalocarpon, Eugenia sp., O. macrocalyx y R. mucosa no mostraron diferencias en los tres tipos de cobertura vegetal. Para L. castilloi y M. zapota las tasas no mostraron diferencias significativas entre el Am y el Bt; sin embargo, los valores del Aj fueron mayores a los del Am y del Bt (L. castilloi: X2 = 5,18; p < 0,02; X2 = 7,12; p < 0,007 y M, zapota: X2 = 11,67; p < 0,001 y X2 = 10,7; p < 0,001 respectivamente).
La tasa de depredación de semillas fue diferente para cada especie (F = 3,12; p < 0,04); la más baja fue de 0,15 sd sem-1 (Eugenia sp. en Aj) y la más alta fue de 15,2 sd sem-1 (M. zapota, en Aj). Cuatro especies mostraron mayor tasa de depredación en Aj (A. megalocarpon, L. castilloi, M. zapota y O. macrocalyx) y dos especies en Am (R. mucosa y Eugenia sp.). Para A. megalocarpon y L. castilloi las más bajas se presentaron en Bt, y para M. zapota y O. macrocalyx en Am (Figura 6b).
Supervivencia de plántulas
El número total de plántulas supervivientes por cobertura vegetal fue significativamente diferente (F = 5,04; p < 0,021). En el Aj se presentó mayor supervivencia en cinco de las seis especies evaluadas. Por especie, la cantidad de plántulas supervivientes de A. megalocarpon, Eugenia sp., M. zapota y R. mucosa estuvo influenciada por al menos uno de los tipos de cobertura vegetal. A. megalocarpon mostró diferentes porcentajes de plántulas supervivientes en las tres clases de cobertura vegetal (Aj-Am: X2 = 26,96; p < 0,001; Aj-Bt: (X2 = 7,94; p < 0,001; Am-Bt: X2 = 6,42; p < 0,01), siendo mayor en Aj (70,9%) y menor en Am (20,9%). Eugenia sp. y R. mucosa presentaron similar supervivencia de plántulas en Am y Bt (50% y 47%; 26% y 25%, respectivamente), la mayor supervivencia de estas dos especies se presentó en Aj (Eugenia sp.: 71%, y R. mucosa: 52%); estos valores fueron significativamente diferentes a los del Am (X2 = 3,78; p = 0,049; X2 = 8,56; p = 0,003; respectivamente) y Bt (X2 = 5,19; p < 0,022; X2 = 9,51; p < 0,003). M. zapota no mostró diferencia entre el Aj y el Am (50% y 40%), ambas coberturas fueron significativamente diferentes a las valores del bosque (22%; X2 = 10,68; p < 0,001; X2 = 5,21; p < 0,02, respectivamente). L. castilloi y O. macrocalyx no mostraron diferencias significativas entre las coberturas de vegetación (Figura 7a).
En el vivero, las diferencias de sombra no ejercieron influencia en la proporción de plántulas supervivientes de A. megalocarpon, Eugenia sp., L. castilloi, M. zapota y O. macrocalyx. La única especie que se vio influenciada por las clases de sombra fue R. mucosa, la cual presentó menor supervivencia en S40% (42%), diferente a los valores de la S-60% (91,5%; X2 = 18,6; p < 0,001) y S-80% (87%; X2 = 16; p < 0,001). La cantidad de plántulas supervivientes en el vivero fue diferente para cada especie (F = 5,88; p < 0,005). A. megalocarpon mostró la menor supervivencia de plántulas (promedio: 36%), mientras que las demás especies mostraron mejor supervivencia con promedios entre 74%-89% (Figura 7b). En el vivero se encontraron valores de supervivencia más altos para todas las especies en relación al campo, sin embargo sólo tres especies mostraron diferencias significativas: Eugenia sp. (F = 18,59; p < 0,01); L. castilloi (F = 60,6; p < 0,002) y O. macrocalyx (F = 5,01; p < 0,67).
Tasa de crecimiento de plántulas
En campo los tres tipos de cobertura vegetal no influyeron significativamente en las tasas de crecimiento de las especies, el mismo resultado se obtuvo al evaluar el efecto de sombra. La tasa de crecimiento fue significativamente diferente entre las especies, tanto en campo (F = 197,9; p < 0,001), como en el vivero (F = 9,89; p < 0,001). La mayor tasa de crecimiento promedio en campo y vivero lo presentó Eugenia sp. (2,5 y 1,6 cm sem-1, respectivamente). En campo L. castilloi y A. megalocarpon mostraron la menor tasa de crecimiento (0,31 y 0,36 cm sem-1, respectivamente) y en el vivero los menores valores lo mostraron A. megalocarpon (0,55 cm sem-1) y M. zapota (0,69 cm sem-1; Figura 8).
Al contrastar el promedio de crecimiento entre vivero y campo, se encontró que Eugenia sp., M. zapota, O. macrocalyx y R. mucosa no mostraron diferencias. A. megalocarpon y L. castilloi presentaron mayor tasa de crecimiento en vivero que en campo (F = 17,34; p < 0,01 y F= 78,1; p < 0,001, respectivamente).
DISCUSIÓN Y CONCLUSIONES
Las condiciones de temperatura, luz y humedad en el suelo, tanto en campo como en vivero, fueron suficientes para que las semillas iniciaran el proceso de germinación y establecimiento, esto coincide con lo señalado por Sánchez et al. (2003), Romo (2005), Myers y Harrison (1975) y Holl (1999) para cada variable, respectivamente. El no haber encontrado diferencias en la humedad del suelo y temperatura ambiental en las tres clases de cobertura vegetal y en vivero puede explicarse porque en la zona no se presenta una estación seca marcada y porque el año en que se efectuó el estudio correspondió a un año lluvioso, lo que se reflejó a nivel de parcelas en el experimento a nivel de microclima (Conagua, 2008). En particular, durante el tiempo del experimento se registraron lluvias intensas al menos cada tercer día, excepto en el mes de mayo, que se presentó un periodo seco de 16 días. Por otra parte, los bosques en la zona de estudio están sujetos al aprovechamiento, por lo que la extracción selectiva abre el dosel a niveles similares a los encontrados en los acahuales maduro y joven, lo que puede explicar, en parte, porqué en la mayoría de los parámetros evaluados no se encontraron diferencias de respuesta de las especies entre los tres tipos de cobertura.
Los tiempos de inicio de la germinación obtenidos en este estudio, están dentro de los intervalos reportados por otros autores que experimentaron con semillas recién colectadas y tiempos en la siembra de semillas, similares a los realizados en este estudio (sin pretratamiento y sin almacenamiento); Sautu et al. (2006), registraron en condiciones de vivero para Aspidosperma cruenta–una especie muy cercana a A. megalocarpon– el inicio de la germinación a los 13 días, tiempo que es próximo a los 17 días encontrados en este estudio, mientras que para O.macrocalyxdeterminaron un periodo similar a lo encontrado en este estudio (10 días). Para O. macrocalyxFoster y Delay (1998) encontraron que, en condiciones de vivero, el inicio de la germinación fue a los nueve días después de la siembra sin tratamiento pregerminativo y, además, mencionan que el número de días disminuyó a cinco al aplicarle escarificación mecánica. Parraguirre (1992), encontró para M.zapotaun tiempo de inicio de germinación de 16 días en vivero, mientras que Cordero y Boshier (2003) mencionan que la germinación inicia entre la segunda y quinta semana después de la siembra (ambos sin tratamiento pregerminativo), lo cual coincide con los resultados obtenidos en este estudio (24 días). Para L.castilloiel tiempo de inicio de la germinación encontrado en este estudio (tres días) es menor a lo registrado por Cordero y Boshier (2003) que mencionan que inicia a germinar después de 16 días con tratamiento pregerminativo. Para Eugenia uniflora, Franceschini (2000) determinó un tiempo de inicio de germinación de 24 días, dato que es menor a lo encontrado en este estudio para Eugenia sp. (119 días promedio).
Capacidad de germinación en campo y vivero
La capacidad de germinación obtenida en el vivero para A. megalocarpon, L. castilloi, M. zapota, O. macrocalyx y R. mucosa es alta (>=76%) de acuerdo con el criterio de Arriaga et al. (1994) que consideran que bajo criterios comerciales, en condiciones de vivero se debe de obtener al menos 60% de semillas germinadas para considerar como aceptable la producción de plántulas; Eugenia sp. quedó fuera de este límite.
Aunque se utilizó el mismo lote de semillas, en el caso del campo las especies mostraron menor porcentaje de germinación con relación al vivero, esto se debe básicamente a que una considerable proporción de las semillas fueron depredadas por la fauna silvestre o atacadas por hongos, disminuyendo así la cantidad final de semillas. En este sentido, Whelan et al. (1991), Martínez-Ramos (1994) y Jordano et al. (2002) argumentan que la depredación es la causa principal de la disminución del número final de semillas que germinan en condiciones naturales, por lo que recomiendan que las semillas se oculten para disminuir la probabilidad de depredación. Cabe mencionar que las semillas fueron cubiertas con tierra completamente para minimizar la depredación, a pesar de ello, la fauna desenterró y consumió una proporción considerable de semillas, como sucedió con M. zapota (54% en Aj) y R. mucosa (45% en Am). A pesar de este fenómeno, los porcentajes de germinación obtenidos en el campo son altos (47% promedio general) en relación con otros estudios similares que registran entre 5% (Martínez-Sánchez, 2004) y 15% de germinación (Pereyra y Fredericksen, 2002) en experimentos similares realizados en vegetación natural. Aunque este porcentaje no alcanza los niveles recomendados por Arriaga et al. (1994), estos resultados pueden considerarse adecuados, porque evitan el proceso de transporte, trasplante y mortalidad de las plántulas (Valtierra et al., 2008), además de que resulta más económico.
La alta capacidad de germinación lograda en campo y en vivero se atribuye a que se usaron semillas maduras y también a que fueron sembradas casi inmediatamente después de colectadas, sin afectar el proceso de germinación para especies que pierden la viabilidad rápidamente (Arriaga et al., 1994; Vázquez-Yanes et al., 1997; Longman, 2003). A. megalocarpon que pertenece a la familia Apocynaceae, se caracteriza por presentar semillas que pierden la viabilidad rápidamente (Alzugaray et al., 2006); por otro lado, la siembra inmediata bajo condiciones ambientales adecuadas, evitó la entrada de latencia obligada (sensu Arriaga et al., 1994) para las semillas de M. zapota, O. macrocalyx, L. castilloi y R. mucosa las cuales se consideran ortodoxas (Cordero y Boshier, 2003; Isabeth et al., 2003; Lopes et al., 2006). Además, las semillas fueron enterradas completamente, lo que evitó la desecación y hubo humedad suficiente para asegurar la germinación (Arriaga et al., 1994).
Capacidad de germinación por especie
Foster y Delay (1998), mencionan que O. macrocalyx obtuvo un porcentaje de germinación <1% para semillas dispersadas de forma natural bajo los árboles padres en bosque tropical (después de 65 días de observación). En este estudio, también bajo condiciones de campo y en un bosque natural, la proporción de semillas germinadas para esta especie fue de 75%; esto se puede atribuir a que las semillas fueron sembradas y cubiertas completamente con tierra, manteniendo mayor humedad. Estos mismos autores, colectaron y sin almacenar sembraron las semillas de esta especie, obteniendo en laboratorio 100% de germinación con semillas escarificadas y 48% de germinación con semillas sin escarificar; mientras que en este trabajo en el vivero se obtuvo una germinación >90%, a pesar de no haber escarificado. En este estudio, no se escarificaron las semillas debido a que se quería reproducir la germinación como ocurre de manera natural. Las diferencias encontradas pueden deberse a que las semillas fueron colectadas del árbol, garantizando la cosecha reciente.
Sautu et al. (2006) registran para L. castilloi una capacidad de germinación de 54% en condiciones de laboratorio, Cordero y Boshier (2003) mencionan una germinación de 70%, en este estudio, la germinación de semillas alcanzada fue un poco mayor a los trabajos revisados (80%).
Parraguirre (1992), menciona que M. zapota en condiciones de vivero germina entre el 92 al 100%, en este trabajo la diferencia (80%) se puede deber a que las intensas lluvias que se presentaron propiciaron en algunos casos que las semillas se fueron más abajo dentro del sustrato, dificultando la emergencia de la plúmula al momento de germinar, ya que éstas presentaban la radícula y la plúmula pero sin alcanzar a emerger; estas semillas se consideraron como no germinadas.
Por otro lado, Sautu et al. (2006) determinaron 20% de germinación para Aspidosperma cruenta en condiciones de laboratorio, dato inferior a lo encontrado en condiciones de vivero para A. megalocarpon (81%), lo cual puede deberse a la siembra cercana al periodo de cosecha.
Dado que no se logró identificar la especie de Eugenia y que existe poca literatura sobre la misma, no es posible comparar el dato con Eugenia uniflora de la cual Franceschini (2000) menciona una capacidad de germinación de 24% en condiciones de laboratorio, resultado que es similar a lo encontrado en el estudio en el vivero.
Depredación de semillas
La poca influencia de las clases de cobertura vegetal en la cantidad de semillas depredadas tal vez se deba a que en el área de estudio los acahuales jóvenes y maduros son parches relativamente pequeños (1-3 ha) que se encuentran inmersos en remanentes de vegetación madura, lo que puede estar provocando que la fauna sea similar o hasta compartida. Esto coincide con lo reportado por Martínez-Sánchez (2004), que encontró igual depredación de semillas en fragmentos de bosque y bosque continuo en Los Tuxtlas. Contrario a esto, Pereyra y Fredericksen (2002) mencionan mayor depredación de semillas en áreas perturbadas que en zonas conservadas de bosque tropical. La fauna depredadora fue la misma en las tres coberturas vegetales, los organismos causantes de la depredación de las semillas de M. zapota y R. mucosa básicamente fueron mamíferos como tepescuintle (Cuniculus paca) y zereque (Dasyprocta punctata); L. castilloi, O. macrocalyx y A. megalocarpon fueron atacadas por una especie de hormiga pequeña que consumió los cotiledones de las semillas al momento en que estos se encontraban hinchados por la absorción de agua. O. macrocalyx fue bastante atacada por hongos blancos que en ocasiones llegaron a cubrir completamente algunas semillas, para Eugenia sp. no se identificó al depredador. A pesar de que el porcentaje de depredación fue <54%, esta se considera baja, ya que en este sentido Martínez-Sánchez (2004), registró tasas de depredación entre 74 y 97%, lo cual se puede atribuir a que las semillas se enterraron.
Influencia del hábitat en la supervivencia de plántulas en campo
La mayor supervivencia de plántulas encontrada en Aj, se pudo deber principalmente a dos factores: a) las plántulas no sufrieron daños por caída de ramas, frutos y hojas secas que es la primera causa de mortalidad de plántulas en los bosques tropicales (Clark y Clark, 1984; Vázquez-Yanes y Orozco-Segovia, 1992; Martínez-Ramos, 1994; Martínez-Ramos y Álvarez-Buylla, 1995), y b) este hábitat es un sitio más abierto que combina tanto luz directa como diferentes niveles de sombra que parecen ser más adecuados para ser asimilados por las plántulas, condición que probablemente les confirió mayor tasa fotosintética y, por consecuencia, mayor probabilidad de supervivencia (Martínez-Ramos y Álvarez-Buylla, 1995; Marañón et al., 2004a).
Los datos obtenidos en este estudio, concuerdan con los de Kumbongmayum et al. (2005) que señalan mayor supervivencia en parches de vegetación secundaria que bajo sombra de vegetación conservada. En contraparte Paul et al. (2004), registran igual supervivencia de plántulas en parches y bajo bosque para cuatro especies tropicales en Uganda. Por otro lado, Rickera et al. (2000), mencionan que las especies varían en sus requerimientos de luz, lo que para algunas puede ser excesivo para otras puede ser la cantidad necesaria. Tal vez por eso, L. castilloi y O. macrocalyx, especies que son demandantes de luz en su etapa de plántulas (Cordero y Boshier, 2003), mostraron menor vigor en el bosque y probablemente ésta pueda ser la causa de su muerte en un tiempo posterior.
Supervivencia en vivero
Las plántulas del vivero presentaron alto porcentaje de supervivencia (Arriaga et al., 1994; Pereyra y Fredericksen, 2002) el cual fue mayor con relación al del campo. Esto puede deberse a que las plántulas no estuvieron tan expuestas a la depredación, con excepción de A. megalocarpon cuyas plántulas fueron atacadas en una sola noche por hormigas arrieras. Esto ha sido mencionado como uno de los principales problemas de pérdida de plántulas en vivero (Vázquez-Yanes et al., 1997). Por otra parte, en el corto periodo de sequía, se aplicó riego previniendo el posible estrés hídrico a las plántulas (Marañón et al., 2004a). Las especies no mostraron diferencias significativas en la mortalidad como respuesta a la cantidad de sombra suministrada. Sin embargo, R. mucosa y M. zapota, que son especies esciófitas típicas de bosques primarios (Ibarra-Manríquez et al., 2001; Pennington y Sarukhán, 2005) presentaron mayor mortalidad en donde hubo mayor exposición solar (sombra 40%).
Crecimiento de plántulas en campo y vivero
Mientras que diversos autores concuerdan que en el bosque conservado se observa menor crecimiento de plántulas y el mayor crecimiento ocurre en sitios donde existe más incidencia de luz, como en parches de vegetación secundaria (Paul et al., 2004; Khumbongmayum et al., 2005), bordes de claros (Pereyra y Fredericksen, 2002) y zonas abiertas completamente (Marañón et al., 2004b), en este estudio no se observó influencia por el tipo de cobertura vegetal. La posible explicación a esta diferencia es porque en el área de estudio los niveles de luz registrados en el sotobosque (51,4%), superan por mucho los niveles de luz de las áreas conservadas de los estudios revisados, lo cual se debe a la intensidad de uso de este recurso.
El mayor crecimiento en vivero para A. megalocarpon, L. castilloi, M. zapota y O. macrocalyx se puede deber a que las plántulas no estuvieron expuestas tan abiertamente a defoliación y a patógenos (Martínez-Ramos, 1994) y porque el sustrato comercial usado tiene la cualidad de contener nutrientes que se van liberando gradualmente (Arriaga et al., 1994, Vázquez-Yanes et al., 1997). Los niveles de luz usados en el vivero no resultaron estresantes para las plántulas de las diferentes especies, al menos en las primeras etapas evaluadas. En relación con esto, Martínez-Ramos (1994), Plana (2000), Rickera et al. (2000) mencionan que muchas especies tienen intervalos amplios de tolerancia de luz y nutrientes y que ésto puede variar entre las especies y entre el estado de plántula y juvenil. De las especies utilizadas en este estudio M. zapota y R. mucosa son propias de las selvas maduras (Pennington y Sarukhán, 2005), mientras que O. macrocalyx, A. megalocarpon, L. castilloi y Eugenia sp. pueden formar parte de la selva o presentarse en fases avanzadas de la sucesión. En este caso, las primeras pudieran corresponder a lo que Spurr y Barnes (1982) llaman especies de fase vacía, las cuales germinan y se establecen bajo el dosel y son lo suficientemente tolerantes a la sombra ya que las plántulas sobreviven en un número pequeño y esperan algún evento que les permita completar su desarrollo.
A modo de conclusión se puede decir que las condiciones ambientales del área de estudio en las tres clases de cobertura vegetal son las adecuadas para la germinación, crecimiento y establecimiento de plántula de las especies estudiadas. Que la siembra directa en campo con semillas recién colectadas puede ser una opción viable como estrategia para la restauración de áreas degradadas, aunque se recomienda que la siembra de semillas en campo se realice durante la época de lluvias. Que las tasas de germinación de semillas y supervivencia de plántulas en el vivero son aceptables en términos comerciales para la producción de plántulas. Que las clases de sombra usadas no ejercen influencia en la germinación, supervivencia y crecimiento de las especies evaluadas. Que la siembra de semillas disminuye la probabilidad de ser depredadas. La información generada nos permite sugerir la utilización de las especies estudiadas en la rehabilitación de áreas degradadas del bosque original.
REFERENCIAS
Alzugaray C., N.J. Carnevale, A.R. Salinas y R. Pioli. 2006. Calidad de semillas de Aspidosperma quebracho-blanco Schlecht. Quebracho. Revista de ciencias forestales 13:26-25. [ Links ]
Arriaga, M.V., V.G. Cervantes y A. Vargas-Mena. 1994. Manual de reforestación con especies nativas: colecta y preservación de semillas, propagación y manejo de plantas. 1ª edición. Instituto Nacional de Ecología, SEDESOL, UNAM. México, D.F. 179 p. [ Links ]
Camacho-Cruz, A., M. González-Espinosa, J.H.D., Wolf y B.H.J. de Jong. 2000. Germination and survival of tree species in disturbed forests of the highlands of Chiapas, Mexico. Canadian Journal of Botanic 78:1309-1318. [ Links ]
Clark, D.A. y D.B. Clark. 1984. Spacing dynamics of a tropical rain forest tree: evaluation of the Janzen-Connell model. The American Naturalist 124:769-788. [ Links ]
Conagua. 2008. Precipitación diaria de estaciones hidroclimatológicas de la entidad. Estación Boca del Cerro, Tenosique. Consultada octubre del 2008. http://www.tabasco.gob.mx. [ Links ]
Cordero, J. y D.H. Boshier. 2003. Árboles de Centroamérica un manual para extensionistas. Department of Plant Sciences University of Oxford-Centro Agronómico Tropical de Investigación y Enseñanza. Costa Rica. 1077 p. [ Links ]
Didham R.K. y J.H. Lawton. 1999. Edge structure determines the magnitude of changes in microclimate and vegetation structure in tropical forest fragments. Biotropica 31:17-30. [ Links ]
Enciclopedia de los Municipios de México. 2005. Instituto Nacional para el Federalismo y el Desarrollo Municipal, Gobierno del Estado de Tabasco, Tabasco, México. http://www.e-local.gob.mx/work/templates/enciclo/tabasco/index.html [ Links ]
Figueroa, J. 2000. Aspectos ecológicos de la germinación en especies del bosque templado-húmedo del sur de Chile. Revista Chilena de Flora y Vegetación Chloris Chilensis. 3(2). http://www.chlorischile.cl/semillas/semillas.htm. [ Links ]
Foster, S.M. y L.S. Delay. 1998. Dispersal of mimetic seeds of three species of Ormosia (Leguminosae). Journal of Tropical Ecology 14:389-411. [ Links ]
Franceschini, C.M. 2000. Morfología de embriones y plántulas en mirtáceas del Nordeste Argentino. Ciencia y Tecnología, Comunicaciones Científicas y Tecnológicas. 3 p. http://www.unne.edu.ar/Web/cyt/cyt/biologia/b039.pdf [ Links ]
Guariguata R.M. y Ostertag R. 2002. Sucesión secundaria. p: 592-623. In: Guariguata, M. R. y G. H. Kattan (eds). Ecología y conservación de bosques tropicales. Libro Universitario Regional. Cártago, Costa Rica. [ Links ]
Harms, K.E. y C.E.T. Paine. 2003. Regeneración de árboles tropicales e implicaciones para el manejo de bosques naturales. Revista Ecosistemas 3. 16p. http://rua.ua.es/dspace/bitstream/10045/8893/1/ECO_12%283%29_03.pdf [ Links ]
Harper, A.K., S.E. MacDonald, J.P. Burton, J. Chen, D.K. Brosofske, C.S. Saunders, S.E. Euskirchen, D. Roberts, S.M. Jaiteh y P. Esseen. 2005. Edge influence on forest structure and composition in fragmented landscapes. Conservation Biology 19(3):768-782. [ Links ]
HemiView. 1999. User Manual Version 2.1. Delta-T Devices, Ltd. Cambridge, UK. [ Links ]
Holl, D.K. 1999. Factors limiting tropical rain forest regeneration in abandoned pasture: seed rain, seed germination, microclimate, and soil. Biotropica 31(2):229-242. [ Links ]
Ibarra-Manríquez, G., M. Martínez-Ramos y K. Oyama. 2001. Seedling functional types in a lowland rain forest in Mexico. American Journal of Botany 88(10):1801-1812. [ Links ]
INEGI. 2006. Cuaderno Estadístico Municipal de Tenosique, Tabasco. Gobierno del Estado de Tabasco. http://www.inegi.gob.mx/est/contenidos/espanol/sistemas/cem06/estatal/tab/m017/index.htm [ Links ]
Isabeth L., M. Villafana, N. Guezou, F. Chabai, L. Germosén-Robineau. 2003. Manual de cultivo y conservación de plantas medicinales, Tomo III, Árboles Dominicanos. Enda-Caribe, AFVP & Fundación Moscoso Puello, Santo Domingo. 152 p. [ Links ]
Jordano, P., R. Zamora, T. Marañón y J. Arroyo. 2002. Claves ecológicas para la restauración del bosque mediterráneo. Aspectos demográficos, ecofisiológicos y genéticos. Ecosistemas 10(1). http://www.revistaecosistemas.net/pdfs/312.pdf. [ Links ]
Khumbongmayum, D.A., M.L. Khan y R.S. Tripathi. 2005. Survival and growth of seedlings of a few tree species in the four sacred groves of Manipur, Northeast India. Current Science 88(10-11):1781-1788. [ Links ]
Lanly, J.P. 2003. Deforestation and forest degradation factors. Congress Proceedings B, XII World Forestry Congress, 21-28 September 2003, Quebec, Canada. Pp. 75-83. [ Links ]
Longman K.A. 2003. Raising seedlings of tropical trees. Tropical trees: Propagation and planting manuals. SRM Production Services, Malaysia. Pp.138. http://www.fao.org/DOCREP/006/AD230E/AD230E00.HTM [ Links ]
Lopes J.C., P.C. Dias y C.M. Peixoto de Macedo. 2006. Tratamentos para acelerar a germinação e reduzir a deterioração das sementes de Ormosia nitida vog.1. R. Árvore, Viçosa-MG 30(2):171-177. [ Links ]
Marañón, T., J.J. Camarero, J.C. Mario Díaz, J.M. Espelta, A.H.P. Jordano, F. Valladares, M. Verdú y R. Zamora. 2004a. Heterogeneidad ambiental y nicho de regeneración. In: Valladares F. (ed). Ecología del bosque mediterráneo en un mundo cambiante. Ministerio de Medio Ambiente, EGRAF, S. A., Madrid, España. Pp. 69-99. [ Links ]
Marañón, T., R. Villar, J.L. Quero y I.M. Pérez-Ramos. 2004b. Análisis del crecimiento de plántulas de Quercus suber y Q. canariensis: Experimentos de campo y de invernadero. Cuaderno de la Sociedad Española de Ciencias Forestales 20:87-92. [ Links ]
Martínez-Ramos, M. y E. Álvarez-Buylla. 1995. Ecología de poblaciones de plantas en una selva húmeda de México. Boletín de la Sociedad Botánica de México 56:121-153. [ Links ]
Martínez-Ramos, M. 1994. Regeneración natural y diversidad de especies arbóreas en selvas húmedas. Boletín de la Sociedad Botánica de México 54:179-224. [ Links ]
Martínez-Sánchez, J.L. 2004. Fragmentación y remoción de semillas en el piso de la selva húmeda tropical: el caso de la reserva natural de Los Tuxtlas, sureste de México. Universidad y Ciencia 20(39):7-14. [ Links ]
Mulawarman, J.M. Roshetko, S.M. Sasongko y D. Irianto. 2003. Tree seed management - seed sources, seed collection and seed handling: a field manual for field workers and farmers. International Centre for Research in Agroforestry (ICRAF) and Winrock International. Bogor, Indonesia. 54 p. [ Links ]
Myers, J.M. y D.S. Harrison. 1975. Drip and overhead sprinkler irrigation effect on soil moisture in a citrus grove. Proceedings of Florida State Horticultural Society 88:10-16. [ Links ]
Newmark, W.D. 2001. Tanzania forest edge microclimatic gradients: dynamic patterns. Biotropica 33: 2-11. [ Links ]
Ochoa-Gaona, S., I. Pérez-Hernández y B.H.J. de Jong. 2008. Fenología reproductiva de las especies arbóreas del bosque tropical de Tenosique, Tabasco, México. Revista de Biología Tropical 56(2):657-673. [ Links ]
Parraguirre, L.C. 1992. Germinación de las semillas de trece especies forestales comerciales de Quintana Roo. Memorias del Taller Madera, Chicle y Milpa, Contribuciones al Manejo Integral de las Selvas de Quintana Roo, México. PROAF, INIFAP, USAID y WWF-US. Chetumal, Quintana Roo. Pp. 67-80. [ Links ]
Paul, R.J., M. A. Randle, C.A. Chapman y L.J. Chapman. 2004. Arrested succession in logging gaps: is tree seedling growth and survival limiting? African Journal of Ecology 42:245-251. [ Links ]
Pennington, T.D. y J. Sarukhán. 2005. Árboles tropicales de México. Manual para la identificación de las principales especies. Universidad Nacional Autónoma de México, Instituto de Ecología, Fondo de Cultura Económica, México D.F., México. 523 p. [ Links ]
Pereyra, M.M. y S.T. Fredericksen. 2002. Regeneración por semilla de especies maderables en áreas de aprovechamiento forestal en un bosque húmedo tropical en Bolivia. Documento Técnico. Objetivo Estratégico de Medio Ambiente (USAID/Bolivia). 16 p. [ Links ]
Plana, E. 2000. Introducción a la ecología y dinámica del bosque tropical. Curso sobre gestión y conservación de bosques tropicales. Centro Tecnológico Forestal de Cataluña. http://politicaforestal.ctfc.es/es/documents/ponb.pdf. [ Links ]
Rickera, M., C. Siebeb, S. B. Sánchez, K. Shimadab, C.B. Larson, M. Martínez-Ramos y F. Monagninie. 2000. Optimising seedling management: Pouteria sapota, Diospyros digyna, and Cedrela odorata in a Mexican rainforest. Forest Ecology and Management 139:63-77. [ Links ]
Romo, R.M. 2005. Efecto de la luz en el crecimiento de plántulas de Dipteryx micrantha Harms "shihuahuaco" transplantadas a sotobosque, claros y plantaciones. Ecología Aplicada 4(1 y 2):1-8. [ Links ]
Roxburgh, J.R. y D. Kelly. 1995. Uses and limitations of hemispherical photography for estimating forest light environments. Zealand Journal of Ecology 19(2):213-217. [ Links ]
Sánchez, D., E. Arends y V. Garay. 2003. Caracterización de las semillas de seis especies frutales arbóreas, usadas por la etnia Piaroa en la Reserva forestal Sipapo, estado Amazonas, Venezuela. Revista Forestal Venezolana 47(2):31-36. [ Links ]
Sautu, A., M.J. Baskin, C.C. Baskin y R. Condit. 2006. Studies on the seed biology of 100 native species of trees in a seasonal moist tropical forest, Panama, Central America. Forest Ecology and Management 234:245-263. [ Links ]
Soilmoisture. 1998. Manual para el manejo de tensiómetro y recomendaciones de uso. Santa Bárbara, California. 24 p. [ Links ]
Spurr, A.H. y B.V. Barnes. 1982. Ecología Forestal. AGT Editor, México. 690 p. [ Links ]
Valtierra, P.E., S.O.T. Magaña, L.M. Vanegas, C.M.P. Lozano, G.C.M. Hernández. y L.H.P. Fierro. 2008. Reforestación; Evaluación externa ejercicio fiscal 2007.COLPOS, CONAFOR, SEMARNAT.115 p. [ Links ]
Vázquez-Yanes, C. y A. Orozco-Segovia. 1992. El bosque lluvioso en América Tropical: Dinámica forestal, reforestación, manipulación de las semillas y problemas de manejo. Tree Planters' Notes 43(4):119-124. [ Links ]
Vázquez-Yanes, C., A. Orozco, M. Rojas, M.E. Sánchez y V. Cervantes. 1997. La reproducción de las plantas: semillas y meristemos. Fondo de Cultura Económica. México. http://bibliotecadigital.ilce.edu.mx/sites/ciencia/volumen3/ciencia3/157/htm/lcpt157.htm. [ Links ]
Whelan, C. J., M.F. Willson, C.A. Tuma y I. Souza-Pinto. 1991. Spatial and temporal patterns of postdispersal seed predation. Canadian Journal of Botany 69:428-436. [ Links ]
Willan, R.L. 1991. Guía para la manipulación de semillas forestales, estudio con especial referencia a los trópicos. FAO Montes 20/2. Roma, Italia. 502 p. [ Links ]
Zar, J. H. 1999. Biostatistical Analysis. Prentice Hall, Nueva Jersey, EU. 663 p. [ Links ]
Nota
Este documento se debe citar como: Pérez-Hernández, I., S. Ochoa-Gaona, G. Vargas-Simón, M. Mendoza-Carranza y N. Antonio González-Valdivia. 2011. Germinación y supervivencia de seis especies nativas de un bosque tropical de Tabasco, México. Madera y Bosques 17(1):71-91.














