Services on Demand
Journal
Article
Indicators
Related links
Share
Revista de la Sociedad Química de México
Print version ISSN 0583-7693
Rev. Soc. Quím. Méx vol.44 n.4 Ciudad de México Oct./Dec. 2000
Investigación
Deposición selectiva de cobre utilizando CVD
Jorge Ramírez-Ortiz,1* Tetsuya Ogura,2 Carlos Ríos-Martínez,3 Luis Rodríguez Fernández4 y Horacio Flores Zúñiga5
1 Facultad de Ciencias Químicas, Universidad Autónoma de Zacatecas, Carr. Ciudad Cuauhtémoc Km 0.5, Guadalupe, Zac., Tel. 014 923 1006. E-mail: jramirez@cantera.reduaz.mx
2 Departamento de Química, ICET-UAG, Av. Patria 1201, Guadalajara, Jalisco.
3 CREN-UAZ, Ciprés 10, Zacatecas, Zacatecas.
4 Instituto de Física, Universidad Nacional Autónoma de México, Circuito Exterior, Coyoacán, México 04510 D.F.
5 Departamento de Metalurgia, CIMAV, Miguel de Cervantes # 120, Chihuahua, Chihuahua.
Recibido el 12 de septiembre del 2000.
Aceptado el 18 de octubre del 2000.
Resumen
La deposición química de vapor (CVD) es una técnica que se ha utilizado con éxito para obtener películas metálicas delgadas de cobre. Adicionalmente, mediante el tratamiento previo del substrato se puede depositar selectivamente, esto es, recubrir sólo aquellas regiones predeterminadas del substrato. En este trabajo se presentan los resultados de la producción in situ de semillas de algunos metales empleados con éxito en el depósito selectivo de Cu sobre obleas de silicio.
Palabra clave: deposición química de vapor, CVD, deposición selectiva, cobre, película.
Abstract
Chemical Vapor Deposition (CVD) is a technique which has been used successfully for obtaining thin copper metallic films. Additionally, through prior treatment of the substrate, selective deposits can be carried out, that is, coating only the predetermined regions of the substrate. In this work we present the results of the in situ production of seeds made from some metals used successfully in the selective deposition of Cu on silicon wafers.
Keywords: chemical vapor deposition, CVD, selective deposition, copper, films.
Introducción
El desarrollo de dispositivos lógicos rápidos y memorias de gran capacidad, requiere una reducción de las dimensiones de los componentes semiconductores y sus líneas de interconexión. La resistencia de conductores de aluminio / cobre y la gran capacitancia de estructuras basadas en SiO2 dieléctrico, restringen enormemente la reducción de sus dimensiones. De igual importancia son las fallas causadas por electromigración entre las líneas conductoras, cuando su sección transversal es muy pequeña (< 0.35 µm). Alternativamente, las líneas de interconexión de cobre metálico tienen una gran energía de activación contra la electromigración y su baja resistividad (1.67 µΩ cm a 22 °C) es también una ventaja importante [1].
La fabricación de componentes semiconductores óxido-metal de séptima generación (CMOS) utiliza cobre para las líneas de interconexión [2], pero se enfrenta a la dificultad para grabar en seco el patrón determinado de cobre. Por esto un esfuerzo importante se ha dedicado al desarrollo de un proceso de deposición química de vapor (DQV) de cobre, que permita el depósito selectivo de la película de Cu y la obtención de un recubrimiento homogéneo y preciso. En términos generales, la CVD selectiva disminuirá el número de etapas del proceso de fabricación de circuitos integrados (IC) y permitirá aumentar su eficiencia [3,4].
Algunos compuestos de cobre como los β-dicetonatos de Cu(I) y Cu(II) suelen usarse como precursores en la DQV de Cu [6-7], ya que al igual que otros compuestos similares [8-10], son relativamente fáciles de sublimar a bajas temperaturas (< 100 °C); para entonces ser desproporcionados y reducidos en fase gaseosa, produciendo especies complejas de cobre que se adhieren a la superficie del substrato para reaccionar y establecer núcleos de cobre metálico que van a formar islas o placas para después coalecer en una película continua, por otra parte los subproductos que se desprenden del substrato se agregan al flujo gaseoso principal para salir del reactor [5], así se produce la película que servirá como línea de interconexión en un IC. En la búsqueda de un proceso que evite el grabado en seco de la película de cobre, se han explorado procesos que orienten el depósito a regiones predeterminadas del substrato, como la formación de barreras superficiales mediante contacto y/o difusión, o la implantación de iones y técnicas de llenado son utilizadas para sembrar con diversas especies metálicas o sensibilizar el substrato, y aunque generan buenos resultados, la tecnología empleada o los precursores utilizados las hacen sumamente restrictivas.
Alternativamente, las especies metálicas o semillas pueden producirse in situ mediante una reacción de reducción, para que actúen como agentes iniciadores del depósito selectivo de Cu. En este trabajo, se presentan los resultados de la producción in situ de semillas de algunos metales (Ag, Au, Co, Pd y Pb) que fueron empleadas con éxito para depositar selectivamente películas de Cu sobre obleas de silicio.
Resultados y discusión
En la Tabla 1, se presenta una recopilación de los resultados más importantes para cada una de las sales metálicas estudiadas. Como podrá apreciarse, la formación de especies reducidas de la sal metálica, como en los casos de Ag, Au, Co, Pd y Pb, es una condición necesaria para la formación de la película. Sin embargo, esta condición no es suficiente, como lo indica el caso del Cu, que no indujo la formación de películas de Cu, aún cuando sus sales si formaron las especies reducidas correspondientes. Por otra parte, elementos como Mn y Sb, cuyas sales no produjeron especies reducidas al reaccionar con NaBH4, no indujeron el depósito de la película de cobre. En este punto, es importante señalar que a temperaturas mayores del intervalo de operación señalado, se produce lo que se conoce como depósito de capa, perdiéndose la propiedad de selectividad en cualquier región del substrato.
Aunque como se mencionó anteriormente, las semillas de los metales Ag, Au, Co, Pd y Pb produjeron resultados positivos para el depósito selectivo, sólo en algunos casos se analizó la película de Cu resultante, utilizando difracción de rayos X (XRD) y microscopía electrónica de barrido (SEM). Las reflexiones 2θ encontradas en los espectros de XRD, características de las fases existentes en las películas depositadas, indican una estructura policristalina de las mismas.
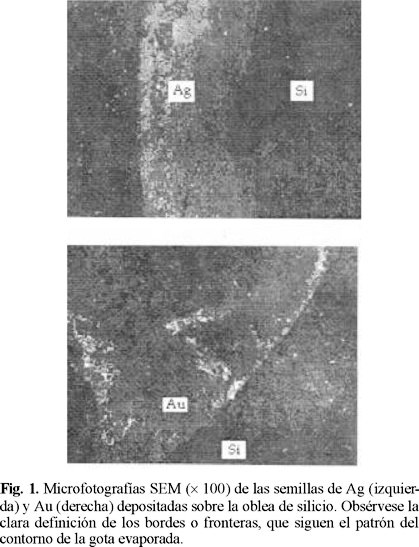
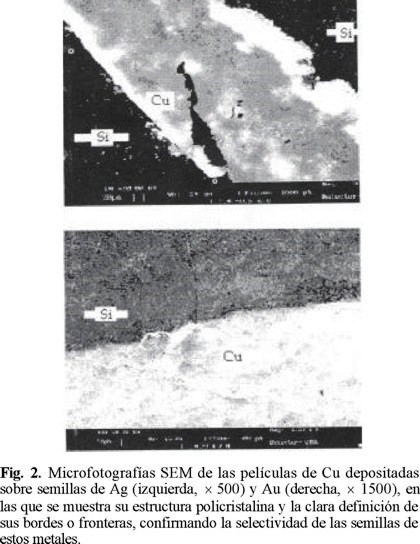
La figura 1, muestra microfotografías SEM de las semillas de Ag (arriba) y Au (abajo) sobre obleas de silicio. La baja amplificación permite observar que se conserva bien definido el borde de la gota evaporada. Por su parte la figura 2, muestra las microfotografías de las películas de Cu depositadas sobre las semillas de Ag (arriba) y Au (abajo), en las que se puede observar claramente, la estructura policristalina de las mismas. Igualmente, se puede apreciar que la película depositada sigue un patrón radial de crecimiento, a través de la coalescencia de las pequeñas islas formadas durante la evaporación de la gota de solución de semilla por efecto de la tensión superficial. Particularmente, las semillas de oro producen una la película mucho más homogénea, cuyo borde irregular es producto de la rugosidad de la oblea.
La distribución de semillas de algunas sales en la oblea de silicio y las correspondientes películas de cobre depositadas selectivamente se analizaron mediante espectroscopia de retrodispersión de Rutherford (RBS), técnica con la que es posible determinar el perfil de la concentración de elementos en las capas superficiales de un substrato, utilizando la retrodispersión elástica del ión incidente y su pérdida de energía en el interior del material. Para el análisis de las muestras se utilizó un haz de iones de 4He+ con energía de 2 MeV producidos por medio del acelerador Peletrón de 3MV. El área del haz en la superficie de las muestras fue de 1 mm2. Los iones retrodispersados por el blanco en un ángulo θ = 168° con respecto a la incidencia del haz, fueron registrados por medio de un detector de partículas de barrera superficial. Las señales producidas por el detector fueron tratadas y registradas en un analizador multicanal. En cada muestra se efectuó un barrido bombardeando diferentes puntos de la superficie.
Para las especies reducidas, se ve que éstas se distribuyen en una superficie circular de 7 mm de diámetro, correspondiente a la superficie de la gota utilizada, figuras 1 y 2. En el caso particular de las semillas de Ag, se encontró una concentración promedio de 0.4 µg / cm2 en la zona circular, de los que 0.24 µg / cm2 forman una región superficial de 460 Å de espesor, mientras que el resto se difunde exponencialmente en el silicio, hasta una profundidad de 2100 Å. El caso de las semillas de Au es un tanto diferente, ya que además de la superficie circular, que tiene un promedio de 1.5 µg / cm2, se observaron unas zonas pequeñas, con diámetros de 1.5 a 2 mm, cuya concentración es mucho mayor, llegando hasta los 28 µg / cm2.
En la figura 3, se muestran cuatro espectros de RBS sobrepuestos correspondientes a diferentes puntos de la superficie de la película de cobre depositada sobre semillas de Ag a una temperatura de 230 °C. Estos espectros están ordenados de manera ascendente de acuerdo a la cantidad de cobre correspondiente a cada uno de ellos y se designan con las letras a, b, c y d respectivamente. Los picos que corresponden a los iones retrodispersados por átomos de cobre son aquellos que están comprendidos entre el canal 400 y 550, siendo la altura de éstos proporcional a la cantidad de cobre en la región analizada. Las flechas de la figura 3, indican la posición en donde se espera el escalón del substrato (Si) y los picos correspondientes al Cu y Ag, cuando estos últimos se encuentran en la misma región superficial del substrato. Entre más masivo es un átomo, menor será la energía que pierde el ión retrodispersado 4He+, por lo que los escalones de elementos pesados aparecen hacia la derecha del espectro, en tanto que los elementos más ligeros se encontrarán a la izquierda.
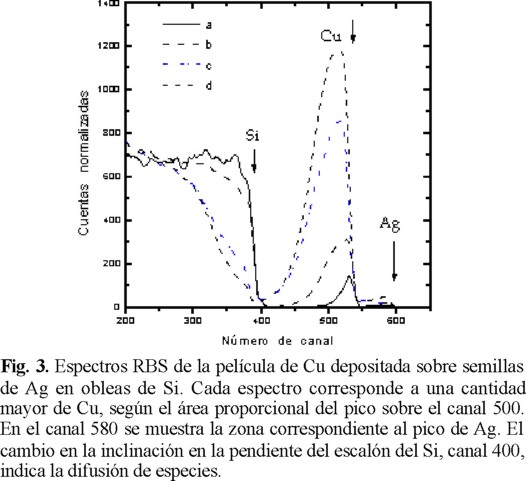
De los análisis RBS de las películas de Cu se encuentra que la cantidad de cobre depositado por DQV es más grande en las regiones donde es mayor la cantidad de plata depositada. Los espectros a y b de la figura 3, corresponden a regiones de la muestra donde el cobre no llega a formar una película superficial uniforme, pues se observa que el escalón correspondiente al silicio se encuentra en la zona superficial del blanco. La inclinación de la parte superior del escalón de silicio y la anchura del pico de Cu en el espectro b evidencian la difusión del Cu en el silicio. En estas regiones, donde no se llega a formar una película uniforme de Cu, se encontró una cantidad promedio de 3.17 µg / cm2 (±50 %) y 0.24 µg / cm2 (±30 %) de plata. Igualmente, se encontró que en promedio el Cu se difunde dentro del silicio hasta una profundidad de 5000 Å, mientras que la plata lo hace hasta unos 2800 Å.
Para los puntos correspondientes a los espectros c y d de la (Fig. 3), se tiene que el Cu está formando una película uniforme sobre la superficie del silicio, para luego difundirse en su interior. Lo anterior se deduce a partir del desplazamiento de la posición del escalón del silicio y por el cambio en su inclinación. En las regiones correspondientes a estos espectros, el grosor de la película de cobre varía de 1000 Å a 2000 Å, para luego difundirse en el silicio hasta una profundidad de unos 6800 Å. La cantidad promedio de Cu observada es de 39 µg / cm2 (±60 %) y de 0.867 µg / cm2 (±40 %) de Ag.
Parte experimental
El substrato utilizado es una oblea de silicio (Motorola) con una capa natural de óxido y con dimensiones de 7 × 1 × 0.3 cm. El sembrado se hace sobre el substrato limpio, colocando varias gotas de 4 µL de una solución 0.01M de la sal del metal correspondiente (Aldrich), que luego se evaporan en un plato caliente. Una vez a temperatura ambiente, la sal depositada en el substrato se hace reaccionar con una solución recién preparada de NaBH4, (Aldrich) para producir las especies reducidas o semillas. La oblea sembrada se enjuaga varias veces con agua desmineralizada, se seca con aire caliente, para luego ser colocada en el reactor y hacer la deposición selectiva de Cu. El complejo empleado como precursor es el hexafluoroacetilacetonatocobre(II) Cu(hfac)2 (Aldrich). El proceso de deposición selectiva de Cu se efectuó en un reactor tubular horizontal de pared caliente fabricado en el laboratorio. En este reactor, el precursor se sublima en el extremo izquierdo a 60 °C y un flujo de H2 (30 ml / min) lo transporta hacia el extremo derecho donde se lleva a cabo la reacción manteniendo unas temperaturas entre los 186 y 230 °C.
La composición y morfología de las películas de Cu producidas se determinó con un difractómetro Siemens D500 (línea Kα-Cu) y un microscopio electrónico de barrido 440 Cambridge-Leika. Por otra parte, las especies químicas resultantes de la reacción de reducción con NaBH4 fueron identificadas mediante difracción de rayos X (XRD) de los precipitados correspondientes, obtenidos in vitro [11]. Complementariamente, la distribución de las semillas, antes y después de la formación de la películas de cobre correspondientes fueron estudiadas mediante retrodispersión de Rutherford (RBS) realizada con un Acelerador Tandem Pelletron de 3 MV y el microscopio electrónico de barrido JSM-5800.
Conclusiones
Nuestros resultados confirman que la reacción de reducción in situ desarrollada en este trabajo, basada en NaBH4, es una buena aproximación para generar las especies metálicas necesarias para el depósito selectivo de películas de Cu. Igualmente, se encontró que la película de Cu se deposita sobre el área donde se secó la gota de sal metálica y que se produce una película de borde bien definido a lo largo de la frontera de la gota evaporada.
Los resultados para los metales Ag, Au, Co y Pd concuerdan con su ya conocida selectividad para el depósito de Cu. Sin embargo, es necesario realizar una caracterización más precisa de las especies metálicas que dan lugar a esta propiedad de selectividad, además de dilucidar el mecanismo de difusión de las especies respectivas y su influencia en el proceso de deposición.
Agradecimientos
El autor JRO agradece el apoyo del Programa SUPERA de ANUIES, folio No. 0482. LRF reconoce el apoyo del CONACyT al proyecto clave G0010-E.
Referencias
1. Jackson, R. L.; Broadbent, E.; Cacouris, T.; Harrus, A.; Biberger, M.; Patton, E.; Walsh T. Solid State Technology 1998, 41, 49-50. [ Links ]
2. Andricacos, P. C. The Electrochemical Society Interface 1999, Spring, 32-34. [ Links ]
3. Gelatos, A. V.; Jain, A. Marsh, R.; Mogab C. J. MRS Bull. 1994, 49-53. [ Links ]
4. Kaloyeros, A. E.; Fury, M. A. MRS Bull 1993, June, 22-26. [ Links ]
5. Van Herment, L.; Spendlove, B.; Sievers, R. E. J. Electrochem. Soc. 1965, 112, 1123-1126. [ Links ]
6. Girolami, G.S.; Jeffries, P.M.; Dubois, L.H. J. Am. Chem. Soc. 1993, 115, 1015-1024. [ Links ]
7. Burke, A.; Braeckelmann, G.; Danger, M.; Eisenbraun, E.; Kaloyeros, A. E. J. Appl. Phys. 1997, 82, 4651-4660. [ Links ]
8. Kim, D-H.; Wentfor, R. H.; Gill, W. N. J. Vac. Sci. Technol. 1994, A12, 153-157. [ Links ]
9. Chen, Y. D.; Reisman, A.; Turlik, I.; Temple, D. J. Electrochem. Soc. 1995, 142, 3911-3913. [ Links ]
10. Kim, Y. S.; Jung, D.; Min, S-K. Thin Solid Films 1999, 349, 36-40. [ Links ]
11. Glavee, G. N.; Klabunde, K. J.; Sorensen, C. M.; Hadjipanayis, G. C. Langmuir 1993, 9, 162-169. [ Links ]














