Services on Demand
Journal
Article
Indicators
Related links
Share
Perinatología y reproducción humana
On-line version ISSN 2524-1710Print version ISSN 0187-5337
Perinatol. Reprod. Hum. vol.28 n.4 Ciudad de México Oct./Dec. 2014
Artículo original
Efecto in vitro del pentóxido de vanadio (V2O5) sobre la calidad espermática
In vitro effect of vanadium pentoxide (V2O5) on sperm quality
Yoeli Méndez,* Francisco Báez,* Patricia Villamediana*
* Laboratorio de Citogenética. Facultad Experimental de Ciencias, Universidad del Zulia. Maracaibo, Venezuela.
Correspondencia:
Yoeli Méndez
Villa Santa Lucía, Casa G9, Yaritagua,
Estado Yaracuy, Venezuela.
Tel: +58 2514824934 / +58 412 6424016
E-mail: yoe4_ml@hotmail.com
Recibido: 09 de julio de 2014
Aceptado: 21 de agosto de 2014
RESUMEN
El vanadio es un metal pesado considerado como un contaminante ambiental, producto de la manipulación antropogénica, que incide sobre el potencial reproductivo masculino, especialmente sobre la movilidad espermática. Esta investigación tuvo como objetivo determinar el efecto in vitro del pentóxido de vanadio sobre la calidad espermática. Se incubaron suspensiones de espermatozoides humanos por 24 horas bajo concentraciones de 0, 1 y 2 ppm V2O5, se realizó la valoración de la movilidad y vitalidad espermática, la integridad de membrana, la reacción acrosómica y la integridad de la cromatina espermática. El V2O5 alteró de manera significativa la movilidad espermática, específicamente los patrones de movilidad espermática moderado (p < 0.01), lento (p = 0.01) e inmóvil (p < 0.01). Los grupos tratados con V2O5 presentaron un porcentaje de espermatozoides vivos significativamente mayor al grupo control (p < 0.01). La integridad de membrana y reacción acrosómica no resultaron afectadas por la exposición de espermatozoides humanos a V2O5 (p > 0.05). De igual modo, no se observaron alteraciones del material nuclear (p > 0.05). El vanadio es capaz de alterar la movilidad y vitalidad espermática sin inducir cambios sobre la integridad de membrana y la cromatina espermática.
Palabras clave: Vanadio, espermatozoides humanos, movilidad espermática, vitalidad espermática, integridad de la cromatina espermática.
ABSTRACT
Vanadium is a heavy metal considered an environmental pollutant product of anthropogenic manipulation; it influences the masculine reproductive potential, especially the sperm motility. This research had the objective of determining the effect of vanadium pentoxide on sperm quality in vitro. Spermatozoa were incubated for 24 hours under 0, 1 and 2 ppm V2O5 concentrations, and sperm motility and vitality, membrane integrity, acrosome reaction and sperm chromatin integrity were assessed. V2O5 altered sperm motility in a significant way, specifically moderated (p < 0.01), slow (p = 0.01), and non motile (p < 0.01) sperm motility patterns. The groups treated with V2O5 had a major percentage of live spermatozoa than the control group (p < 0.01). Membrane integrity and acrosome reaction were not affected by human sperm exposition to V2O5 (p > 0.05). Similarly, we did not observe nuclear material alterations. Vanadium is able to alter sperm motility and viability without inducing changes on membrane and chromatin integrity.
Key words: Vanadium, human spermatozoa, sperm motility, sperm viability, sperm chromatin integrity.
INTRODUCCIÓN
El vanadio es un metal que presenta diferentes estados de oxidación, de los que sólo los estados VIII, VIV y VV presentan funciones biológicas conocidas. Uno de los compuestos que contienen vanadio más empleados comercialmente es el pentóxido de vanadio (V2O5). Éste es un agente químico peligroso con un límite de exposición ocupacional a sus polvos y humos de 0.05 mg/m3 (IARC).
Todos los petróleos crudos y materiales de origen fósil, especialmente los petróleos de Venezuela, contienen V2O5 en concentraciones que van desde 282 a 1,180 µg/g. Este metal pesado se utiliza también en la industria metalúrgica y agrícola, producción de vidrio, pinturas de aplicación común, colorantes para fotografía y cinematografía, entre otros. El V2O5 es considerado un contaminante ambiental producto de la manipulación antropogénica.1
La incorporación del vanadio al organismo de los mamíferos se da a través de la piel, el tracto gastrointestinal y el sistema respiratorio, ingresando al interior celular mediante transporte aniónico. Dicho metal es capaz de interactuar con moléculas orgánicas como péptidos, proteínas, aminoácidos y azúcares en el estado de oxidación IV y V, al ser acumulado en hígado, riñón, huesos, pulmones, y al atravesar las barreras placentaria y hematotesticular.1
Como función biológica, se le atribuye la participación en el transporte de electrones en organelos celulares de organismos como los tunicados, inhibición de ATPasas, participación en la regulación de la bomba Na++/K+, transporte y oxidación de la glucosa e inhibición de la lipólisis y gluconeogénesis.2 Por otro lado, se ha observado que el vanadio posee propiedades que le asemejan a la insulina y que actúa como un agente antiproliferativo y proapoptótico, por lo que actualmente se evalúa su uso en terapias antitumorales.3
La exposición crónica por inhalación en ambientes laborales conlleva a afecciones pulmonares como bronquitis, laringitis y faringitis, así como también a alteraciones del ritmo cardiaco.1 Por otro lado, se ha observado que la exposición a pentóxido de vanadio puede ocasionar fragmentación del DNA,4 así como la inducción de aberraciones cromosómicas estructurales y numéricas sobre células inmunitarias y ováricas.1
Estudios realizados en ratas demuestran que la exposición a sulfato de vanadio ocasiona disminución de la movilidad espermática por inhibición de la síntesis de fructosa, así como disminución de la concentración espermática y atrofia de los túbulos seminíferos (Jain y cols., 2007).5 D'Cruz y colaboradores6 observaron que la exposición in vitro de espermatozoides humanos a compuestos organometálicos de vanadio disminuye la movilidad de los mismos. Esta investigación fue realizada con la finalidad de estudiar el efecto del pentóxido de vanadio sobre los parámetros espermáticos humanos y contribuir al esclarecimiento del mecanismo bajo el que este metal disminuye la fertilidad masculina.
Material y métodos
Obtención de la muestra
Las muestras de semen fueron obtenidas de individuos voluntarios residentes en el Municipio Maracaibo, Estado Zulia, en edades comprendidas entre 20 y 30 años. Dichos voluntarios autorizaron la evaluación y tratamiento de las muestras suministradas, bajo la protección de la divulgación de sus identidades.
La toma de la muestra se realizó por masturbación, luego de 3-5 días de abstinencia sexual, depositándola en un colector estéril. Ésta fue llevada en los próximos 20 minutos al Laboratorio de Citogenética de la Facultad Experimental de Ciencias, LUZ.
Evaluación seminal
El análisis seminal incluyó evaluación del color, volumen, pH y viscosidad seminal, la concentración, movilidad, morfología y viabilidad espermática, bajo los parámetros establecidos por la Organización Mundial de la Salud (OMS).
Integridad de membrana plasmática
La evaluación de la integridad de membrana se realizó aplicando el test hiposmótico (HOST). En 500 µL de solución hiposmótica (citrato de sodio al 1%) se colocaron 125 µL de semen y se incubó a 37 oC por 30 min. Para medir el hinchamiento espermático, se procedió a observar bajo el microscopio de contraste de fase a 400X, evaluando 100 espermatozoides por muestra, considerándose como viables aquellos que presentaron cola curvada o enrollada como reacción al cambio osmótico.7
Capacitación espermática y reacción acrosómica
Se colocaron 100 µL de suspensión espermática en un vial; posteriormente, se añadieron 100 µL de una solución de CTC (20 mM Tris-HCl, 130 mM NaCl, 5 mM L-cisteína y 750 mM clortetraciclina) y se mezclaron con cuidado. Luego de 10 segundos, se detuvo la reacción por adición de 16 µL de una solución de paraformaldehído al 12.5% v/v en 0.5 M de Tris-HCl. Las muestras se mantuvieron a 4 oC en la oscuridad hasta su evaluación dentro de las 24 horas posteriores a la preparación. Se evaluaron 100 espermatozoides por muestra.8 Los espermatozoides fueron clasificados como no capacitados (NC), aquellos que presentaron fluorescencia verde brillante distribuida uniformemente en la cabeza del espermatozoide; como capacitados (C), aquellos que presentaron la región acrosomal verde fluorescente y región postacrosomal oscura; y como acrosoma reaccionado (AR), aquellos que presentaron la cabeza del espermatozoide parcialmente teñida de verde fluorescente, verde en la región postacrosomal o sin fluorescencia.
Compactación de la cromatina espermática
Se realizó un frotis de la suspensión espermática y se dejó secar al aire para proceder al tratamiento con el kit Diff-Quick®. A continuación, se colocó la lámina portaobjetos con la muestra en la solución fijadora (metanol) por 10 segundos, luego se transfirió al colorante 1 (eosina) y tras 10 segundos, se extrajo la lámina y se lavó suavemente. Por último, se tiñó con el colorante 2 (tiazina) por 10 segundos, se lavó suavemente y se dejó secar al aire. La muestra fue observada bajo el microscopio de contraste de fases con el objetivo de 100x; se evaluaron 100 espermatozoides, clasificándolos como espermatozoides con cromatina compactada, aquellos débilmente teñidos; y como espermatozoides con cromatina descompactada, aquellos fuertemente teñidos.9
Fragmentación del DNA espermático
El análisis de la fragmentación del DNA espermático se llevó a cabo bajo la metodología propuesta por Fernández y su equipo.10 Las muestras fueron teñidas con la solución de Wright y se contaron 100 espermatozoides por muestra, clasificándolos como espermatozoides sin DNA fragmentado, aquellos con un halo de DNA grande o mediano; y como espermatozoides con DNA fragmentado, aquellos con un halo de DNA pequeño, sin halo o degradados.
Diseño experimental
Luego de colectadas y transportadas las muestras al laboratorio, se procedió a realizar la evaluación seminal, de la integridad de la membrana plasmática, de la capacitación espermática y reacción acrosómica, de la compactación de la cromatina espermática y de la fragmentación del DNA espermático.
Seguidamente, se tomaron tres alícuotas de una concentración de 5 x 106 espermatozoides/mL; una de éstas se empleó como control durante cada ensayo, mientras que las dos restantes se emplearon para realizar el tratamiento con concentraciones de 1 y 2 ppm V2O5. Las muestras fueron incubadas por 24 horas en una atmósfera de 5% CO2 en aire saturado de humedad y a una temperatura de 37 oC en medio definido modificado (mDM).11
Luego de realizado el tratamiento, se procedió a evaluar la movilidad, vitalidad, integridad de membrana plasmática, capacitación espermática y reacción acrosómica, compactación de la cromatina espermática y fragmentación del DNA espermático.
Análisis estadístico
Los resultados fueron expresados como media ± desviación estándar. El análisis estadístico fue realizado con el programa SAS (SAS Institute, 2001) mediante el Procedimiento Lineal General (PROC GLM) y el estadístico LSMEANS. Se calculó el coeficiente de correlación de Spearman (r) para determinar el grado de correlación entre los parámetros estudiados. El nivel de significancia aceptado fue de p ≤ 0.05.
RESULTADOS
Los datos reflejados en el cuadro I indican que la exposición in vitro a V2O5 es capaz de disminuir la movilidad espermática. Los patrones de movilidad espermática moderado (p < 0.01), lento (p = 0.01) e inmóvil (p < 0.01) resultaron alterados de manera significativa, disminuyendo la movilidad espermática a medida que se incrementó la concentración de dicho metal. El cuadro II presenta los coeficientes de correlación para los parámetros seminales tras 24 horas de incubación; se observa una correlación positiva media entre la concentración de V2O5 y el porcentaje de espermatozoides inmóviles.

Se observó que la vitalidad espermática también resultó influenciada al exponer espermatozoides humanos a vanadio (Cuadro I). Los grupos expuestos a 1 y 2 ppm V2O5 presentaron un porcentaje de espermatozoides muertos menor al grupo control (p < 0.01).
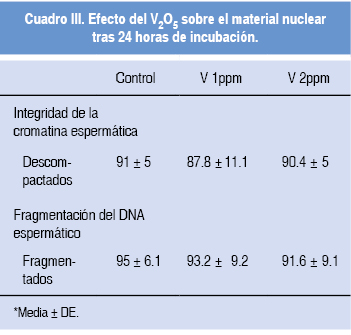
La integridad de membrana y reacción acrosómica no resultaron afectadas por la exposición de espermatozoides humanos a vanadio (p > 0.05) (Cuadro I). De igual modo, no se observaron alteraciones del material nuclear (p > 0.05) (Cuadro III).
DISCUSIÓN
La infertilidad masculina es responsable de alrededor de un 45% de los casos de fallas reproductivas entre parejas, bien sea por causas endocrinas, inmunológicas, infecciosas, genéticas o por exposición a factores ambientales como la temperatura y elementos tóxicos.7 Bajo distintos mecanismos, estos factores alteran la calidad espermática, comprometiendo la capacidad del gameto masculino de fecundar al ovocito y desarrollar un embarazo a término.12,13
Pocos estudios han sido realizados en espermatozoides humanos para valorar el efecto que ejerce el vanadio sobre la calidad espermática. Uno de ellos, realizado por D'Cruz y colaboradores,6 demostró que la exposición in vitro de espermatozoides humanos a compuestos organometálicos de vanadio (IV) disminuye su movilidad. De modo similar, la presente investigación muestra una disminución significativa de la movilidad espermática, efecto que pudo ser mediado por la inhibición de la ATPasa Na+/K+, dineína14,15 o de enzimas que participan en la glucólisis.16
El vanadio entra a las células en forma de vanadato (VO3-), y bajo un pH fisiológico, es reducido a vanadil (VO2+), catión que interactúa con diversas moléculas.17 Dicho metal pesado es capaz de inhibir enzimas como la gliceraldehído-3-fosfato deshidrogenasa (GAPDH), provocando la acumulación de intermediarios metabólicos de la vía glucolítica, así como la disminución de la concentración de ATP.16 La disminución del batido flagelar incide directamente sobre la capacidad de desplazamiento del espermatozoide a lo largo del tracto genital femenino y sobre el proceso de capacitación, imposibilitando el proceso de fecundación.18
De modo interesante, se observó que espermatozoides expuestos a V2O5 presentaron una vitalidad significativamente mayor respecto al grupo control. Es conocido que ratones knock out para el gen que codifica la GAPDH mantienen un consumo de oxígeno invariable a pesar de la disminución de la concentración de ATP y de la movilidad espermática.19 En este sentido, el V2O5 presentaría un comportamiento similar al compuesto ornidazol, el cual disminuye la movilidad espermática sin afectar la vitalidad espermática.20 Por otro lado, Ray y colaboradores21 observaron que la vitalidad no es afectada al exponer células a concentraciones entre 25-75 µM NH4VO3, evidenciando que bajas concentraciones de vanadio no presentan actividad citotóxica in vitro. A pesar de los distintos estudios realizados sobre el uso de sustratos energéticos22 y la compartimentalización del metabolismo energético en espermatozoides,23 persisten actualmente dudas sobre el aprovechamiento de distintas fuentes energéticas por parte de esta célula altamente diferenciada.
No se observaron variaciones significativas en la integridad de membrana y reacción acrosómica al exponer espermatozoides humanos a V2O5, resultados que coinciden con los obtenidos por D'Cruz y colaboradores.6 Sin embargo, Shrivastava y su grupo24 observaron peroxidación lipídica en células hepáticas al suministrar vanadil sulfato a ratas, mientras que Roess y colegas25 reportaron que el NaVO3 es capaz de disminuir la fluidez de membrana. Por otro lado, Castellini y su equipo26 describen la aparición de numerosos pliegues en la membrana acrosomal al exponer in vitro espermatozoides de conejo a concentraciones superiores a 1 µM de NaVO3.H2O.
El V2O5 no alteró la estructura de la cromatina espermática in vitro, en contraste con lo observado por D'Cruz y colaboradores.6 Dicho estudio sugiere que la exposición a compuestos organometálicos de vanadio (IV) causa roturas en el DNA, lo que estaría relacionado con el inicio del evento apoptótico; sin embargo, esta propiedad es atribuida al complejo ciclopentadienil-vanadio. De modo similar, Rodríguez-Mercado y su grupo27 reportaron la inducción de fragmentación del DNA en leucocitos en presencia de V2O5 de manera dosis/tiempo dependiente. Es conocido que la fragmentación del DNA puede estar relacionada con el estadio del ciclo celular, de modo que células en activo proceso de proliferación resultan más susceptibles a tal alteración.28
El espermatozoide es una célula diferenciada, caracterizada a su vez por presentar un núcleo altamente compactado debido a la presencia de proteínas ricas en residuos de arginina y cisteína denominadas protaminas, lo que les permite unirse al DNA y formar puentes disulfuro inter- e intramoleculares. El vanadio en distintos estados de oxidación es capaz de interactuar con moléculas con grupos funcionales sulfhidrilo y, particularmente, con los residuos de cisteína, favoreciendo la formación de puentes disulfuro. Tal cualidad podría favorecer la preservación de la integridad de la cromatina espermática; sin embargo, en la presente investigación, el proceso de licuefacción y separación del plasma seminal podría incidir directamente sobre el comportamiento de la cromatina espermática e inducir una rápida descondensación de la misma.29
El vanadio, en sus distintos compuestos químicos, es capaz de interactuar con múltiples moléculas en sistemas biológicos, pudiendo alterar el comportamiento de los mismos en diversas maneras. El potencial reproductivo masculino resulta afectado por este metal; sin embargo, el mecanismo bajo el que el vanadio ejerce su efecto deletéreo sobre los distintos parámetros espermáticos apenas comienza a ser elucidado.
CONCLUSIONES
La exposición in vitro de espermatozoides humanos a V2O5 causa alteraciones sobre la movilidad y vitalidad espermática; sin embargo, la integridad de membrana, reacción acrosómica e integridad de la cromatina espermática no se ven afectadas por este metal bajo las concentraciones estudiadas.
REFERENCIAS
1. Rodríguez J, Altamirano M. Vanadio: contaminación, metabolismo y genotoxicidad. Rev Int Contaminación Ambiental. 2006; 22: 173-89. [ Links ]
2. Pacheco J, Salas P, Galli C. Actividad insulino-mimética del vanadio. Rev Quím (Venezuela). 2006; 10: 3-10. [ Links ]
3. Korbecki J, Baranowska-Bosiacka I, Gutowska, Chlubek D. Biochemical and medical importance of vanadium compounds. Acta Biochim Pol. 2012; 59: 195-200. [ Links ]
4. Altamirano-Lozano M, Álvarez-Barrera L, Basurto-Alcántara F, Valverde M, Rojas E. Reprotoxic and genotoxic studies of vanadium pentoxide in male mice. Teratogen Carcin Mut. 1996; 16: 7-17. [ Links ]
5. Jain G, Pareek H, Sharma S, Bhardwaj M, Khajja B. Reproductive toxicity of vanadyl sulphate in male rats. J Health Sci. 2007; 53: 137-41. [ Links ]
6. D'Cruz O, Ghosh P, Uckun F. Spermicidal activity of metallocene complexes containing vanadium (IV) in humans. Biol Reprod. 1998; 58: 1515-26. [ Links ]
7. Giraldo N, Correa J, Vásquez N. Evaluación del efecto de la refrigeración sobre la calidad del semen equino. Revista CES. 2006; 2: 8-16. [ Links ]
8. Valeris R, Villamediana P, Quintero A, Parra O, Sandoval J, Ghebrehiwet B. Expression and distribution of the complement receptor gC1qR in bovine sperm. Revista Científica, FCV-LUZ. 2008; 18: 22-7. [ Links ]
9. Sousa A, Tavares R, Velez de la Calle J, Figueiredo H, Almeida V, Almeida-Santos T et al. Dual use of diff-quick-like stains for the simultaneous evaluation of human sperm morphology and chromatin status. Human Reprod. 2009; 24: 28-36. [ Links ]
10. Fernández J, Muriel L, Rivero M, Goyanes V, Vazquez R, Alvarez J. The sperm chromatin dispersion test: a simple method for the determination of sperm DNA fragmentation. J Androl. 2003; 24: 59-66. [ Links ]
11. Younis A, Zuelke K, Harper K, Oliveira M, Brackett B. In vitro fertilization of goat oocytes. Biol Reprod. 1991; 44: 1177-82. [ Links ]
12. Lazaros L, Vartholomatos G, Hatzi E, Kaponis A, Makrydimas G, Kalantaridou S et al. Assessment of sperm chromatin condensation and ploidy status using flow cytometry correlates to fertilization, embryo quality and pregnancy following in vitro fertilization. J Assist Reprod Genet. 2011; 28: 885-91. [ Links ]
13. Robinson L, Gallos I, Conner S, Rajkhowa M, Miller D, Lewis S et al. The effect of DNA sperm fragmentation on miscarriage rates: a systematic review and meta-analysis. Hum Reprod. 2012; 27: 2908-17. [ Links ]
14. Gibbons I, Cosson M, Evans J, Gibbons B, Houck B, Martinson K et al. Potent inhibition of dynein adenosinetriphosphatase and of the motility of cilia and sperm flagella by vanadate. Proc Natl Acad Sci. 1978; 75: 2220-4. [ Links ]
15. Macara I. Vanadium, an element in search of a role. Trends Biochem Sci. 1980; 5: 92-4. [ Links ]
16. Benabe J, Echegoyen L, Pastrana B, Martínez-Maldonado M. Mechanism of inhibition of glycolysis by vanadate. J Biol Chem. 1987; 262: 9555-60. [ Links ]
17. Ahmed A, Arakawa H, Tajmir-Riahi H. Binding of oxovanadium ions to the major and minor grooves of DNA duplex: stability and structural models. Biochem Cell Biol. 2006; 84: 677-83. [ Links ]
18. Miller D, Hollenbeck B, Smith G, Randolph J, Christman G, Smith Y et al. Processed total motile sperm count correlates with pregnancy outcome after intrauterine insemination. Urology. 2002; 60: 497-501. [ Links ]
19. Miki K, Qu W, Goulding E, Willis W, Bunch D, Strader L et al. Glyceraldehyde 3-phosphate dehydrogenase-S, a sperm-specific glycolytic enzyme, is required for sperm motility and male fertility. Proc Natl Acad Sci. 2004; 101: 16501-6. [ Links ]
20. Siva A, Yeung C, Cooper T, Shivaji S. Antimicrobial drug ornidazole inhibits hamster sperm capacitation, in vitro. Reprod Toxicol. 2006; 22: 702-9. [ Links ]
21. Ray R, Ghosh B, Rana A, Chatterjee M. Suppression of cell proliferation, induction of apoptosis and cell cycle arrest: chemopreventive activity of vanadium in vivo and in vitro. Int J Cancer. 2006; 120: 13-23. [ Links ]
22. Rodríguez-Gil J. Energy management of mature mammalian spermatozoa. In: Alemayehu L, editor. Success in artificial insemination-quality of semen and diagnostics employed. Intech; 2013. p. 153-174. [ Links ]
23. Kim Y, Haidl G, Schaefer M, Egner U, Mandal A, Herr J. Compartmentalization of a unique ADP/ATP carrier protein SFEC (sperm flagellar energy carrier, AAC4) with glycolytic enzymes in the fibrous she at of the human sperm flagellar principal piece. Dev Biol. 2007; 302: 463-76. [ Links ]
24. Shrivastava S, Jadon A, Shukla S, Mathur R. Chelation therapy and vanadium: effect on reproductive organs in rats. Indian J Exp Biol. 2007; 45: 515-23. [ Links ]
25. Roess D, Smith S, Winter P, Zhou J, Dou P, Baruah B et al Effects of vanadium-containing compounds on membrane lipids and on microdomains used in receptor-mediated signaling. Chemis Biodivers. 2008; 5: 1558-70. [ Links ]
26. Castellini C, Mourvaki E, Sartini B, Cardinali F, Moretti E, Collodel G et al. In vitro toxic effects of metal compounds on kinetic traits and ultrastructure of rabbit spermatozoa. Reprod Toxicol. 2009; 27: 46-54. [ Links ]
27. Rodríguez-Mercado J, Mateos-Nava R, Altamirano-Lozano M. DNA damage induction in human cells exposed to vanadium oxides in vitro. Toxicol in Vitro. 2011; 25: 1996-2002. [ Links ]
28. Ivancsits S, Pilger A, Diem E, Schaffer A, Rudiger H. Vanadate induces DNA strand breaks in cultured human fibroblasts at doses relevant to occupational exposure. Mutat Res. 2002; 519: 25-35. [ Links ]
29. Björndahl L, Kvist U. Human sperm chromatin stabilization: a proposed model including zinc bridges. Mol Hum Reprod. 2010; 16: 23-9. [ Links ]
Nota
Este artículo puede ser consultado en versión completa en: http://www.medigraphic.com/inper














