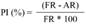En México, el cultivo de gladiolo (Gladiolus grandiflorus) es considerado el tercer cultivo ornamental por su importancia económica, con un valor de producción de 1,136 360.17 miles de pesos durante el 2020 (SIAP, 2020). Sin embargo, diversos factores pueden disminuir el volumen y calidad de la producción del gladiolo, entre los que sobresalen problemas fitosanitarios ocasionados por hongos, bacterias y virus (Elmer y Kamo, 2018).
La pudrición del cormo, inducida por Fusarium oxysporum f sp. gladioli, es una de las enfermedades más importantes del gladiolo, al provocar la marchitez y amarillamiento de hojas y una pudrición seca en la base del cormo que afecta la calidad de la vara floral (Khan et al., 2017). La pudrición del cormo se observa como un cambio en la coloración que va, de marrón claro a marrón oscuro a negro y finaliza con la momificación del cormo. Cuando la infección ocurre en los cormos almacenados en refrigeración, ocasiona una infección severa que puede llevar a la muerte de la planta y/o pérdidas económicas del 60 al 100% de la producción (Khan et al., 2017; Elmer y Kamo, 2018).
Fusarium oxysporum es un hongo cosmopolita que puede sobrevivir por años en el suelo sin la presencia del hospedante. Por otra parte, el uso de fungicidas a base de bencimidazoles y azoles es el método de control utilizado generalmente. Considerando que la persistencia del patógeno incrementa la aplicación de agroquímicos para el control fitosanitario de los cultivos, se genera otra serie de problemas como: la selección de cepas del patógeno resistente a estos productos, el incremento de costos de producción, además los riesgos de daño al ambiente y la salud humana, los cuales son cada vez mayores (Al-Hatmi et al., 2019; Marx-Stoelting et al., 2020).
Considerando lo anterior, es necesario llevar a cabo la búsqueda de alternativas económicas y ecológicamente viables para el manejo de este patógeno (Alizadeh et al., 2020). Entre las alternativas económica y ambientalmente sustentables, se encuentra el uso de microorganismos para el control de diversos hongos y bacterias fitopatógenas (Goredema et al., 2020). Al respecto, se han reportado bacterias del género Streptomyces como antagonistas a diversos hongos patógenos. El antagonismo de los estreptomicetos se debe a la producción de metabolitos secundarios con actividad fungicida en combinación con enzimas extracelulares del tipo quitinasas y pectinasas (Pedroza et al., 2019; Danial et al., 2020; Tlemsani et al., 2020; Zhang et al., 2020). La cepa CACIS-1.16CA (Streptomyces sp.) es una especie que produce una mezcla de metabolitos de color amarillo solubles en agua, que ejercen un efecto inhibitorio sobre el crecimiento de hongos fitopatógenos de los géneros Curvularia, Aspergillus, Helminthosporium, Fusarium, Alternaria, Phytophthora, Colletotrichum y Rhizoctonia (Evangelista-Martínez, 2014). En el mercado de los biopesticidas, existen dos productos comerciales que se basan en especies de Streptomyces, tal como S. lydicus WYEC108 y S. griseoviridis K61, ambas controlan especies de Fusarium spp., en diferentes cultivos (Evangelista-Martinez et al., 2020; Shrestha et al., 2020). El objetivo de este trabajo fue seleccionar estreptomicetos antagonistas contra F. oxysporum y evaluar in vitro e in vivo la actividad inhibitoria del extracto bioactivo de aislados de Streptomyces sp., para controlar el desarrollo de pudrición en cormos de gladiolo.
Materiales y métodos
Aislamiento y caracterización del hongo patógeno. A partir de un lote de 60 cormos de gladiolo de la variedad borrega blanca, provenientes del Estado de México y con síntomas de pudrición del cormo (Figura 1), se seleccionaron seis cormos a partir de los cuales se aisló y purificó a tres aislados del hongo Fusarium sp. (GL1, GL2 y GL3). Se obtuvieron cultivos monospóricos siguiendo el protocolo reportado por González-Pérez et al. (2009) y se mantuvieron en cajas de Petri con medio de cultivo agar, dextrosa y papa (PDA), incubados en oscuridad a una temperatura de 27 ºC.
La caracterización morfológica de los hongos aislados se realizó de acuerdo con caracteres descritos por Leslie et al. (2006). La identificación a nivel de género se realizó comparando las características morfológicas de la colonia (forma y color de la colonia, tipo de hifas, presencia de clamidosporas, macro y microconidios) y se registraron la forma, longitud y ancho de 50 macroconidios y 50 microconidios seleccionados al azar.
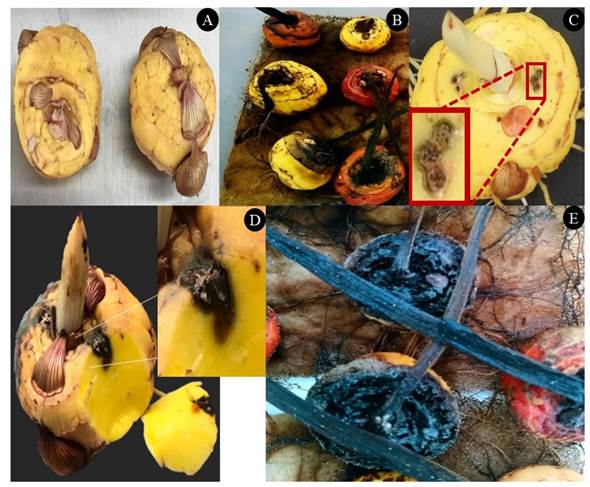
Figura 1 Cormos de gladiolo asintomáticos de la variedad borrega blanca (A). Cormos con síntomas de pudrición donde se aisló a F. oxysporum (B), los cuales fueron reproducidos mediante dos heridas realizadas con tres punciones y deposición de una solución de 5 μL de conidios a una concentración de 2.4 x106 conidios mL-1 de F. oxysporum GL1 (C). El corte perpendicular en el sitio de las heridas, muestra que a los 20 días después de la inoculación, la pudrición avanza en el interior del cormo (D) y después de tres a cuatro meses el cormo presenta una pudrición seca y oscura (E).
Identificación molecular. A partir de uno los tres aislados de Fusarium spp., se seleccionó por su patogenicidad y velocidad de crecimiento in vitro, una colonia monoesporica del aislado GL1. La identificación molecular del hongo se realizó mediante la extracción de ADN, siguiendo el protocolo de extracción con DNazol (Life Technologies), con algunas modificaciones. La amplificación por PCR de los fragmentos del gen que codifica para la β-Tubulina se realizó con los oligonucleótidos T1 (5´-AACATGCGTGAGATTGTAAGT-3´) y T2 (5´-TAGTGACCCTTGGCCCAGTTG-3´) (O´Donell & Cigelnik, 1997), Histona 3 con los oligonucleótidos H3-1b (5´-CGCGGCGAGACTGGATGTCCTT-3´), H3-1a (5´-ACTAAGCAGACCGCCCGCAGG-3´) (He et al., 2017), factor de elongación-1α con los oligonucleótidos EF-1 (5′-ATGGGTAAGGA(A/G)GACAAGAC-3′), EF-2 (5′-GGA(G/A)GTACCAGT(G/C)ATCATGTT-3′) (Herkert et al., 2019) y finalmente la región ITS utilizando oligonucleótidos universales ITS4 (5′-TCCTCCGCTTATTGATATGC-3′) e ITS5 (5′-GGAAGTAAAAGTCGTAACAAGG-3′) siguiendo el protocolo y condiciones de amplificación reportados previamente (Betancourt-Resendes et al., 2012; Uc-Varguez et al., 2018). Los fragmentos amplificados fueron purificados y enviados para su secuenciación a MACROGEN en Korea. La secuencia resultante, fue editada con el programa edit sequence (DNASTAR) y posteriormente se compararon con secuencias reportadas en la base de datos del NCBI, con ayuda del algoritmo de BLAST disponible en Internet.
Preparación del inóculo. La suspensión de conidios empleada para obtener la MIC, MLC y para los experimentos de infección de los cormos, se preparó a partir de un cultivo del hongo crecido por 11 días en cajas Petri con medio PDA. A una caja Petri con el hongo, se le agregó 5 mL de agua destilada estéril para remover la masa de conidios. La suspensión se filtró a través de varias capas de gasa y algodón para descartar residuos de micelio. La suspensión se centrifugó a 6000 rpm/10 min a 25 °C. El precipitado de conidios se lavó dos veces con agua destilada estéril, luego se resuspendió y con ayuda de la cámara de neubauer se ajustó la concentración a 1×105 conidios mL-1 o 2.4 × 106 según la actividad a realizar in vitro o in vivo respectivamente.
Prueba de patogenicidad del aislado de Fusarium sp. La patogenicidad de los aislados del hongo se verificó mediante inoculación de 30 cormos de gladiolo. Todos los cormos fueron desinfectados por inmersión en una solución de NaOCl al 0.3%/2 min, enjuagados con agua destilada estéril/1 min, seguido por una inmersión en etanol al 70%/2 min, y enjuagados con agua destilada estéril/1 min. Al final, el exceso de humedad se eliminó con papel absorbente estéril (González-Pérez et al., 2009).
Los cormos desinfectados fueron inoculados experimentalmente, mediante dos heridas hechas en la parte superior del cormo con tres punciones (por herida) realizadas con un palillo estéril. Posteriormente, en cada herida se depositó 5 µL de una solución de 2.4x106 conidios mL-1 de F. oxysporum, obtenidos de una colonia con 11 días de crecimiento en medio PDA. Todos los cormos incluyendo controles inoculados con agua destilada estéril, fueron incubados en condiciones de oscuridad en una cámara bioclimática a 25 °C y 70% de humedad. El registro sintomatológico se realizó a intervalos de cinco días durante 30 días. Finalmente, los cormos se mantuvieron por cuatro meses bajo las mismas condiciones y solo se registró el síntoma final (González-Pérez et al., 2009).
Crecimiento de Streptomyces spp. Cultivos de 22 cepas de Streptomyces se obtuvieron del banco de germoplasma de Actinomicetos conservado en la Subsede Sureste del CIATEJ, provenientes de suelos de Aguascalientes, Campeche, Hidalgo y Yucatán. Adicionalmente, en los ensayos se utilizó como cepa control a Streptomyces lydicus WYEC 108. Todas las cepas se crecieron en medio agar International Streptomyces Project 2 (ISP 2) a una temperatura de 29 °C durante 14 días. Para los experimentos de antagonismo se preparó un inóculo general (IG) que consistió de esporas de cada cepa a una concentración de 108 UFC mL-1 (Evangelista-Martínez, 2014).
Evaluación antagónica de estreptomicetos contra F. oxysporum. La actividad antagónica de las 22 cepas de Streptomyces se realizó mediante ensayos de confrontación dual en medio ISP2 (Evangelista-Martínez et al., 2020). Se inocularon 3 mL del IG en el borde de la caja Petri con el medio ISP 2 y al centro de la caja se depositó un disco de agar con micelio activo de un cultivo de F. oxysporum de 11 días de crecimiento en PDA. Los cultivos se mantuvieron a 29 °C durante 11 días y se midió el crecimiento del hongo en dirección del estreptomiceto mediante un vernier digital (Caldi-6MP Truper). El porcentaje de inhibición (PI) se calculó a partir de la fórmula:
en donde “FR” representa el radio de crecimiento (mm) del hongo en la caja control y “AR” es el radio de crecimiento del hongo en dirección al crecimiento de Streptomyces (Dikhoba et al., 2019).Obtención del extracto bioactivo (EB) de Streptomyces sp. El extracto bioactivo de los dos aislados con mayor actividad antagonica (Streptomyces sp. GCAL-9 y CACIS 1.6 CA), se obtuvo mediante una fermentación en fase sólida (FES) empleando espuma de poliuretano (Evangelista-Martínez et al., 2020). El soporte tenía una dimensión de 12 x 10 x 2.5 cm, al cual se le agregó 70 mL de caldo ISP2 inoculado con una suspensión de esporas de cada uno de los estreptomicetos, ajustando la turbidez a una DO450 de aproximadamente 1.0. La FES se realizó en recipientes de plástico estéril para cultivo in vitro de plantas. El caldo ISP2 se inoculó. Posteriormente, las cajas se cerraron e incubaron en condiciones de oscuridad a 29 °C por 21 días. El EB producido se separó de las células mediante filtraciones en serie, iniciando con papel filtro Whatman No 3., seguido de papel Whatman No. 1, filtro micropore de 0.65 µm hasta terminar con un filtro Micropore de 0.22 µm. El extracto se almacenó a 4 °C hasta su uso (Evangelista-Martínez et al., 2020).
MIC y MLC por el método de microdilución. La concentración mínima inhibitoria del extracto bioactivo se realizó empleando placas de 96 pozos en el medio caldo papa dextrosa (PDB) de acuerdo a la Clinical and Laboratory Standards Institute (CLSI, 2017). Las pruebas MICs se realizaron en microplacas estériles de 96 pozos conteniendo 100 µL de caldo PDB. Posteriormente, a cada pozo ubicado en la primera columna se le adicionaron las muestras a evaluar, finalizando con un volumen de 200 µL. Los pozos de la primera columna con las diferentes muestras, se homogenizaron y tomaron 100 µL de cada pozo y colocaron en los pozos de la segunda columna y así sucesivamente, de manera que la concentración en el primer pozo quedó a la mitad respecto a la concentración en la solución (two-fold dilutions). Una vez terminadas las diluciones, a cada pozo se le agregó 100 µL de conidios ajustados a 1 X 105 conidios mL-1, se mezclaron y mantuvieron en incubación a 29 °C. La inhibición del crecimiento del hongo se determinó a las 24, 48 y 72 h mediante adición de resazurina (Barua et al., 2017). La resazurina se empleó como indicador de crecimiento del hongo, cuando la solución fue de color azul se consideró inhibición del crecimiento, mientras que la coloración rosa indicó crecimiento o ausencia de inhibición. La MIC se definió como la menor concentración del EB que inhibió el crecimiento de F. oxysporum.
El valor de la concentración mínima letal (MLC) se determinó al subcultivar directamente de la placa usada para el cálculo de la MIC, 5 mL de la masa celular del hongo de cada pozo en microplaca con caldo PDB. Los cultivos se mantuvieron a 29 °C por tres días hasta observar crecimiento micelial. El crecimiento del hongo después de este periodo fue indicativo de control fungistático, mientras que la ausencia de crecimiento indicó actividad fungicida del EB. La MLC se definió como la menor concentración en la que no existió crecimiento del hongo. El EB de Streptomyces sp., GCAL-9 y CACIS 1.6 CA, se analizó por duplicado en dos experimentos independientes. Como control de crecimiento se empleó el producto carbendazim (Syngenta) preparado a una concentración de 72.8 mg mL-1.
Efecto del EB sobre la germinación de microconidios. La actividad inhibitoria del EB se evaluó mediante un ensayo de inhibición de la germinación de los conidios. El ensayo se realizó en portaobjetos con cavidad en 40 µL de volumen final que contenía 20 µL de caldo PDB mezclado con 10 µL de la suspensión de conidios de F. oxysporum (105 conidios mL-1) más 10 µL de la solución del EB a diferentes concentraciones. Las concentraciones evaluadas fueron a ¼, ½, 1, 4, 6 y 8 MIC’s (0.0475, 0.095, 0.19, 0.38, 1.14, 1.52 mg mL-1). Enseguida se colocó un cubreobjetos y se mantuvieron en una cámara húmeda a 29 °C en oscuridad. Como control se usó agua destilada estéril. El efecto sobre la germinación se determinó cada hora durante 8 horas de crecimiento, empleando un microscopio invertido (modelo Olympus), contabilizando 100 conidios al azar, separando los conidios germinados de los que aún no lo estaban (Evangelista-Martínez et al., 2020). El experimento se llevó a cabo por triplicado y la evaluación se basó en la presencia del tubo de germinación. Un conidio se consideró germinado, si el tubo de germinación alcanzó el doble del diámetro del conidio. Los resultados se expresaron como el porcentaje de conidios germinados (PG) comparado al control, con base a la siguiente formula (Zhang et al., 2020):
Actividad fungicida del EB. El potencial fungicida del EB sobre F. oxysporum se evaluó realizando ensayos de germinación de esporas a diferentes concentraciones y dando seguimiento a diferentes tiempos de contacto con los conidios. Los experimentos se realizaron por el método de microdilución previamente descrito. Las concentraciones del EB fueron 1, 2 y 3 MIC’s. Como control positivo se empleó Carbendazim a 72.8 mg mL-1. Después de realizar las mezclas del caldo PDB y el EB, se agregó 100 µL de la suspensión de conidios y homogenizó. Durante cada hora y hasta completar 4 h, de cada mezcla se tomaron 5 µL de la suspensión y depositó en cajas Petri con medio PDA y se incubó a 29 °C durante tres días. Se determinó el tiempo de contacto óptimo para ejercer el efecto fungicida, en aquellas muestras donde no se presentó crecimiento.
Efecto protector del EB en cormos de gladiolo. La evaluación del efecto del EB para el control de la pudrición en cormos de gladiolo, se realizó empleando 50 cormos de gladiolo de la variedad Red Beauty por cada tratamiento. El proceso de desinfección de los cormos y de la inoculación con la suspensión de conidios de F. oxysporum, se realizó como se describió previamente.
Los tratamientos evaluados fueron: a) cormos inoculados con F. oxysporum y tratados con agua; b) cormos inoculados con F. oxysporum y tratados con Carbendazim (72.8 mg mL-1); c) cormos inoculados con F. oxysporum y tratados con EB MIC (0.19 mg mL-1) y d) cormos inoculados con F. oxysporum y tratados con EB al doble de la MIC (0.38 mg mL-1). Posteriormente, los cormos de todos los tratamientos fueron almacenados en condiciones de oscuridad en una cámara bioclimática a 25 °C y 70% de humedad.
Los síntomas fueron registrados, cada cinco días a partir del tiempo cero hasta veinte días después de la inoculación, en cinco cormos por cada tratamiento. La variable dureza o firmeza de los cormos, fue el parámetro empleado para determinar el efecto protector del EB en los cormos inoculados, utilizando un Texturómetro digital Shimadzu® EZ-SX con una aguja de 5mm de diámetro en una mesa base estándar. La prueba de compresión se realizó a una velocidad de 3mm/s y una profundidad de 0.5mm. La dureza de los cormos se registró en Newtons (Morales-Pérez et al., 2014).
Análisis de datos. Los datos registrados para el PG fueron analizados estadísticamente mediante un ANOVA multifactorial y mediante una prueba de separación de medias por LSD. Los datos registrados para la dureza del cormo fueron analizados estadísticamente mediante una ANOVA simple y una prueba de separación de medias por Tukey, con ayuda del programa Statgraphics centurión XVIII.
Resultados y discusión
Aislamiento y caracterización del patógeno. A partir de cormos de gladiolo con síntomas de pudrición asociado a la presencia de Fusarium spp., se obtuvieron tres aislados (GL1, GL2 y GL3) con características morfológicas del género. A partir de los tres aislados de Fusarium, se generaron cepas monospóricas que se caracterizaron por desarrollar un micelio aéreo con tonalidades blanquecinas a naranjas, sin la presencia de hifas enrolladas. También se detectó la presencia de macroconidios fusiformes y ligeramente curvos con la célula apical cónica y la basal ovalada, entre uno y tres septos; los microconidios presentaron morfología ovalada y sin septos (Cuadro 1). Estas características coinciden con las reportadas para F. oxysporum (González-Pérez et al., 2009; Hafizi et al., 2013; Leslie et al., 2006).
Cuadro 1 Características macroscópicas y microscópicas registrados de la colonia mo nospórica de F. oxysporum GL1 aislada a partir de cormos de gladiolo con síntomas de pudrición.
| Características morfológicas | zDescripción |
|---|---|
| Color de la colonia | Tonalidades naranjas y blancas, micelio aéreo |
| Morfología del macroconidio | Fusiforme, ligeramente curvo |
| Morfología de la célula apical | Cónica y curva |
| Morfología de la célula de la base | Ovalada |
| Largo de macroconidios (µm) | 52.9 |
| Ancho de macroconidios (µm) | 7.4 |
| Número de septos | 3 |
| Morfología del microconidio | Ovalada |
| Largo de microconidio (µm) | 20.4 |
| Ancho de microconidios (µm) | 7.3 |
zLas mediciones y registros al microscopio se realizaron mediante la observación directa y medición de 50 macroconidios y 50 microconidios de la colonia monospórica del hongo a 40x.
Identificación molecular del hongo aislado de cormos con pudrición. El análisis de la secuencia de los fragmentos de ITS (584 pb) del aislado Fusarium oxysporum GL1 mostró, al comparar con secuencias registradas en el genbank, una similitud del 96% con secuencias ITS del género F. oxysporum. El mismo resultado se obtuvo al analizar las secuencias de los genes que codifican a la β-Tubulina (549 pb, 95% de similitud), histona 3 (458 pb, 94% de similitud) y factor de elongación-1α (300 pb, 98% de similitud). Considerando las características morfológicas y la estrecha similitud molecular con especies del género Fusarium, se sugiere que el aislado GL1 aislado de cormos con pudrición pertenece a F. oxysporum.
Prueba de patogenicidad del aislado de F. oxysporum. El aislado GL1 indujo la aparición de síntomas, por lo que la identificación molecular, así como los ensayos in vitro e in vivo descritos se realizaron utilizando esta cepa. Los cormos inoculados presentaron un síntoma inicial a los 15 días (Figura 1), que se caracterizó por una coloración café en el interior del cormo, así como una pérdida de turgencia; superficialmente el síntoma fue imperceptible (Figura 1C), pero cuando se realizó un corte perpendicular del cormo se observó el cambio de color a partir del sitio de inoculación (Figura 1D). Los cormos tres a cuatro meses después de la inoculación, se secaron adquiriendo una coloración café oscura (Figura 1E). Lo anterior concuerda con la sintomatología descrita para la pudrición de cormos de gladiolo debidas a Fusarium (González-Pérez et al., 2009; Michel-Aceves et al., 2014; Pedroza et al., 2019).
Actividad antagónica in vitro. La actividad antagónica de las 22 cepas de estreptomicetos contra el aislado de F. oxysporum GL1 se presentó en el Cuadro 2. En ella se observa, para los estreptomicetos de suelo del Estado de Hidalgo y del Estado de Aguascalientes un PI menor al 20%, mientras que para los estreptomicetos que provienen de suelos de los Petenes, en dos se observa un PI ligeramente superior al 30% y solo para Streptomyces sp. CACIS-1.16CA un PI mayor al 40%. Para el caso de Streptomyces sp., GCAL-9, se observó un PI de 40.4. Resultados similares se observaron con la cepa control S. lydicus WYEC 108 (PI= 41.1%). En general no se observaron diferencias en el PI de S. lydicus y los estreptomicetos CACIS-1.16CA y GCAL-9. Con base a estos resultados se seleccionaron estos aislados para evaluar el EB correspondiente. Los PI obtenidos con Streptomyces sp. CACIS-1.16 CA y Streptomyces sp. GCAL-9 son cercanos a los resultados reportados para otros actinomicetos sobre F. oxysporum (PI de 58.1%), lo que confirma la capacidad de algunas especies del género Streptomyces para inhibir a F. oxysporum (Goredema et al., 2020; Nguyen et al., 2020; Tlemsani et al., 2020). Resultados previos con Streptomyces sp. CACIS 1.16CA mostraron actividad antagonista contra otras especies de Fusarium, fluctuando entre 40 al 70% la inhibición en el crecimiento del hongo (Evangelista- Martinez, 2014).
Cuadro 2 Actividad antagonista de 22 Estreptomicetos sobre Fusarium oxysporum, determinada mediante el porcentaje de inhibición del crecimiento del hongo en dirección del actinomiceto en ensayos de antagonismo dual.
| Cepa | PI (%) | Cepa | PI (%) |
|---|---|---|---|
| Suelos del Parque Nacional El Chico, Hidalgo | |||
| CACIA 1.3 HGO | 17.1 | CACIA 1.5 | 10.1 |
| CACIA 1.33 HGO | 14.1 | CACIA 1.7 | 14.1 |
| Suelos de la Reserva de la Biósfera Los Petenes, Campeche | |||
| CACIS 1.16 CA | 43.4 | CACIS 2.30 CA | 19.1 |
| CACIS 2.16 CA | 30.3 | CACIS 2.3 CA | 24.2 |
| CACIS 2.17 CA | 32.3 | CACIS 2.5 CA | 19.1 |
| CACIS 2.26 CA | 20.2 | ||
| Suelos de campo de cultivo de chile serrano, Aguascalientes | |||
| AGS 4 | 28.2 | AGS 13 | 32.3 |
| AGS 6 | 24.2 | AGS 32 | 15.1 |
| AGS 9 | 25.2 | AGS 44 | 26.2 |
| AGS 10 | 35.10 | AGS 50 | 29.2 |
| AGS12 | 23.2 | AGS 58 | 31.7 |
| Suelos de Yucatán | |||
| GCAL 9 | 40 | Streptomyces lydicus wyec 108z | 41.1 |
zCepa comercial utilizada como referencia.
Determinación de la MIC y MLC del EB contra F. oxysporum . El extracto bioactivo (EB) de Streptomyces sp. GCAL-9, producido mediante una fermentación sólida, tal como se describió en materiales y métodos, se utilizó para obtener la concentración mínima inhibitoria (MIC) y mínima letal (MLC) sobre F. oxysporum. Se obtuvo una MIC de 0.19 mg mL-1, mientras que la MLC fue del 0.38 mg mL-1. La MIC obtenida en el trabajo es similar a los reportados para otras cepas de Streptomyces, consideradas con efecto antimicrobiano sobresaliente sobre diferentes especies de bacterias y hongos, incluyendo F. oxysporum (Hima-Bindu et al., 2017; Pérez-Rojas et al., 2015).
Efecto del EB sobre la germinación de conidios de F. oxysporum. El extracto bioactivo del aislado CACIS 1.16 CA, no inhibió la germinación de los conidios de Fusarium sp. GL1, sugiriendo que el antagonismo que presentó en los ensayos de antagonismo dual (Cuadro 2), se debe posiblemente a competencia directa y no necesariamente debido a la producción de compuestos extracelulares con actividad antagónica (Alizadeh et al., 2020). Considerando lo anterior, los ensayos subsecuentes se realizaron únicamente con el EB de la cepa de Streptomyces sp. GCAL-9.
Los resultados de la evaluación del efecto de cinco concentraciones del EB de la cepa Streptomyces sp. GCAL-9 sobre la germinación de conidios de F. oxysporum, muestran diferencias significativas (p≤0.05) en el porcentaje de inhibición de la germinación a partir de la aplicación de ½ MIC, con un valor de alrededor del 90 % respecto al control. Concentraciones mayores del EB inhibieron completamente la germinación (Figura 2A). A nivel morfológico, se observaron cambios estructurales en los conidios con el EB a ½, 1 y 2 MIC´s en comparación con los conidios en fase de germinación (Figura 2B). Se observa una evidente disrupción de la fase de transición hacia la formación del tubo de germinación y a medida que se incrementa la concentración del EB, se presenta una reducción en el tamaño de los conidios, un cambio de la forma alargada de los macroconidios a redondeada e hinchada, formación excesiva de vacuolas en el citoplasma, dejan de ser evidentes los septos, y formación excesiva de vacuolas. Estas características se han observado en otros trabajos (Cordova-Albores et al., 2016), en particular en la evaluación del aceite de Jatropha curcas y algunos aceites derivados sobre la germinación en conidios de F. oxysporum f. sp. gladioli; los autores reportaron algunos efectos morfológicos en los conidios como bordes irregulares, hinchados, poca o nula presencia de organelos, y en los conidios germinados se presentó poco crecimiento de hifas y aparición de un número elevado de vacuolas en el citoplasma.
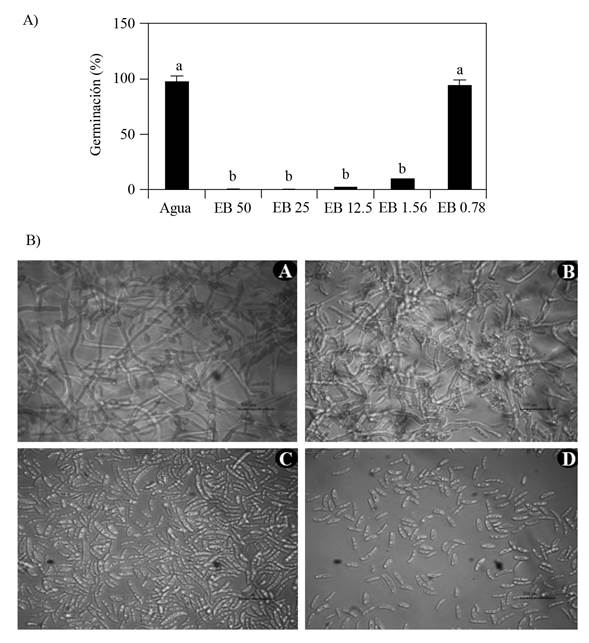
Figura 2 Efecto del extracto bioactivo (EB) sobre la germinación de conidios de F. oxysporum. 2A) Porcentaje de germi nación de conidios después de 8 h de tratamiento con cinco concentraciones de EB de Streptomyces sp., GCAL-9. Columnas con la misma letra no son significativamente diferentes según la prueba de LSD (p≤0.05); 2B) La ger minación de los conidios de F. oxysporum en agua como control A), fue similar a la que ocurrió al 0.78% B) del EB, mientras que concentraciones como 25% C) y 12.5% D) inhibieron el 100% la germinación de los conidios del hongo.
Otros autores reportaron que, compuestos extracelulares de Streptomyces blastmyceticus afectan la germinación de conidios de Colletotrichum acutatum y F. oxysporum, destacando efectos sobre la permeabilidad de la membrana de los conidios, además de cambios en su morfología con una reducción de su tamaño y presencia de una superficie arrugada en los conidios e hifas, en comparación a la superficie lisa de los conidios no expuestos a los compuestos (Kim et al., 2019).
El tiempo óptimo del efecto fungicida del EB se determinó evaluando durante tres días la capacidad de germinación de los conidios y crecimiento del micelio de F. oxysporum después de estar expuesto a diferentes concentraciones (1, 2 y 3 MIC´s) y tiempos (0, 1, 2, 3 y 4 h) de exposición al EB (Figura 3). Los resultados muestran que la concentración de 1 MIC (0.19 mg mL-1), 2 MIC (0.38 mg mL-1) y 3 MIC (0.57 mg mL-1) inhibieron la germinación y crecimiento de micelio del hongo con una hora de contacto con el EB de GCAL-9, este efecto se observó durante los tres días en los que se mantuvieron los subcultivos en condiciones de 29 °C. Mientras que el Carbendazim a la dosis evaluada (72.8 mg mL-1), permitió la reactivación del conidio y, por tanto, el crecimiento del micelio al ser transferidos a medio PDA (Figura 3). Estos resultados confirman el potencial antimicrobiano de los compuestos extracelulares liberados por la cepa de Streptomyces sp. GCAL-9. Por otra parte, difieren del reporte de Alburqueque y Gusqui (2018), quienes mencionan que Carbendazim fue 100% efectivo para inhibir el desarrollo de F. oxysporum a las 72 h después del tratamiento bajo condiciones in vitro.
Figura 3 Tiempo óptimo del efecto fungicida del EB de Streptomyces sp., GCAL-9. Crecimiento micelial en caja Petri con medio PDA después de tres días de subcultivo de la solución de conidios de F. oxysporum proveniente de la micro dilución en placa con el EB a 1, 2 y 3 MICs F y G), después de 0 A), 1 B), 2 C), 3 D) y 4 E) horas de tratamiento con el EB.
Control de la pudrición en cormos con el EB. Los cormos inoculados con F. oxysporum y protegidos con diferentes concentraciones de extracto bioactivo, no mostraron diferencias en síntomas externos con relación a cormos protegidos con Carbendazim, los primeros 20 días después de la inoculación. Por otro lado, cormos inoculados y sin ninguna protección, presentaron ligeros síntomas externos, tales como pequeñas manchas café oscuras en los sitios inoculados, con presencia de micelio blanco cremoso, estos síntomas son similares a los reportados para la pudrición del cormo por Fusarium sp. (Pedroza et al., 2019; González-Pérez et al., 2009). Cortes de los cormos inoculados mostraron que la mancha café obscuro avanzó y extendió en el interior del cormo (Figura 1). Lo anterior sugiere que existen diferencias entre tratamientos después de 15 días, pero su estimación requiere de métodos alternativos al registro sintomatológico utilizado (González-Pérez et al., 2009).
La dureza medida con el texturómetro digital Shimadzu, mostró que los cormos inoculados con F. oxysporum y protegidos con el extracto bioactivo de Streptomyces sp. G-CAL9 a 0.19 y 0.38 mg mL-1, fueron inicialmente similares con la dureza de los cormos control en los primeros 10 días después del tratamiento. Sin embargo, la firmeza de los cormos tratados con EB 15 (2MIC) y 20 días (1 MIC) después del tratamiento fue mayor con relación a los controles tratados con agua y fungicida comercial (p≤0.05) (Figura 4), sugiriendo que el EB protegió el deterioro de los cormos debidos al desarrollo del patógeno inoculado (González-Pérez et al., 2009). Las diferencias observadas respecto a la efectividad en el tiempo de las dos concentraciones del EB probablemente se deban a factores tales como diferencias en la absorción, permanencia y translocación del EB, influenciada además por diferencias superficiales en los cormos utilizados, según lo describe Mirabent (2012) como los principales factores que influyen en la eficacia de los fungicidas. Tomando en cuenta lo anterior, evaluaciones futuras deberán considerar el uso de coadyuvantes que mejoren la absorción, adherencia, movilidad y por ende la eficacia del EB.
Por otro lado, los cormos tratados con el fungicida comercial a base de Carbendazim presentaron una dureza similar a la que presentaron los cormos del tratamiento control, sugiriendo que el fungicida comercial a la dosis aplicada en este trabajo, no impidió el desarrollo del hongo en los cormos inoculados, ya que el Carbendazim tiene un efecto sobre la germinación de conidios de los hongos al inhibir el ensamblaje de la Beta-tubulina en la mitosis e inhibir la formación del apresorio, el crecimiento y desarrollo del micelio de los hongos (FRAC, 2019) tal como se corroboró en los ensayos de inhibición en microplaca.
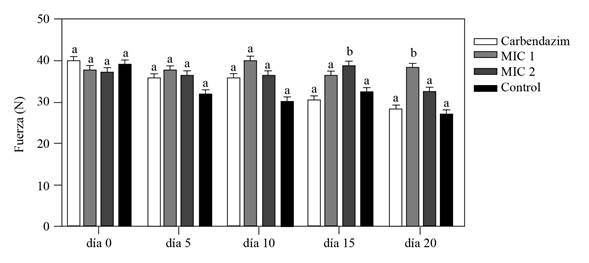
Figura 4 Firmeza de cormos de gladiolo inoculados experimentalmente con una solución de 5 μL de conidios de F. oxyspo rum a 2 x 106 conidios mL-1 y protegidos con EB de Streptomyces sp., GCAL-9 con uno (0.19 mg mL-1) y dos (0.38 mg mL-1) veces la concentración MIC; registrados a los 0, 5,10, 15 y 20 días después de la inoculación con un texturómetro digital Shimadzu. Los controles del ensayo fueron, cormos inoculados con el hongo y protegidos con carbendazim a 72.8 mg mL-1 y agua. Columnas con la misma letra no son significativamente diferentes según la prueba de Tukey (p≤0.05).
Conclusiones
El estudio demostró el potencial antifúngico del extracto bioactivo obtenido por fermentación en fase solida de la cepa de Streptomyces sp. GCAL-9, al inhibir la germinación total de conidios y el crecimiento micelial de F. oxysporum a una dosis de 0.19 y 0.38 mg mL-1, y por su efecto protector, al mantener durante 15 y 20 días la firmeza de cormos de gladiolo inoculados con conidios del hongo, bajo condiciones controladas in vivo.











 text in
text in