Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista mexicana de fitopatología
On-line version ISSN 2007-8080Print version ISSN 0185-3309
Rev. mex. fitopatol vol.25 n.2 Texcoco 2007
Artículos científicos
Incidencia de Hongos Potencialmente Toxígenos en Maíz (Zea mays L.) Almacenado y Cultivado en el Norte de Tamaulipas, México
Incidence of potencially toxigenic fungi in maize (Zea mays L.) in storage and cultivated in northern Tamaulipas, Mexico
Sanjuana Hernández-Delgado1, Miguel Ángel Reyes-López1, Jesús Gerardo García-Olivares1, Netzahualcoyotl Mayek-Pérez1 y César Augusto Reyes-Méndez2
1 Instituto Politécnico Nacional, Centro de Biotecnología Genómica, Blvd. del Maestro s/n esq. Elias Piña, Col. Narciso Mendoza, Reynosa, Tamaulipas, México CP 88710. Correspondencia: nmayek@ipn.mx.
2 INIFAP, Campo Experimental Río Bravo, Apdo. Postal 172, km 62 Carr. Matamoros-Reynosa, Río Bravo, Tamaulipas, México CP 88900.
Recibido: Enero 12, 2007
Aceptado: Abril 25, 2007
Resumen
Cincuenta y cuatro muestras de maíz amarillo y 43 con grano blanco se colectaron en 2005 en seis almacenes de Díaz Ordaz, Reynosa y Río Bravo, Tamaulipas, México. Para determinar la incidencia de hongos en las muestras, se sembraron diez granos en papa-dextrosa-agar por siete días y se registró el número de granos invadidos. En Río Bravo se cultivaron 14 híbridos de maíz amarillo y 11 blancos durante 2005. A la cosecha se tomaron muestras de grano de cada híbrido y se procesaron como se indicó anteriormente. En almacén, en maíz amarillo se observó 50.3% de incidencia de Aspergillus, 5.5 de Fusarium y 15.9 de Penicillium; mientras que en maíz blanco fue 44.6, 6 y 10.4%, respectivamente. En campo, los maíces amarillos mostraron mayor presencia de Aspergillus (3.1%), Fusarium (76.9%) y Penicillium (11.6%) que los maíces blancos (2.4, 63.6 y 7.9%, respectivamente) Los maíces amarillos (DK697, DK1060; Garst 8222, 8285, 8288; Golden Acres 8112, 8311, 8460) mostraron mayor incidencia de hongos que los maíces blancos (Tigre; H-437, 436; Asgrow 7573W). En maíz blanco y amarillo almacenado en el norte de Tamaulipas el género Aspergillus presentó la mayor incidencia, mientras que Fusarium fue el más frecuente en campo.
Palabras clave: Hongos del grano, Aspergillus spp., Fusarium spp., Penicillium spp.
Abstract
Fifty four samples of yellow maize grain and 43 of white grain were collected in six silos from Diaz Ordaz, Reynosa, and Rio Bravo, Tamaulipas, Mexico, in 2005. To determine the incidence of fungi in the samples, ten grains were cultivated in potato-dextrose-agar medium during seven days and the number of invaded grains were recorded. In Rio Bravo, 14 hybrids with yellow grain and 11 with white grain were cultivated during 2005. Grain samples from each hybrid were collected during harvest and processed as already described. In samples from silos, incidence of Aspergillus was 50.3% on yellow maize, Fusarium 5.5%, and Penicillium 15.9%, while on white maize it was 44.6, 6, and 10.4%, respectively. Under field conditions, yellow maize hybrids showed greater incidence of Aspergillus (3.1%), Fusarium (76.9%), and Penicillium (11.6%) than white maize hybrids (2.4, 63.6, and 7.9%, respectively). Yellow maize hybrids (DK-697, DK-1060; Garst 8222, 8285, 8288; Golden Acres 8112, 8311, 8460) showed greater fungal incidence than white maize hybrids (Tigre; H-437, H-436; Asgrow 7573W). The genus Aspergillus showed the greatest incidence on yellow and white maize grain in silos in northern Tamaulipas, while Fusarium was the most frequently found in the field.
Keywords: Grain fungi, Aspergillus spp., Fusarium spp., Penicillium spp.
El cultivo del maíz (Zea mays L.) es importante para México, debido a que junto con el frijol (Phaseolus vulgaris L.) constituye la base alimenticia de millones de mexicanos. En el 2004 se sembraron aproximadamente 8.4 millones de ha con maíz, con una producción de grano de alrededor de 21.7 millones de ton y un rendimiento promedio de 2.6 ton ha-1. En el estado de Tamaulipas, el cultivo ocupó poco más de 220 mil ha con una producción de alrededor de 710 mil ton y rendimiento promedio de 3.2 ton ha-1 (SIAP, 2006). De acuerdo con el INEGI (2005) se consumen anualmente poco más de 20 millones de ton de maíz y dadas las variaciones en los volúmenes de producción del grano, en ocasiones se importa de otros países, principalmente de los Estados Unidos de América. En México sólo se cuenta con la norma NOM-188-SSA1-2002 (Diario Oficial de la Federación, 2002) para la regulación del contenido de aflatoxinas totales en cereales de origen nacional o importado para el consumo humano y animal. Esta norma incluye al arroz (Oryza sativa L.), la cebada (Hordeum vulgare L.), la avena (Avena sativa L.), el centeno (Secale cereale L.), el maíz, el sorgo [Sorghum bicolor (L.) Moench.] y el trigo (Triticum aestivum L.). Sin embargo, en dicha norma no se considera que las aflatoxinas presentan diferente toxicidad, y además, que los cereales pueden estar contaminados por otras micotoxinas. De lo anterior se infiere que en México, los cereales están sujetos a un control parcial en cuanto al límite en el contenido de micotoxinas, y se desconoce el grado de exposición de los consumidores de maíz a las aflatoxinas (Martínez-Flores y García-Aguirre, 2003). A pesar de que el potencial productivo del maíz es mayor al consignado en las estadísticas de producción de México, una serie de factores adversos de naturaleza biótica (enfermedades, plagas, malezas) y abiótica (sequía, salinidad, altas temperaturas) afectan constantemente dicha producción. En el caso de Tamaulipas, la mayor proporción de la superficie cultivada con maíz se concentra en la región norte, donde también se cultiva sorgo. Dicha región se caracteriza por presentar cultivos de temporal, períodos de sequía y altas temperaturas intermitentes. Aunado a lo anterior, se registra comúnmente la incidencia de hongos fitopatógenos que principalmente invaden al grano. En el caso del maíz destacan los géneros Aspergillus, Fusarium y Penicillium, mismos que ocasionan efectos nocivos en el cultivo y en los consumidores del grano (Rodríguez-del Bosque et al., 1995; Rodríguez-del Bosque, 1996). Los tres géneros presentan especies productoras de micotoxinas: en Aspergillus son comunes las aflatoxinas, principalmente las B1, M1 y G1 (A. flavus Link:Fr.); en Fusarium son importantes las fumonisinas, zearalenona y los tricotecenos, entre otras; mientras que en Penicillium destacan la síntesis de la patulina, la citrina y la ocratoxina A. Los efectos en el corto y largo plazo después del consumo de micotoxinas se traducen en desórdenes fisiológicos, citotóxicos e inmunosupresivos; así como por sus efectos teratogénicos, mutágenos y cancerígenos (Albright, 2001; Fandohan et al., 2003; Munkvold, 2003; Peraica y Dominan, 2001). Este trabajo surge de la necesidad de incrementar el conocimiento sobre la biología de los hongos toxígenos en maíz en Tamaulipas, México y de apoyar en el diseño de estrategias de manejo integrado que tiendan a minimizar sus daños directos al cultivo y a los consumidores, entre las que destaca la identificación y aprovechamiento de nuevas fuentes de resistencia a la infección por hongos potencialmente toxígenos. Por ello, los objetivos del presente trabajo fueron: 1) Determinar la incidencia de hongos potencialmente toxígenos en grano de maíz cosechado directamente en campo y almacenado en diferentes lugares del norte de Tamaulipas, México; y 2) determinar la relación entre la incidencia de los hongos potencialmente toxígenos y las condiciones de cultivo (ambiente, germoplasma de maíz) o de almacenamiento (ambiente, tipo de grano).
MATERIALES Y MÉTODOS
Incidencia de hongos toxígenos en grano de maíz almacenado.
Se realizaron colectas de grano de maíz de junio a septiembre de 2005 en bodegas ubicadas en los municipios de Díaz Ordaz (dos), Reynosa (dos) y Río Bravo (dos), Tamaulipas, México. En total, se tomaron 97 muestras (54 de maíz amarillo y 43 con grano blanco) mismas que consistieron en 500 a 1500 g cada una. Diez granos de cada muestra se desinfectaron con hipoclorito de sodio 2% por 3 min, se enjuagaron en agua destilada estéril y se secaron con papel estéril. Posteriormente, se colocaron en cajas Petri con medio de cultivo papa-dextrosa-agar a 30°C durante siete días en oscuridad. A los tres días en incubación se registró el número de colonias y granos invadidos por hongos de los géneros Fusarium, Aspergillus y Penicillium. A los siete días, se tomaron muestras de las colonias observadas a fin de confirmar la identidad de cada género presente mediante la observación de sus características macro y micromorfológicas y la ayuda de literatura especializada: Fusarium (Booth, 1971; Chelkowski, 1989; Nelson et al., 1983; 1994); Aspergillus (Klich y Pitt, 1988; Raper y Fennell, 1965); Penicillium (Pitt, 1979). El ensayo se repitió dos veces. La relación de bodegas muestreadas y el número de muestras obtenidas se detalla en el Cuadro 1.
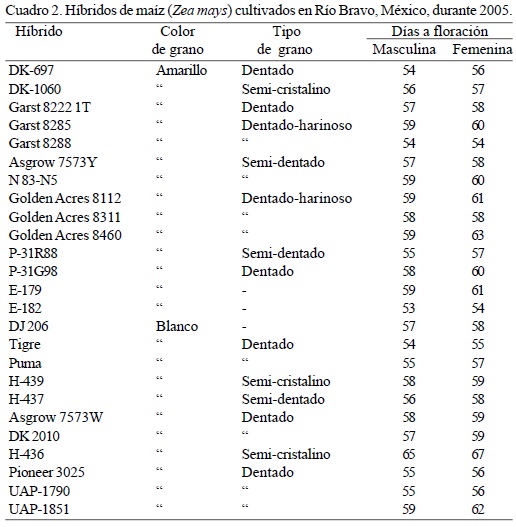
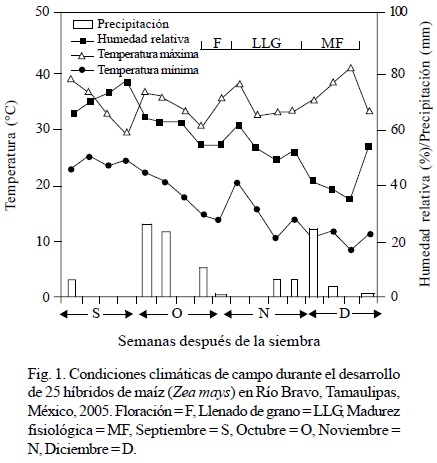
Incidencia de hongos toxígenos en maíz cultivado en el campo. Se cultivaron 25 híbridos (14 con grano amarillo y 11 con grano blanco) de maíz de diferentes casas comerciales de origen nacional e importado de EUA (Cuadro 2) en un diseño experimental de bloques completos al azar con cuatro repeticiones en Río Bravo, Tamaulipas, a partir del 30 de agosto de 2005 (ciclo otoño-invierno de 2005-2006). La cosecha se realizó el 23 de enero de 2006 formando una muestra compuesta de 200 g del grano de cada unidad experimental. La semilla se procesó en el laboratorio de modo similar a lo indicado en la primera fase del trabajo. Adicionalmente, se registraron algunas variables del crecimiento (altura de la planta y de la mazorca, aspecto de la planta) y fenológicas (días a floración femenina y masculina), así como las condiciones climáticas durante el desarrollo del experimento (temperaturas máximas y mínimas, precipitación pluvial y humedad relativa) (Fig. 1).
Análisis estadístico. Con los datos de incidencia de hongos toxígenos en grano almacenado se calcularon los porcentajes de invasión de acuerdo con el origen del material (bodega) y el tipo de grano (blanco o amarillo). En el caso de los datos de campo, los porcentajes de invasión por cada género se normalizaron con la transformación arcoseno raíz del porcentaje, y posteriormente se sometieron al análisis de varianza donde las fuentes de variación fueron el híbrido de maíz y las repeticiones. En los casos en que dicho análisis detectó diferencias significativas, la comparación de medias se llevó a cabo mediante la prueba de Tukey (P = 0.05).
Finalmente, se realizó un análisis de correlación simple de Pearson entre los porcentajes de infección por hongos en la semilla en el germoplasma sembrado en campo y algunas características fenológicas y del crecimiento (Martínez-Garza, 1988). El análisis estadístico se realizó con el programa SAS versión 6.12 para Windows (SAS Institute, Cary, NC, EUA).
RESULTADOS
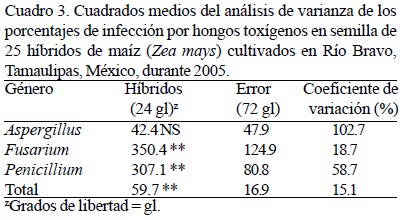
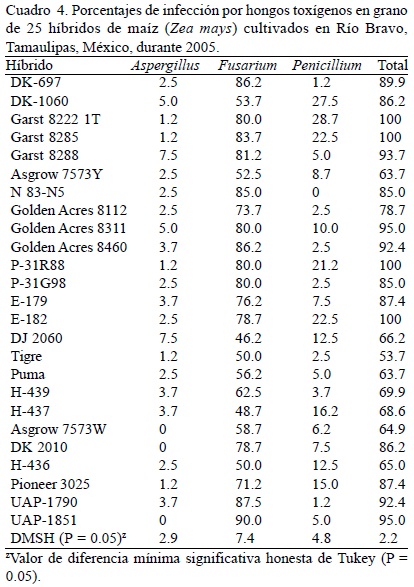
En el grano almacenado se observó que el maíz amarillo exhibió 50.3% (datos ponderados por el número de muestras en cada sitio) de incidencia de Aspergillus, 5.5% de Fusarium y 15.9% de Penicillium (71.7% en total), mientras que en maíz blanco, la incidencia fue de 44.6, 6 y 10.4%, respectivamente (61% en total) (Cuadro 1). El análisis de varianza de los porcentajes de invasión para cada género de hongo y del porcentaje total de infección de los tres géneros detectó diferencias significativas entre híbridos para los casos de invasión de Fusarium, Penicillium y total de los tres géneros (Cuadro 3). En campo, los maíces amarillos mostraron mayor incidencia de Aspergillus (3.1%), Fusarium (76.9%) y Penicillium (11.6%) que los maíces blancos (2.4, 63.6 y 7.9%, respectivamente). Los maíces amarillos DK-697 y DK-1060, Garst 8222, 8285 y 8288 y Golden Acres 8112, 8311 y 8460 mostraron mayor incidencia de los tres géneros de hongos toxígenos; mientras que los maíces blancos Tigre, H-437, H-436 y Asgrow 7573W presentaron la menor incidencia. Los híbridos de grano blanco UAP-1851, DK-2010 y Asgrow 7573W no presentaron incidencia de Aspergillus. De los hongos potencialmente toxígenos detectados en maíz blanco y amarillo almacenado en el norte de Tamaulipas, México, Aspergillus fue el más frecuente (incidencia mayor a 40%), mientras que en campo la mayor incidencia la presentó el género Fusarium (más de 60%) (Cuadro 4). En el análisis de correlación no se encontró relación positiva significativa entre los valores de incidencia de hongos y las características del crecimiento y/o fenológicas registradas en campo, aunque se observó relación negativa no significativa (P = 0.05) entre el ciclo biológico (días a floración masculina y femenina) con la incidencia de hongos potencialmente toxígenos de los tres géneros (datos no incluidos).
DISCUSIÓN
En este trabajo se observó mayor incidencia de hongos toxígenos en maíz blanco almacenado, mientras que en campo se observó un comportamiento inverso. En almacén, la incidencia de Aspergillus fue mayor, mientras que en campo fue significativamente baja. El manejo inadecuado del grano durante la cosecha, transporte y almacenaje generalmente ocasiona el incremento de grano enmohecido. Una cosecha inoportuna y el uso de cosechadoras mal calibradas que generan daño mecánico al grano, así como una deficiente desecación del mismo antes del almacenamiento, promueven el incremento de Aspergillus y Penicillium en el grano de maíz (Munkvold, 2003). El manejo inadecuado de las temperaturas en el almacén también es un factor que promueve el desarrollo de hongos potencialmente toxígenos. Munkvold (2003) encontró que las temperaturas óptimas para almacenar granos no deben exceder preferentemente los 20°C. En los almacenes donde se tomaron muestras de grano de maíz en este trabajo y de acuerdo con lo reportado por los encargados de los mismos, las temperaturas medias oscilan entre 24 y 28°C diariamente, favorables para el desarrollo de hongos potencialmente toxígenos. A pesar de que la alta incidencia de hongos toxígenos no necesariamente está relacionada con la alta producción de micotoxinas, es notable el hecho de que el efecto potencial de éstas últimas es acumulativo en los sistemas biológicos expuestos o consumidores del grano contaminado. Por ello, las instituciones involucradas en la sanidad de los alimentos deben implementar las medidas necesarias para promover la inocuidad del grano de maíz producido en el norte de Tamaulipas, México. Martínez-Flores y García-Aguirre (2003) y Robinson-Fuentes et al. (2005) indicaron que es importante realizar muestreos periódicos para determinar la calidad sanitaria del grano de maíz en los almacenes e inclusive en el mismo campo de cultivo y en el grano recién cosechado, de modo que paulatinamente se reduzca el riesgo sanitario que representa el consumo de maíz contaminado, principalmente en el caso de estratos poblacionales económicamente menos favorecidos donde el consumo de maíz es de importancia básica. Mientras que en grano almacenado el género predominante fue Aspergillus en maíz cultivado en campo en Río Bravo, la incidencia de Fusarium fue significativamente mayor. La incidencia de Fusarium observada en campo en este trabajo (76%) fue mayor al reportado por Kedera et al. (1999) en maíz cultivado en Kenia (47%), Bucio-Villalobos et al. (2001) en Guanajuato, México (35%) y Bucio-Villalobos et al (2005) (31%) también en diversas localidades de Guanajuato, México, aunque menor a lo encontrado en maíz cultivado en Nepal (Desjardins et al., 2000), donde se reportó una incidencia mayor a 95%. De manera similar, los porcentajes de infección causadas por especies de Aspergillus potencialmente toxígenas en grano almacenado son similares a los reportados por Martínez-Flores y García-Aguirre (2003), quienes realizaron un estudio también en el norte de Tamaulipas, México, donde destacó dicho género por su alta incidencia y la presencia de aflatoxinas en el maíz amarillo importado principalmente de EUA. En tres localidades de Brasil se observaron resultados parecidos a los aquí encontrados en cuanto a hongos toxígenos en tres híbridos de maíz en condiciones de campo: 77% de Fusarium, 15% de Aspergillus y 47% de Penicillium (Almeida et al., 2000). La relación inversa encontrada entre las incidencias de Aspergillus y Fusarium en grano de campo y grano almacenado observa estrecha relación con las condiciones ambientales favorables para el desarrollo de ambos géneros en este estudio. Shelby et al. (1994) sugirieron que el clima seco justo antes del inicio del período de polinización es un factor importante para promover la mayor incidencia de Fusarium y la consiguiente producción de sus toxinas. Por su parte, Widstrom et al. (1990) y Shephard et al. (1996) indicaron que la mayor incidencia de Fusarium y la producción de toxinas se relacionan con climas secos y calientes. En campo, el período de floración del germoplasma del maíz evaluado en Río Bravo coincidió con un período de alrededor de 15 a 20 días con prácticamente nula precipitación pluvial, humedad relativa mayor al 60% y temperaturas medias máximas superiores a 28°C (Fig. 1). Aunque estas condiciones climáticas también son apropiadas para la infección exitosa del grano de maíz en campo por Aspergillus (Bucio-Villalobos et al., 2001; Payne, 1987; Sauer, 1987), posiblemente la infección del género fue menor debido a la baja presencia de inóculo en la localidad de prueba en comparación con las mostradas por Fusarium (Bucio-Villalobos et al., 2001). En campo se detectaron algunos híbridos con grano blanco que presentaron baja incidencia de hongos toxígenos (Tigre, H-437, H-436 y Asgrow 7573W) e incluso se observaron algunos híbridos que no mostraron infección por Aspergillus (UAP-1851, DK-2010 y Asgrow 7573) (Cuadro 4). Bucio-Villalobos et al. (2001) y Munkvold (2003) señalaron que es difícil alcanzar la resistencia a hongos toxígenos debido a la ausencia de genes mayores, principalmente. No obstante lo anterior, se han detectado algunas fuentes de resistencia a A. flavus tales como Tex6, GT-MAS:gk, Oh516, LB31 y MI82 (Campbell y White, 1995; Hamblin y White, 2000; Walker y White, 2001). La incorporación de la resistencia a Aspergillus y Fusarium a germoplasma comercial susceptible se dificulta por problemas de adaptación y porque la resistencia es poligénica (King y Scott, 1981; Headrick y Pataky, 1991; Holley et al., 1989; Munkvold, 2003), por lo que los híbridos de maíz destacados en este trabajo deberán evaluarse en campo y condiciones controladas para ratificar la resistencia a la infección por hongos toxígenos. Posteriormente, otros estudios serán necesarios para el aprovechamiento de la resistencia.
CONCLUSIONES
El género Aspergillus fue el más frecuente (más de 40%) en grano de maíz blanco y amarillo almacenado en el norte de Tamaulipas, México, mientras que en campo la mayor incidencia la presentó Fusarium (más de 60%). Los híbridos de maíz amarillo DK-697, DK-1060, Garst 8222, Garst 8285, Garst 8288 y Golden Acres 8112, 8311 y 8460 mostraron la mayor incidencia de hongos potencialmente toxígenos en general; mientras que los maíces blancos Tigre, H-437, H-436 y Asgrow 7573W presentaron la menor incidencia. Los híbridos de grano blanco UAP-1851, DK-2010 y Asgrow 7573W no presentaron incidencia de Aspergillus; dicho germoplasma deberá evaluarse para ratificar su posible tolerancia a la infección de hongos en la mazorca.
AGRADECIMIENTOS
El presente trabajo fue financiado por el Instituto Politécnico Nacional (proyecto CGPI 20050254). C. A. Reyes-Méndez, M.A. Reyes-López y N. Mayek-Pérez son becarios del Sistema Nacional de Investigadores. N. Mayek-Pérez es becario COFAA y EDI del Instituto Politécnico Nacional. Los costos de publicación fueron cubiertos por el Fondo Mixto-Gobierno del Estado de Tamaulipas, México. Los trabajos de campo fueron financiados por la Fundación Produce Tamaulipas, A.C. y el INIFAP (proyecto No. 2052372A).
LITERATURA CITADA
Albright, D.M. 2001. Human health effects of airborne mycotoxin exposure in fungi-contaminated indoor environments. Professional Safety 46:26-28. [ Links ]
Almeida, A.P., Correa, B., Mallozzi, M.A.B., Sawazaki, E., and Valente-Soares, L.M. 2000. Mycoflora and aflatoxin/ fumonisin production by fungal isolates from freshly harvested corn hybrids. Brazilian Journal of Microbiology 31:321-326. [ Links ]
Booth, C. 1971. The genus Fusarium. Commonwealth Mycology Institute. Kew, Surrey, United Kingdom. 237 p. [ Links ]
Bucio-Villalobos, C.M., Guzmán-De Peña, D. y Peña-Cabriales, J.J. 2001. Aflatoxin synthesis in corn fields in Guanajuato, Mexico. Revista Iberoamericana de Micología 18:83-87. [ Links ]
Bucio-Villalobos, C.M., Martínez-Jaime, O.A. y Morales-González, R.H. 2005. Contaminación con hongos en maíz recién cosechado en el estado de Guanajuato durante el año 2003. pp. 425-431. Memorias del VII Congreso Nacional de Ciencia de los Alimentos y II Foro de Ciencia y Tecnología de Alimentos. Guanajuato, Guanajuato, México. 484 p. [ Links ]
Campbell, K.W., and White, D.G. 1995. Inheritance of resistance to Aspergillus ear rot and aflatoxin in corn genotypes. Phytopathology 85:886-896. [ Links ]
Chelkowski, J. 1989. Fusarium: Mycotoxins, Taxonomy and Pathogenicity. Elsevier. Amsterdam, The Netherlands. 492 p. [ Links ]
Desjardins, A.E., Manandhar, G., Plattner, R.D., Maragos, C.M., Shresta, K., and McCormick, S.P. 2000. Ocurrence of Fusarium species and mycotoxins in Nepalese maize and wheat and the effect of traditional processing methods on mycotoxin levels. Journal of Agriculture and Food Chemistry 48:1377-1483. [ Links ]
Diario Oficial de la Federación. 2002. Productos y Servicios. Control de Aflatoxinas en Cereales para Consumo Humano y Animal. Especificaciones Sanitarias. Norma Oficial Mexicana (NOM-188-SSA1-2002). México. 23 p. [ Links ]
Fandohan, P., Hell, K., Marasas, W.F.O., and Wingfield, M.J. 2003. Infection of maize by Fusarium species and contamination with fumonisin in Africa. African Journal of Biotechnology 2:570-579. [ Links ]
Hamblin, A.M., and White, D.G. 2000. Inheritance for resistance to field aflatoxin accumulation in maize grain. Plant Breeding 109:292-303. [ Links ]
Headrick, J.M., and Pataky, J.K. 1991. Maternal influence on the resistance of sweet corn lines to kernel infection by Fusarium moniliforme. Phytopathology 81:268-274. [ Links ]
Holley, R.N., Hamilton, P.B., and Goodman, M.M. 1989. Evaluation of tropical maize germplasm for resistance to kernel colonization by Fusarium moniliforme. Plant Disease 73:578-580. [ Links ]
Instituto Nacional de Estadística, Geografía e Informática (INEGI). 2005. Indicadores del sector alimentario. Disponible en: http://www.inegi.gob.mx/economia. Consulta efectuada el 20 de marzo de 2006. [ Links ]
Kedera, C.J., Plattner, R.D., and Desjardins, A.E. 1999. Incidence of Fusarium spp., and levels of fumonisin B1 in maize in Western Kenya. Applied and Environmental Microbiology 65:41-44. [ Links ]
Klich, M.A., and Pitt, J.I. 1988. Aspergillus: A Laboratory Guide to Common Aspergillus Species and their Teleomorphs. Commonwealth Scientific and Industrial Research Organization (CSIRO). Canberra, Australia. 116 p. [ Links ]
King, S.B., and Scott, G.E. 1981. Genotypic differences in maize to kernel infection by Fusarium moniliforme. Phytopathology 71:1245-1247. [ Links ]
Martínez-Flores, R. y García-Aguirre, G. 2003. Inspección de aflatoxinas en maíz cultivado, almacenado y transportado en el estado de Tamaulipas, México, en 1998. Anales del Instituto de Biología, Serie Botánica 74:313-321. [ Links ]
Martínez-Garza, A. 1988. Diseños experimentales. Métodos y Elementos de Teoría. Ed. Trillas. México. 756 p. [ Links ]
Munkvold, G.P. 2003. Cultural and genetic approaches to managing mycotoxins in maize. Annual Review of Phytopathology 41:99-116. [ Links ]
Nelson, P.E., Toussoun, T.A., and Marasas, W.F.O. 1983. Fusarium species: An Illustrated Manual for Identification. Pennsylvania State University Press. University Park, Pennsylvania, USA. 193 p. [ Links ]
Nelson, P.E., Dignani, M.C., and Anaissie, E.J. 1994. Taxonomy, Biology, and clinical aspects of Fusarium species. Clinical Microbiology Reviews 7:479-504. [ Links ]
Payne, G.A. 1987. Aspergillus flavus infection of maize: silos and kernels. pp. 119-129. In: M.S. Zuber, E.B. Lillehoj, and B.L. Renfro (eds.). Aflatoxin in Maize: A Proceeding of the workshop. CIMMYT. El Batan, Texcoco, Edo. de Mexico. 381 p. [ Links ]
Peraica, M., and Dominan, A.M. 2001. Contamination of food with mycotoxins and human health. Archives of Industrial Hygiene and Toxicology 52:23-35. [ Links ]
Pitt, J.I. 1979. The Genus Penicillium, and Its Teleomorphic States: Eupenicillium, and Talaromyces. Academic Press. New York, USA. 641 p. [ Links ]
Raper, K.B., and Fennell, D.I. 1965. The Genus Aspergillus. Williams and Wilkins. Baltimore, MD, USA. 686 p. [ Links ]
Robinson-Fuentes, V.A., García-Aguilar, L. y González-Huape, L.J. 2005. Niveles de micotoxinas en maíz disponible en el estado de Michoacán, México. Ciencia Nicolaíta 40:67-76. [ Links ]
Rodríguez-Del Bosque, L.A. 1996. Impact of agronomic factors on aflatoxin contamination in preharvest field corn in northeastern Mexico. Plant Disease 80:988-993. [ Links ]
Rodríguez-Del Bosque, L.A., Reyes-Méndez, C.A., Acosta-Núñez, S., Girón-Calderón, J.R., Garza-Cano, I. y Villanueva-García, R. 1995. Control de aflatoxinas en maíz en Tamaulipas. Folleto Técnico 17. Instituto Nacional de Investigaciones Forestales y Agropecuarias. Río Bravo, Tamaulipas, México. 20 p. [ Links ]
Sauer, D.B. 1987. Conditions that affect growth of Aspergillus flavus and production of aflatoxin in stored maize. pp. 41-50. In: M.S. Zuber, E.B. Lillehoj, and B.L. Renfro (eds.). Aflatoxin in maize: A Proceeding of the workshop. CIMMYT. El Batan, Edo. de Mexico. 381 p. [ Links ]
Shelby, R.A., White, D.G., and Bauske, E.M. 1994. Differential fumonisin production in maize hybrids. Plant Disease 78:582-584. [ Links ]
Shephard, G.S., Thiel, P.G., Stockenstrom, S., and Sydenham, E. 1996. Worldwide survey of fumonisin contamination of corn and corn based products. Journal of Association of Official Analytical Chemists 79:671-686. [ Links ]
Sistema Integral de Información Agroalimentaria y Pesquera (SIAP). 2006. Información agrícola anual y por estados. SAGARPA. México Disponible en http://www.siap.sagarpa.gob.mx. Consulta efectuada el 24 de marzo de 2006. [ Links ]
Walker, R.D., and White, D.G. 2001. Inheritance of resistance to Aspergillus ear rot and aflatoxin production of corn from CI2. Plant Disease 85:322-327. [ Links ]
Widstrom, N.W., McMillan, W. W., Beaver, R.W., and Wilson, D.M. 1990. Weather associated changes in aflatoxin contamination of preharvest maize. Journal of Production Agriculture 3:196-199. [ Links ]














