Introducción
La enfermedad arterial periférica (EAP) involucra una gran variedad de enfermedades arteriales no coronarias, causadas por el proceso de aterosclerosis de las arterias. Su prevalencia, cada vez mayor en pacientes con diabetes mellitus e hipertensión arterial sistémica, aumenta de manera pronunciada con la edad y por los factores de riesgo como el tabaquismo y la dislipidemia1. La EAP es más frecuente en el sexo masculino a razón de 1.2:1. Hay una asociación fuerte entre el tabaco y la isquemia crítica, el abandono de este se ha acompañado de una reducción en el riesgo de EAP2. En pacientes diabéticos, el riesgo de padecer EAP es dos veces más frecuente, la gravedad de la enfermedad es mayor que en los no diabéticos, con un riesgo de amputación de 5 a 10 veces mayor3.
En la EAP la calcificación intravascular es un predictor de mal pronóstico, asociándose de manera directa con un aumento de la mortalidad o morbilidad cardiovascular4 e incrementándose en pacientes que hayan sido sometidos a una amputación mayor5. Esta calcificación causa estenosis de manera progresiva, disminución de la presión de perfusión, isquemia de los tejidos y claudicación intermitente6,7. La EAP es una de las principales causas para la limitación de las actividades y disminución de la calidad de vida8. Un gran porcentaje de EAP cursa asintomático9 (grado 0 de Rutherford), otros con claudicación intermitente (grado I de Rutherford), en los casos más graves se presenta dolor en reposo (grado II de Rutherford), úlceras y la gangrena (grado III de Rutherford), indicadores de isquemia grave (Tabla 1)10. La isquemia crónica que amenaza la extremidad es la manifestación clínica más grave de la EAP11.
Tabla 1 Clasificación de Fontaine y Rutherford
| Estadificación de la enfermedad arterial de las extremidades inferiores | ||||
|---|---|---|---|---|
| Clasificación de Fontaine | Clasificación de Rutherford | |||
| Estadio | Síntomas | Grado | Categoría | Síntomas |
| I | Asintomático | 0 | 0 | Asintomático |
| II | Claudicación intermitente | I | 1 | Claudicación leve |
| 2 | Claudicación moderada | |||
| 3 | Claudicación grave | |||
| III | Dolor isquémico en reposo | II | 4 | Dolor isquémico en reposo |
| IV | Úlcera o gangrena | III | 5 | Pérdida de tejido menor |
| 6 | Pérdida de tejido mayor | |||
Adaptada de León-Rey et al., 201710.
El índice tobillo brazo (ITB) tiene una sensibilidad del 75% y una especificidad del 86% para diagnosticar EAP12. El ultrasonido junto con el ITB brinda información necesaria acerca de la anatomía, tratamiento y pronóstico, útil para el seguimiento de angioplastia y del bypass periférico13, con una sensibilidad del 85-90% y una especificidad mayor del 95%14. La angiografía por tomografía y la angiografía por resonancia magnética en la EAP de la extremidad inferior presenta excelentes resultados, con una sensibilidad del 95% y especificidad del 96% para angiografía por tomografia15, y sensibilidad del 94% y especificidad del 92% para angiografía por resonancia magnética16. La arteriografía nos permite un estudio selectivo del vaso en estudio, y se considera el método de referencia para el diagnóstico y planeación transoperatorio.
El tratamiento inicial de la EAP está dirigido a aliviar los síntomas, incrementar la distancia caminada, reducir el riesgo cardiovascular global y permitir realizar las actividades de la vida diaria sin limitaciones, controlando los factores de riesgo, estimulando el ejercicio físico y las medidas farmacológicas. En pacientes refractarios a estas medidas y en estadios más avanzados se considera la revascularización. Para el manejo invasivo y elección del manejo de revascularización, además de las comorbilidades, experiencia del centro y preferencia del paciente, la anatomía de la lesión siguiendo las recomendaciones TASC II11 (Inter-Society Consensus for the Management of Peripheral Arterial Disease) (Tabla 2). Los procedimientos para modificar la placa de calcio, como la angioplastia transluminal percutánea (ATP), pueden presentar durante el tratamiento endovascular una expansión subóptima, asociado con una pérdida aguda de la permeabilidad debido a una estenosis del vaso tratado, reduciendo la eficacia del procedimiento con una pérdida aguda de la permeabilidad y un mayor riesgo de complicaciones, como la disección residual que suele requerir stents17; también se observa una alta tasa de fracaso crónico debido a la reestenosis, lo que resulta en la revascularización de la lesión diana. Las técnicas ablativas (aterectomía) las utilizamos para mejorar el diámetro de la luz del vaso al eliminar la placa de ateroma, sin embargo son inherentes a ellas algunas complicaciones vasculares como la embolización distal junto con una permeabilidad subóptima, con significancia estadística18. No obstante, bajo estudio con microscopia electrónica, ni la angioplastia con balón a alta presión ni la aterectomía alteran significativamente el calcio profundo, en comparación con otras técnicas disponibles de reciente creación19.
Tabla 2 Clasificación TASC II (Inter-Society Consensus for the Management of Peripheral Arterial Disease)
| TASC II | |||
|---|---|---|---|
| Lesiones aortoilíacas | Lesiones femoropoplíteas | ||
| Tipo de lesión | Descripción | Tipo de lesión | Descripción |
| A | Estenosis unilateral o bilateral de la AIC Estenosis unilateral o bilateral > 3 cm de la AIE | A | Estenosis única < 10 cm de longitud Oclusión única < 5 cm de longitud |
| B | Estenosis>3 cm de la aorta infrarrenal Oclusión ilíaca unilateral Estenosis única o múltiple 3-10 cm que incluye la AIC y no la AFC Oclusión unilateral de la AIE que no afecta la AFC ni hipogástrica | B | Múltiples lesiones, cada una < 5 cm Estenosis u oclusión única < 15 cm que no incluye la poplítea infragenicular Lesiones únicas o múltiples en ausencia de continuidad con vasos tibiales para mejorar el flujo de entrada a un bypass distal Oclusión gravemente calcificada < 5 cm de longitud |
| C | Oclusión de AIC bilateral Estenosis bilateral de la AIE 3-10 cm que afecta la AIE pero no a la AFC Estenosis unilateral de la AIE que engloba la AFC o hipogástrica Oclusión unilateral gravemente calcificada de la AIE | C | Múltiples lesiones > 15 cm de longitud total Lesión recurrente que necesita tratamiento después de 2 intervenciones endovasculares |
| D | Oclusión de la aorta infrarrenal Enfermedad difusa de la aorta infrarrenal y ambas ilíacas Estenosis difusa unilateral que afecta a AFC, AIE y AIC Oclusión unilateral de AIC y AIE Oclusión bilateral de AIE Estenosis ilíaca en pacientes con AAA que requiere tratamiento quirúrgico no endovascular | D | Oclusiones de la AFS o AFC > 20 cm que incluyen la poplítea Oclusión crónica de la poplítea que incluye la trifurcación de los vasos distales |
AFC: arteria femoral común; AIC: arteria ilíaca común; AIE: arteria ilíaca externa; AFS: arteria femoral superficial; AAA: aneurisma de aorta abdominal. Adaptada de Norgren et al., 200711 .
Teniendo aún este campo (modificación del calcio profundo) para la investigación, la litotricia intravascular (LIV) aparece como una opción más para el manejo de lesiones calcificadas y la preparación del vaso con el fin de mejorar la distensibilidad luminal y facilitar el tratamiento endovascular definitivo20. Está basada en la litotricia extracorpórea usada para el tratamiento de los cálculos renales, tecnología que fue consecuencia de la investigación aplicada con fines militares durante la Segunda Guerra Mundial, se diseñó un generador de ondas de choque cuyo fundamento se basa en la producción de una chispa eléctrica en una cápsula elipsoidal sumergida en el agua. Después de siete años de investigación y desarrollo, Chaussy (Hospital Universitario de Múnich) realizó en 1980 la primera litotricia extracorpórea en humanos21.
Aprobada el 16 de septiembre de 2016 por la Food and Drug Administration (FDA) en EE.UU., la LIV cumple el mismo principio que sus predecesores, pero con ciertas adaptaciones. Consiste en la aplicación de energía de presión sónica pulsada para modificar el calcio en la íntima y en la media22 sin afectar los tejidos blandos locales o liberar émbolos, actúa de manera selectiva sobre el calcio debido a la ausencia de interfaz de densidad dura en el tejido vascular normal y blando, evita la disipación de la energía de LIV, disminuyendo de esta manera las complicaciones inmediatas como la estenosis y el espasmo del vaso.
Estas adaptaciones consisten en la incorporación de 4-5 emisores de litotricia (fuente de ondas de presión acústica) en el eje longitudinal del catéter de angioplastia con balón que emiten ondas de presión acústicas pulsátiles localizadas circunferencialmente para modificar el calcio vascular. La aplicación de una descarga eléctrica entre dos electrodos resulta de la formación de un pulso sónico de presión esféricamente hacia afuera del emisor sobre las paredes del balón y su transmisión sobre la placa de calcio23. Las ondas de choque viajan a través del tejido vascular con un efecto mínimo debido a las características similares de impedancia acústica del agua y del tejido blando (es decir, agua, 1.5 ×106 kg/[m2·s]; músculo, 1.7 ×106 kg/[m2·s]). Los efectos sobre el calcio se observan cuando las ondas de choque encuentran tejido con diferentes impedancias acústicas, como la transición de tejido blando a tejido calcificado (impedancia acústica del hueso, 7.8 ×106 kg/[m2·s]). Sin embargo, el margen de seguridad de la LIV es estrecho debido a la exposición directa del emisor activado y las ondas al tejido circundante, lo que puede aumentar el riesgo de lesión tisular con la consiguiente ruptura, disección o sangrado24. Planteando estos desafíos se realizan tres modificaciones: a) las ondas de presión de LIV generan pulsos de presión negativa pico mínimos y positivos seguros para los tejidos, lo que permite una fuerza de compresión suficiente para modificar el calcio vascular al tiempo que mitiga la lesión de los tejidos blandos debido a la cavitación excesiva o la tensión de tracción; b) los emisores de ondas de presión están encerrados dentro de un globo inflado lleno de líquido para mitigar las lesiones térmicas, y c) se disponen en serie múltiples emisores a lo largo del eje del catéter para el tratamiento longitudinal del vaso calcificado25.
La preparación del vaso con LIV se utilizó primeramente para enfermedad arterial coronaria y más tarde en vasos periféricos, donde se demostró que es eficaz y segura para la modificación de la placa calcificada, logrando una reducción del diámetro de la estenosis del 59.3%, con complicaciones vasculares raras como limitación del flujo o disección en solo el 1.25% de los casos26.
El éxito del tratamiento con LIV fue del 100% en lo demostrado por el estudio DISRUPT PAD (estudio multicéntrico y de un solo brazo), en el que se trataron 95 pacientes con lesiones femoropoplíteas calcificadas sintomáticas de ≤ 15 cm, quienes presentaron una estenosis residual promedio del 24% y una ganancia aguda de 3 mm; solo implantaron un stent (1%). La permeabilidad de los vasos fue del 77% a los seis meses evaluada mediante ecografía dúplex27.
Este procedimiento se ha usado para tratar arterias ilíacas con claudicación o isquemia crítica de las extremidades con calcificaciones severas. Armstrong, en el estudio DISRUPT PAD III, evaluó la seguridad y eficacia de LIV en EAP ilíaca «en el mundo real» en 118 pacientes con un total de 200 lesiones. Demostró una reducción constante de la estenosis con pocas complicaciones, con morbilidad y mortalidad reducidas, este grupo requirió menos tratamientos complementarios (41.2%)28. Adams refiere una ganancia aguda promedio de 3.4 mm al final del procedimiento con una estenosis del 23.6%, utilizando otras tecnologías basadas en balón (53% de los casos) y con menor frecuencia aterectomía o stent (19.8 y 29.9%)29.
La seguridad y el rendimiento de la LIV en patología arterial periférica, a referir por Brodmann en un estudio con 35 pacientes con EAP con diámetros del vaso tratado 3.5-7 mm, estenosis ≥ 70%, longitud de la lesión ≤ 150 mm y un vaso permeable al pie, para ser tratados con LIV mediante técnica estandarizada con elección del balón en relación con la arteria a tratar 1:1, insuflando el balón a 4 ATM y aplicando 30 pulsos seguidos de una dilatación adicional a las presiones nominales, el seguimiento lo realizó con ITB durante seis meses, teniendo como resultados el mejoramiento del ITB y la categoría Rutherford con éxito en todos sus pacientes al presentar una estenosis residual menor del 23.4% con una ganancia aguda de 2.9 mm, asimismo, no presentó complicaciones vasculares y no se implantaron stents, además no se informaron eventos adversos importantes durante el seguimiento30.
La LIV para el tratamiento de EAP sintomática localizada en la arteria femoral común es segura y eficaz según Muhammad (2022). En su estudio se trataron 68 lesiones en cinco años y se comparó la LIV y la aterectomía; tuvieron eventos de revascularización similares, con un éxito técnico del 100%, además, ambas intervenciones tuvieron tasas de complicaciones similares después del procedimiento, en el caso de LIV se colocó un stent y en la aterectomía dos stents de rescate31.
Gunnar compara en pacientes con enfermedad arterial femoropoplítea con calcificaciones moderadas o graves la realización de LIV con la ATP como método de preparación de vaso para angioplastia con balón medicado o colocación de stent, encontrando una diferencia en el éxito (estenosis residual ≤ 30%) entre estos para LIV (66.4%) frente a ATP (50.4%), mientras que las disecciones limitantes de flujo fueron 1.4% en LIV frente a 6.8% para ATP, la necesidad de posdilatación o stent fue para LIV 5.2 y 4.6%, comparado con el 17 y 18.3% para ATP respectivamente8. Brodmann presenta el estudio DISRUPT PAD II22, donde evalúan el tratamiento de lesiones femoropoplíteas calcificadas en 60 pacientes, con los siguientes resultados: una estenosis residual final del 24.2%, con una ganancia aguda media de 3.0, con una tasa de eventos adversos mayores a los 30 días del 1.7%, con una disección de grado D que se resolvió con stent, la permeabilidad primaria a los 12 meses fue del 54.5%, demostrando una seguridad para el empleo de LIV con una menor tasa de eventos adversos mayores.
Para el tratamiento de EAP de arterias por debajo de la rodilla, Brodmann refiere seguridad para el tratamiento de lesiones infrapoplíteas estenóticas y calcificadas, reporta eventos adversos mayores a 30 días del 0% y reducción del porcentaje de estenosis del diámetro de las lesiones diana (del 46.5%). Todos los pacientes lograron estenosis de diámetro residual menor del 50%, presentando una sola disección tipo B y la colocación de dos stents32.
Con estos estudios podemos decir que las lesiones arteriales estenóticas y calcificadas en zona infrapoplítea pueden tratarse de manera segura y exitosa con LIV, como se presentará en el siguiente caso.
Objetivo
Presentar un caso de EAP femoropoplítea TASC II C y su tratamiento mediante el empleo de LIV.
Caso clínico
Paciente de sexo masculino de 65 años de edad que cuenta con el antecedente de hipertensión arterial sistémica de siete años de evolución en manejo con telmisartán, diabetes mellitus de siete años de evolución en manejo con insulina, enfermedad renal crónica sin tratamiento sustitutivo. Tabaquismo, 1-2 cajetillas por año. Esquema de vacunación SARS-CoV-2, tres dosis. Inició su padecimiento un mes previo, al mostrar claudicación con la presencia de ulceración en primer y segundo dedo de pie derecho, con posterior presencia de necrosis seca en la punta de los dedos, acudió con médico, quien realizó lavado quirúrgico y desbridación e inició rivaroxabán, cilostazol y ciprofloxacino, sin presentar mejoría de la sintomatología. A la exploración física, paciente con extremidad pélvica derecha con pulso femoral grado II, pulso poplíteo grado I, pulsos tibiales y pedio grado 0. Presenta necrosis seca del extremo distal de las falanges distales del primer y segundo dedo.
Se realiza ultrasonido Doppler arterial de miembro pélvico derecho, en arteria femoral superficial con presencia de flujo bifásico con velocidad pico sistólico (VPS) de 50 cm/s, a nivel de arteria poplítea con flujo bifásico con VPS 36 cm/s, arteria tibial posterior con flujo monofásico con VPS 20 cm/s, no se detecta flujo en arterias tibial anterior y peronea. Se complementa rastreo con ultrasonido lineal de 8 MHz, con presencia de flujo en arteria tibial posterior con ITB 0.50. Laboratorios: biometría hemática con leucocitos de 10.3, neutrófilos 75%, hemoglobina 13.5 mg/dl, hematocrito 39%, plaquetas 301,000. Química sanguínea: glucosa 82 mg/dl, creatinina 1.58 mg/dl, sodio 138 mEq, potasio 4.8 mEq, hemoglobina glucosilada 9.0.
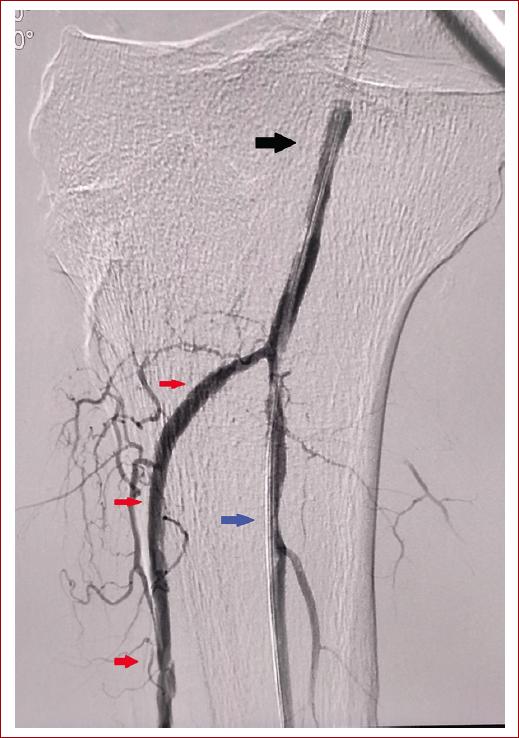
Se clasifica como EAP Rutherford grado III, categoría 5, WIfI 2-2-0. Para completar protocolo de estudio se realiza en sala de hemodinamia arteriografía con sustracción digital diagnóstico-terapéutica. Presenta una variedad anatómica con una bifurcación alta de arteria tibial posterior, ya que usualmente la arteria poplítea se bifurca en arteria tibial anterior y tronco tibioperoneo por debajo del borde inferior del músculo poplíteo33, en este caso presenta una variedad tipo IIB, según Kim et al., ya que la arteria tibial posterior nace a la altura o por encima de la articulación de la rodilla. Tronco común para arterias peronea y tibial anterior34 (Fig. 1).
En la arteriografía diagnóstica a nivel de femoropoplíteo encontramos múltiples zonas de estenosis críticas que repercuten hemodinámicamente, a nivel de tronco tibioperoneo, arteria peronea y arteria tibial anterior en tándem (Figs. 2 y 3). Se clasifica como EAP femoropoplítea TASC II C, teniendo múltiples opciones terapéuticas se decide continuar con manejo endovascular y realizar LIV de las zonas afectadas.

Figura 2 Arteriografía diagnóstica inicial, evidenciando múltiples zonas de estenosis críticas con repercusión hemodinámica (flechas negras), así como una variedad anatómica con bifurcación de arteria tibial posterior alta (flecha amarilla).
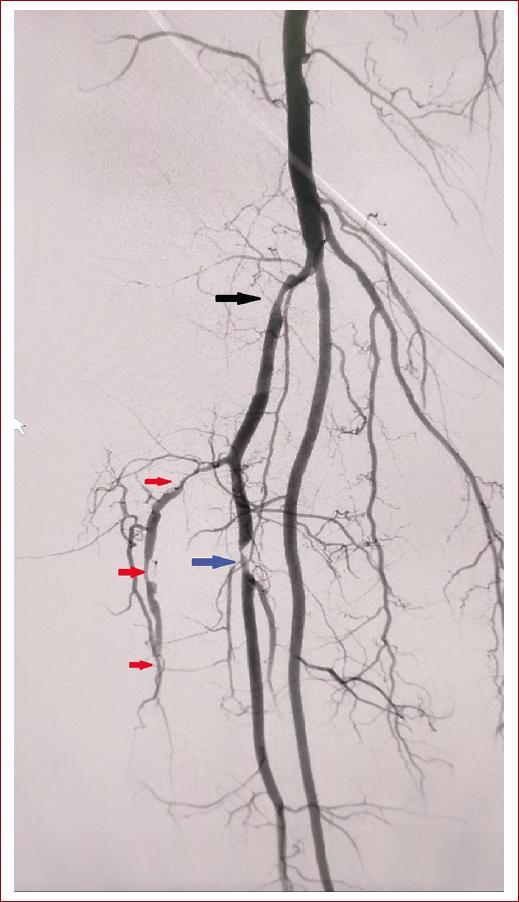
Figura 3 Arteriografía diagnóstica. Estenosis en tronco tibioperoneo (flecha negra). Estenosis en arteria peronea (flecha azul). Múltiples zonas de estenosis críticas en tándem en arteria tibial anterior (flechas rojas).
Ya con acceso en arteria femoral durante arteriografía se realiza canulación de arteria poplítea y posteriormente canulación selectiva de arteria tibial anterior con guía 0.018 montada en catéter soporte, realizando mapa digital; se realiza cambio por guía 0.014, se introduce balón para LIV de 3.5 x 40 mm de longitud, se insufla balón a 4 ATM, abarcando las estenosis críticas de esta arteria (previamente conectado al generador) y suministramos 30 pulsaciones en dos ciclos. Se retira dispositivo, con la misma guía 0.014 se logra canular arteria peronea continuando con mismo catéter con las mismas medidas de 3.5 x 40 mm de longitud, se coloca en sitio de estenosis crítica y posteriormente se insufla nuevamente hasta 4 ATM administrando 30 pulsaciones en dos ciclos. Ya en un tercer tiempo se trata el inicio de la bifurcación de tronco tibioperoneo, con terapia de LIV de 3.5 x 40 mm de longitud insuflado a 4 ATM con 30 pulsaciones en dos ciclos. Se realiza control angiográfico con mejoría de las lesiones en arteria tibial anterior, peronea y tronco tibioperoneo, sin presentar reestenosis, no siendo necesaria la angioplastia con balón medicado o la colocación de stent (Fig. 4). Se termina procedimiento sin presentar complicaciones.
Resultados
Cursa con buena evolución posquirúrgica inmediata, con controles de laboratorio con creatinina en 1.0 y urea en 16. Tolerando la vía oral y la deambulación, al rastreo con ultrasonido Doppler se identifica flujo bifásico en los tres vasos con un ITB de 0.8, se decide su egreso a las 24 h posquirúrgicas. Se da seguimiento por la consulta externa a los 10 días para vigilancia de sitio de punción, con mejoría de la deambulación a distancias más largas, al mes, tres y seis meses, con buena delimitación y sin progresión de la necrosis distal de la punta del 1.º y 2.o dedo de pie derecho, sin requerir de amputación menor de dichos dedos. El seguimiento hemodinámico del pie se valoró con ultrasonido Doppler arterial, presentando a nivel de arteria poplítea flujo bifásico con VPS 44 cm/s, flujo monofásico en arteria tibial anterior con VPS 26 cm/s, arteria peronea con flujo monofásico con VPS 26 cm/s, arteria tibial posterior flujo bifásico con VPS de 30 cm/s, con un ITB de 0.71.
Conclusión
La prevalencia e incidencia de EAP es cada día más alta, con lesiones cada vez más complejas. Actualmente el arsenal terapéutico es amplio y aunque el tratamiento abierto tiene sus indicaciones específicas, y es nuestra última opción terapéutica cuando otras modalidades han fallado, ha sido poco a poco desplazada como tratamiento inicial por los procedimientos endovasculares (por su baja mortalidad, morbilidad y días de estancia intrahospitalaria), ya sea angioplastia simple o medicada con o sin la colocación de stent. Aquí se presenta la LIV como un método endovascular con buenos resultados, con una baja estenosis residual, menor tasa de complicaciones como disección arterial, y menor requerimiento de angioplastia o stent posterior. Los pacientes con presencia de lesiones calcificadas moderadas y severas que tienen mayor riesgo de reestenosis son los que más se beneficiarían de este manejo, al presentar resultados positivos en cuanto a la estenosis, permeabilidad, seguridad del procedimiento y uso de stent. Sin embargo, se tendrán que seguir realizando estudios para demostrar el beneficio a mayor tiempo en comparación con otras técnicas endovasculares. Y a nivel personal habrá que considerar la disponibilidad de los materiales, el costo de estos y la experiencia del cirujano endovascular.











 text new page (beta)
text new page (beta)