Introducción
La candidiasis ocular tiene una incidencia del 2-26.5% en los pacientes con candidemia según las diferentes series1,2. Se han descrito dos entidades clínicas: coriorretinitis, cuando las lesiones se limitan a coroides y retina; y endoftalmitis, en el caso de que haya extensión al humor vítreo, normalmente manifestada como esferas algodonosas o «perlas vítreas». Esta última es frecuente en los casos en los que la exploración viene motivada por la clínica ocular, y aparece raramente en el contexto de pacientes con candidemia conocida por hemocultivo en los que se ha iniciado ya una terapia antifúngica sistémica1,3. Los factores de riesgo para el desarrollo de la afectación ocular son los mismos que favorecen encontrar hemocultivos positivos: catéter venoso central, nutrición parenteral total, uso de antibióticos de amplio espectro, cirugía abdominal reciente, neutropenia y terapia con glucocorticoides4.
Debido a que la candidiasis ocular puede ser inicialmente silente desde el punto de vista clínico, o los pacientes presentar un estado funcional que les impide manifestar sus síntomas, algunos autores defienden la necesidad de hacer un examen fundoscópico en todo paciente con candidemia al inicio del diagnóstico, y seriadamente mientras los hemocultivos se mantengan positivos1. Sin embargo, la Sociedad Española de Inflamación Ocular (SEIOC) recomienda realizar el cribado cuando el paciente refiera sintomatología2.
La pérdida de visión suele ser común en mayor o menor grado en caso de afectación vítrea, o cuando el foco retinocoroideo se encuentra próximo a la fóvea, pero las consecuencias visuales finales no pueden determinarse hasta semanas o meses tras el inicio de la enfermedad. Salvo en los casos de no percepción de luz, la visión suele mejorar una vez resuelto el proceso inflamatorio. Aunque el pronóstico visual se prevea pobre, siempre merece la pena realizar un diagnóstico y tratamiento precoces con un seguimiento estrecho con el objetivo de conseguir la mejor agudeza visual (AV) final4. Gracias a la imagen retiniana multimodal podemos establecer un diagnóstico inicial certero y seguir de forma estrecha la evolución del proceso infeccioso e inflamatorio, así como diagnosticar sus complicaciones, como: desarrollo de neovascularización coroidea (NVC), progresión de los focos vítreos, formación de membranas epirretinianas (MER), agujeros maculares o desprendimiento de retina.
Caso clínico
Presentamos el caso de una paciente mujer de 22 años, hospitalizada en el contexto de una reintervención de cirugía bariátrica por obstrucción de sleeve gástrico. Durante esta, presentó varios episodios febriles con hemocultivos positivos para Staphylococcus epidermidis y Candida albicans sensible a fluconazol, voriconazol y anfotericina, por lo que se solicitó al servicio de oftalmología la valoración del fondo de ojo para descartar la afectación ocular. En ese momento la paciente estaba recibiendo tratamiento intravenoso con 600 mg de fluconazol cada 24 horas.
Durante la primera exploración realizada a pie de cama con oftalmoscopia indirecta, la paciente no refirió pérdida de AV; sin embargo se detectaron varias hemorragias con centro blanco (Roth spots) difusas en polo posterior. Ante este hallazgo se decidió continuar con la evaluación en las consultas de oftalmología.
A los tres días, la paciente refirió pérdida de AV, constatándose 0.16 en ojo derecho (OD) y 1.0 en ojo izquierdo (OI). En la biomicroscopia de polo anterior se observaron signos inflamatorios (Tyndall de dos cruces en OD y una en OI, así como inyección ciliar). Se realizaron fotografías de control de fondo de ojo (Clarus 700, Carl Zeiss Meditec Inc. Dublin, California, EE.UU.), en las que se objetivaron las manchas de Roth asociadas a exudados blanquecinos compatibles con infiltración coroidea candidiásica (Fig. 1A). La angiografía fluoresceínica (AGF) (Canon CF-60, Canon Inc., Tokio, Japón) destacó una leve difusión papilar con integridad de la vasculatura retiniana (Fig. 1B). La tomografía de coherencia óptica de dominio espectral (SD-OCT, Spectralis, Heidelberg Engineering, Heidelberg, Alemania) mostró lesiones hiperreflectivas bien delimitadas en capas externas con sombras lumínicas posteriores y puntos hiperreflectivos tanto en retina como en vítreo (Fig. 1C). Tras la valoración inicial con imagen multimodal, y ante la alta sospecha de coriorretinitis candidiásica sin afectación vítrea se reforzó el tratamiento con fluconazol intravenoso a 400 mg cada 12 horas.
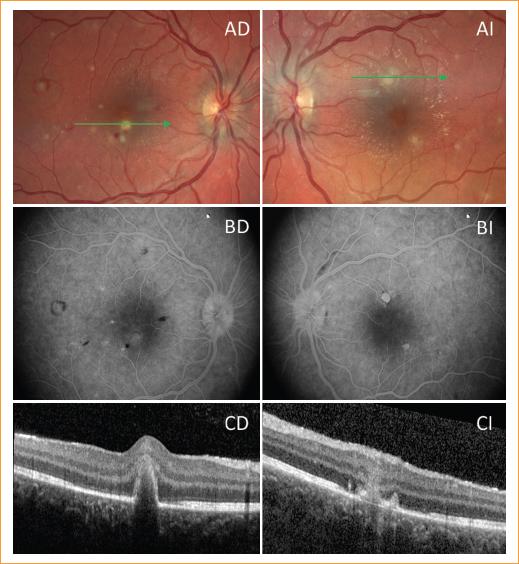
Figura 1 Imagen multimodal inicial de los ojos derecho (D) e izquierdo (I). A: fotografías de fondo de ojo en las que se aprecian exudados blanquecinos sobreelevados de bordes imprecisos y manchas de Roth, sin signos de vitritis. Las flechas indican el corte de la tomografía de coherencia óptica (OCT) mostrado en el apartado C. B: angiografía con fluoresceína en fase tardía que muestra zonas hipofluorescentes por efecto pantalla correspondientes con las áreas de hemorragia y zonas de tinción hiperfluorescentes en los lugares de los exudados. C: tomografía de coherencia óptica de dominio espectral en el que se observan lesiones hiperreflectivas en retina externa con discontinuidad de las líneas IS/OS (internal segment-outer segment) y del epitelio pigmentario de la retina (EPR), con sombra posterior que desdibuja la vasculatura coroidea subyacente.
Los controles posteriores mediante retinografía y SD-OCT revelaron la regresión de todas las lesiones del OI y de la mayoría del OD. Sin embargo, se constató en OD el crecimiento de la lesión subfoveal y parafoveal inferior con migración de los focos de las capas más internas hacia el vítreo (Fig. 2 A-C). Debido a esta progresión a endoftalmitis se pautó tratamiento intravítreo con voriconazol (100 mg/0.1 ml), y se sustituyó el tratamiento sistémico por voriconazol 300 mg cada 12 horas por su mayor penetrancia en los tejidos oculares. Se decidió también realizar una angiografía por OCT (OCTA Spectralis, Heidelberg Engineering, Heidelberg, Alemania) que inicialmente no arrojó signos de neovascularización.
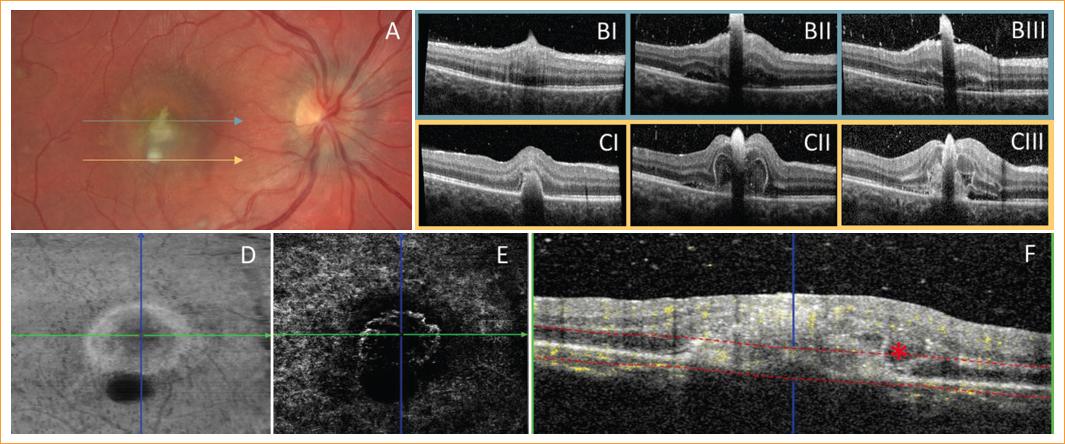
Figura 2 A: fotografía de fondo de ojo que muestra persistencia de exudados en mácula, las flechas y los colores indican la altura de los cortes de tomografía de coherencia óptica (OCT) representados en B y C. B y C: tomografía de coherencia óptica de dominio espectral en la que se observa la migración del infiltrado superior (B) desde las capas internas de la retina hacia vítreo con presencia de líquido subretiniano; y del exudado inferior (C) desde coroides hacia el interior con deformación de las capas externas y posteriormente interas de la retina a su paso con formación de membrana neovascular (MNV) a la semana (I), dos semanas (II) y tres semanas (III) del diagnóstico. D-F: angiografía por OCT; en face (D) con sombra inferior por efecto pantalla del exudado más interno, y reconstrucción de plexo avascular + coriocapilaris (E) con formación de MNV tipo II. En la vista de diagrama de flujo + OCT (F) se puede ver el pitchfork sign típico de las membranas inflamatorias (asterisco).
A pesar de la buena respuesta inicial, con desaparición de signos inflamatorios en cámara anterior, a los cinco días de seguimiento tras la segunda inyección intravítrea de voriconazol la paciente refirió empeoramiento de la AV, hasta 0.05. Se observó en la SD-OCT la presencia de engrosamiento y desprendimiento neurosensorial con signo de la horca o pitchfork sign en las zonas de migración de los infiltrados inicialmente originados en las capas externas (Fig. 2), por lo que se realizó una nueva OCTA que constató la aparición de una membrana neovascular (MNV) (Fig. 2 D-F).
En la OCTA se objetivó una MNV macular, por lo que se pautó tratamiento con 2 mg de aflibercept (Eylea®, Regeneron Pharmaceuticals, Tarrytown, NY, EE.UU.) intravítreo en 0.05 ml en dosis única que consiguió una regresión de la MNV (Fig. 3 A-C).
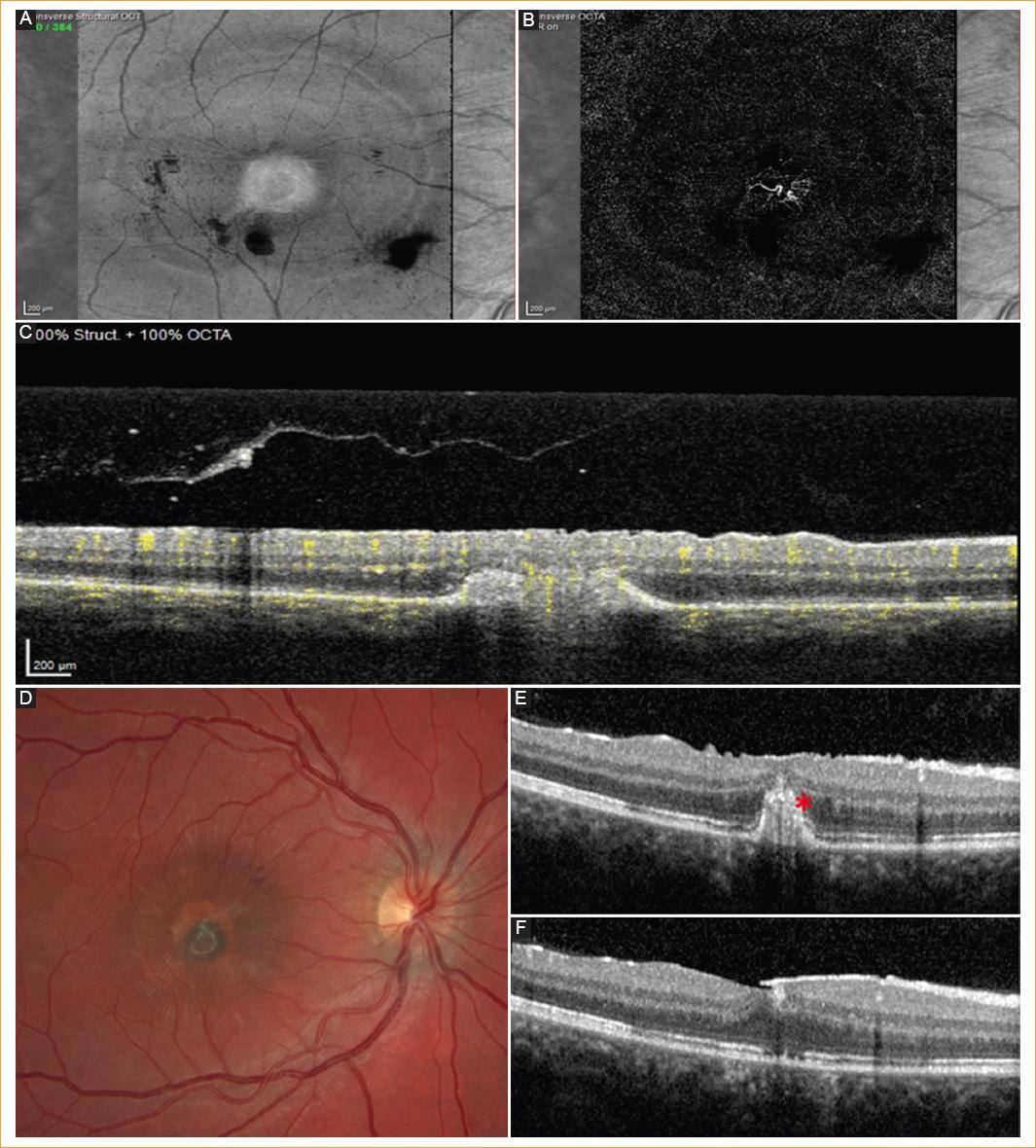
Figura 3 A-C: angiografía por tomografía de coherencia óptica (OCT) a las tres semanas de la dosis de aflibercept, tanto la vista en face (A y B) como el diagrama de flujo + OCT (C) muestran regresión de la NVC. D: fotografía de fondo de ojo con desaparición de los focos infecciosos, cicatrización hiperpigmentada redondeada tras la regresión de la neovascularización coroidea tipo II y formación de membrana epirretiniana (MER) a los tres meses del diagnóstico. E y F: tomografía de coherencia óptica de dominio espectral sección del área cicatricial (B) con material hiperreflectivo y discontinuidad en la línea de elipsoides (asterisco); sección foveal (C) con formación de MER también a los tres meses.
El tratamiento con voriconazol sistémico se suspendió a las seis semanas del inicio de la enfermedad por toxicidad hepática y se continuó con la administración intravítrea hasta la desaparición completa de los focos infecciosos tras cuatro inyecciones (un total de seis). A los tres meses del inicio del cuadro, la paciente presentaba una AV de 0.7 en el OD y de 1.0 en OI sin presentar metamorfopsias a pesar de la aparición de una MER traccional en el OD y de la cicatrización en capas externas como secuela del proceso inflamatorio.
Discusión
Aunque no siempre es posible evaluar a los pacientes con pruebas de imagen por su estado general, cada vez son más los trabajos que describen los hallazgos de la candidiasis ocular en SD-OCT y OCTA y los relacionan con otras modalidades de imagen5,6. Stephens et al. describen dos patrones claros de invasión en función de la imagen de SD-OCT; el primero de infiltración coriorretiniana de Candida spp. que provienen de las arterias ciliares posteriores cortas produciendo lesiones (sub-EPR) solitarias o múltiples que pueden romper, y posteriormente progresar hacia las capas internas de la retina; el segundo patrón se produce en forma de infiltrados en retina interna y fenómenos vasculíticos focales, que en SD-OCT se traducen en lesiones hiperreflectivas y adyacentes o sobre los vasos superficiales sin afectación coroidea, y que en fundoscopia son compatibles con la presencia de Roth spots como manifestación de ruptura vascular y posterior formación de trombos plaquetarios. Estas lesiones, que aparecen como consecuencia de la alteración del endotelio, aparecen en múltiples patologías, y aunque la endocarditis bacteriana sea la causa más frecuente, deben hacernos pensar en que el paciente pueda padecer alguna enfermedad del tejido conectivo, anemia, leucemia o diabetes si no presenta clínica compatible con un proceso infeccioso5,7.
Veronese et al. establecen correlaciones entre las áreas de hipoperfusión en la angiografía con verde de indocianina con áreas oscuras en OCTA al analizar el segmento correspondiente a la coriocapilaris, resaltando la importancia de establecer comparaciones entre las formas de imagen tradicionales y los nuevos medios con el OCTA6. Con la ayuda de estas técnicas podemos apreciar con mayor detalle el progreso, las complicaciones y la respuesta al tratamiento.
La inflamación del segmento posterior del ojo es la tercera causa de aparición de MNV, detrás de la degeneración macular asociada a la edad (DMAE) y la miopía patológica. Normalmente suelen darse en pacientes en edad laboral, clínicamente suelen manifestarse como escotomas y metamorfopsias cuando afectan a la fóvea, y su evolución puede generar la pérdida irreversible de la visión central. Se producen como consecuencia del estímulo angiogénico que genera la propia respuesta inflamatoria, y por disrupciones puntuales del complejo EPR-membrana de Bruch. Debido a que los botones o yemas neovasculares proliferan en espacios localizados, los pacientes suelen requerir menos dosis de antiangiogénicos que en casos de DMAE si se controla también la respuesta inflamatoria. Los focos inflamatorios, las lesiones cicatriciales y granulomatosas, así como el líquido subretiniano e intrarretiniano no asociados a MNV, potencialmente presentes en los casos de coriorretinitis, complican el diagnóstico certero de NVC. Al emplear AGF se muestra como una lesión isofluorescente o hiperfluorescente con fuga tardía, presentando diferencias sutiles con lesiones inflamatorias, siendo difíciles de distinguir. La SD-OCT dará en la mayor parte de los casos una imagen de MNV tipo II, estructura hiperreflectiva sólida y anterior a un EPR discontinuo; el pitchfork sign es distintivo de las MNV tipo II de causa inflamatoria y consiste en proyecciones hiperreflectivas en forma de dedo desde la membrana a las capas externas de la retina. Cuando el diagnóstico con estas dos pruebas de imagen plantea dudas, la OCTA resulta esclarecedor gracias a su capacidad para detectar el flujo sanguíneo en las diferentes capas o estratos de coroides y retina de manera no invasiva; si bien es cierto que los actuales algoritmos funcionan mejor a la hora de caracterizar la neovascularización en la DMAE, con una adecuada revisión y ajuste manual de la segmentación, esta modalidad de imagen nos permite hacer un diagnóstico diferencial certero con las lesiones mencionadas y evaluar la respuesta al tratamiento con antiangiogénicos8.
En este caso, la falta de respuesta del foco subfoveal con el tratamiento con fluconazol justificó la necesidad de cambiar a tratamiento con voriconazol por su perfil farmacocinético y mayor eficacia contra levaduras a nivel ocular tanto de forma sistémica como intravítrea9. Siempre hay que vigilar los posibles efectos secundarios de los fármacos y valorar el riesgo/beneficio de la medicación sistémica una vez que existen siembras vítreas, dado que cuando existe solo afectación de la cámara vítrea el tratamiento sistémico carece de utilidad. La colaboración con los especialistas de medicina interna y enfermedades infecciosas es fundamental para controlar el foco sistémico y las posibles toxicidades e interacciones farmacológicas, especialmente si se tiene en cuenta la patología subyacente al tipo de paciente que tiene predisposición a sufrir candidiasis ocular10.
Conclusión
La mayor comprensión de la evolución de la enfermedad gracias a las técnicas de imagen multimodal nos permite entender mejor la fisiopatología de la infección y diferenciar mejor en cada caso qué opción terapéutica es la más recomendable. La imagen multimodal nuevamente es clave en el diagnóstico de la enfermedad y de sus complicaciones, permitiéndonos actuar de manera rápida y precisa en cada momento. El tratamiento intensivo es fundamental incluso en casos de mal pronóstico visual, como el que se presenta con importante afectación subfoveal, puesto que puede haber una mejoría visual final impredecible con el paso del tiempo.











 text new page (beta)
text new page (beta)


