Introducción
El linfoma cutáneo primario es el segundo tipo más común de linfoma extraganglionar y se define como una neoplasia hematológica presente en la piel sin evidencia de enfermedad extracutánea en el momento del diagnóstico1. Las neoplasias de células T o NK maduras son en general raras, comprendiendo el 10 y 20% de los linfomas del mundo occidental y oriental, respectivamente. En Asia los linfomas extraganglionares de células T/NK se encuentran asociado a virus de Epstein Barr (VEB)2. Los casos de linfoma cutáneo de células T comprenden principalmente aquellos que involucran micosis fungoide, síndrome de Sézary, trastornos linfoproliferativos cutáneos primarios CD30 positivos, linfoma de células T subcutáneo similar a paniculitis, linfoma extraganglionar de células T/NK-tipo nasal (LECTNK), infección crónica activa por VEB, subtipos raros de linfoma de células T cutáneo periféricos y linfoma de células T cutáneo periférico no especificado3.
La radiación local se ha aplicado con fines curativos y paliativos en la práctica clínica4. El objetivo de este artículo es describir la presentación del LECTNK cutáneo primario, empleando una estrategia multidisciplinaria.
Reporte de caso
Paciente mujer de 32 años, con antecedente de una sola gestación que terminó en cesárea, asociado a una trombosis de miembro inferior izquierdo con resolución mediante trombectomía, hace un año y ocho meses. A los dos meses presenta úlcera sin resolución en la región medial de pierna izquierda, siendo sometida a resección y colocación de injerto libre. A la semana aparecen nuevas lesiones, una en la región del sóleo inferior y otra en el gastrocnemio, de 1.5 y 3 cm, respectivamente. Le realizan biopsia de dicha úlcera, con resultado de acúmulos focales de células redondas, monomorfas. La inmunohistoquímica (IHQ) resultó negativa para CD20, siendo positiva para CD3 citoplasmático y CD56, con Ki67 del 70%. Compatible con linfoma paniculítico de células T/NK. Con estas características acude al instituto, observándose las dos lesiones tipo úlcera con exposición de tejidos profundos, sangrante, y alteraciones de piel en la cara anterior de la pierna izquierda (Fig. 1). Se obtuvieron lesiones sospechosas en el estudio de nasofibroscopia; al estudio de angiotomografía de miembros inferiores, no se visualizan lesiones en el sistema arterial o venoso, pero en las partes blandas presenta perdida de continuidad cutánea y afectación del músculo gastrocnemio medial (Fig. 2). En el resto de estudios de extensión como tomografía espiral multicorte (TEM) de macizo facial, tórax, abdomen y pelvis, no mostraron lesiones primarias o secundarias. Así mismo, la aspiración y la biopsia de médula ósea no demostró infiltración neoplásica. Los exámenes hematológicos y bioquímicos se encontraron dentro de los parámetros normales. No se realizó la prueba sanguínea de VEB por el costo elevado. Se concluyó que se trataba de un LECTNK primario cutáneo de pierna, con un índice pronóstico para células natural killer (PINK) intermedio. Iniciando tratamiento a base del esquema DeVic (etopósido, ifosfamida, dexametasona y carboplatino) cada tres semanas hasta completar tres cursos concurrente con radioterapia (RT), abarcando por extensión la lesión cutánea visible y por profundidad evidenciado previamente por la TEM, a dosis de 5,000 cGy en 25 sesiones en técnica especial de radioterapia de intensidad modulada (IMRT) (Figs. 3 y 4). Durante el tratamiento de irradiación se evidenciaron cambios de regresión tumoral y deterioro del injerto de piel. A los seis meses postirradiación no se evidencia actividad tumoral clínica ni tampoco imagenológica, por lo que a los nueve meses se realiza nuevo injerto de piel autólogo para cubrir el defecto cutáneo, resultando viable luego de 12 meses postratamiento (Fig. 5) y no presentando lesiones recurrentes clínicas, imagenológicas ni hematológicas.
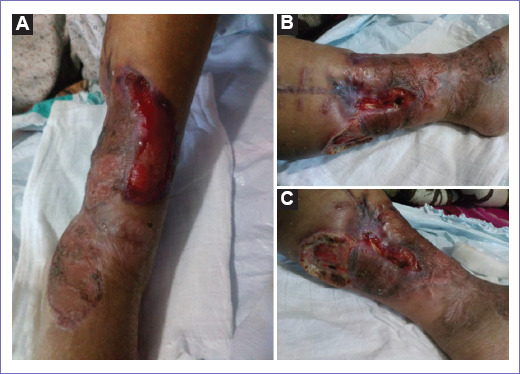
Figura 1 Imágenes de pierna izquierda (preirradiación): presentando dos lesiones ulceradas, de bordes irregulares, sobre elevados en cara posteromedial en 1/3 inferior, extendiéndose hasta la cara anterior. Con áreas con cambio de coloración de la piel (impresiona necrosis), sangrado activo moderado. La úlcera medial con una longitud de 8 cm, evidenciándose el periostio, y la úlcera posterior con un diámetro de 7 cm, con exposición del músculo gastrocnemio medial. A: vista anterior. B: vista medial. C: vista posterior.
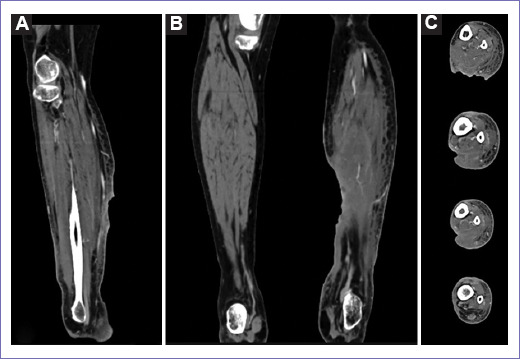
Figura 2 Tomografía espiral multicorte de pierna izquierda (preirradiación): a nivel infrapoplíteo, presenta pérdida de continuidad cutánea asociado a incremento de volumen e hiperdenso del tejido subcutáneo, asociado a disrupción del patrón muscular gastrocnemio medial y sóleo. Estructuras vasculares en ambos miembros inferiores de adecuado trayecto y sin defecto de llenado. A: vista sagital. B: vista coronal. C: vista en axial de arriba hacia abajo.

Figura 3 Delimitación del volumen de irradiación. A: vista axial, observándose lesión grosera diana (GTV) (color verde) abarcando la lesión ulcerada y las áreas hiperdensas, el volumen clínico diana (color celeste) con una expansión de 1 cm de la GTV sin incluir el paquete muscular profundo, y el volumen de tratamiento planificado (PTV) con una expansión simétrica de 7 mm. B: vista posteromedial, observándose las lesiones ulceradas delimitadas y la cobertura total del PTV. C: vista lateral, observándose el bolus (color blanco) cubriendo el PTV en las zonas ulceradas.
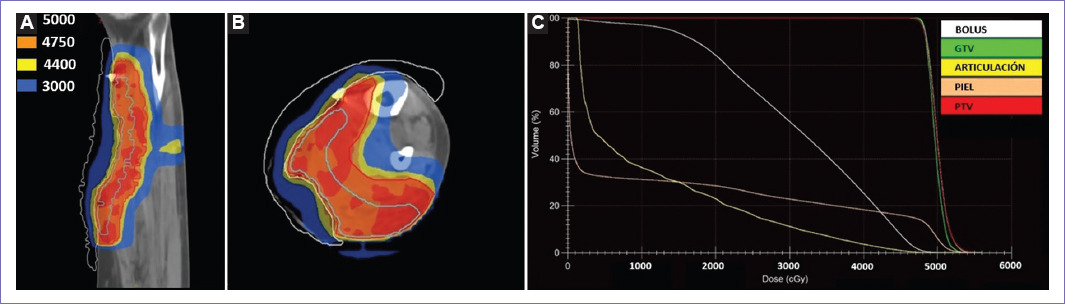
Figura 4 Planificación de irradiación con energía de 6 MV. A y B: planificación en técnica especial de radioterapia de intensidad modulada, observándose las curvas de 5,000 cGy (color rojo) dentro del volumen de tratamiento planificado (PTV), de 4,750 cGy con una cobertura total del PTV, curva de 4,400 cGy (color amarillo) y 3,000c Gy (color azul), estas dos últimas mostrando el decaimiento de la dosis. No existiendo dosis alta de más del 110%. C: histograma dosis-volumen, mostrando una conformidad del 95% para la dosis de 5,000 cGg para la lesión grosera diana (color verde) y PTV (color rojo). La menor dosis de irradiación en bolus (color blanco), piel (color naranja) y articulación de tobillo (color amarillo).

Figura 5 Evolución clínica de la lesión tumoral: A: a la sesión 10 de radioterapia, persisten las úlceras con las mismas características destructivas, pero sin sangrado en zonas adyacente. B: a la sesión 15 de radioterapia, las úlceras presentan tejido de granulación y reducción del tamaño, tanto en la úlcera medial como en la posterior de 7 y 6 cm, respectivamente. C: a la sesión 25 de radioterapia, las úlceras han sido reemplazadas por tejido de granulación, recuperando mayoritariamente el espesor de la pierna. D: a los 14 días postirradiación, utilizando solo apósitos hidrocoloides, se observa la reepitelización a partir de los bordes del defecto cutáneo. E: a los cuatro meses postirradiación, la mayor parte del defecto cutáneo se encontraba epitelizado. F: a los dos meses postinjerto autólogo, evidenciándose solo dos áreas ulceradas de 1 cm en proceso de cicatrización.
Discusión
El LECTNK casi siempre es un linfoma relacionado con el VEB y es relativamente común en Asia, América Central y América del Sur4,5.
Tiene características clínicas e histológicas muy características, con comportamiento clínico y pronóstico completamente diferentes en comparación con los linfomas ganglionares que pueden afectar la piel de manera secundaria, requiriendo un tipo de tratamiento diferente. Por lo tanto, los linfomas cutáneos primarios se incluyen como entidades distintas en las clasificaciones actuales de linfomas2.
El LECTNK primario cutáneo tiene una frecuencia menor al 1%6, con un comportamiento clínico agresivo, con presentación tipo placas ulcerante, tumores o como múltiples nódulos subcutáneos con o sin necrosis en las extremidades, cabeza-cuello y tronco, con un fenotipo de células T CD3(+), CD4(-), CD8(+), proteínas citotóxicas positivo y CD56 positivo7. En nuestro caso siendo compatible clínicamente, por la presencia de úlceras destructivas en un solo miembro inferior.
Las biopsias (sacabocados, por incisión o por escisión) de lesiones cutáneas sospechosas ayudan en el diagnóstico. Se debe considerar una nueva biopsia si la muestra histopatológica es insuficiente para hacer un diagnóstico final8. Morfológicamente, la presencia de infiltrados linfoides angiocéntricos, necrosis tisular zonal e imágenes citológicas marcadamente aberrantes son hallazgos diagnósticos necesarios para esa entidad tumoral9. Los paneles de IHQ adecuados para el diagnóstico pueden incluir CD2, CD3, CD4, CD8, CD20, CD30, CD56, cinasa de linfoma anaplásico, BCL6, Ki-67 y otros paneles de tipificación. El reordenamiento del gen del receptor de células T clonales, incluidas las cadenas alfa/beta (α/β) y gamma/delta (γ/δ), es esencial para hacer un diagnóstico preciso y decidir una estrategia de tratamiento8.
Los principales diagnósticos diferenciales patológicos incluyen el linfoma de células T γ/δ y el linfoma de células T tipo paniculitis subcutánea. El primero puede mostrar la presencia de EBER, pero carece de expresión de CD56. El linfoma subcutáneo de células T similar a una paniculitis y el linfoma de células T γ/δ se caracterizan por el reordenamiento monoclonal de los genes del receptor de células T β y γ a nivel molecular, mientras que LECTNK manifiesta un perfil genético de línea germinal en casi todos los casos8. Por lo tanto, es necesaria la integración de datos histológicos, inmunohistoquímicos y genotípicos para una identificación segura de LECTNK primario cutáneo. En nuestro caso no contamos con estudios de reordenamiento de genes, pero nos ayudó la morfología y la positividad a CD3 y CD56, catalogándose como un LECTNK primario cutáneo.
Se recomienda TEM contrastada y la tomografía por emisión de positrones con 18-fluorodesoxiglucosa (PET-18F) de cuerpo entero para pacientes con linfoma cutáneo de células T agresivos, como el LECTNK. La aspiración y biopsia de médula ósea tienen valor informativo. Se debe tener en cuenta el examen del oído, la nariz y la garganta para los pacientes4. En nuestro caso no tenemos acceso a la PET-18F. Sin embargo, en la evaluación clínica e imagenológica por TEM no se evidenciaron lesiones que hagan sospechar de algún primario ganglionar o en mucosas. La evaluación de la médula ósea determinó que no existía infiltración.
Los pacientes con LECTNK primario cutáneo se caracterizan por una alta tasa de aparición de enfermedad en estadio avanzado y un pronóstico extremadamente precario10,11. Jiang et al., en su serie de 18 años, recolectaron 30 casos, encontrando el predominio en menores de 60 años (53%), varón (63%), ECOG (Eastern Cooperative Oncology Group) 0-1 (70%), síntomas B (60%), lactato deshidrogenasa láctica (LDH) elevada (63%), estadio Ann Arbor I-II (50%) e índice pronóstico internacional (IPI) ≥ 2(63%)11. Siendo nuestro aparentemente típico, a excepción de ser mujer, su LDH es normal y no presenta síntomas B. No consideramos utilizar el IPI, ya que se tenía la certeza de ser un TNK, por lo que se decidió utilizar el PINK, obteniéndose la categoría de intermedio, con un punto por «tumores no nasales en la presentación».
Se ha descrito que la carga viral de VEB es de importancia pronóstica, desafortunadamente no fue posible la realización de este examen en nuestro paciente por la ausencia de accesibilidad a este examen auxiliar, aunque el esquema de terapia no varía con la carga viral12.
La quimioterapia (QT) sistémica es necesaria para reducir el fracaso del tratamiento en pacientes con LECTNK nasal en etapa temprana. Se ha confirmado que la quimiorradioterapia concurrente (QT-RT) mejora el control local de la enfermedad y reduce la recaída sistémica, que se ha informado en ensayos clínicos13. En Japón, un estudio de fase I/II evaluó la aplicación simultánea de RT (50 Gy) y DeVIC en 33 pacientes. De los 26 pacientes evaluables para una respuesta, la tasa de respuesta global (RG) y respuesta completa (RC) fue del 81 y 77%, respectivamente. En un análisis actualizado con una mediana de seguimiento de 67 meses, las tasas de supervivencia global (SG) y supervivencia libre de progresión (SLP) a cinco años fueron del 70 y 63%, respectivamente, con toxicidades tardías aceptables14. Como esquema secuencial, se evaluó la eficacia del régimen dexametasona, metotrexato, ifosfamida, l-asparaginasa y etopósido (SMILE), obteniendo tasa de RG y RC del 90 y el 69%, respectivamente en 29 pacientes con LECTNK nasal localizado que recibieron SMILE seguido de RT15. Aunque la QT seguida de RT es conveniente para la pronta aplicación de la terapia, el régimen SMILE debe usarse con precaución debido a su mayor índice de toxicidad hematológica16. Por lo tanto, la QT y la RT combinadas (simultáneas o secuenciales) se consideran actualmente como el tratamiento estándar para pacientes con enfermedad limitada.
En los LECTNK primarios cutáneos se podría aplicar la QT intensiva de los LECTNK, incluso los pacientes con enfermedad avanzada podrían tratarse con QT a base de platino con o sin irradiación local, pero hasta ahora los resultados del tratamiento han sido decepcionantes4,17. Se reporta tratamiento con QT sola o QT-RT, obteniendo RC (46.6%), remisión parcial (13.3%), enfermedad estable (6.7%) y progresión de enfermedad (33.4%). En nuestro caso se decidió utilizar el esquema de QT-RT, ya que la lesión primaria era extensa con un comportamiento destructivo. Por lo que era necesario iniciar la irradiación inmediatamente, evitando la recaída sistémica mediante el esquema DeVIC.
Es posible que se requiera radiación de dosis alta en el sitio primario para un buen control del tumor, pero el papel de la radiación local no se ha aclarado para los pacientes con lesiones de LECTNK generalizadas. La Guía de práctica clínica de la National Comprehensive Cancer Network (NCCN) recomienda una dosis de radiación de 45-50.4 Gy cuando se aplica la terapia combinada, y 50 Gy o más con RT sola8. El International Lymphoma Radiation Oncology Group (ILROG) y la European Society for Medical Oncology (ESMO) recomendaron una dosis de 50 Gy en la lesión inicial seguida de una irradiación de refuerzo de 5-10 Gy en las lesiones residuales4.
En el escenario paliativo la radiación debería ser fraccionada en casos que involucren un gran campo de radiación18. No se ha aclarado la dosis de radiación paliativa adecuada para LECTNK, pero es posible que se requieran dosis altas de radiación para obtener un buen alivio de los síntomas y control del tumor4.
La radiación local para el linfoma cutáneo primario se basa en el concepto «radioterapia a sitio involucrado» (ISRT), que minimiza el área profiláctica irradiada sin comprometer el resultado del tratamiento. Conserva los órganos adyacentes no afectados, como los pulmones, los huesos y los músculos. El volumen clínico diana (CTV) para pacientes con enfermedad en parche y/o placa debe abarcar la epidermis y la dermis, y el de los pacientes con lesiones tumorales debe abarcar la extensión del tumor19. El margen del campo lateral de la radiación local definitiva puede limitarse a 2-3 cm más allá de la lesión definida antes del tratamiento y el área sospechosa20. Para la RT paliativa, el CTV abarcará la lesión visible con un margen de 1-2 cm de piel circundante de aspecto saludable18. Se debe seleccionar la energía del haz de electrones adecuada para la dosis de la superficie de la piel y el grosor de las lesiones del parche y la placa, y se pueden considerar los haces de fotones para las lesiones tumorales. Se utiliza un bolus diario de 0.5-1 cm de grosor para prescribir hasta la línea de isodosis del 80-90% para cubrir cada lesión4. En sitios anatómicos complejos como la cara, axila y mama, y en sitios de superficies convexas como el cuero cabelludo y las extremidades es necesaria la técnica de campo múltiple. La IMRT utiliza fotones de 6 MV y colimadores binarios, podría ser útil para obtener una distribución de dosis homogénea en sitios anatómicos complejos y sitios de superficie convexa. Las ventajas de la IMRT son: a) distribución homogénea de la dosis en la piel y el área subcutánea; b) campo de radiación de forma irregular para evitar órganos de riesgo, y c) preservación de estructuras profundas como la médula ósea y los órganos viscerales. Mientras tanto, las desventajas incluyen la técnica compleja y la inconveniencia de modificar el plan tras la reducción del tumor21. En nuestro caso, por ser una lesión ulcerante y con alteraciones en la epidermis que coberturaba el 80% del perímetro de la extremidad, y con la intención de preservar drenaje linfático de la pierna, se utilizó IMRT, delimitando como lesión grosera diana (GTV), a la úlcera tumoral y cambios dérmicos, como CTV, con una expansión de 1 cm del GTV, y como volumen de tratamiento planificado, con una expansión de 0.5 cm del CTV. Obteniéndose buena respuesta clínica a partir de la sesión 10, finalizando con respuesta completa en la extremidad (Fig. 2).
Presenta bajas tasas de supervivencia, con supervivencia del 16% a los cinco años6. La mediana de supervivencia de los pacientes con lesiones cutáneas localizadas es de 27 meses y la de los pacientes con lesiones extracutáneas diseminadas varía de 5 a 10 meses4,17.
El LECTNK primario cutáneo es raro, clínicamente agresivo, por lo que deben ser revisados por un equipo multidisciplinario para garantizar la selección de una estrategia de tratamiento adecuado según la estadificación, las características clínicas y la condición del paciente. Se requieren más estudios prospectivos y retrospectivos y una base de datos de registro a gran escala para establecer el estándar de manejo.











 text new page (beta)
text new page (beta)


