Introducción
El cáncer de mama (CaMa) es el más frecuentemente diagnosticado y las tasas de incidencia se encuentran en crecimiento en todo el mundo1. Según la Organización Mundial de la Salud (OMS)2 representa el 16% de los cánceres femeninos y se estima que 626,679 mujeres con CaMa murieron en 20183. En Colombia, en 2014, el Ministerio de Salud afirmó que por su causa anualmente fallecen 2,649 mujeres4; las tasas de incidencia de CaMa en algunas ciudades de Colombia van de 65,7 por 100,000 en Barranquilla, a 27,7 en Pasto5, y la tasa mortalidad en Barranquilla es de 15,7 por 100,0006.
La tasa de supervivencia a cinco años es una forma precisa para estimar el pronóstico de supervivencia de un paciente con cáncer, dependiendo del estadio al momento del diagnóstico; suelen ser cercanas al 100% en estadio 0 o I, del 93% en estadio II, el 72% en III y del 22% en estadio IV o con metástasis7. Sin embargo, estos datos se modifican por factores de riesgo personales y el tipo de tratamiento7. A mayor edad, mayor probabilidad de fallecer por otra patología y en pacientes menores a 35 años, probablemente porque no suelen realizarse tamización8.
Usach et al.9, compararon la supervivencia del CaMa según el diagnóstico asistencial vs. el programa de detección precoz, sin encontrar diferencias significativas: en el primer grupo fue 85.9% y 93.7% en el segundo. Los factores que suelen determinar la supervivencia son: la invasión linfovascular, los estadios III y IV y la presencia de tumor en los bordes quirúrgicos10. Aunque la mayoría de los CaMa presentan signos y síntomas tempranos, el diagnóstico se hace en su gran mayoría en estadios avanzados y el tiempo para iniciar el tratamiento es excesivamente prolongado11. Uno de los factores más críticos para mejorar la supervivencia es el tiempo entre el diagnóstico y el tratamiento, iniciar este sin que se presenten retrasos que pongan en riesgo la vida, ya sea por parte de las entidades de salud o por el mismo paciente12. Las demoras del tratamiento se han asociado con menor supervivencia en el CaMa, donde un tiempo superior a tres meses entre la aparición de los primeros síntomas y el inicio del tratamiento disminuye la supervivencia global (SG)10. El retraso también puede ser por causa del propio paciente o por demora del proveedor13. En países de América Latina solamente el 26.4% de los casos obtiene un tratamiento oportuno y el 23% interpone recursos legales para acceder a los servicios de salud14, lo cual evidencia la falta de adherencia a los programas de promoción de la salud y prevención de la enfermedad. Por otro lado, también puede haber relación entre el tiempo de inicio del tratamiento y el método de detección empleado, tal como fue descrito por León et al., quienes compararon el autoexamen vs. screening, encontrando diferencias significativas (p < 0.05) a favor del segundo grupo15.
En Colombia, en la ley 1384 de 201016, en el Plan decenal para el control del cáncer 2012-202117 y en la Política de Atención Integral en Salud18, se establecen las acciones para el abordaje integral del cáncer incorporando actividades individuales y colectivas para la identificación oportuna de factores de riesgo y su intervención18. En Barranquilla y la región caribe colombiana no se han encontrado estudios que muestren el comportamiento de la supervivencia en CaMa en función de la agilidad en la atención, por lo que el objetivo del presente estudio es determinar la supervivencia según el tiempo entre el diagnóstico y el tratamiento en mujeres con CaMa atendidas en un centro oncológico del caribe colombiano.
Metodología
Tipo de estudio
Estudio analítico, tipo cohorte cerrada retrospectiva de mujeres diagnosticadas con CaMa entre el 1 de enero de 2002 y el 31 de diciembre de 2013, atendidas en un centro oncológico de la ciudad de Barranquilla, en quienes se evaluó la SG.
Fuentes y pacientes
Las fuentes de información fueron la historia clínica, los certificados de defunción y las bases de datos gubernamentales consultadas en la Registraduría Nacional del Estado Civil (RNEC) y el Registro Único de Afiliados (RUAF). Se incluyeron pacientes con tumor primario de mama, con registro biopsia anexado a la historia clínica e información sobre inicio y continuación del tratamiento; se excluyeron tumores de mama secundarios y sin información en las bases de datos nacionales (RNEC y RUAF).
Definiciones y desenlaces
Se tomó la fecha de diagnóstico histopatológico como inicio de seguimiento. Se utilizó la fecha específica de muerte por certificado de defunción y se restó de la primera para determinar la supervivencia; en las supervivientes se tomó la fecha de último contacto en la institución. El seguimiento se realizó hasta el 31 de diciembre de 2013. Los pasos para actualizar la información de último contacto o muerte se tomaron de lo sugerido por el Instituto Nacional de Cancerología19.
Se analizó la variable «régimen de salud», ya que en Colombia el aseguramiento es financiado con aportes de trabajadores y empleadores, en lo que se conoce como «régimen contributivo», el cual es obligatorio para empleados dependientes y parcialmente voluntario para independientes. La población «pobre» y desempleada es cubierta por un sistema de salud subsidiado por el Estado (régimen subsidiado) financiado mediante aportes al Fondo de Solidaridad y Garantías (FOSYGA)20. Para garantizar la validez de la información, debido a que los datos se tomaron de fuentes secundarias, se llevó a cabo una verificación de la información, contrastando con las historias clínicas.
Análisis estadístico
Se empleó estadística descriptiva con frecuencias y porcentajes, media y desviación estándar. En el análisis bivariante se empleó χ2 o Fisher según la distribución de las variables. Se realizó análisis de Kaplan-Meier para obtener la probabilidad acumulada de SG a cinco años y se realizó la prueba de rango logarítmico (log-rank) para comparar las funciones de supervivencia en las variables estratificadas. Se analizó la diferencia entre la fecha de tratamiento en la institución y la fecha del diagnóstico; fue dicotomizada según la mediana obtenida, en las categorías 60 días y más y menos de 60. Se realizó una regresión logística binaria, por el método de introducción, las variables incluidas en el modelo fueron aquellas con valores de p mayores a 0.2 en el análisis bivariante simple (supervivencia vs. factor). Para el análisis de los datos se usó el programa SPSS, versión 19.
Aspectos éticos
Este estudio, con base en lo dispuesto en la Resolución 8430 de 199321 se considera sin riesgo; en él se respetó la confidencialidad de la información al no solicitar el nombre de las pacientes; se trabajó sobre datos procesados y en todo momento hubo acogimiento a las Normas de Buenas Prácticas Clínicas en Investigación. Adicionalmente, este trabajo fue aprobado por un Comité de Ética en investigación independiente de la Universidad del Norte, bajo Acta de Evaluación N.° 160 del 10 de agosto de 2017.
Resultados
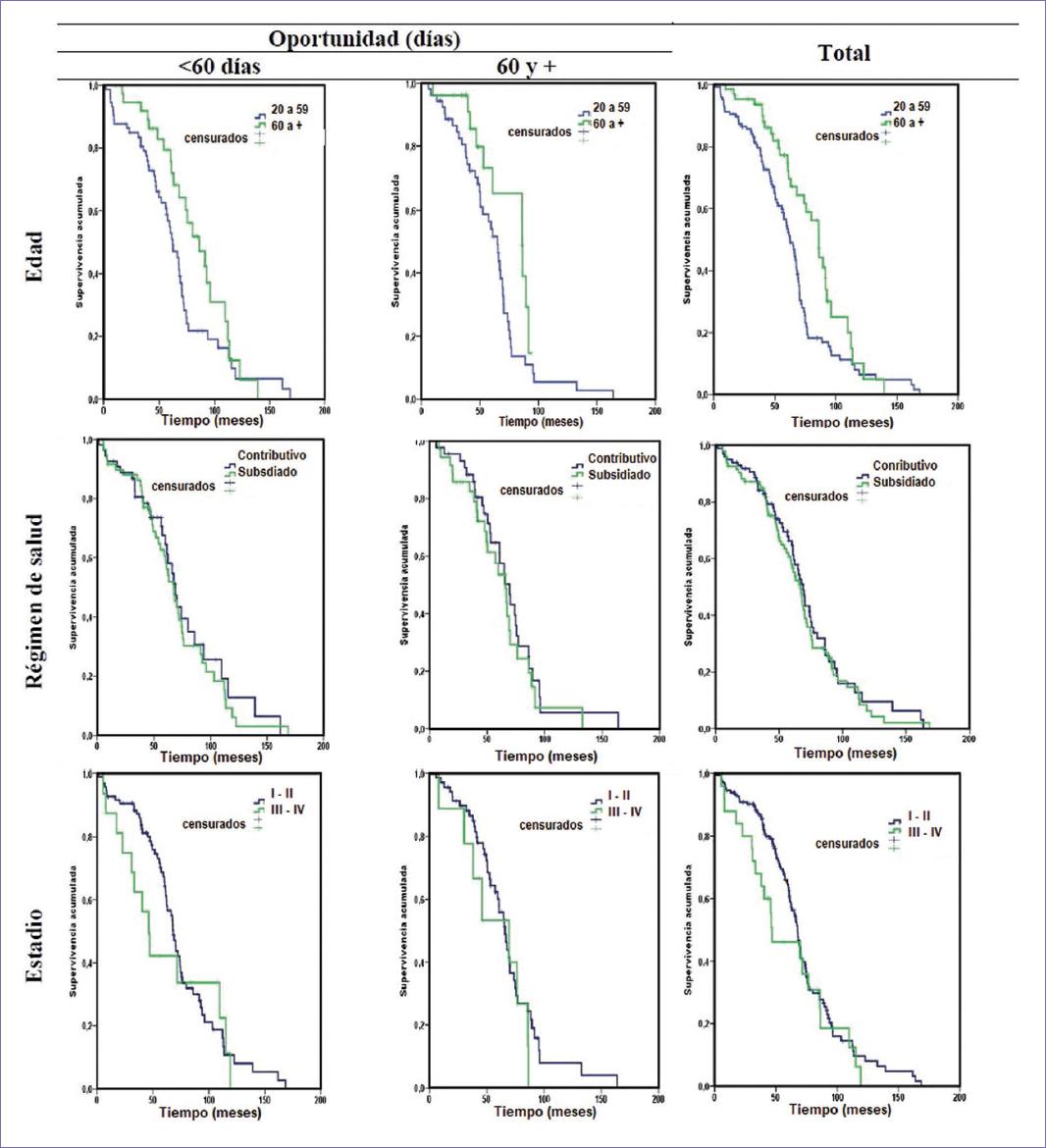
La media de edad fue 55.3 años (± 12.2) y la mediana 58.5; la mayoría, el 54.5%, tenía entre 40 y 59 años, pero la proporción de pacientes jóvenes (20 a 39 años) fue del 9.4%. La media de tiempo entre inicio del tratamiento y el diagnóstico fue de 99.9 días (± 132.3), y alrededor de una tercera parte tuvo que esperar 90 días o más para ser atendidas luego de su diagnóstico (Tabla 1). Por otro lado, la inmensa mayoría de tumores correspondía a carcinomas ductales (infiltrantes): 92.8%, siendo los estadios predominantes el I y el II, con un 86.8%; el 9.8% de los casos tuvo metástasis, el 44.3% fue positivo para receptores de estrógeno/progesterona (E/P+) y el 16.8% para Her2; así mismo, el 28.1% recibió solamente un agente principal, ya que en la mayoría de los casos se optó por terapia combinada (Tabla 1). La media de SG fue de 69.3 meses (intervalo de confianza del 95% [IC 95%]: 63.4-75.3), con un error típico de 3.1. Al estratificar por el tiempo de atención, se encontró que la supervivencia fue menor en el grupo de 90 días y más: 60.9 meses (IC 95%: 54.3-67.6), ya que en el de 60 a 89 fue de 74.8 (IC 95%: 50.9-94.6), en el de 30 a 59 de 70.3 (IC 95%: 58.9-81.8) y en el de menos de 30 días, 72.9 (IC 95%: 61.2-84.5) (Fig. 1).
Tabla 1 Características clínicas y sociodemográficas de las pacientes
| Variables | % (n = 235) |
|---|---|
| Características sociodemográficas | |
| Edad | |
| 20 a 39 | 9.4 |
| 40 a 59 | 54.5 |
| 60 a 79 | 33.2 |
| 80 y + | 3.0 |
| Régimen de salud | |
| Subsidiado | 44.7 |
| Contributivo | 55.3 |
| Tiempo en la atención (días)* | |
| < 30 | 37.0 |
| 30 a 59 | 21.9 |
| 60 a 89 | 11.5 |
| ≥ 90 | 29.7 |
| Características del tumor | |
| Morfología | |
| Ductal | 92.8 |
| Lobulillar | 2.1 |
| Otro | 5.1 |
| Estadio | |
| I | 33.6 |
| II | 53.2 |
| III | 9.8 |
| IV | 3.4 |
| Metástasis | |
| Sí | 9.8 |
| No | 90.2 |
| Receptores E/P† | |
| Sí | 44.3 |
| No | 55.7 |
| Receptores Her2 | |
| Sí | 16.8 |
| No | 83.8 |
| Tratamiento | |
| Monoterapia | 28.1 |
| Combinada | 71.9 |
| Estado | |
| Fallecido | 37.9 |
| Vivo | 62.1 |
*n = 192.
†Estrógeno/progesterona.
El análisis subsecuente se restringe a las pacientes que tenían el dato del tiempo en la atención (n = 192), encontrando que la supervivencia fue similar (χ2: 0.011; p = 0.917) tanto en las pacientes con 60 días o más como menos de 60 días: 67.1 vs. 66.4%. La supervivencia fue significativamente mayor (p < 0.05) en las pacientes de 20 a 59 años, 74.6 vs. 51.5%; en las pertenecientes al régimen de salud subsidiado 73.4 vs. 60.2%; en las que tenían estadio III o IV la supervivencia fue mayor, 84 vs. 64.1% (Fisher < 0.05), y en las que tenían receptores E/P+ la supervivencia también fue mayor, 83.5 vs. 51.5% (p < 0.05). En el resto de los casos las diferencias no fueron estadísticamente significativas (p > 0.05). Al estratificar según el tiempo en la atención, las diferencias en la supervivencia fueron significativas para las mismas variables anteriores en las que tenían 60 días o más, y en las que tenían menos de 60 días, las diferencias fueron significativas para régimen de salud y receptores E/P (p < 0.05) (Tabla 2).
Tabla 2 Supervivencia según tiempo entre el diagnóstico e inicio del tratamiento y variables de estudio
| Tiempo en la atención (días) | Total | ||||||||
|---|---|---|---|---|---|---|---|---|---|
| < 60 días | ≥ 60 días | ||||||||
| Vivo (%) | Muerto (%) | p | Vivo (%) | Muerto (%) | p | Vivo (%) | Muerto (%) | p | |
| Edad | |||||||||
| 20 a 59 | 52 (71.2) | 21 (28.8) | 0.14 | 42 (79.2) | 11 (20.8) | 0.001 | 94 (74.6) | 32 (25.4) | 0.001 |
| ≥ 60 | 23 (57.5) | 17 (42.5) | 11 (42.3) | 15 (57.7) | 34 (51.5) | 64 (48.5) | |||
| Régimen de Salud | |||||||||
| Contributivo | 30 (55.6) | 24 (44.4) | 0.02 | 29 (65.9) | 15 (34.1) | 0.802 | 59 (60.2) | 39 (39.8) | 0.052 |
| Subsidiado | 45 (76.3) | 14 (23.7) | 24 (68.6) | 11 (31.4) | 69 (73.4) | 25 (26.6) | |||
| Morfología | |||||||||
| Ductal | 69 (65.7) | 36 (34.3) | 0.715 | 48 (64.9) | 26 (35.1) | 0.165 | 117 (65.4) | 62 (34.6) | 0.226 |
| No ductal | 6 (75.0) | 2 (25.0) | 5 (100.0) | 0 (0.0) | 11 (84.6) | 2 (15.4) | |||
| Estadio | |||||||||
| I-II | 62 (63.9) | 35 (36.1) | 0.134 | 45 (64.3) | 25 (35.7) | 0.140 | 107 (64.1) | 60 (35.9) | 0.036 |
| III-IV | 13 (81.3) | 3 (18.8) | 8 (88.9) | 1 (11.1) | 21 (84.0) | 4 (16.0) | |||
| Metástasis | |||||||||
| Sí | 10 (71.4) | 4 (28.6) | 0.770 | 5 (100.0) | 0 (0.0) | 0.165 | 15 (78.9) | 4 (21.1) | 0.309 |
| No | 65 (65.7) | 34 (34.3) | 48 (64.9) | 26 (35.1) | 113 (65.3) | 60 (34.7) | |||
| Receptores E/P | |||||||||
| Sí | 45 (80.4) | 11 (19.6) | 0.003 | 31 (88.6) | 4 (11.4) | 0.000 | 76 (83.5) | 15 (16.5) | 0.000 |
| No | 30 (52.6) | 27 (47.4) | 22 (50.0) | 22 (50.0) | 52 (51.5) | 49 (48.5) | |||
| Receptores Her2 | |||||||||
| Her2+ | 15 (75.0) | 5 (25.0) | 0.368 | 12 (80.0) | 3 (20.0) | 0.362 | 27 (77.1) | 8 (22.9) | 0.146 |
| Her2 | 60 (64.5) | 33 (35.5) | 41 (64.1) | 23 (35.9) | 101 (64.3) | 56 (35.7) | |||
| Monoterapia | |||||||||
| Sí | 15 (71.4) | 6 (28.6) | 0.587 | 18 (81.8) | 4 (18.2) | 0.08 | 33 (76.7) | 10 (23.3) | 0.112 |
| No | 60 (65.2) | 32 (34.8) | 35 (61.4) | 22 (38.6) | 95 (63.8) | 54 (36.2) | |||
Se empleó el método de Kaplan-Meier mediante comparaciones globales log-rank (Mantel-Cox) en aquellas variables que mostraron diferencias significativas (p < 0.05) en la supervivencia, para lo cual fueron también dicotomizadas estas variables, encontrando que para la edad la supervivencia fue de 63.3 meses (IC 95%: 56.1-70.5) para las de 20 a 59 años y de 81.1 meses (IC 95%: 71.8-90.4) para las de 60 años y más (χ2: 8.001; p = 0.005); para el régimen de salud las diferencias tampoco fueron significativas (χ2: 0.373; p = 0,541): 71.9 meses (IC 95%: 62.6-81.3) para el régimen contributivo y 67 meses (IC 95%: 59.2-74.8) para el régimen subsidiado. Para el estadio las diferencias no resultaron significativas (χ2: 1.587; p = 0.208): 71 meses (IC 95%: 64.4-77.7) para I y II, y 58.8 meses (IC 95%: 43.8-73.7) para III y IV. Para los receptores E/P, si bien la supervivencia fue mayor en las que tenían positiva esta prueba (71.9 meses; IC 95%: 63.7-80.2) frente a las negativas (64.1 meses; IC 95%: 56.4-71.8), las diferencias no fueron significativas (χ2: 1.454; p = 0.228). Al estratificar los datos por tiempo en la atención, las diferencias no fueron significativas en ninguna de las variables, con excepción de la edad (χ2: 7,911; p = 0.005) (Fig. 2). Finalmente, el análisis de regresión logística mostró que las categorías de las variables incluidas en el modelo que mostraron significancia estadística (p < 0.05) fueron: edad menor de 60 años, régimen de salud subsidiado y receptores E/P+ (Tabla 3).
Tabla 3 Variables del modelo de regresión
| Wald | p | OR (IC 95%) | |
|---|---|---|---|
| Estadio I-II | 3.12 | 0.08 | 0.32 (0.09-1.13) |
| Edad: 20 a 59 años | 6.84 | 0.01 | 2.51 (1.26-5.01) |
| Régimen subsidiado | 5.42 | 0.02 | 2.27 (1.14-4.54) |
| Her2+ | 1.76 | 0.18 | 0.42 (0.12-1.51) |
| Receptores E/P+ | 17.06 | 0.00 | 7.10 (2.8-18) |
| Sin metástasis | 0.03 | 0.86 | 0.88 (0.22-3.59) |
| Carcinoma ductal | 1.33 | 0.25 | 0.36 (0.07-2.03) |
| Tiempo de atención<60 días | 0.52 | 0.47 | 0.77 (0.39-1.55) |
| Constante | 1.27 | 0.26 |
IC 95%: intervalo de confianza del 95%; OR: odds ratio.
Discusión
Existen trabajos en el interior del país que describen el comportamiento de la supervivencia por CaMa22-26, pero este es el primero que lo hace en la región caribe colombiana. Los resultados mostraron una supervivencia general del 62.1%, inferior a la de Bucaramanga22, Cali (66.8%)25 y a la del Instituto Nacional de Cancerología (INC)23 (aunque esta fue a dos años), 80.8%, pero superior a la de Manizales26, 51.4%. Por medio de la regresión logística se encontró que las pacientes con menor edad tuvieron menor supervivencia, a diferencia de lo encontrado en países desarrollados como lo reportado por Fredholm et al.27 y en países en desarrollo como lo descrito por Chung et al.28 en donde las pacientes más jóvenes tuvieron peor pronóstico. El porcentaje de mujeres en estadio II (53.2%) fue inferior al descrito por Gutiérrez et al., en Neiva29, 83.3%, pero superior al trabajo de Aguirre et al.30, 25%. Es conocido que el estadio clínico y la supervivencia suelen guardar una relación inversamente proporcional entre sí31. Por otro lado, el grado de avance de la enfermedad podría influir en la selección de casos debido a que es posible que se diagnosticasen más los estadios avanzados; sin embargo, la mayoría de los casos estudiados (86.8%) se encontraban en estadios I y II; pese a ello, llama la atención que hubo una supervivencia mayor para los estadios III y IV.
Se ha documentado que el tipo histológico tiene un significado especial en estudios a corto y largo plazo32. En el presente estudio no se encontró diferencia estadística en la supervivencia según la morfología, de manera semejante a como lo encontraron Acea et al.33. Con respecto a los receptores hormonales E/P+, su presencia suele asociarse con mejor pronóstico34, y en nuestro trabajo, aquellas pacientes positivas a estos receptores tuvieron una supervivencia siete veces mayor (p < 0.05) que las que resultaron negativas a estos marcadores. En 2017, alrededor del 95% de la población colombiana tenía aseguramiento en salud, siendo la cobertura del régimen subsidiado del 45.5%35. Leyes como la 1438 de 201136 y la 1751 de 201537 han propiciado un acceso universal a la atención médica sin distinguir régimen de salud, ya que en el pasado el Plan Obligatorio de Salud del Régimen Contributivo era más completo. Aunque estos cambios legislativos no han sido implementados en su totalidad, se pudo observar en el presente trabajo que las pacientes pertenecientes al régimen subsidiado tuvieron una mejor supervivencia (p < 0.05) al compararlas con las del régimen contributivo, lo cual denota un avance hacia la equidad en la atención.
El tiempo medio entre el inicio del tratamiento y el diagnóstico fue de 99.9 días, valor superior al encontrado en Bogotá por Sánchez et al.12: 75 días. Según otro estudio38 en diferentes ciudades de Colombia, el estrato socioeconómico alto (IV y V), la escolaridad superior al nivel de bachillerato y la afiliación al régimen contributivo son determinantes sociales capaces de explicar las barreras existentes para el acceso y tratamiento oportuno. Como limitante, al utilizar el diseño de «cohorte» de tipo retrospectivo existió la posibilidad de ocurrencia de sesgo de selección, debido a que algunos casos pudiesen haber sido captados a partir del desenlace, pero esto no fue así, ya que cada registro fue analizado a partir de la información obtenida en la institución; sin embargo algunos casos (n = 55) fueron excluidos del análisis por ausencia de información concerniente a las principales variables estudiadas. Así mismo, por falta de información consignada en las bases de datos y en las historias clínicas, no se pudo llevar a cabo la medición de factores diferentes a los estudiados.
Conclusiones
Se encontró una supervivencia diferente a la de otros estudios llevados a cabo en el país, la cual fue significativamente mayor en pacientes jóvenes, afiliadas al régimen subsidiado y con receptores E/P+. El tiempo de atención fue cercano a los tres meses, pero no estuvo relacionada con mejor o peor supervivencia. Con los esfuerzos del sistema de salud y de las instituciones prestadoras de servicio, la supervivencia ha mejorado, lo que muestra en cierta forma el resultado de la eficacia en el tratamiento. Sin embargo, se recomienda, en un siguiente estudio, incluir en el análisis de supervivencia variables de tipo clínico, como el tipo de quimioterapia y esquema recibidos, la presencia de ganglio centinela y si la paciente presenta obesidad y comorbilidades antes y después del diagnóstico; también variables administrativas, como el tiempo entre la sospecha clínica y el diagnóstico histopatológico. Se necesitan intervenciones para reducir retrasos en el inicio del tratamiento, mejorar el cumplimiento de la terapia endocrina y aumentar la adherencia a las guías de tratamiento, principalmente cuando las poblaciones objetivo son de alto riesgo39. Resulta importante poder convocar otras instituciones del país, para llevar a cabo un estudio multicéntrico en que la representatividad de las colombianas sea amplia. También es necesario llevar a cabo estudios orientados a reconocer el papel potencial de las diferencias biológicas en la expresión de los receptores de estrógeno y sensibilidad a la terapia endocrina40, tal como ocurrió con los resultados obtenidos. Por otro lado, es necesario fortalecer las Rutas Integrales de Atención en Salud (RIAS), donde se incorporen actividades individuales y colectivas para la identificación oportuna de factores de riesgo y su intervención, los programas de promoción de la salud y prevención de la enfermedad para la detección precoz y tratamiento oportuno del CaMa.











 text new page (beta)
text new page (beta)