Introducción
Los tumores del sistema nervioso central (SNC) son un problema mundial de salud pública, representan algunos de los tumores malignos más mortales, refractarios al tratamiento e impactantes en la calidad de vida de pacientes y cuidadores1. La incidencia mundial estimada es 10.82 por 100,000 personas cada año, las metástasis intracraneales son hasta 10 veces más comunes que las neoplasias primarias2,3; seguidas en frecuencia por meningiomas y gliomas con incidencia 7.72 y 3.2 por cada 100,000 respectivamente4-6. El glioblastoma (GBM), anteriormente nombrado glioblastoma multiforme por su compleja imagen histológica, representa el tumor primario maligno más común del SNC, constituyendo el 16% de todas las neoplasias primarias intracraneales, pero el 45.6% de los malignos7,8. El lóbulo frontal es su localización más común (25%), seguido por lóbulo temporal (20%), parietal (13%) y occipital (3%)9,10. La sexta edición de la clasificación de tumores del SNC de la Organización Mundial de la Salud (OMS) es la más utilizada, remarcando la histología11. Pueden aparecer en cualquier momento de la vida, aunque su pico de incidencia se encuentra en la sexta década de la vida y su incidencia aumenta drásticamente a partir de los 54 años, en infantes compone una incidencia de 0.15 por cada 100,000 habitantes; con una leve predilección en hombres sobre mujeres (1.3:1) y caucásicos sobre otras razas, aunque mundialmente existe una gran variabilidad de estos datos12. Menos del 20% tiene historia familiar de cáncer definida y menos del 5% presenta mutaciones germinales13. La exposición a radiación ionizante representa el factor de riesgo mejor establecido14. Actualmente se encuentran en estudio como factores de riesgo otros tipos de radiación, como la proveniente de celulares, y la infección de virus oncogénicos15,16. Es de esperar que con el avance de ciencias derivadas de la genética como la radiología genómica se permita una mejor subclasificación y tratamiento personalizado17. La presentación clínica depende de diferentes factores, incluyendo la localización, el tamaño de la masa y las estructuras comprometidas; la sintomatología incluye cefaleas, déficits neurológicos focales y progresivos, además de crisis convulsivas como los síntomas más comunes en la consulta de primera vez18. Aquellos con tumores en el lóbulo frontal pueden sufrir cambios de la personalidad y el estado de ánimo, aquellos con epilepsia tienden a vivir más19. El procedimiento de imagen preferido para el abordaje diagnóstico es la resonancia magnética nuclear contrastada, mientras que la tomografía computarizada es preferible en los casos de urgencia20. El diagnóstico definitivo es por histología21. El tratamiento implica la máxima resección o la obtención de biopsia del tumor cuando esta no es posible (tumores en tallo encefálico), además del uso de radioterapia y quimioterapia. A pesar del tratamiento intensivo, el pronóstico general es malo y la supervivencia media ronda los 15 meses22,23. En pacientes pediátricos que presentan tumores congénitos, el teratoma es el tumor primario más común. Los tumores congénitos se consideran diferentes desde el punto de vista histológico y molecular; algunos provienen de células neuronales, se agrupan como tumores neuroectodérmicos primitivos que representan los malignos más comunes en este grupo24-26. Los meduloblastomas son para los pacientes pediátricos en general las neoplasias primas malignas más comunes, con su pico de incidencia a los 8 años, pudiendo aparecer en adultos; la detección temprana mejora el pronóstico. Los tumores primarios del SNC representan el 9.4% del total de neoplasias, además de mostrarse como el tumor sólido más común y segunda causa de muerte por cáncer en aquellos con 0-19 años27-29. Su conocimiento epidemiológico es necesario, ya que permite un abordaje más personalizado; desgraciadamente no se cuenta con suficientes estudios recientes que aborden las características de los tumores de alto grado dentro de la literatura de habla hispana. Se busca definir las características clínicas y epidemiológicas más importantes.
Metodología
Se realizó un estudio retrospectivo y descriptivo de pacientes dentro de cualquier grupo etario con diagnóstico histológico de tumor primario del SNC de alto grado por medio de una revisión de expedientes clínicos de pacientes con diagnóstico de tumores grado 3 o 4 de la OMS en el periodo de enero de 2016 a diciembre de 2020 utilizando el código de la Clasificación internacional de enfermedades, 10.a edición (C-71), que proporcionó el departamento de estadística del centro. Se obtuvieron datos demográficos, incluyendo variables como sexo, edad, entidad federativa de residencia actual y de origen. Además, se registró la presencia de comorbilidades, síntomas pivote (presentación clínica inicial), síntomas cardinales (síntomas que hicieron ir a consulta), diagnóstico y si fallecieron.
El comité de ética e investigación del instituto de los autores autorizó la difusión, publicación y permiso de análisis de expedientes clínicos con clave de registro MP20-00001. Como criterios de exclusión se incluyó el no haber sido diagnosticado en el tiempo de la revisión, el mal llenado del expediente clínico, la no inclusión de las variables que estudiar, además de no contar con diagnóstico por histología. Para el análisis estadístico se realizó la prueba de Kolmogorov-Smirnov para distribución normal de las variables, las variables continuas fueron representadas mediante media y desviación estándar o mediana e índice intercuartil y las variables categóricas fueron representadas mediante porcentajes. El análisis estadístico se realizó mediante el programa SPSS v26 (SPSS Inc. Software, Chicago, Illinois, EE.UU.). El tamaño mínimo de la muestra de una población a estudiar de 169 casos brindados por el departamento de estadística; que requirió un nivel de confianza del 95%, margen de error del 5% y heterogeneidad del 50%, fue calculado como 105 casos.
Resultados
Se incluyeron 114 casos de tumores primarios de alto grado del SNC. Posterior a la revisión y exclusión de casos, existió una leve predilección por el sexo masculino, encontrándose 64 casos (56.1% una relación 1.3:1), 52 (45.6%) habían fallecido al momento de realizar el estudio y el diagnóstico histológico más común fue el de GBM, seguido por meduloblastoma y ependimoma anaplásico. La localización más común fue el lóbulo frontal, en 37 casos (32.5%), seguido por fosa posterior en 27 casos (23.7%) y en tercer lugar el lóbulo temporal en 14 (12.3%). La gran mayoría tuvo un síntoma pivote por lo menos por 3-6 meses antes de ir a consulta y el más común fue la cefalea holocraneal en 50 pacientes (43.8%), seguido por crisis convulsivas, debilidad muscular y hemiparesia corporal. El síntoma más común que hizo a los pacientes ir a consultar fueron las crisis convulsivas en 23 pacientes (19.9%), seguido por alteración de estado de consciencia en 18 (15.8%), aquellos que iniciaron con convulsiones tardaron menos tiempo en general para buscar atención médica. La mayoría, 70 pacientes (61.4%), no contaban con antecedentes personales no patológicos de importancia, mientras que solo 20 (17.5%) casos tenían historia familiar de cáncer establecida, la mayoría no tenía comorbilidad y 54 (47.4%) recibieron más de tres abordajes terapéuticos con intención curativa (resección, quimioterapia, radioterapia o colocación de válvula de drenaje ventrículo peritoneal), 3 (2.8%) recibieron tratamiento médico paliativo como sedación, uso de esteroides para edema cerebral y anticonvulsivantes (Tabla 1).
Tabla 1 Características de la población
| Variable | N = 114 (%) |
|---|---|
| Hombre | 64 (56.1) |
| Edad* | 19 (8-51) |
| Fallecidos | 52 (45.61) |
| Pediátricos | 26/56 (46.4) |
| Adultos | 26/58 (44.8) |
| Grado OMS | N = 114 (%) |
| 3 | 26 (22.8) |
| 4 | 88 (77.2) |
| Localización tumor | N = 114 (%) |
| Lóbulo frontal | 37 (32.5) |
| Fosa posterior | 27 (23.7) |
| Lóbulo temporal | 14 (12.3) |
| Tallo encefálico | 9 (7.9) |
| Lóbulo parietal | 8 (7.0) |
| Cerebelo | 6 (5.3) |
| Hipotálamo | 4 (3.5) |
| Tálamo | 4 (3.5) |
| Lóbulo occipital | 3 (2.7) |
| Glándula pineal | 2 (1.8) |
| Síntoma pivote | N = 128 (%) |
| Cefalea holocraneana | 56 (43.75) |
| Convulsiones | 18 (14.06) |
| Debilidad muscular | 9 (7.03) |
| Hemiparesia corporal | 9 (7.03) |
| Náuseas y/o vómitos | 8 (6.25) |
| Cefalea hemicraneana | 6 (4.68) |
| Alteración estado de alerta | 5 (3.9) |
| Síndrome cerebeloso | 5 (3.9) |
| Ataxia | 3 (2.34) |
| Irritabilidad | 3 (2.34) |
| Tinnitus | 3 (2.34) |
| Trombosis venosa profunda | 3 (2.34) |
| Número de síntomas pivote por paciente | N = 114 (%) |
| 1 | 100 (87.7) |
| 2 | 12 (10.5) |
| 3 | 2 (1.8) |
| Síntomas cardinales | N = 146 (%) |
| Convulsiones | 29 (19.86) |
| Alteración estado de alerta | 23 (15.75) |
| Hemiparesia corporal | 20 (13.69) |
| Cefalea holocraneana | 13 (8.9) |
| Síndrome cerebeloso | 12 (8.21) |
| Parálisis facial | 9 (6.16) |
| Ataxia | 7 (4.79) |
| Náusea y/o vómitos | 5 (3.42) |
| Debilidad muscular | 5 (3.42) |
| Alteración visión | 3 (2.05) |
| Otros | 20 (13.68) |
| Número de síntomas cardinales por paciente | N = 114 (%) |
| 1 | 88 (77.2) |
| 2 | 20 (17.5) |
| 3 | 6 (5.3) |
| Antecedentes personales no patológicos | N = 114 (%) |
| Tabaquismo | 25 (21.92) |
| Alcoholismo | 19 (16.66) |
| Ninguno | 70 (61.4) |
| Historia familiar de cáncer | N = 114 (%) |
| Sí | 20 (17.5) |
| No | 94 (82.5) |
| Comorbilidades | N = 129 (%) |
| Ninguna | 74 (57.36) |
| Hipertensión arterial sistémica | 21 (16.27) |
| Diabetes mellitus tipo 2 | 14 (10.85) |
| Enfermedad psiquiátrica previa | 10 (7.75) |
| Tratamiento neoplasia | N = 289 (%) |
| Resección completa | 104 (35.98) |
| Radioterapia | 17 (5.88) |
| Quimioterapia | 59 (20.41) |
| Colocación válvula de drenaje ventrículo | 75 (25.95) |
| Peritoneal | |
| Resección parcial | 26 (8.99) |
| Médico paliativo | 8 (2.76) |
| Número de tratamientos por paciente | N = 114 (%) |
| 0 | 3 (2.6) |
| 1 | 28 (24.6) |
| 2 | 29 (25.4) |
| 3 | 37 (32.5) |
| 4 | 17 (14.9) |
OMS: Organización Mundial de la Salud.
*Uso de mediana, cuartil 1 y cuartil 3 para representar datos
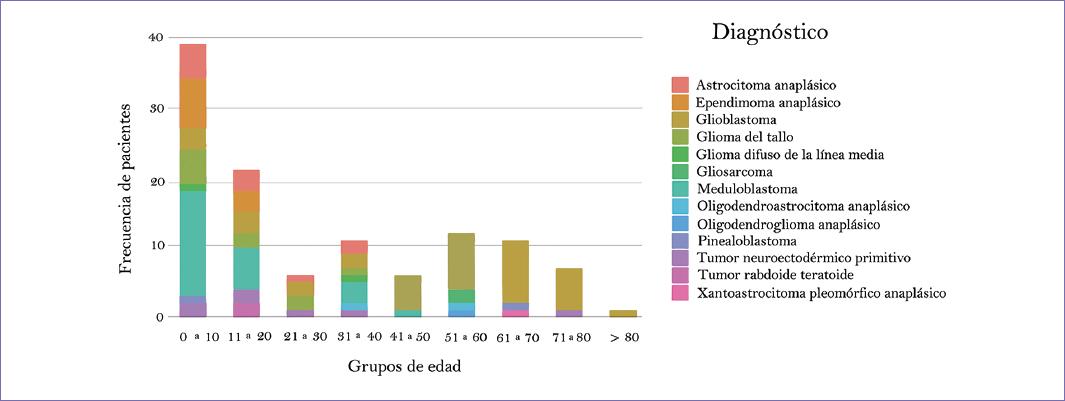
La edad promedio en pacientes pediátricos fue de 8 años, mientras que en adultos fue de 51 años; se encontraron 56 tumores de alto grado en pediátricos y 58 en adultos; en ambos grupos la mayoría fue de sexo masculino, el tumor de adultos más común fue el GBM en 35 (60.3%) casos; en pediátricos fueron 4 (7.1%) casos, la mayoría de tumores pediátricos fueron meduloblastoma en 20 (35.7%) pacientes, mientras que en adultos estos fueron 5 (8.6%); el ependimoma anaplásico, que representó el tercer tumor más frecuente, fue exclusivo de pacientes pediátricos (Fig. 1).
Los pacientes pediátricos tuvieron más tumores grado 3, 20 (35.7%) frente a 6 (10.3%) de adultos. El lóbulo frontal fue el más afectado en adultos, en 31 (53.9%) de estos, mientras que fosa posterior en pediátricos en 23 (41.1%), el síntoma pivote más común en pediátricos y adultos fue la cefalea (48.4 y 38.2%), seguido por debilidad muscular e irritabilidad en adultos. Las crisis convulsivas también fueron la presentación que más llevó a pacientes a consultar (23.4% en pediátricos y 17.7% en adultos); seguido por alteración de estado de alerta en pediátricos y hemiparesia corporal en adultos. Los adultos presentaron en un 27.6% más de un síntoma cardinal para ir a consultar, frente al 17.9% de los pediátricos, solo un pediátrico presentó tres síntomas, frente a cinco adultos (Tabla 2).
Tabla 2 Comparación población pediátrica y adulta
| Pediátricos (< 18 años) N = 56 (%) | Adultos (≥ 18 años) N = 58 (%) | |
|---|---|---|
| Hombre | 32 (57.14) | 32 (55.17) |
| Edad* | 8 (5-11.75) | 51 (35.5-62.25) |
| Fallecimientos | 26 (46.4) | 26 (44.8) |
| Diagnóstico | ||
| 1. Glioblastoma | 4 (7.1) | 35 (60.3) |
| 2. Meduloblastoma | 20 (35.7) | 5 (8.6) |
| 3. Ependimoma anaplásico | 10 (17.9) | 0 (0) |
| Grado OMS | ||
| 3 | 20 (35.7) | 6 (10.3) |
| 4 | 36 (64.3) | 52 (89.7) |
| Tumor localización | ||
| 1. Frontal | 9 (17.9) | 32 (53.9) |
| 2. Fosa posterior | 23 (41.1) | 4 (6.9) |
| 3. Temporal | 3 (5.4) | 7 (13.6) |
| Síntoma pivote | N = 62 (%) | N = 68 (%) |
| Cefalea holocraneana | 30 (48.38) | 26 (38.23) |
| Convulsiones | 2 (3.22) | 4 (5.88) |
| Debilidad muscular | 13 (20.96) | 6 (8.82) |
| Irritabilidad | 0 (0) | 9 (13.23) |
| Síntoma cardinal | N = 67 (%) | N = 79 (%) |
| 1. Cefalea holocraneana | 4 (5.97) | 9 (11.39) |
| 3. Convulsiones | 15 (23.38) | 14 (17.72) |
| 4. Alteración estado de alerta | 13 (19.4) | 10 (12.65) |
| 5. Vómitos y/o náuseas | 3 (4.48) | 4 (5.06) |
| 6. Tinnitus | 0 (0) | 1 (1.26) |
| 7. Síndrome cerebeloso | 8 (11.94) | 4 (5.06) |
| 8. Debilidad muscular | 0 (0) | 5 (6.32) |
| 9. Hemiparesia corporal | 4 (5.97) | 16 (20.25) |
| Número de síntomas cardinales | ||
| 1 | 46 (82.1) | 42 (72.4) |
| 2 | 9 (16.1) | 11 (19) |
| 3 | 1 (1.8) | 5 (8.6) |
| Antecedentes | ||
| Tabaquismo | 2 (3.57) | 23 (39.65) |
| Alcoholismo | 0 (0) | 20 (34.48) |
| Nada | 53 (94.64) | 19 (32.75) |
| Historia familiar de cáncer | 9 (16.1) | 11 (19) |
| Tratamiento | N = 158 (%) | N = 131 (%) |
| 1. Resección | 60 (37.97) | 44 (33.58) |
| 2. Resección parcial | 9 (5.69) | 8 (6.1) |
| 3. Quimioterapia | 27 (17.08) | 32 (24.42) |
| 4. Radioterapia | 38 (24.05) | 37 (28.24) |
| 5. Colocación válvula de drenaje ventrículo peritoneal | 20 (12.65) | 6 (4.58) |
| 6. Médico paliativo | 4 (2.53) | 4 (3.05) |
| Número de tratamientos | ||
| 0 | 2 (3.6) | 1 (1.7) |
| 1 | 13 (23.2) | 15 (25.9) |
| 2 | 18 (32.1) | 11 (19) |
| 3 | 9 (16.1) | 28 (48.3) |
| 4 | 14 (25) | 3 (3.2) |
OMS: Organización Mundial de la Salud.
*Mediana, cuartil 1 y 3 para presentar datos.
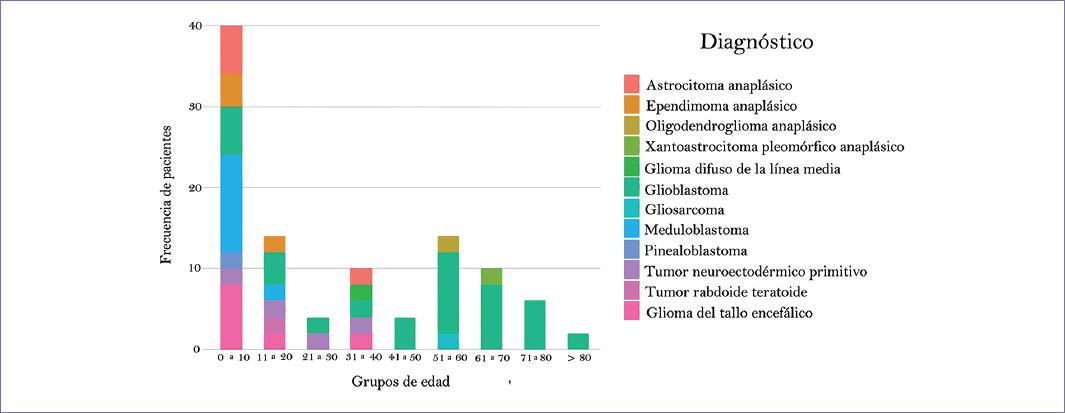
El tumor más mortal a partir de los 10 años fue el GBM en todos los grupos etarios, mientras que en el grupo de 0-10 años el meduloblastoma ocupó este lugar (Fig. 2).
Los tumores que también se encargaron de representar mayor estancia hospitalaria fueron el meduloblastoma y el GBM (Fig. 3).
Discusión
En el estudio de Jaime Guevara et al.30 realizado en el 2003 se abordó un seguimiento de 10 años y estudiaron 151 pacientes, incluyendo a gliomas de bajo grado. Se demostró que después de los 70 años de edad, la mayoría son tumores malignos (87.5%) comparado con este, donde se encontró que adultos en general tenían menos tumores de grado 3 y que prácticamente todos eran grado 4 a partir de edades superiores, además de resaltar la falta de estudios epidemiológicos sobre tumores del SNC en México, otros hallazgos similares fueron la mayoría de sexo masculino, el GBM como tumor maligno más frecuente y la sintomatología clínica para acudir a consulta. A su vez mostraron una mortalidad superior, un 56.4% que se puede atribuir al tiempo de 10 años. Hernández et al.31, con datos de los años 2000-2006, analizaron los datos obtenidos de un centro sobre el GBM en 120 pacientes, de estos, 4 fueron pediátricos, que en este caso representó un 3.3% de su población, mientras que en nuestro estudio hubo 4 pediátricos con GBM, que representó el 10.3% de los 39 GBM totales, mostraron una predisposición masculina, cefalea como manifestación clínica más frecuente sin especificar si fue el síntoma que los hizo buscar atención médica o el tiempo que llevaban con este, mostraron predilección por lóbulo frontal y temporal, la localización de tálamo y lóbulo occipital fueron raras, el 58.3% de su población recibió resección y radioterapia y el 12.5% triple terapia con resección, radioterapia y quimioterapia, ellos también reportaron dos gliosarcomas en su estudio. Mujtaba et al.32 estudiaron tumores de alto grado durante 5 años en un centro de la India, en 226 pacientes, mostrando mayor predisposición del sexo masculino, el grupo de edad más común fue 41-50 años (en nuestro caso fue 51-60 años) con un 11.9% representando el grupo menor de 20 años, en nuestro caso, los pediátricos representaron casi la mitad, su paciente más joven tenía 12 años, mientras que nosotros reportamos pacientes que iban desde 0 años; los síntomas más comunes reportados fueron dolor de cabeza, vómitos y debilidad o fatiga, el tumor predominante fue el GBM, seguido por oligodendroastrocitoma y oligodendroglioma, que en nuestro caso representaron el 2.7% frente al 15% de ellos. En la Universidad La Sapienza, en Roma, se mostró como edad promedio de aparición de tumor maligno primario los 57 años, siendo la mayoría hombres33. En un estudio a largo plazo, 35 años, en Navarra, España, se estudiaron 1,175 tumores de alto grado, la mayoría fueron hombres y aproximadamente el 10% pediátricos, el grupo de edad principal fue 55-64 años; los gliomas fueron la neoplasia más común, seguido por inespecíficos y embrionarios34. Se muestra la variabilidad morfológica que existe dentro de los diferentes sitios geográficos mencionados, de importancia es mencionar que la población estudiada pertenece en su totalidad al área metropolitana de Monterrey, se observa además la importancia de prestar atención a los síntomas que algunos consideran benignos como la cefalea, insistiendo principalmente en las red flags de esta misma, se ha reconocido la importancia de encontrar estos tumores de manera temprana para mejorar la supervivencia y es de recalcar que al momento de abordar el segundo y tercer lugar en frecuencia en adultos y pediátricos estos muestran variación, se puede observar la importancia general que tienen estos al mencionar los días de estancia, algunos superando 50 días o 100 días representando un golpe a la economía y al desarrollo biopsicosocial en un solo internamiento. El insistir en el abordaje terapéutico intensivo cuando sea pertinente es necesario además de mencionar la necesidad que existe en la población latinoamericana de estudios epidemiológicos más especializados como prospectivos y que se basen en ramas emergentes de la medicina, buscando clasificación morfológica, pero a su vez una tipificación genética y/o molecular. Limitaciones: no contar con escalas de funcionalidad, no contar con mortalidad exacta, el tiempo de 5 años por ser el tiempo de almacenaje de expedientes (un estudio prospectivo es necesario). Es de resaltar dentro de las fortalezas de este estudio la clasificación histológica precisa, uso de conceptos de síntoma cardinal, pivote y la duración; y la inclusión de todos los de alto grado.











 text new page (beta)
text new page (beta)