Introducción
Los paragangliomas extraadrenales surgen del sistema simpaticoadrenal, clasificándose según el sitio de origen primario. Los paragangliomas de cabeza y cuello son tumores poco frecuentes, benignos, con inervación parasimpática, que comprenden el 0.03% de todos los tumores humanos y menos del 0.5% de todos los tumores de cabeza y cuello, con una incidencia anual del 0.001%1.
Se presentan dos casos de mujeres con glomus carotídeo proveniente de la zona alta andina, ubicada en la región Junín del Perú, ambas tratadas el 2020, solo con irradiación externa en esquema fraccionado convencional. Además, se revisa la literatura al respecto.
Reporte de casos
Caso 1
Mujer de 26 años, nacida y proveniente de la ciudad de Huancayo, que se ubica a 3,259 msnm. Con tiempo de enfermedad de 36 meses, caracterizado por una masa de crecimiento lento a nivel de la región cervical derecha, de consistencia dura, asociado a dolor tipo hincada. Acude el 2020, evidenciándose la masa de 5 cm de longitud, de consistencia dura. Se realiza tomografía helicoidal multicorte (TEM) contrastada con secuencia de angiotomografía (angiotem), evidenciándose tumoración a nivel de la bifurcación carotídea de 5 x 3.5 cm, con realce en la fase arterial. Es evaluada por el servicio de cabeza y cuello, catalogándose como Shamblin III (Figs. 1 y 2), y se deriva al servicio de radioterapia. Se programa radioterapia externa a dosis de 4,600 cGy en 23 sesiones a nivel de tumoración cervical derecha. Se delimita el GTV (gross tumor volume), como la tumoración grosera en la secuencia contrastada de la tomografía; y se define el PTV (planning target volume), como el producto de la expansión simétrica de 0.5 cm del GTV. Se realizan dos planificaciones, una en técnica tridimensional (3D) y otra en técnica de arco volumétrico modulado (VMAT), ambos realizados en el sistema de planificación Mónaco, que utiliza el método de Monte Carlo (Fig. 3). La paciente recibe la irradiación, teniendo como efectos adversos durante el tratamiento sequedad a nivel de cavidad oral. A los seis meses de seguimiento, presenta enfermedad estable.
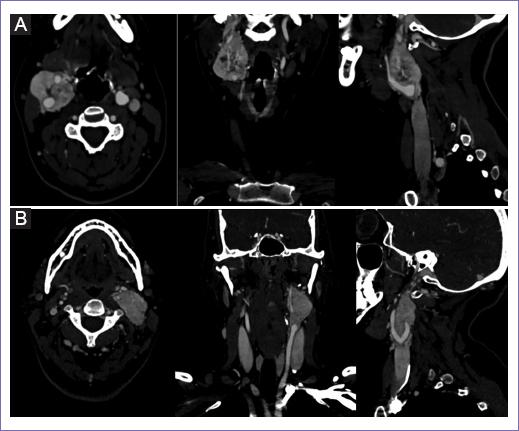
Figura 1 Imágenes de tomografía helicoidal multicorte. A: angiotomografía de paciente mujer de 26 años. A nivel de la bifurcación de la carótida derecha, se evidencia masa que mide 5 x 3.5 x 3 cm, separa ampliamente la carótida interna y externa, con realce en la fase arterial. B: angiotomografía de paciente mujer de 42 años. Lesión expansiva hipervascularizada a nivel de la bifurcación de la carótida común izquierda, mide 3.6 x 2.4 x 4.4 cm de diámetro transversos y cefalocaudal respectivamente, engloba la carótida interna, contacta y desplaza la carótida externa.
Caso 2
Mujer de 42 años, nacida y proveniente de la ciudad de Huancayo. Con tiempo de enfermedad de 16 meses, caracterizado por sensación de masa con crecimiento lento a nivel de la región cervical izquierda, de consistencia dura. Acude el 2020, evidenciándose la masa a nivel del triángulo carotídeo, de consistencia dura y pulsátil. Se realiza TEM contrastada con secuencia de angiotem, evidenciándose una lesión expansiva hipervascularizada a nivel de la bifurcación de la carótida común izquierda de 3.6 x 4.4 cm. Es evaluada por el servicio de cirugía de cabeza y cuello, y se cataloga como lesión Shamblin III (Figs. 1 y 4). Se la deriva al servicio de radioterapia. Se programa radioterapia externa a dosis de 4,600 cGy en 23 sesiones a nivel de tumoración cervical derecha. Se delimita el GTV, como la tumoración grosera en la secuencia contrastada de la tomografía; y se define el PTV, como el producto de la expansión de 0.5 cm alrededor del GTV. Se realizan dos planificaciones, una en técnica 3D y otra en técnica VMAT (Fig. 5). La paciente recibe la irradiación, teniendo como efectos adversos durante el tratamiento sequedad a nivel de cavidad oral. A los cinco meses de seguimiento, presenta enfermedad estable.
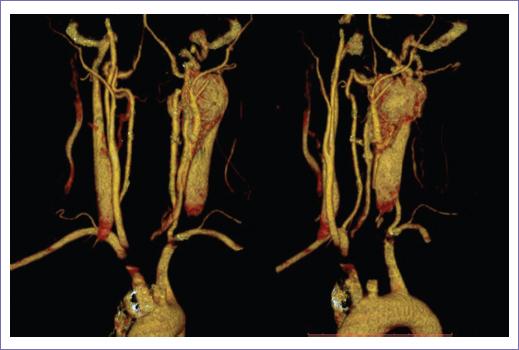
Figura 4 Reconstrucción tridimensional del caso 2, se evidencian el glomus del cuerpo carotídeo derecho contactando más de 270° en la carótida interna, compatible con Shamblin III.
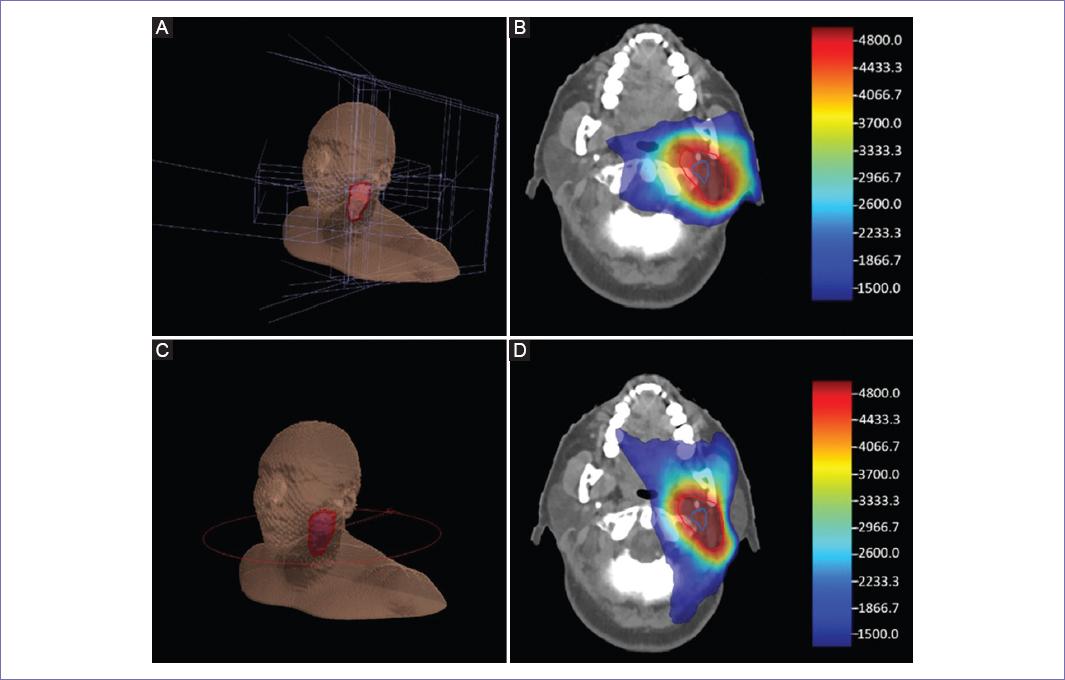
Figura 5 Planificaciones del caso 2. A: planificación tridimensional con cinco haces de entrada en ángulo 30°, 60°, 90°, 120° y 150°. B: curvas dosimétricas en planificación tridimensional. C: planificación de arco volumétrico modulado (VMAT) con un arco de 360°. D: curvas dosimétricas en planificación VMAT.
Discusión
Los paragangliomas pertenecen a los tumores neuroendocrinos y tienen un origen ectodérmico (cresta neural). Estas células paraganglionares pertenecen al sistema extraadrenal y neuroendocrino, y están ubicadas junto a los vasos sanguíneos y nervios. Funcionan como un quimiorreceptor directamente sensible a los cambios arteriales de presión de oxígeno y de dióxido de carbono. También, aunque indirectamente, es sensible a cambios de pH y temperatura, induciendo cambios reflejos en la actividad vasomotora y respiratoria2,3. La localización en la región de la cabeza y cuello representa el 3% de todos los paragangliomas en el cuerpo. Aunque la mayoría de estos son esporádicos, no se puede descartar por completo una predisposición familiar1. Se describe que las mutaciones de la línea germinal de SDHB, SDHD, VHL y RET están involucradas en el feocromocitoma familiar4. Estos tumores tienen un curso indolente con un patrón de crecimiento progresivo variable que va desde ser asintomáticos y diagnosticados incidentalmente en exámenes de imágenes, hasta producir parálisis de pares craneales y compresión del tronco encefálico.
Son cuatro las localizaciones del desarrollo del glomus particularmente comunes: 1) la región del ganglio inferior (ganglio nodoso) y la porción cervical del nervio vago (glomus vagale o tumor del cuerpo vagal); 2) la bifurcación carotídea (tumor del cuerpo carotídeo); 3) la cavidad del oído medio (tumor del glomus tympanicum), y 4) la región del bulbo yugular (tumor del glomus yugular)5. Las líneas siguientes nos enfocaremos en la revisión sobre la fisiopatología, diagnóstico y manejo del glomus del cuerpo carotídeo (GCC).
El GCC fue descrito en 1743 por von Haller6, corresponde aproximadamente a tres cuartos de todos los paragangliomas (60-78%), son de baja frecuencia, con una incidencia de 1:30,000 a 1:100,000 personas1. Su etiología estaría relacionada con la hipoxia crónica y mutaciones en los genes relacionados con la oxemia. Es interesante que estos tumores se observen en personas que viven a gran altura o que se encuentran en un estado hipóxico crónico. Existe una clara asociación entre la altitud y su aparición, observándose una mayor incidencia en poblaciones que habitan por encima de los 2,000 metros sobre el nivel del mar (msnm). En Bolivia se reporta una prevalencia de 1 en 1,000 a una altura de 3,000 msnm. Las estimaciones en el Perú indican que son aproximadamente 10 veces más frecuentes en altitudes elevadas que a nivel del mar. Se establece la hipoxia crónica como factor de riesgo; por situaciones patológicas de baja oxigenación tisular, como enfermedad pulmonar obstructiva crónica o cardiopatías con bajos niveles de oxigenación de la hemoglobina2,7-9. Ocurren predominantemente en el sexo femenino, con una relación 1.5:8.3, y después de la quinta década de vida; la presentación clínica habitual es una masa cervical lateral, de carácter asintomático y crecimiento lento, detrás del ángulo mandibular, en el triángulo anterior del cuello. La manifestación bilateral y el crecimiento multilocular son más comunes en las ocurrencias hereditarias, mientras que la ocurrencia esporádica se caracteriza principalmente por una manifestación predominantemente unilateral y solitaria2. En el GCC a menudo existe una masa no dolorosa que sobresale hacia afuera. Debido a la lenta tasa de crecimiento, los tumores son identificados principalmente por el paciente y no por el médico. El tiempo promedio para hacer un diagnóstico correcto suele ser de uno a tres años2. Entre los síntomas clínicos más comunes son: la resistencia a la presión, sensación de zumbidos en la zona del cuello, parálisis de un par craneal, síndrome de Horner, disfagia, bradicardia, síncope, infecciones recurrentes de las vías respiratorias superiores y accidentes cerebrovasculares. Durante el examen clínico, el GCC se puede desplazar en el plano horizontal, mientras que el desplazamiento en el eje vertical no es posible por la fijación en el espacio carotídeo (signo de Fontaine). También se puede palpar o escuchar un zumbido sobre el tumor, debido al alto flujo sanguíneo y las derivaciones arteriovenosas existentes2,3. Estos hallazgos son compatibles con ambas pacientes.
La extensión y la localización de los GCC generalmente se pueden demostrar en la ecografía, especialmente en relación con las mediciones de flujo. La TEM permite evidenciar la localización exacta y extensión, así como las erosiones e infiltraciones óseas. Después de la administración del medio de contraste, se produce un enriquecimiento fuerte y homogéneo del medio de contraste debido a la estructura densa de los vasos. Debido al alto volumen de la derivación, la vena yugular a menudo se contrasta al principio. La resonancia magnética puede detectar GCC pequeños, que no son detectados en la TEM. Además, la infiltración de las paredes de los vasos de la arteria carótida interna o la vena yugular interna a menudo se puede detectar con dicho estudio; son hipointensas en las imágenes ponderadas en T1, y de intermedia a hiperintensa en las imágenes ponderadas en T2. También existe la posibilidad de diagnóstico mediante gammagrafía con 131 metayodobencilguanidina2,10. En ambas pacientes con la angiotem se logró caracterizar la lesión de cuerpo carotídeo.
El diagnóstico diferencial debe realizarse con tumores neurogénicos dependientes del par craneal vago o sistema simpático (estos presentan captación, sin embargo, no es temprana), tumores de glándulas salivares, adenopatías metastásicas y, más infrecuente, hemangiopericitoma parafaríngeo.
Según la extensión, invasión de las estructuras vecinas y las complicaciones de una extirpación, Shamblin propuso la siguiente clasificación:
- Tipo I: tumor de pequeño tamaño, usualmente menor a 4 cm, fácilmente resecable.
- Tipo II: tumor de tamaño medio, usualmente mayor a 4 cm, rodea la carótida interna o externa sin englobarlas y está más adherido, sin embargo, existe un plano de disección entre el tumor y el vaso.
- Tipo III: tumor voluminoso, que engloba las carótidas, con posibilidad de resección de la carótida para su excisión11. En ambas pacientes la lesión contactaba más de 270° de la carótida interna, siendo compatible con Shamblin III.
Esta clasificación permite orientar la opción de manejo quirúrgico. Para los GCC de tipo I y II, la cirugía parece una opción de tratamiento viable. Para los GCC de tipo III, la morbilidad en términos de déficit de pares craneales y complicaciones es considerable; en particular, el uso de la manipulación y reconstrucción de la arteria carótida interna y, potencialmente, la ligadura de la arteria carótida externa, parecen ir acompañadas de una alta incidencia de accidentes cerebrovasculares12.
Los avances en las técnicas microquirúrgicas, las tecnologías en imágenes para la navegación intraoperatoria, la embolización preoperatoria y los dispositivos de monitorización perioperatoria han mejorado enormemente los resultados quirúrgicos de los paragangliomas. Como resultado, para muchos pacientes la resección quirúrgica es ahora una opción más segura y razonable en comparación con años anteriores. Sin embargo, la cirugía para los tumores del cuerpo carotídeo tiene como consecuencia el deterioro de los nervios craneales hasta en un 10% de los casos1. Debido a este riesgo, la resección subtotal conservando la función neurológica y seguida de radiocirugía o radioterapia postoperatoria se ha adoptado como el tratamiento estándar para muchos tumores grandes13. La radiocirugía estereotáctica (SRS) ha desempeñado un papel cada vez más importante en el tratamiento de estos tumores, como un abordaje inicial o como rescate después de una resección incompleta.
Los tumores glómicos se consideran tumores radiosensibles y la radioterapia convencional ha demostrado tasas de control tumoral en el grupo de tumor de glomus yugular, que oscilan entre el 86 y el 97%14,15. El proceso de radioterapia fraccionada incluye una expansión del volumen total del tumor para tener en cuenta las incertidumbres técnicas y posicionales durante la administración de radioterapia. Esto significa que incluso cuando se utilizan técnicas avanzadas como la radioterapia de intensidad modulada o la terapia de arco volumétrico modulado (generada mediante aceleradores lineales), el volumen de tratamiento planificado que recibe la dosis prescrita siempre supera el volumen bruto del tumor e incluye tejido normal. Como resultado, los nervios craneales adyacentes y las estructuras vasculares críticas reciben dosis de radiación similares a las del tumor. Esto ha llevado a muchos radiooncólogos a optar por esquemas de fraccionamiento, para reducir el riesgo de toxicidad de las estructuras normales13.
Henzel, et al. informaron un control del tumor local del 100% durante un periodo de cinco años sin indicios de toxicidad grave (grado 3 o 4)16, mientras que Hinerman, et al. reportaron en 104 pacientes con 121 paragangliomas, con 24 ubicados en el cuerpo carotídeo, que el 82.6% fueron tratados con fraccionamiento convencional, ya sea con técnicas 3D o radioterapia de intensidad modulada (IMRT), y lograron una tasa de control local a 10 años del 94%17. Otros estudios han informado que el control local del tumor varía entre el 80 y el 100% cuando se administran dosis de radiación de 45 a 50 Gy en 20 a 30 fracciones, siendo administrada de 180-200 cGy por sesión, durante un periodo de cinco semanas2,13.
Los paragangliomas de cabeza y cuello pueden tratarse con éxito con cirugía, radioterapia fraccionada o SRS, según la extensión de la enfermedad y el estado general del paciente. La elección del tratamiento depende de la ubicación y extensión del tumor, la presencia de múltiples tumores, la edad y la salud del paciente y las preferencias del paciente y del médico. Con el advenimiento de técnicas más conformadas, la IMRT y la radioterapia estereotáctica fraccionada (SRF) se han convertido en los métodos de tratamiento de elección. Este último se prefiere en la mayoría de los casos debido a la dosis integral más baja y la homogeneidad de la dosis mejorada en comparación con la IMRT.
La principal limitación de la radiocirugía con gamma knife en el tratamiento de los paragangliomas está relacionada con la ubicación del tumor. Este no es ideal para tumores glómicos extracraneales extensos, como tumores del cuerpo del nervio vago y GCC, debido a las limitaciones de la inmovilización del paciente13. Si en estas localizaciones está contraindicada la resección quirúrgica, está indicada la SRS o SRF con Cyberknife o acelerador lineal (LINAC); y si en el centro de radioterapia no está disponible la tecnología para hipofraccionamientos extremos, se brindará radioterapia externa fraccionada convencional con LINAC.
En las últimas décadas, con la mejora de la precisión y verificación de la zona de irradiación, la IMRT, la VMAT y la SRF se han convertido en las técnicas de elección18, ya que permiten la reducción del daño colateral de irradiación al tejido sano circundante. Se compara cuatro planes de tratamiento, siendo los cuatro realizados en el sistema de planificación Mónaco. De los cuales son dos planes en técnica 3D y dos planes en técnica VMAT a partir de los dos casos.
En el caso del GCC derecho: en el plan de técnica 3D vs. técnica VMAT, en la cavidad oral, se incrementa la dosis media de 9.1 a 19.5 Gy, con valores similares en la dosis máxima de 45.9 a 44.5 Gy; en la glándula parótida ipsilateral se reduce la dosis media de 47.5 a 23.1 Gy, con valor similar en la dosis máxima de 54.1 a 55.9.3 Gy; en la glándula submaxilar contralateral disminuye la dosis media de 19.1 a 10.3 Gy, la dosis máxima de 27.9 a 15.6 Gy; en la médula espinal disminuye la dosis media de 28.5 a 16.1 Gy, la dosis máxima de 40.8 a 26.9 Gy; en el músculo constrictor se reduce la dosis media de 36.3 a 24.6 Gy, la dosis máxima con valores similares de 47.2 a 48.9 Gy (Fig. 3).
En el caso del GCC izquierdo: en el plan de técnica 3D vs. técnica VMAT, en la cavidad oral se incrementa la dosis media de 10 a 15 Gy, la dosis máxima con valores similares de 34.7 a 34.0 Gy; en la glándula parótida ipsilateral se reduce la dosis media de 34.5 a 17.9 Gy, pero un incremento en la dosis máxima de 51.5 a 57.3 Gy; en la glándula submaxilar contralateral se reduce la dosis media de 14.9 a 6.9 Gy, la dosis máxima de 19.5 a 14.5 Gy; en la médula espinal se reduce la dosis, la media de 16.9 a 10.9 Gy, la dosis máxima de 26.6 a 19.5 Gy; en el músculo constrictor se reduce la dosis media de 23.9 a 16.3 Gy, la dosis máxima con valores similares de 47.7 a 48.5 Gy (Fig. 5).
Ambas técnicas obtuvieron una cobertura y conformación tumoral similar, pero es evidente los mejores resultados dosimétricos por la marcada reducción de irradiación colateral en los órganos de riesgo cercanos al PTV en la técnica VMAT, comparándola con la técnica 3D. Los beneficios potenciales del VMAT no se limitan a una disminución de la toxicidad, sino que además deberían traducirse en una mejor adherencia durante el tratamiento. Sin embargo, una desventaja conocida del VMAT en comparación con la 3D es el aumento de volumen de dosis dispersa, contribuyendo al riesgo potencial de tumores secundarios19.
En nuestro centro no se cuenta con un equipo que brinde radiocirugía, sin embargo, se utiliza la mejor técnica disponible para el paciente, al ser una tumoración benigna, ya que si en este momento no preservamos los órganos de riesgo cercanos, los pacientes se encontrarán con importantes efectos secundarios permanentes después de la terapia. Existe pocos estudios que evalúen la toxicidad tardía por irradiación a partir de los tres años. Sin embargo, el desarrollo de xerostomía, disfagia y fibrosis del cuello, son los efectos adversos que afectan la calidad de vida. Incluso en pacientes que recibieron dosis biológica equivalente a 40 Gy o mayores a nivel cervical, estos presentaron algún grado de disfagia, xerostomía y fibrosis de cuello, los resultados a los cuatro años fueron del 38.3, 71.3 y 57.7% respectivamente, mientras que los resultados a los ocho años fueron del 48.2, 66 y 68.4% respectivamente20,21. Esto demuestra la necesidad de preservar el tejido sano con la mejor técnica de irradiación disponible en los centros de radioterapia.











 text new page (beta)
text new page (beta)




