Introducción
El tumor de células gigantes de hueso (TCG) es una de las neoplasias óseas poco frecuentes y menos predecibles en cuanto a comportamiento, ya que prácticamente todos los tumores óseos contienen células gigantes. La principal localización de estas lesiones es en la periferia de la rodilla hasta en un 50% de los casos, seguido del segmento proximal del húmero, fémur y región distal de la tibia. En muy raras ocasiones se afectan los huesos planos como el sacro y la pelvis.
Se ha descrito en la literatura médica el termino hemicorporectomía (HC) como el procedimiento en el que se realiza la amputación de la pelvis por desarticulación a través de la columna vertebral, previa transección de la aorta, vena cava inferior y médula espinal, así como la creación de conductos para derivación urinaria y del tubo digestivo.
Originalmente la técnica fue descrita por Kredel en 1950, sin embargo, el primer reporte de la realización de este procedimiento fue comentado por Kennedy, et al. en 1960.
Hasta el 2008 se reportaron 57 casos en la literatura mundial, no existen reportes en la literatura médica en México. Presentamos el primer caso de amputación translumbar (AT) realizado en nuestra unidad hospitalaria, se trata también del primer caso de células gigantes en topografía del sacro tratado mediante este procedimiento radical en nuestro país.
Reporte de caso
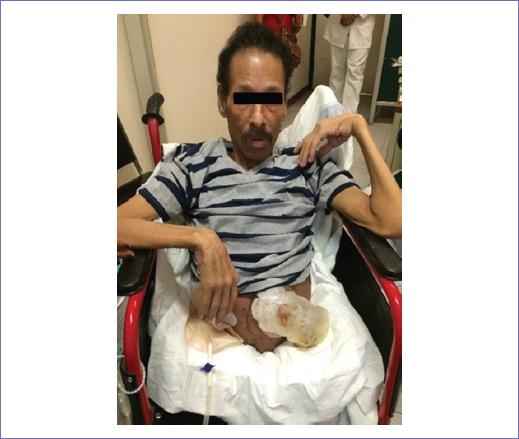
Hombre de 50 años de edad, con historia de 11 meses de evolución, caracterizada por dolor lumbar, parestesias en miembros pélvicos y pérdida progresiva de la fuerza muscular. En los últimos seis meses, exacerbación del cuadro. Inicialmente fue valorado fuera de la institución, documentándose tumor de sacro por tomografía. Se tomó biopsia, que reveló un TCG, se consideró no candidato a tratamiento quirúrgico y se le suministraron dos ciclos de quimioterapia con doxorubicina y dacarbazina, con nula respuesta y morbilidad hematológica, aunándose dolor pélvico de difícil control. Dos meses antes de la valoración en nuestra unidad presentó paraparesia y pérdida de control de esfínteres, incremento del dolor y escaras por decúbito prolongado. Ingresa a la unidad en malas condiciones generales, desnutrición y dolor refractario al manejo con múltiples esquemas analgésicos, por clínica y tomografía franca progresión del tumor con infiltración a tejidos blandos de la pelvis, exteriorización del tumor en diversos sitios de la pelvis; por tomografía, tumor central con evidente destrucción del sacro, infiltración a recto, vejiga y afectación de ambas articulaciones sacroiliacas, extensión hasta L2 (Fig. 1 A y B). Se realiza resonancia magnética, que corrobora los mismos hallazgos.
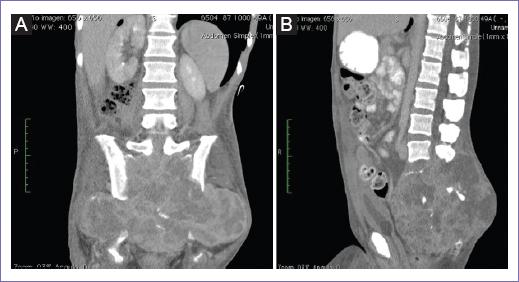
Figura 1 A: tomografía, tumor central con evidente destrucción del sacro, infiltración a recto, vejiga y afectación de ambas articulaciones sacroiliacas, extensión hasta L2. Corte coronal. B: tomografía, tumor central con evidente destrucción del sacro, infiltración a recto, vejiga y afectación de ambas articulaciones sacroiliacas, extensión hasta L2. Corte sagital.
Evaluación preoperatoria
Se inicia manejo de forma multidisciplinaria, control analgésico por clínica del dolor, corrección del estado nutricional y metabólico por el Departamento de Nutrición (suministración de nutrición parenteral), manejo local y sistémico de la sepsis (Servicio de Cirugía Oncológica). Se realiza sesión departamental de Comité de tumores con la participación de Cirugía Oncológica, Neurocirugía, Angiología, Urología, Cirugía Plástica, Anestesiología y Terapia Intensiva. Por las características de la lesión se descartó la posibilidad de tratamiento conservador, siendo la HC la alternativa para ofrecer el control tumoral óptimo, de la sepsis y el dolor refractario. Se informó al paciente la conclusión de la sesión, aceptando el procedimiento, fue valorado por psiquiatría y trabajo social.
Se realizo el procedimiento en dos fases. En una primera cirugía los servicios de urología y cirugía oncológica realizan la derivación urinaria (conducto ileal tipo Bricker con técnica de Lynch Gregor) y la derivación de tubo digestivo mediante colostomía. Curso postoperatorio sin complicaciones con ambos estomas funcionales. Dos semanas después se realiza la amputación translumbar.
Técnica quirúrgica
En apego a la técnica descrita por Aust y Page, modificada por Jamil Ahmad-Carlton Banett Jr. y colaboradores, se procedió a un abordaje en sentido posteroanterior. Con el paciente en decúbito lateral izquierdo, se realiza una incisión en el vértice de la apófisis espinosa de T12, con extensión de la incisión bilateral hasta crestas iliacas en su segmento posterior. A nivel de L2-L3 se procede a identificación, sección y ligadura progresiva de vasos lumbares, sección de cuerpo vertebral en L3, transección del saco dural y cierre con sutura vascular, sección de los fascículos musculares de la masa común para lumbar, ligamentos interespinosos y desinserción distal de la fascia toracolumbar, sección del erector de la columna, cuadrado lumbar e inserciones intertransversas (Fig. 2). Se procede a colocación del paciente en decúbito supino, extensión de la incisión de crestas iliacas a superficies de cuádriceps femoral con isla de piel y con vértice medio en sínfisis del pubis, se realiza desinserción de oblicuos y rectos abdominales en segmentos distales, abordaje preperitoneal de cavidad abdominal, se identifica división de iliaca común, se disecan hacia distal arterias y venas iliacas externas, hasta su trayecto femoral, se liberan ambos colgajos vascularizados de cuádriceps femorales (Fig. 3), ligadura de vasos iliacos internos, sección de psoas bilateral, se completa sección anterior de cuerpo vertebral y se extrae en bloque columna vertebral desde L3, pelvis y miembros pélvicos (Fig. 4). Cierre de abdomen residual por rotación de colgajos de extremidades. Se completó el procedimiento en 7 horas, con un sangrado transoperatorio de 10,000 cc, curso transoperatorio sin descompensación hemodinámica, térmicas ni compromiso de bomba cardiaca, se transfundieron en total 21 paquetes globulares sin complicaciones.
Vigilancia postoperatoria
Ingresó a la Unidad de Cuidados Intensivos (UCI), fue extubado a las 6 horas de su ingreso, continuó con estabilidad hemodinámica, se inició dieta a las 24 horas con adecuada tolerancia y progresión de esta. Fue egresado a las 48 h de la UCI, se mantuvo 7 días en piso de cirugía oncológica para continuar cobertura con antimicrobiana, vigilancia de los colgajos y sus condiciones generales, no presentó complicaciones y fue egresado en buenas condiciones, con mínimo dolor en sitio de los colgajos. Actualmente, posterior a terapia física y de rehabilitación, se mantiene estable, realizando sus actividades cotidianas y en seguimiento por consulta externa.
Discusión
El TCG es una de las neoplasias óseas menos frecuentes y predecibles en cuanto a comportamiento. El diagnóstico requiere de correlación clínico-radiológica y un análisis histológico minucioso para excluir otras lesiones óseas que contienen células gigantes. La principal ubicación de estas lesiones es periférica. Rara vez los huesos planos se ven afectados, el sacro en un 1.7 a 8.2% de los casos1.
Se presentan como tumores masivos, su tamaño y localización hacen su tratamiento quirúrgico riesgoso y técnicamente difícil. La radioterapia se ha planteado como una alternativa en tumores con características desfavorables, sin embargo, cuando es factible, la tasa de respuesta es pobre, se incrementa la posibilidad de segundas neoplasias, morbilidad posradiación y tasas altas de recurrencia (15-49%). Chakravati reportó cinco casos de TCG de sacro tratados con radioterapia a dosis de 40 a 70 Gy, 2 de los pacientes desarrollaron progresión a los 5 y 8 meses, ameritando cirugía, el resto cursó con periodos libres de enfermedad de entre 3 a 10 años. En nuestro paciente el volumen tumoral, su extensión y la sepsis asociada a la infiltración excluía esta modalidad de tratamiento2,3.
La embolización transarterial puede ser considerada una opción adecuada. Hosalkar, et al. reportaron el uso de esta técnica en repetidas ocasiones para control tumoral. En nuestro paciente la sepsis de tejidos blandos cercana a los sitios de punción y la rica vascularidad del tumor no le hacían candidato al procedimiento4.
El manejo quirúrgico de este tipo de neoplasia se considera la mejor opción de tratamiento cuando es posible. La técnica de HC fue descrita por Kredel en 1950, el primer reporte de la realización de la técnica fue descrito por Kennedy, et al. en 1960; Aust, Absolon y Page integraron el primer reporte de supervivencia a largo plazo después de la cirugía5,6. La revisión de la literatura mostró que la técnica había persistido sin cambios, hasta la modificación sugerida back to front para disminuir el sangrado transoperatorio, descrita por Carlton, et al. en el 2008. Hasta esta fecha estaban reportados 57 casos en la literatura mundial por diversas patologías, predominantemente osteomielitis pélvica terminal, condrosarcoma pélvico y cordoma sacro, solo existen dos reportes previos de pacientes con tumor de células gigantes del sacro tratados con HC (Terz, et al. en 1990 y Brugger en 1992)7,8. Posterior a la revisión exhaustiva realizada con motivo del caso y la escueta información encontrada en la literatura mundial, se describe nuestra experiencia en el primer tratamiento con esta modalidad, con lo cual se logró un resultado favorable en control tumoral de la sepsis local, del dolor y la supervivencia del paciente (Fig. 5).











 text new page (beta)
text new page (beta)