Introducción
El tracto gastrointestinal es el principal sitio de localización de los linfomas extraganglionares, que constituyen del 5 al 20% de estos; es un padecimiento raro, pues representa solo el 0.2% de los tumores malignos del intestino delgado. Reportes del linfoma primario gastrointestinal (LPG) en EE.UU. estiman una incidencia anual de 1.73 casos por 100,000 habitantes. Como factores de riesgo identificados se encuentran infecciones (Helicobacter pylori, virus de la inmunodeficiencia humana, virus de Epstein Barr, virus de hepatitis B, Campylobacter jejuni y virus linfotrópico humano de células T tipo 1), inmunosupresión y enfermedad inflamatoria intestinal1,3.
En cuanto a la histología, cerca del 90% del linfoma gastrointestinal primario son de células B, con poca frecuencia de linfoma de células T y Hodgkin. Ciertos subtipos histológicos tienen predilección: el linfoma MALT (tejido linfoide asociado a la mucosa), en estómago; el linfoma de células del manto, en íleon terminal, yeyuno y colon; el linfoma de células T asociado a enteropatía, en yeyuno, y el linfoma folicular, en duodeno6.
Caso clínico
Se presenta el caso de un hombre de 61 años de edad, con evolución de dos meses con dolor abdominal generalizado de predominio en mesogastrio tipo cólico asociado a náuseas, vómito, constipación y melena. Niega fiebre o pérdida de peso. A la exploración física no se encontraron adenopatías palpables en cuello, región axilar o inguinal; abdomen distendido, con peristalsis aumentada, blando, depresible, con dolor a la palpación en marco cólico izquierdo, hipocondrio derecho y epigastrio, sin datos de irritación peritoneal, se palpa tumor a nivel de fosa ilíaca derecha de bordes mal definidos, no ascitis ni visceromegalias. Citometría hemática: hemoglobina 14 g/dl, leucocitos 10.1 x 103/mcl, neutrófilos 83%, bandas 11%, plaquetas 337 x 103/mcl. Tiempos de coagulación, química sanguínea, electrolitos séricos y pruebas de función hepática normales. Marcadores tumorales normales: antígeno carbohidrato (CA) 19-9 de 10.61 U/ml y antígeno carcinoembrionario (ACE) de 0.68 ng/ml. La tomografía de abdomen y pelvis contrastada (Fig. 1) reveló una imagen sugestiva de lesión neoplásica dependiente de íleon distal, de pared irregular y engrosada, midiendo en su diámetro mayor 39.2 mm, asociada a estriación de grasa mesentérica circundante, adenopatías mesentéricas y paraaórticas de 33.6 x 22.1 x 22.3 mm y por encima de la bifurcación aortoilíaca un conglomerado ganglionar de 58.8 x 42.6 x 58.2 mm.
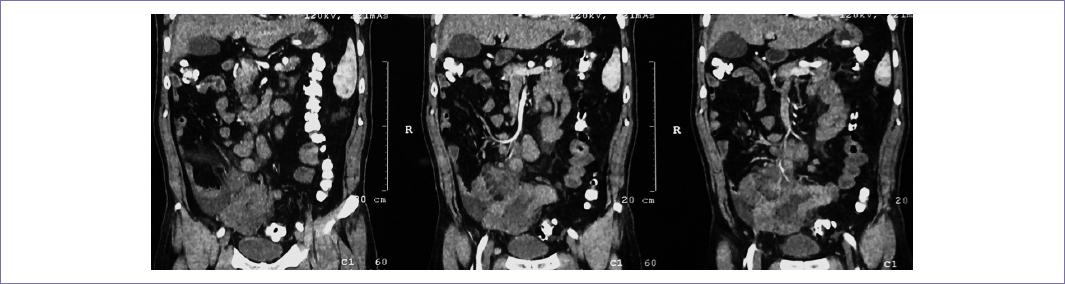
Figura 1 Tomografía computarizada con contraste intravenoso, se identifica lesión neoplásica en íleon distal de pared regular y engrosada (flecha), adenopatías mesentéricas y paraaórticas (flecha).
Se programa para laparotomía exploradora y se encuentran: 1,500 ml de líquido citrino en cavidad, tumor intraluminal de 10 x 12 cm en íleon proximal (170 cm de ángulo de Treitz y 110 cm de válvula ileocecal) adherido a apéndice cecal y a omento mayor, asociado a múltiples adenopatías en raíz de mesenterio de hasta 8 cm, e implantes intraluminales de 1 cm en intestino delgado a 10 cm proximal y distal, implantes en omento mayor de 4 y 5 cm, implante en raíz de mesenterio de 3 cm y en peritoneo de colon sigmoides, sin datos de actividad tumoral en cápsula hepática, porta hepatis, cápsula esplénica ni resto de superficies peritoneales (Fig. 2). Se realizó resección intestinal de segmento afectado y anastomosis laterolateral mecánica, omentectomía parcial, apendicectomía y resección de implante en sigmoides.
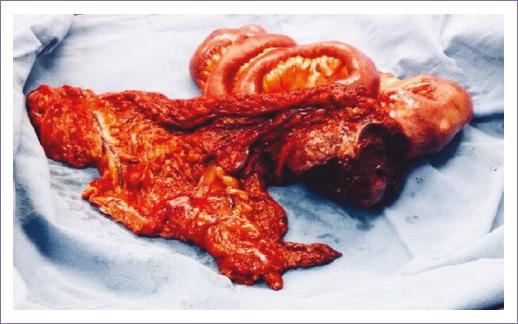
Figura 2 Pieza quirúrgica, tumor de 10 x 12 cm en íleon proximal, implantes (flecha) intraluminales en intestino delgado, en omento mayor y en raíz de mesenterio.
El reporte histopatológico describe linfoma difuso no Hodgkin de células pequeñas de íleon, ulcerado, con infiltración a la pared hasta la subserosa, diámetro mayor de 13 cm. Infiltración a conglomerado ganglionar de mesenterio, infiltración a ganglios de epiplón, infiltración en sigmoides (diámetro de 1.5 cm) e infiltración a apéndice cecal. En citológico de líquido peritoneal se reportan células mesoteliales, de reacción inflamatoria. La inmunohistoquímica (Fig. 3) reporta linfoma folicular intestinal de células B, CD 20 positivo, Ki-67 con índice de proliferación celular del 5%.
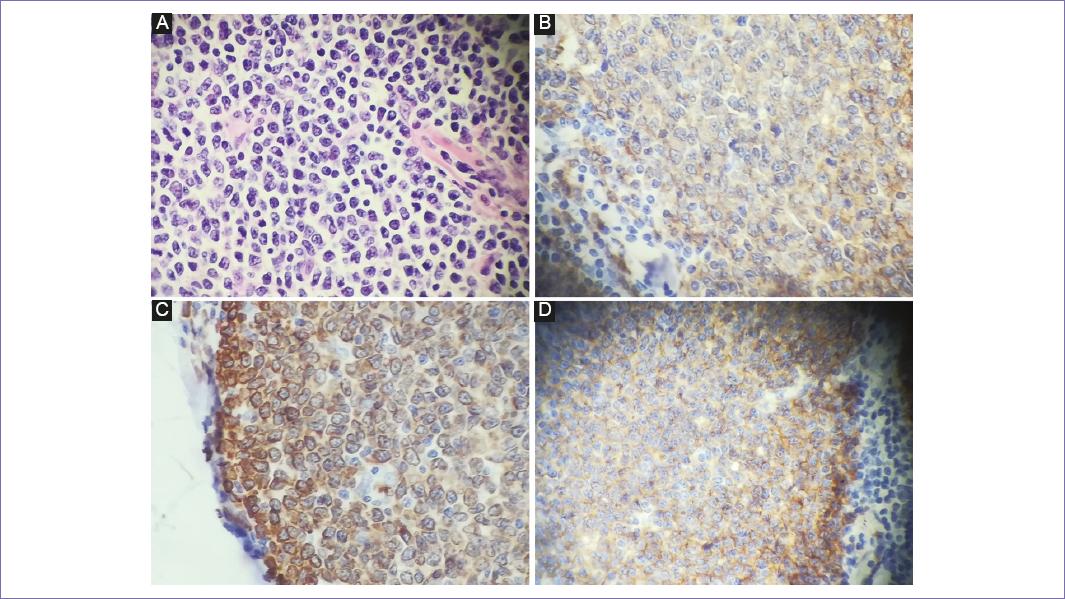
Figura 3 Estudio histopatológico. Tinción con hematoxilina-eosina, infiltración de células linfoides neoplásicas. A: células tumorales inmunoreactivas. B: marcador CD20. C: marcador CD 79. D: marcador bcl-2.
El paciente fue valorado por el Servicio de Hematología en consulta externa, que inició tratamiento con quimioterapia a base de vincristina, ciclofosfamida, doxorubicina y prednisona.
Discusión
Para definirse como un LPG debe cumplir con los criterios de Dawson: lesión predominantemente gastrointestinal, con o sin diseminación a ganglios regionales, no involucra ganglios mediastinales o periféricos, no involucra hígado o bazo y los leucocitos o diferencial están dentro de parámetros normales3. Puede realizarse tránsito intestinal, ultrasonido, resonancia magnètica, tomografía computarizada o gammagrafía, así como endoscopia asistida con balón, cápsula endoscópica y ultrasonido endoscópico, que además nos permite la toma de biopsia4.
Para la estadificación se utilizan los criterios de Ann Arbor o el sistema Lugano (Tabla 1)3.
Tabla 1 Estadificación según Lugano y Ann Arbor
| LUGANO | ANN ARBOR | |
|---|---|---|
| ESTADIO I | Confinado al tracto gastrointestinal | En una sola región linfática u órgano linfoide como el timo (I). En una sola área de un solo órgano fuera del sistema linfático (IE) |
| ESTADIO II | Se extiende en el abdomen de la región gastrointestinal primaria | En 2 o más grupos ganglionares en mismo hemidiafragma (II). Extensión de un solo grupo ganglionar hacia órgano adyacente (IIE) |
| ESTADIO II 1 | Involucra ganglios regionales (paragástrico o paraintestinal) | |
| ESTADIO II 2 | Involucra ganglios distales (paraaórtico, paracaval, pélvico, inguinal, mesentérico) | |
| ESTADIO IIE | Penetra serosa para extenderse a órganos adyacentes o tejidos | |
| ESTADIO III | No hay estadio III | En ambos lados del diafragma, se disemina a región u órgano adyacente a ganglios linfáticos (IIIE), bazo (IIIS) o ambos (IIISE) |
| ESTADIO IV | Diseminación extraganglionar o involucra ganglios supradiafragmáticos | Se disemina fuera del sistema linfático, en órgano no adyacente a ganglios involucrados o a médula ósea, hígado, médula espinal o pleura |
No es frecuente que el omento esté implicado con el linfoma porque no contiene tejido linfoide, la diseminación puede tener diferentes vías como la superficie peritoneal visceral, el ligamento gastrocólico y el mesocolon transverso. La linfomatosis peritoneal (LP) se manifiesta como un subtipo histológico agresivo de linfoma de alto grado con progresión y deterioro rápido7.
Actualmente la cirugía se indica en caso de hemorragia, perforación u oclusión; en pacientes insensibles a otros manejos o con complicaciones tiene como ventajas: diagnóstico histopatológico, estadificación y pronóstico más exacto, disminuir la carga tumoral, mejorar síntomas y fortalecer el efecto de laquimioterapia postoperatoria1. Lightner, et al. comparan opciones de tratamiento para LPG y concluyen que la cirugía seguida de quimioterapia adyuvante es el tratamiento de elección.
La supervivencia general a 5 años del linfoma primario intestinal es del 53-86.4%. En un estudio realizado por Hong, et al. se observó que la supervivencia a 5 años libre de progresión (SLP) y la supervivencia global (SG) fueron significativamente mayores en el grupo de cirugía comparado con aquellos en los que no se realizó.
De acuerdo a Shannon, et al., tienen mejor pronóstico las mujeres, mientras que la raza negra tiene peor pronóstico; los pacientes que se sometieron a cirugía no tienen mal pronóstico en comparación con aquellos que tienen recomendada la cirugía pero que esta no se realiza. El índice pronóstico internacional es el más utilizado para estadificar la mayoría de los subtipos de linfoma no Hodgkin, e incluye como factores de riesgo: edad > 60 años, 2 o más sitios extraganglionares, estadio Ann Arbor III-IV, estado funcional 2 o más de acuerdo a la escala del Grupo Oncológico Cooperativo del Este (ECOG, por sus siglas en inglés) y elevación de deshidrogenasa láctica (DHL). Se considera un riesgo bajo 1 factor de riesgo, bajo-intermedio 2 factores, alto-intermedio 3 factores y alto, 4-5 factores6.
Conclusión
El LPG puede presentarse con oclusión intestinal como en el caso presentado. El cuadro clínico, los estudios de laboratorio y de imagen por sí solos pueden llevar a un diagnóstico incorrecto, por lo que tiene un papel clave la cirugía, que permite establecer un diagnóstico histológico definitivo e iniciar la quimioterapia de acuerdo con el tipo histológico, el estadio y la edad del paciente. En este caso no solo encontramos involucro de ganglios mesentéricos, sino también extensión transcelómica al omento mayor, hallazgo poco frecuente en este padecimiento y que inicialmente pudiera orientar a una histología de tipo adenocarcinoma. Aunque sea una presentación rara, la LP es una posibilidad a tener en cuenta cuando encontramos un tumor maligno en el íleon terminal.











 text new page (beta)
text new page (beta)


