Definición
El síndrome polen-alimento (SPA) es una reacción alérgica que se produce por el consumo de frutas frescas, vegetales y/o frutos secos, asociada a la sensibilización alérgica concomitante a aeroalérgenos de tipo pólenes de árboles, malezas o pastos.1,2,3Esta reacción es causada por una hipersensibilidad de tipo I, mediada por IgE, debido a la reactividad cruzada entre los alérgenos de los pólenes y los presentes en alimentos de origen vegetal.4
El nombre de síndrome de alergia oral ha caído en desuso debido a que se ha demostrado que los síntomas no se restringen a la cavidad oral y algunos pacientes pueden presentar síntomas sistémicos e incluso anafilaxia.4,5
Epidemiología
La prevalencia es difícil de estimar, ya que se basa en los reportes de pacientes seleccionados con alergia a pólenes y hay pocos estudios en población general. En pacientes adultos que presentan alergia respiratoria se ha documentado un rango de prevalencia de entre 8 a 70 %. En niños se considera que la prevalencia es de 5 %.6,7
La prevalencia depende también del área geográfica, y por ende del tipo de polen responsable. Por el ejemplo, en Europa se estima que la prevalencia es de 30 a 60 %, especialmente en el norte, donde hasta 40 a 50 % de los pacientes con sensibilización al abedul presentan SPA.8,9 En la zona del Mediterráneo donde hay baja sensibilización al abedul y Ambrosia, la prevalencia de SPA baja hasta 20 %.10,11 En Latinoamérica y México existen pocos reportes sobre prevalencia de SPA, por lo que es difícil estimar su prevalencia real.
Fisiopatología
Radauer et al. propusieron en 2008 una clasificación de los alérgenos basada en las familias de proteínas.11 Tres familias son las que con mayor frecuencia están implicadas en el SPA:
Profilinas
Proteínas relacionadas de defensa (PR-10)
Proteínas trasportadoras de lípidos no específicas (ns-LTP).12
Otras familias de proteínas se han estudiado como responsables de SPA, tal sucede con las proteínas tipo taumatinas (TLP), isoflavonas reductasas (IFR) y las b1,3 gluconasas; sin embargo, no están completamente caracterizadas.12,13
Proteínas similares a Bet v1 (PR-10)
Las proteínas PR-10 tienen un peso molecular que oscila entre 16 y 18 kDa y un punto ácido isoeléctrico entre 4.4 y 6.1. Son proteínas relacionadas con la defensa de las plantas que son destruidas por enzimas digestivas y altas temperaturas, por lo que en general los pacientes pueden tolerar la ingesta de los alimentos que las contienen de forma cocida o procesada.14,15
Estas proteínas PR-10 desempeñan un papel importante en el trasporte de esteroides y se ha descrito un ligando natural, denominado Quercetina 3-O-sophoroside, un flavonoide con potente acción antioxidante.16,17
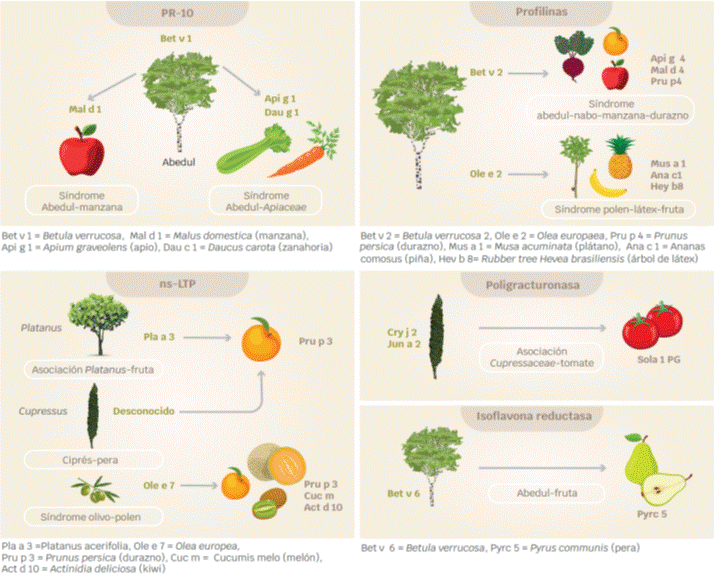
Bet v 1 (alérgeno principal del abedul) y Mal d 1, de la manzana, son considerados los alérgenos mayores de la familia de proteínas PR-10. Bet v 1 está presente en 90 % de los pacientes con alergia al abedul. Las proteínas de Bet v 1 son específicas de los árboles de las familias Betulaceae y Fagaceae, del orden de los Fagales.18,19
Los alérgenos pertenecientes a la familia PR-10 se encuentran en numerosas frutas de la familia de las rosáceas, como chabacano (Pru ar 1), cereza (Pru av 1), fresa (Fra a 1), durazno (Pru p 1); o de otros frutos, como kiwi (Act d 8); en vegetales, como apio (Api g 1), zanahoria (Dau c 1); y leguminosas, como soya (Gly m 4) y cacahuate (Ara h 8).20,21 La secuencia y la homología estructural en estas proteínas es responsable de la reactividad cruzada.7
Profilinas
Las profilinas son proteínas ubicuas de tipo unión a actina, con un peso molecular de 12 a 15 kDa, y juegan un papel importante en el citoesqueleto de células de plantas y animales.6,22
Son proteínas bien conservadas en plantas y comparten una identidad de secuencia de entre 70 a 85 %, tienen la ca racterística de que son desnaturalizadas por altas temperaturas y por las enzimas digestivas, siendo la excepción las profilinas del apio que, se ha documentado, resisten el calor).23,24
Las profilinas son consideradas un panalérgeno por excelencia, debido a que se encuentran en muchos alimentos derivados de plantas, como la manzana (Mal d4), cereza (Pru av4), pera (Pyr c4), durazno (Pru p4), chabacano (Pru ar4), plátano (Mus a1), piña (Ana c1), melón (Cuc m2), tomate (Sola l1), fresa (Fra a4), lichi (Lit c1); en vegetales, como apio (Api g4), paprika, pepino, calabaza; en legumbres, como la soya (Gly m3), frijol, cacahuate (Ara h5); y en frutos secos, como nueces (Jug r7) y avellanas (Cor a2).25,26,27
Las profilinas provenientes de las gramíneas son los inductores más potentes de sensibilización a estas proteínas, como el pasto Timoteo (Phl p12), Artemisia (Art v4) y Ambrosia (Amb v8).28,29,30
Bet v2, la profilina perteneciente al abedul, es un alérgeno menor, ya que la sensibilización es menor a 20 % en Europa del Norte.31
Proteínas de transferencia de lípidos no específicas (ns-LTP)
Las ns-LTP son prolaminas que pertenecen a la familia de proteínas relacionadas con defensa PR-14. Se les denomina no específicas porque tienen la capacidad de transportar numerosos ligandos hidrofóbos.32
Tienen un peso molecular de 7 a 14 KDa. Su identidad de secuencia es de 25 a 67 % entre alérgenos de las diferentes plantas y puede ser tan cercano a 70 % entre familias relacionadas, como las rosáceas.33
Son resistentes a altas temperaturas y enzimas gástricas, lo que explica por qué además de ser responsables del SPA, pueden sensibilizar al paciente por vía gastrointestinal y ser causa de alergia alimentaria tipo I.34,35
En las frutas, estas proteínas relacionadas con la defensa, se encuentran en la piel más que en la pulpa, como es el caso de la manzana (Mal d 3) y el durazno (Pru p 3), donde incluso están presentes en las fibrillas de la cáscara.
Pru p 3 se considera el prototipo de nsLTP.36,37 Estas proteínas también están distribuidas en pólenes de árboles, como el olivo (Ole e 7); en malezas, como Artemisia (Art v 3) y Ambrosia (Amb v 6). Hasta este momento no se ha documen tado su presencia en pólenes de pastos.38,39
Síndromes polen-alimento más frecuentes
El SPA más representativo es el abedul-frutas-vegetales, ya que hasta 70 % de los pacientes con alergia a Betula desarrollan síntomas asociados a alimentos derivados de plantas. Los alimentos más comunes pertenecen a la familia de las Rosaceae, frutos secos y vegetales.39,40
El alérgeno implicado más frecuente es Bet v 1, por su reactividad cruzada por identidad de secuencia de 50 a 60 % entre árboles del orden de los Fagales (Betulceae y Fagaceae) y alimentos derivados de plantas que pertenecen a la familia de las Rosaceae (manzana (Mal d 1), pera (Pyr c 1), durazno (Pru p 3), etc); con Betulacea (Cor a 1) y Apiaceae (zanahoria (Dau c 1) y apio (Api g 1), éstas dos últimas con identidad de secuencia de 40 a 50 % con Bet v1 (Figura 1).40,41,42
El síndrome clínico más común es el abedul-manzana (Bet v 1 y Mal d 1), pero existen otros como el abedul-manzana-zanahoria (Bet v 1, Dau c 1, Api g 1).2
De los síndromes asociados a árboles el más común es el olivo-fruta, desencadenado por la reactividad cruzada entre frutas (como durazno, pera, melón y kiwi) con el árbol del olivo de la familia de las Oleaceas. Las proteínas implicadas son profilinas y ns-LTP.43,44
La sensibilización a Ole e 7, una ns-LTP, se asocia a síntomas sistémicos por durazno (Pru p 3), pera (Pyr c 3), melón (Cuc m 3) y kiwi (Act d 10).4,45
En cambio, la sensibilización a Ole e 2, una profilina, desencadena síntomas localizados a la cavidad oral (Pru p 4, Pyr c 4, Cuc m 2, Act d 9).1,21
El síndrome ficus-fruta, se presenta por sensibilización a Ficus bejamina, un árbol de ornato, con reactividad cruzada con higos, kiwi, papaya y piña por cistein proteasas (Act d 1, Ana c 2, Car p 1).46
Otro síndrome importante es el ciprés-durazno, ocasionado por profilinas (Cup s 8 y Pru p 4) o por las taumatinas (Cup s 3 y Pru p 2) (Figuras 1 y 2).46,47
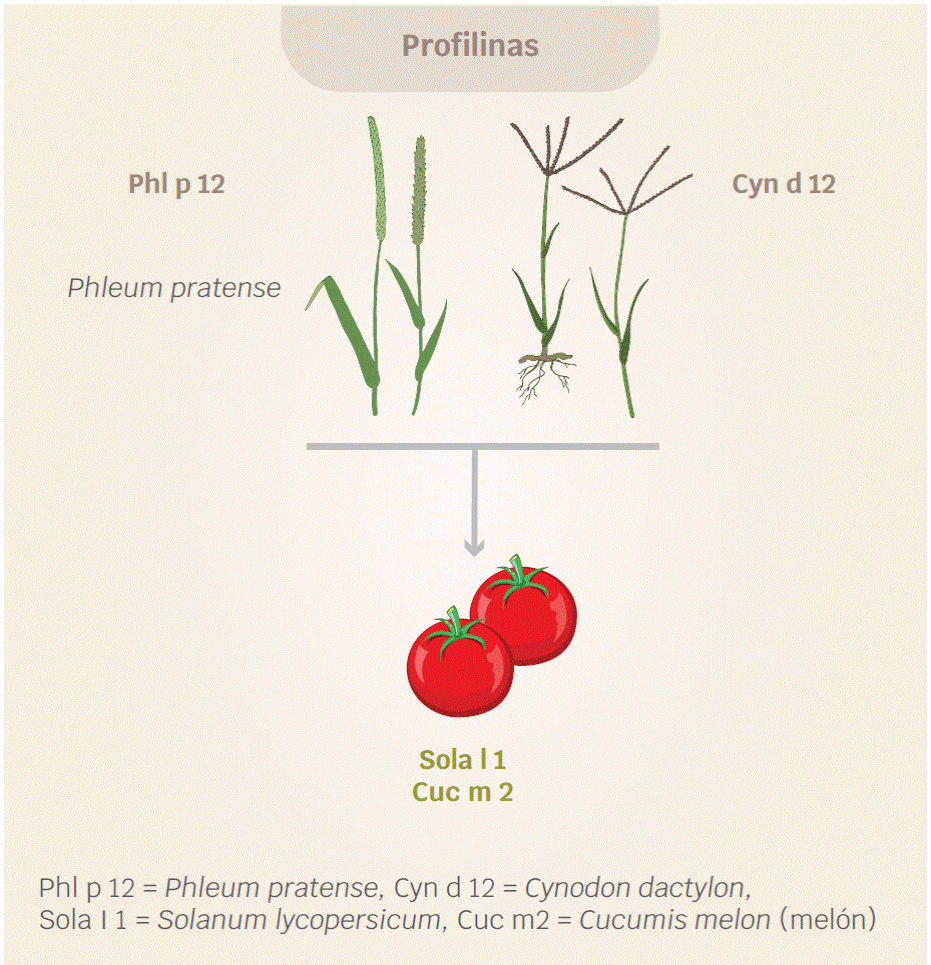
Respecto a los síndromes asociados a pastos, se encuentra el ocasionado por Cynodon dactylon (pata de gallo) que cruza con tomate y melón. Las proteínas implicadas son las profilinas (Cyn d 12, Sola l 1, Cuc m 2) (Figura 3).47,48
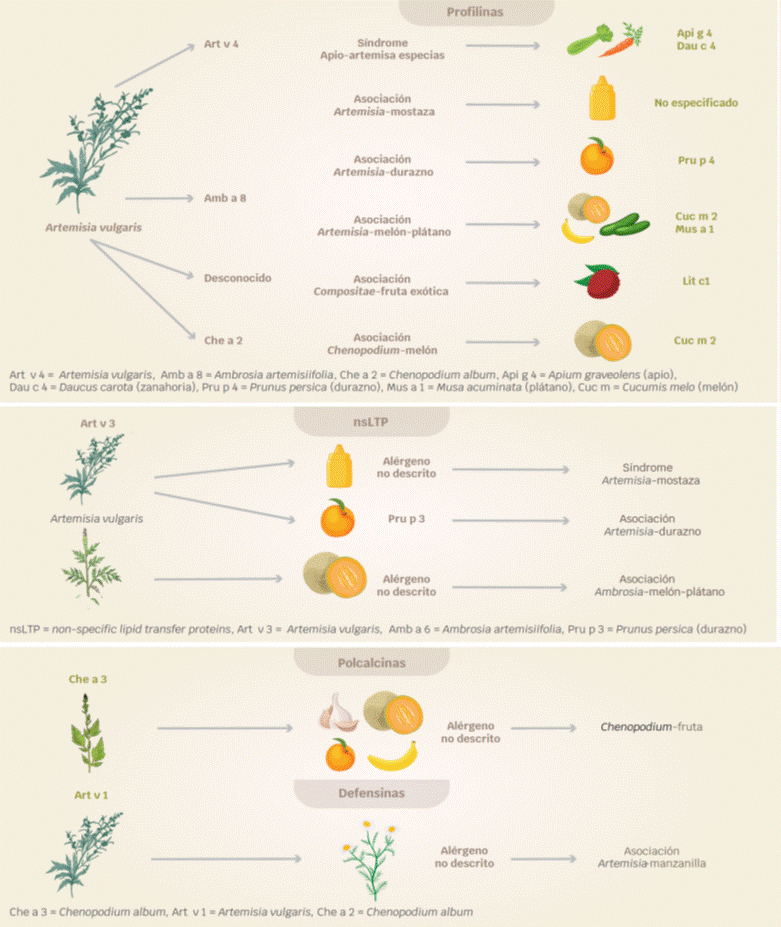
El síndrome apio-abedul-artemisa-especias, es un SPA asociado a proteínas homólogas a Bet v 1 y a profilinas, presentes en apio, especias y otros vegetales.49
El síndrome artemisa-apio-especias, consiste en la sensibilización respiratoria a Artemisia y reactividad cruzada con Apiaceae/Umbilliferae (apio, zanahoria, perejil e hinojo), Amaryllidaceae (ajo, cebolla y cebollín), Solanaceae (paprika) y Piperaceae (pimienta). Las proteínas responsables son profilinas, presentes en Artemisia (Art v 4), apio (Api g 4), zanahoria (Dau c 4) y en especias.50,51
El síndrome artemisa-mostaza es ocasionado por reactividad cruzada entre Artemisia y alimentos de la familia Brassicaceae/Cruciferae: mostaza blanca, mostaza india, repollo, brócoli, coliflor; las causantes son ns-LTP (Art v 3, Sin a 3) y profilinas (Art v 4, Sin a 4).52
Las ns-LTP (Art v3, Pru p3) y las profilinas (Art v 4, Prup 4) son responsables del síndrome artemisa-durazno.53
El síndrome ambrosia-melón-plátano se presenta en pacientes con sensibilización respiratoria a Ambrosia y síntomas con la ingesta de alimentos de las familias: Cucurbitaceae (melón, sandía, calabaza, pepino) y Musaseae (plátano). Las proteínas implicadas son las profilinas (Amb a 8, Cuc m 2, Cuc p 2, Cit la 2, Cuc s 2, Mus xp 1) y ns LTP (Amb a 6, Cuc m 3).54
El síndrome epazote-melón, es ocasionado por la reactividad cruzada entre el epazote (Chenopodium album) y frutas, como melón, plátano y durazno. Las profilinas Che a 2, Mus xp 1, y Pru p 4, respectivamente, son las responsables (Figura 2).54,55
Diagnóstico
Para el diagnóstico del SPA es fundamental una historia clínica detallada (demostrar hipersensibilidad a pólenes mediante pruebas cutáneas o determinación de IgE específica y reto oral con el alimento implicado), las pruebas cutáneas y el reto oral al alimento implicado, elementos que confirman la sospecha clínica.31,55
Aunque los síntomas más comunes son restringidos a la cavidad oral, debe tomarse en cuenta que hasta 3 % de los pacientes presentarán síntomas sistémicos y 1.7 % anafilaxia; no obstante, la estimación de pacientes con SPA y síntomas sistémicos varía en los diferentes estudios publicados, Mansoor y cols. reportaron hasta 10 % y se caracterizaron por urticaria generalizada, sibilancias, disnea y choque anafiláctico, mientas que Kim y cols. registraron síntomas sistémicos en 1 a 8 % de los pacientes con SPA. Los síndromes más asociados al riesgo de presentar síntomas sistémicos son los que involucran a las ns-LTP.31,56
Los síntomas locales en pacientes con SPA son prurito orofaríngeo, palatino y lingual. Sin embargo, pueden presentar otros síntomas considerados sistémicos, como sensación de cuerpo extraño en faringe, disfagia, náuseas, disfonía, prurito nasal y ótico.57
Generalmente, los síntomas se presentan cuando el paciente ingiere el alimento crudo y puede tolerarlo si está cocido o procesado. Usualmente los síntomas se presentan desde segundos, hasta cinco a 10 minutos después de la ingesta.50,58 Entre los factores que pueden influir en la severidad de la reacción, se han identificado la ingesta de antiácidos (que pueden afectar la degradación de las proteínas), la cantidad ingerida, el uso concomitante de antiinflamatorios no esteroideos, el ejercicio y el consumo de bebidas alcohólicas.3,59
En la exploración física se identifica edema en lengua, periorbitario, labios, úvula y región facial; algunos pacientes pueden presentar urticaria de contacto peribucal.3
Es importante documentar hipersensibilidad tipo I, por medio de pruebas cutáneas de prick o IgE específica por InmunoCAP a algún polen de árboles, pastos o malezas.60
Las pruebas prick to prick con el alimento sospechoso, deben llevarse a cabo con frutas, verduras o legumbres frescas (crudas y cocidas) y evitar la contaminación cruzada. En caso de contar con extractos comerciales de alguno de los alimentos, pueden utilizarse considerando que, en caso de un resultado negativo, el prick to prick con el alimento en fresco implicado debe realizarse.45,60
El diagnóstico por componentes es una prueba confiable para identificar el SPA, que al ser una prueba in vitro, no requiere de la reexposición del paciente al alimento o la suspensión de antihistamínicos, ya que mide anticuerpos IgE específicos en sangre. Hasta la fecha hay dos pruebas disponibles: ISAC (Immuno Solid-phase Allergen Chip) y ALEX (Allergy Explorer de Macroarray Diagnostic), que incluyen 112 y 184 alérgenos moleculares respectivamente, siendo la mayor desventaja el alto costo.41,45
La prueba de reto oral con el alimento sospechoso es el estándar de oro para el diagnóstico. Puede realizarse un reto abierto, simple ciego, o doble ciego controlado con placebo; sin embargo, por su facilidad, el reto abierto es más común en la práctica diaria.41,52
Tratamiento
El tratamiento es la evitación del alimento responsable de síntomas, aunque algunos pacientes pueden tolerar alimentos cocinados o procesados cuando las responsables del SPA son proteínas termolábiles, como profilinas o proteínas similares a Bet v 1. En el caso de que la sensibilización sea a una nsLTP, se debe evitar el consumo del alimento en cualquier forma o presentación.52,56
Es tema de discusión suspender, o no, alimentos de la misma familia por una posible reactividad cruzada con alimentos con los cuales el paciente no ha presentado síntomas; sin embargo, se debe considerar en esos casos la realización de prueba de reto o decidir de acuerdo con el resultado por componentes.40,56
Debido a que los síntomas son leves, de corta duración y restringidos a la cavidad oral, no se requiere tratamiento o solo el empleo de antihistamínicos H1 de segunda generación, en caso de ser necesario.40
Cuando se presentan síntomas sistémicos deben tratarse de forma individualizada, y en los casos donde se cumple la definición de anafilaxia, incluso con adrenalina y esteroides sistémicos, si fuera necesario.26,40
Se recomienda tener un plan de acción de anafilaxia, y si es posible contar con un autoinyector de adrenalina en pacientes con alto riesgo de anafilaxia. En México, debido a la falta de disponibilidad del autoinyector, se recomienda cargar con un ámpula de adrenalina y una jeringa para su aplicación en el músculo vasto externo, en caso necesario.16,26
No existe evidencia contundente de que la inmunoterapia a pólenes sea útil para la reactividad cruzada responsable del SPA. La mayor experiencia es en pacientes con síndrome abedul-manzana, donde se utiliza el extracto de abedul o PR-10 recombinante; sin embargo, los resultados dependen de la dosis y la vía de administración: subcutánea o sublingual.4,16
El poco beneficio reportado para la alergia a manzana se basa en la disminución de la reacción en caso de ingesta accidental y tolerancia periférica con producción de IgG4 en estudios clínicos limitados.1
Conclusiones
Los SPA son un tipo de alergia alimentaria que es más frecuente de lo que se reporta; sin embargo, debido a que no en todos los pacientes se realizan las pruebas diagnósticas necesarias, en muchos casos sólo queda como sospecha.
Es importante identificarlo, ya que pese a lo que antes se creía, los pacientes con SPA, pueden presentar síntomas sistémicos, e incluso anafilaxia, lo cual depende del tipo de proteína implicada en su patología; lo que resalta la importancia del diagnóstico molecular por componentes para esta patología, ya que permite conocer el riesgo de complicaciones en este grupo de pacientes.











 text new page (beta)
text new page (beta)