Introducción
Las reacciones adversas a medicamentos se originan por diferentes mecanismos y provocan diversas manifestaciones clínicas.1,2Aproximadamente el 3.6% de los ingresos hospitalarios se deben a reacciones adversas a medicamentos, 17% de los pacientes hospitalizados sufren alguna reacción durante su internamiento y se estima que el 0.5% de éstas son mortales.3
Las reacciones adversas a medicamentos tipo A se presentan en el 80% de los casos y su mecanismo farmacológico depende de la farmacodinamia y farmacocinética, además de la dosis administrada. Las reacciones adversas a medicamentos tipo B aparecen en el 20% de los casos, se consideran independientes de la dosis y pueden tener un mecanismo de hiper- sensibilidad inmunológico (alérgico) o no inmunológico, e implican la activación del sistema inmunitario o de sus vías efectoras.4,5De éstas, el 15% comprenden un mecanismo tipo I mediado por IgE, por ejemplo, la alergia a la penicilina. El 5% de las reacciones tipo B se deben a un mecanismo mediado por células T: tipo IVa (dermatitis por contacto), tipo IVb DRESS (reacción a fármacos con eosinofilia y síntomas sistémicos), tipo IVc (síndrome de Stevens-Johnson - necrólisis epidérmica) y tipo IVb (exantema maculopapular y pustulosis exantematosa generalizada aguda).6
La clasificación de las reacciones de hipersensibilidad a medicamentos se basa en la manifestación clínica de los síntomas típicos y del tiempo de aparición. Originalmente fueron descritas por Gell y Coombs: Tipo I (reacciones mediadas por IgE), Tipo II (reacciones de citotoxicidad mediadas por anticuerpos), Tipo III (reacciones mediadas por complejos inmunes) y Tipo IV (reacciones retardadas).7 Según el tiempo de aparición de las manifestaciones clínicas se dividen en: 1) reacciones inmediatas, que ocurren por lo general dentro de la primera hora, pero en la actualidad se ha extendido ese tiempo hasta 6 horas, y 2) reacciones tardías, que inician después de 6 horas (acelerado), o incluso pasados algunos meses.8
Metodología
Se llevó a cabo la revisión de la bibliografía en las principales bases de datos, con selección de artículos publicados en inglés y español.
Alergia a la penicilina y |Hactámicos
Los beta-lactámicos son la familia más prescrita de antibióticos e incluye: penicilinas, cefalosporinas, monobactámicos y carbapenémicos.9 Son antibióticos seguros; sin embargo, pueden producir reacciones adversas.
Epidemiología
La etiqueta de alergia a la penicilina es común, con una prevalencia del 8-25%.10 Es más frecuente en mujeres y durante la tercera década de la vida; se asocian con factores genéticos y metabólicos.11,12Las pruebas confirmatorias demuestran que solo 1-10% de los pacientes diagnoticados con alergia a la penicilina lo son en realidad.13 Por ejemplo, el exantema maculopapular suele asociarse con infección viral subyacente por virus de Epstein Barr, sobre todo en niños, y se diagnostica erróneamente como alergia a la penicilina.14
Fisiopatología
Las penicilinas son haptenos con alta capacidad para unirse covalentemente a proteínas plasmáticas, y de esta forma generar el complejo: hapteno-proteína. El anillo betalactámico se enlaza con residuos de lisina en las proteínas séricas y genera el determinante antigénico mayor peniciloil. La haptenación a grupos carboxil y tiol genera los determinantes menores peniciloato y peniloato.15
Reacción cruzada con otros betalactámicos
La penicilina y los otros betalactámicos comparten el anillo betalactámico, pero difieren en la cadena lateral R. La cadena lateral R1 es compartida entre algunas penicilinas y cefalosporinas, y es responsable de la reactividad cruzada. La cadena lateral R2 está presente en algunas cefalosporinas y carbapenémicos, pero no en penicilinas.9 La reactividad cruzada entre penicilina y cefalosporinas es del 2%, entre penicilinas y carbapenémicos es menor del 1%, y suele ser nula para monobactámicos.16,17
Clasificación
Una de las clasificaciones de las reacciones de hipersensibilidad se origina por la gravedad de riesgo: bajo, moderado y alto; y no puede apoyar en el abordaje global para establecer el diagnóstico de estas reacciones.18 Figura 1
Diagnóstico
Pruebas cutáneas: incluyen la prueba cutánea por punción, intradérmica y de parche. La peniciloil-polilisina (determinante mayor) y la bencilpenicilina (determinante menor) son los reactantes utilizados para la prueba diagnóstica. La sensibilidad para las pruebas cutáneas es baja (30%), pero la especificidad es alta (97%).19 El valor predictivo positivo con estos reactivos es del 50-75% y el valor predictivo negativo es mayor del 93%. Al continuar la evaluación con la prueba de provocación oral se incrementa el valor predictivo positivo a 95% para la población de riesgo bajo.20
Pruebas in vitro: Son pocas las pruebas disponibles y estandarizadas; se recomiendan cuando existe una re acción grave o cuando las pruebas cutáneas están contraindicadas. La IgE específica tiene una sensibilidad del 19% y especificidad del 97%.19 Se dispone de IgE específica a amoxicilina, ampicilina, penicilina G, penicilina V y cefaclor, con sensibilidad inferior del 50%. La prueba de activación de basófilos no está disponible en varios centros y carece de valor predictivo negativo. Para evaluar las reacciones tardías se dispone de la prueba de transformación de linfocitos, pero existe variabilidad en los laboratorios, por lo que es poco utilizada.18
Prueba de provocación: Es el método de elección para descartar la alergia a la penicilina. Consiste en la administración de 250 o 500 mg de amoxicilina por vía oral y puede llevarse a cabo en un solo paso en pacientes con riesgo bajo. Está contraindicada en reacciones cutáneas severas tardías o pruebas cutáneas por punción positivas.9
Tratamiento
El primer paso es el retiro del fármaco, posteriormente depende del tipo de reacción. En caso de anafilaxia, el tratamiento consiste en adrenalina por vía intramuscular, en dosis de 0.01 mg/kg (máximo 0.5 mg en adultos y 0.3 mg en niños).21 La desensibilización está indicada cuando no exista otra opción de tratamiento. Existen protocolos para la desensibilización a la penicilina, por vía intravenosa y oral, de manera segura y exitosa. Cuadro 1
Cuadro 1 Protocolo de desensibilización oral a penicilina
| Dosis | Unidades | Ruta |
|---|---|---|
| 1 | 100 | Oral |
| 2 | 200 | Oral |
| 3 | 400 | Oral |
| 4 | 800 | Oral |
| 5 | 1600 | Oral |
| 6 | 3200 | Oral |
| 7 | 6400 | Oral |
| 8 | 12,800 | Oral |
| 9 | 25,000 | Oral |
| 10 | 50,000 | Oral |
| 11 | 100,000 | Oral |
| 12 | 200,000 | Oral |
| 13 | 400,000 | Oral |
| 14 | 800,000 | Oral |
| 15 | 1,600,000 | Oral |
Adaptado de: Sullivan T, Yecies L, Shatz G, Parker C, Wedner HJ. Desensitization of patients allergic to penicillin using orally administered betalactam antibiotics. J Allergy Clin Immunol 1982; 69 (3): 275-282.
Se sugiere incrementar la dosis cada 15 a 60 minutos, dependiendo de la tolerancia del paciente y ajustar según la enfermedad de base.
Pronóstico
La historia natural de alergia a la penicilina indica una pérdida de IgE específica con el tiempo; en un estudio se estimó la prevalencia de pruebas cutáneas positivas del 73% a los 12 meses a 22% a 10 años.1,19,22,23
Alergia a antiinflamatorios no esteroideos
Los AINEs son los fármacos más frecuentemente prescritos y las reacciones de hipersensibilidad a estos fármacos son comúnmente reportadas, causadas por diversos procesos fármaco-inmunológicos.24
Epidemiología
La prevalencia de reacciones de hipersensibilidad a AINEs en la población general varía del 0.5-5.7%, mientras que en niños es del 0.3% y aumenta al 0.5% en niños con asma. En adultos con asma grave aumenta al 14.8%, con urticaria crónica espontánea al 30% y con poliposis nasal al 70%. La prevalencia de anafilaxia es del 0.01%. Los medicamentos asociados con las reacciones incluyen: metamizol, ibuprofeno, diclofenaco y ácido acetilsalicílico.25,26
Fisiopatología
Se producen por diferentes mecanismos patogénicos; la mayor parte por un mecanismo no inmunológico causado por la inhibición de la COX-1, aunado a un defecto regulatorio intrínseco: probablemente deficiencia de prostaglandina E2 (encargada de la estabilización de las células inflamatorias; principalmente eosinófilos y mastocitos) y la 5-lipoxigenasa, por medio del receptor EP-2, que inician una cascada bioquímica que implica la producción de leucotrienos, incremento de la expresión del receptor cys-leucotrieno 1 y la liberación de mediadores inflamatorios derivados de eosinófilos y mastocitos;27lo que genera contracción del músculo liso bronquial, vasodilatación y edema. El mecanismo mediado por IgE es menos frecuente.28
Factores de riesgo
El riesgo aumenta en mujeres, durante la edad adulta, en pacientes con atopia, factores genéticos por la coexistencia de polimorfismos y epigenéticos asociados con efectos farmacológicos del propio AINE.29,30
Clasificación
Debido a la heterogeneidad sintomática de las reacciones de hipersensibilidad a AINEs, se ha propuesto una clasificación basada en los síntomas clínicos, cantidad de AINEs implicados, enfermedad subyacente, reacción cruzada y mecanismo fisiopatológico, y se dividen en cinco fenotipos (Cuadro 2).28,29,31Además, existen otros fenotipos: reacciones combinadas, anafilaxia inducida por AINEs dependiente de alimentos y reacciones inmediatas selectivas de múltiples AINEs, que no se encuentran en esta clasificación.25
Cuadro 2 Clasificación de las reacciones de hipersensibilidad a AINEs.
| Tiempo de reacción | Manifestaciones clínicas | Reacción cruzada entre inhibidores COX-1 | Enfermedad subyacente | Mecanismo | Diagnóstico | Tratamiento |
| *Enfermedad respiratoria exacerbada por aspirina (EREA) o NERD | ||||||
| Aguda | Rinitis, congestión nasal, broncoespasmo, exacerbación del asma | Reacción cruzada | Asmarinosinusitispoliposis nasal | Pseudoalergia Inhibición de la COX-1 | Prueba de provocación oral-nasal BAT | Evitar los AINEs (inhibidor de la COX-1) Desensibilización |
| *Urticaria-angioedema exacerbada por múltiples AINEs en pacientes con enfermedad cutánea de base (ECEA) o NECD | ||||||
| Aguda | Urticaria-angioedema | Reacción cruzada | Urticaria crónica | Pseudoalergia Inhibición de la COX-1 | Prueba de provocación oral | Evitar los AINEs (inhibidor de la COX-1) Desensibilización Mepolizumab |
| * Urticaria-angioedema inducida por múltiples AINEs en pacientes asintomáticos (UAIA) o NIUA | ||||||
| Aguda | Urticaria-angioedema | Reacción cruzada | No conocida | Probable pseudoalergia, inhibición de la COX-1 | Prueba de provocación oral | Evitar los AINEs (inhibidor de la COX-1) Desensibilización *Urticaria |
| *Reacciones de hipersensibilidad retardada inducida por un solo AINE (RHRIUA) o SNIUAA | ||||||
| Retardada | Varias: eritema fijo medicamentoso, reacciones ampollosas severas, exantemas maculopapulares, dermatitis de contacto | Puede inducirse por un solo medicamento o por reacción cruzada | Ninguna | Variable | Prueba de parche Prueba de provocación oral | Evitar los AINEs |
COX-1: ciclooxigenasa 1; BAT: prueba de activación de basófilos.
Adaptado de Dykewicz & Lam. Drug Hypersensitivity Reactions. Med Clin N Am 2020; 104: 109-12; y de Doña I, et al. Progress in undestanding hypersensitivity reaction to nonsteroidal anti-inflammatory drugs. Allergy 2020; 75: 561-575.
Diagnóstico
El diagnostico depende en gran medida de la historia clínica, que de manera aislada tiene varias limitaciones. La prueba de provocación oral con ácido acetilsalicílico es el estudio de referencia para establecer el diagnóstico.27
En la actualidad existen diferentes biomarcadores: concentraciones séricas de LTE4, neurotoxina derivada de eosinófilos, L-plastina, esfingosina-1fosfato y periostina o búsqueda de polimorfismos genéticos.
Otros métodos diagnósticos: pruebas cutáneas,32cuantificación de IgE específica, prueba de activación de basófilos o de provocación nasal, tiene participación importante en el diagnósticos incluyen: de cada fenotipo de manera individual, por ejemplo las pruebas cutáneas han demostrado efectividad en las reacciones de hipersensibilidad a un solo fármaco, mientras que las pruebas de reto nasal y la de activación de basófilos son útiles en pacientes con enfermedad respiratoria exacerbada por aspirina, con una sensibilidad del 93.3% cuando se realizan simultáneamente.33,34,35,36,37 Cuadro 3
Cuadro 3 Pruebas diagnósticas para AINES
| Pruebas | Referencia | |
|---|---|---|
| Provocación oral con aspirina (estudio de referencia) | Sensibilidad del 89% Especificidad del 93% | 34 |
| BAL (FAST) Global considerando aspirina, paracetamol, metamizol y naproxeno | Sensibilidad del 63.3% Especificidad del 91-93.3% VPN del 59% VPP del 92% | 35 |
| Prueba de reto nasal con Lys-ASA | ensibilidad del 60% Especificidad del 92.5-95.7% VPN del 78.6 - 89.2% | 36 |
| NPT + BAT | ensibilidad del 80-93.3% Especificidad del 86.7% | 37 |
| Prick test | No validado | No validado |
Tratamiento
El tratamiento incluye evitar los AINEs y la indicación de fármacos alternativos para el dolor.38Los derivados de para-aminofenol (paracetamol) y los inhibidores selectivos de COX-2 a dosis bajas pueden prescribirse con relativa seguridad al presentar pobre reacción cruzada entre estos.39,40
Alergia a sulfonamidas
Las reacciones adversas provocadas por sulfonamidas son cada vez más graves, debido a su prescripción indiscriminada, que conlleva a una elevada incidencia de reacciones medicamentosas, tanto inmunológicas como no inmunológicas.41,42
Epidemiología
La incidencia de erupciones cutáneas inducidas por sulfametoxazol es del 6-8% en pacientes ambulatorios y del 69% en pacientes con VIH.42,43
Fisiopatología
Con base en su estructura química, las sulfonamidas se dividen en tres tipos: sulfonilarilaminas, no sulfonilarilaminas y fármacos que contienen restos de sulfonamida.41,42,44todas las sulfonamidas contienen un residuo NH2- SO2; sin embargo, los antimicrobianos de sulfonamida también contienen un arilamina (-Ar-NH2) en la posición N4 y un anillo con nitrógeno de cinco o seis miembros en la posición N1, en los se ha demostrado que se enlaza a la IgE en los casos de reacciones de hipersensibilidad tipo I. Es posible que estos grupos adicionales tengan participación determinante en la alergia, en lugar del residuo base NH2-SO2 contenido en todas las sulfonamidas.41,43,44
Reacción cruzada
La sensibilización cruzada de estos fármacos también puede incluir a los medicamentos antidiabéticos orales (sulfonilureas) y a los diuréticos sulfamídicos (tiacidas, clortalidona, quinetazona, furosemida y acetazolamida), inhibidores de la anhidrasa carbónica, AI- NEs, antirretrovirales y agonistas del receptor 5HT-3.45
Clasificación
Las reacciones de hipersensibilidad tipo I aparecen en los primeros 30 minutos, y son más frecuentes cuando se administran por vía parenteral que oral; en las reacciones de tipo II puede haber citopenias; en las de tipo III vasculitis entre 7 y 14 días de iniciar el tratamiento y en las de tipo IV la manifestación más común es el exantema maculopapular, incluso se han informado casos de eritema multiforme, eritema fijo, síndrome de Stevens-Johnson - necrólisis epidérmica tóxica, dentro de 48 a 72 h posteriores al contacto.46.47
Diagnóstico
Se han publicado resultados variados de las pruebas de parche. El resultado positivo confirma el diagnóstico; no obstante, el resultado negativo no lo excluye.48En las reacciones de tipo 1 pueden utilizarse las pruebas cutáneas por punción e intradérmicas con sulfametoxazol poli L-tirosina (con lectura a los 15 min), aunque su rentabilidad diagnóstica es deficiente (falsos negativos).46La prueba de transformación de linfocitos muestra una sensibilidad del 66.7% y especificidad del 100%; valor predictivo negativo y positivo del 53.8 y 100%, respectivamente.49
En pacientes con historia clínica dudosa y pruebas cutáneas negativas, el diagnóstico puede confirmarse mediante la prueba de provocación oral controlada y progresiva. Este proceder es frecuente en los casos de exantema fijo medicamentoso y debe evitarse en quienes tienen antecedente de reacciones graves.50,51
Tratamiento
Hasta el momento existen dos protocolos de tratamiento: el primero consiste en retirar el fármaco y el segundo en la desensibilización del mismo. Este último ha brindado la oportunidad de continuar el tratamiento de pacientes cuyo único protocolo efectivo son las sulfonamidas (pacientes con VIH). La desensibilización exitosa de trimetoprima-sulfametoxazol en pacientes con VIH mediante distintos protocolos puede lograrse en la actualidad desde unas cuantas horas hasta varios días.52,53,54,55
Alergia a anestésicos
Las reacciones de hipersensibilidad a anestésicos se incluyen dentro de las reacciones farmacológicas perioperatorias.56
Epidemiología
La incidencia es de 1:10,000 procedimientos, principalmente en adultos, con una relación mujer: hombre de 3:1 y la mortalidad varía del 1.4 al 4.8%. El propofol causa reacciones alérgicas en 1:60,000 exposiciones, conformando el 1-2% de todos los casos de anafilaxia perioperatoria. Las reacciones a midazolam, etomidato, ketamina y agentes inhalatorios son extremadamente raras.57,58
Fisiopatología
Las reacciones IgE mediadas ocurren en el 60% de los casos y generalmente son más graves. Las reacciones farmacológicas perioperatoias por propofol suelen ser mediadas por IgE hacia el determinante antigénico 2,3 diisopropilfenol; las no inmunológicas son causadas por la estimulación directa de mastocitos y basófilos.59
Clasificación
Existen dos grupos químicos no relacionados: 1) barbitúricos: de administración poco frecuente (por ejemplo: tiopental) y 2) no barbitúricos: de indicación común (propofol, ketamina, etomidato, benzodiazepinas y anestésicos inhalados).
Diagnóstico
Los síntomas cutáneos aparecen, incluso, en el 70 y 90% de las reacciones mediadas y no mediadas por ige, respectivamente. Debe sospecharse de alguna reacción alérgica cuando la hipotensión o el broncoespasmo son resistentes al tratamiento de referencia o si fue espontáneo.56,57,58,59
Las pruebas cutáneas por punción deben efectuarse 4-6 semanas después de una reacción.55En caso de resultar negativas deberán llevarse a cabo pruebas intradérmicas (Cuadro 4).53La ige específica tiene participación limitada, debido a su falta de disponibilidad y baja sensibilidad.56La prueba de provocación no se recomienda debido a los efectos farmacológicos.57,58
Tratamiento
Debido a las pequeñas cantidades de lecitina del huevo y aceite de soya en el propofol, existe preocupación acerca de su indicación en pacientes alérgicos a estos alimentos. Sin embargo, dicha relación no se ha confirmado y no se recomienda evitarlo.62En caso de alguna reacción no inmunológica se prefiere anestesia loco-regional con premedicación.58
Anestésicos locales
Epidemiología
La prevalencia de alergia mediada por ige es menor del 1%.63
Fisiopatología
Las reacciones se dividen en:
- Locales: laceración de estructuras nerviosas y necrosis isquémica.
- Sistémicas: por aplicación en sangre o sobredosis. Manifestación de síntomas en el sistema nervioso (parestesias periorales y/o faciales, disartria, sabor metálico, diplopía, trastornos auditivos y convulsiones); puede provocar disminución respiratoria. Los síntomas cardiacos incluyen: disminución miocárdica, intervalo de conducción prolongado, bradicardia, hipotensión e insuficiencia cardíaca).64
- Alérgicas: urticaria, angioedema y anafilaxia,65y tardías: dermatitis de contacto alérgica 24-48 horas después de la exposición.
- Respuestas psicomotoras: reacción vasovagal, hiperventilación y episodios de pánico.66
Las reacciones alérgicas son más probables que se atribuyan a los conservadores (metilparabenos) o antioxidantes (sulfitos).63
Clasificación
La estructura de los anestésicos locales se divide en: grupo aromático (lipófilo), cadena intermedia (és- ter o amida) y grupo amino (hidrofílico).64
1.-Tipo amida: menos alergénico.66,67
* Lidocaína: antiarrítmico sistémico; es el anes tésico administrado con mayor frecuencia
* Mepivacaína
* Bupivacaina: potencial cardiotóxico
* Etidocaína
* Ropivacaína: efecto vasoconstrictor
* Prilocaína: las dosis mayores de 8 mg/kg se asocian con riesgo de metahemoglobinemia
* Articaína
2.- Tipo éster: el ácido para-amonobenzóico es uno de sus metabolitos y el responsable de las reac ciones alérgicas.66,67
* Procaína
*Benzocaína
*Butacaína
*Cocaína
*Tetracaína
*Cloroprocaína
Diagnóstico
En la actualidad se desconoce la sensibilidad y es pecificidad de las pruebas cutáneas por punción; sin embargo, el valor pronóstico negativo es del 97%. La prueba intradérmica se asocia con falsos positivos en 8-15% de los casos (Cuadro 5). Las pruebas de reto subcutáneas son el método de referencia para confirmar la alergia mediada por ige.63Se realizan con 0.1, 0.2, 0.5, 1.0 y 2.0 ml cada 30 minutos.69No existen pruebas in vitro confiables ni estandarizadas Para el diagnóstico de las reacciones tardías pueden llevarse a cabo pruebas de parche.63,69
Tratamiento
Los datos de reactividad cruzada entre anestésicos locales del mismo grupo, y entre agentes de un grupo diferente son limitados y ambiguos.61 Al evitar los vasopresores, se evitan los bisulfitos.68,69En caso de confirmarse la alergia, debe cerciorarse la tolerancia a otros protocolos de tratamiento.59
Alergia a fármacos anticonvulsivos
Los anticonvulsivos son fármacos prescritos, principalmente, para el tratamiento de pacientes con epilepsia y status epilepticus, que representa una de las enfermedades neurológicas más relevantes.70,71,72,73.
Clasificación
Los anticonvulsivos se dividen según la generación en que fueron creados y de acuerdo con su estructura química, es decir, si contienen un anillo aromático o no. Los anticonvulsivos aromáticos incluyen: carbamazepina, oxcarbazepina, fenitoína, lamotrigina, felbamato, fenobarbital, zonisamida y primidona.2 Los anticonvulsivos no aromáticos son: valproato, gabapentina, topiramato, levetiracetam, pregabalina, lacosamida, vigabatrina y brivaracetam. Estos medicamentos provocan la mayor parte de las reacciones de hipersensibilidad, principalmente valproato, gabapentina, topiramato y levetiracetam.74
Fisiopatología
Se desconoce el mecanismo exacto por el que provocan este tipo de respuesta, pero se sospecha que se asocian con la producción de óxido de areno por el citocromo p450 a partir de los anillos aromáticos.75,76
Factores de riesgo
El predictor más significativo de alguna reacción a fármacos anticonvulsivos es el antecedente de una reacción previa, ya sea a algún medicamento de éste u otro tipo. Entre otros factores de riesgo se encuentran: género femenino, extremos de la vida, comorbilidades, estado nutricional y factores dependientes del fármaco, por ejemplo: dosis alta de inicio, o su aumento rápido,75y la indicación concomitante de fármacos que incrementan la concentración plasmática del anticonvulsivo, porque comparten su metabolismo. Asimismo, ciertas poblaciones étnicas se han visto afectadas frecuentemente debido a las asociaciones genéticas HLA: HLA-B*15:02 con síndrome de Steven-Johnson-necrólisis epidérmica tóxica por carbamazepina, oxcarbamazepina, lamotrigina y fenitoína en las poblaciones del sudeste asiático; el HLA A*51:01 con síndrome de Steven-Johnson-necrólisis epidérmica tóxica por fenobarbital en sujetos japone ses y HLA B*31:01 con síndrome DRESS y exantema maculopapular por carbamazepina en el norte de Europa, Japón y Korea.77
Cuadro clínico
Cualquier fármaco anticonvulsivo puede causar re acciones de hipersensibilidad; sin embargo, las principales son las reacciones tardías tipo IV. La mayor parte acontece en los primeros dos meses de iniciar el medicamento.78Las reacciones de hipersensibilidad inmediata a anticonvulsivos aromáticos es excepcional; sin embargo, se han reportado algunos casos.76
Diagnóstico
Las pruebas más utilizadas para establecer el diagnóstico son la prueba de transformación de linfocitos y las de parche, estas últimas con sensibilidad variable, del 20 al 80%,79debido a su falta de estandarización; además, existen diversos factores que afectan el resultado de la prueba: tipo de fármaco, concentración, vehículo, momento de la prueba después de la exposición y cuadro clínico de la reacción. Además, los alérgenos comerciales no están fácilmente disponibles y su uso puede limitarse por el riesgo de recurrencia de la reacción cutánea.79El valor pronóstico positivo y negativo de las pruebas de parche no está bien establecido.80,81Dentro de las ventajas de la prueba de transformación de linfocitos se encuentran: segura, alta posibilidad de identificar múltiples fármacos al mismo tiempo, y la sensibilidad y especificidad es del 60-70% y 100%, respectivamente.82
Tratamiento
El criterio inicial es el retiro del fármaco, según el tipo y severidad de la reacción cutánea. Puesto que los pacientes con reacciones de hipersensibilidad tardía por anticonvulsivos aromáticos tienen elevado riesgo de reacciones con otros medicamentos del mismo tipo, se recomienda evitar la indicación de este grupo de fármacos.83Otros medicamentos sin anillos aromáticos en su estructura química no parecen tener reactividad cruzada con los anticonvulsivos aromáticos; por tanto, pueden prescribirse con seguridad.84
Alergia a medios de contraste
Los medios de contraste yodados son los agentes administrados con mayor frecuencia en todo el mundo. Se estima que su administración se realiza al menos 100 millones de veces cada año en todo el mundo.85
Epidemiologia y factores de riesgo
La incidencia de reacciones de hipersensibilidad estimada varía del 0.5-2% de los pacientes. Aunque los medios de contraste yodados muestran una baja osmolaridad, su perfil de riesgo para reacciones adversas a medicamentos y de hipersensibilidad es considerable, pues ocurren en aproximadamente 3-30 y 1-3%, respectivamente,86 en particular si existe el antecedente de hipersensibilidad relacionada con el medio de contraste.87,88
Fisiopatología
Todos los medios de contraste yodados comparten un núcleo común, llamado anillo de benceno triyodado. Se clasifican en monómeros o dímeros, según la cantidad de anillos (1 o 2) triyodados y si son iónicos No iónicos.89 Las moléculas iónicas tienen un sustituyente carboxilato, mientras que las no iónicas no lo contienen. Los agentes iónicos suelen tener mayor osmolaridad (1500-2000 mosm/L) que los no iónicos (290-860 mosm/L). Es posible que los medios de contraste yodados hiperosmolares y la presencia de una carga, que interrumpe el potencial eléctrico de la membrana celular, contribuyan con el aumento de la toxicidad observada con los agentes iónicos.88,90
Clasificación
Las reacciones de hipersensibilidad a los medios de contraste yodados se clasifican en inmediatas (IR) y no inmediatas (NIR), según su ocurrencia dentro de Hora o después. Las reacciones pueden variar de leves a severas, y la piel es el órgano más frecuentemente afectado. El diagnóstico es complejo, se basa en la historia clínica, pruebas cutáneas y de provocación oral, aunque su función no ha sido totalmente establecida.
Diagnóstico
La sensibilidad diagnóstica de la prueba cutánea por punción varía del 5 al 90%; no obstante, su práctica rutinaria sigue discutiéndose, pero se sabe que la positividad varía según la gravedad de la reacción y del tiempo entre la reacción y el momento en que se realiza la prueba, además de las diferentes concentraciones utilizadas: los medios de contraste yodados no diluidos para las pruebas cutáneas por punción pueden asociarse con resultados falsos positivos. La especificidad de las pruebas cutáneas por punción para los medios de contraste yodados es del 95%.91 La sensibilidad de las pruebas cutáneas intradérmicas disminuye cuando se administran medios de contraste yodados sin diluir, incluso pueden alcanzar una especificidad del 100%.92 El valor pronóstico negativo de las pruebas cutáneas para las reacciones inmediatas es del 94-98% y para las no inmediatas del 68-86%. No existen datos disponibles del valor pronóstico positivo de las pruebas cutáneas, pues es probable que después de la nueva administración de algún medicamento con resultados positivos cause una reacción y no sería ético.93 La prueba de provocación oral es el método de referencia para establecer el diagnóstico; sin embargo, su práctica permanece en discusión porque no está exenta de riesgos.94,95
Tratamiento y pronóstico
La premedicación con corticosteroides y antihistamínicos se indica para reducir la tasa de recciones inmediatas.96,97 La efectividad no se ha documentado por completo y hasta la fecha no existe un protocolo de referencia de premedicación. Además, solo ha demostrado que reduce la tasa de reacciones inmediatas leves y, aún con esto, algunos pacientes pueden tener reacciones con la nueva administración. No se ha informado la efectividad en pacientes con reacciones inmediatas moderadas a graves ni en reacciones de hipersensibilidad no inmediatas. Por tanto, aunque ha ganado una amplia aceptación, su valor es controvertido, porque proporciona al paciente y a los médicos una falsa sensación de seguridad, la evidencia de su eficacia es débil y puede inducir efectos secundarios sustanciales.98
Por esta razón, aunque se trata de una práctica común, la evidencia actual apoya la administración de medios de contraste yodados alternativo, con pruebas cutáneas negativas, sin premedicación y reservarla para casos en los que se desconoce el medio de contraste responsable y existe una necesidad urgente de utilizarlo.99
Alergia a agentes quimioterapéuticos
Los agentes quimioterapéuticos se han indicado para el tratamiento de neoplasias y representan el protocolo de referencia para la mayor parte de de éstas.100,101Sin embargo, pueden inducir reacciones de hipersensibilidad y siguen siendo la tercera causa de anafilaxia inducida por fármacos.102
Epidemiología
Casi todos los fármacos quimioterapéuticos pueden inducir reacciones de hipersensibilidad en el 5% de los pacientes, aunque este porcentaje probablemente esté subestimado.103
En cuanto a los compuestos de platino, el carboplatino es el principal agente que provoca reacciones de hipersensibilidad, incluso en el 46% de los casos tratados con un mínimo de siete ciclos del fármaco.104El oxaliplatino puede inducir reacciones de hipersensibilidad en el 15% (1-25%) de los casos, mientras que cisplatino en el 5%.105Los taxanos pueden provocar reacciones de hipersensibilidad en el 30% de los casos, pero la incidencia disminuye a <5% con premedicación a base de corticosteroides y antihistamínicos.106La incidencia de reacciones de hipersensibilidad por asparaginasa varía del 6-43%, y aumenta a partir de la cuarta dosis.107La incidencia de reacciones a epipodofilotoxinas oscila entre el 6.5-41%.108
Factores de riesgo
Dentro de los factores de riesgo identificados para reacciones de hipersensibilidad asociados con agentes quimioterapéuticos se encuentran: antecedente de reacción a otros fármacos y edad mayor de 60 años (taxanos y platinos), género femenino (platinos) y aumento de la gravedad en reacciones previas (taxanos, platinos y asparaginasa). La atopia no parece ser un factor de riesgo para reacciones de hipersensibilidad a estos fármacos.103
Fisiopatología
Los mecanismos fisiopatológicos de las reacciones de hipersensibilidad asociados con agentes quimioterapéuticos aún no se esclarecen.
Taxanos: paclitaxel (incluido nab-paclitaxel), docetaxel y cabazitaxel provocan reacciones de hipersensibilidad en el 95% de los casos durante la primera o segunda infusión.109Se han relacionado con la activación directa del complemento, mecanismos mediados por ige y previa sensibilización al polen de tejo (Taxus baccata), avellana y nueces.110
Platinos: cisplatino, carboplatino y oxaliplatino provocan reacciones de hipersensibilidad después de múltiples administraciones y se han relacionado con un mecanismo mediado por ige.111
L-asparaginasa: las reacciones de hipersensibilidad ocurren durante la primera hora de la administración, aunque se han reportado reacciones tardías. Se ha relacionado con un mecanismo mediado por ige, incluso se ha informado su posible participación en la activación del complemento mediado por igg/igm.112
Epipodofilotoxinas: etopósido y tenipósido son agentes antimitóticos y las reacciones de hipersensibilidad ocurren después de la exposición repetida a éstos, aunque se han observado reacciones durante la primera administración. Pueden estar implicados mecanismos inmunológicos o no inmunológicos.113
Manifestaciones clínicas
Las características clínicas y la gravedad de la anafilaxia se clasifican, según los criterios de Brown, en: 1) leve (afectación cutánea y subcutánea), 2) moderada (afectación del sistema respiratorio, cardiovascular o gastrointestinal) y 3) grave (en caso de hipoxia, hipotensión o afectación neurológica).114
Diagnóstico
El diagnóstico es clínico y se confirma con pruebas in vivo e in vitro, según el mecanismo inmunológico sugerente y las manifestaciones clínicas.
Pruebas cutáneas por punción e intradérmicas: se realizan cuando se sospecha un mecanismo inmunológico mediado por ige y son útiles en reacciones provocadas por platinos y taxanos.115La sensibilidad para taxanos varía del 8.7%-24.6%, y la especificidad del 100%.116La sensibilidad para platinos es del 80%, y varía del 40 al 100%. El tiempo de la última exposición al platino influye en los resultados de las pruebas, pues se ha informado que los pacientes no expuestos al platino en un periodo mayor de seis meses muestran una sensibilidad tan baja, del 36%, comparada con 83% cuando la reacción de hipersensibilidad es reciente (menor de seis meses).117El valor pronóstico negativo de las pruebas cutáneas es del 50-90% para los taxanos y del 92% para los pla tinos;118el valor pronóstico positivo es difícil de evaluar, porque no sería ético reiniciar el fármaco en pacientes con pruebas cutáneas positivas.117
Pruebas de provocación por vía oral: es el estudio de referencia e implica la administración controlada de un fármaco. Se utiliza para confirmar la tolerancia a los fármacos alternativos con reacción cruzada, por ejemplo evaluar diferentes alternativas dentro de las sales de platino.119
Prueba de activación de basófilos: se ha utilizado en pocos pacientes con reacciones de hipersensibilidad a platinos.120
Triptasa sérica: es un biomarcador ampliamente disponible para la anafilaxia, mediada y no mediada por ige y requiere la comparación de concentraciones basales y durante la reacción de hipersensibilidad.121
Interleucinas: se han detectado altas concentraciones de IL6, IL1B y FNT-alfa en pacientes con reacciones de hipersensibilidad mediada por la liberación de citocinas y con síntomas atípicos de este tipo de reacciones.122
Tratamiento
En caso de anafilaxia debe administrarse adrenalina (0.01 mg/kg/dosis) por vía intramuscular y revalorar cada 5-15 minutos las dosis subsecuentes.123
La desensibilización es el enfoque terapéutico ideal para los pacientes que necesitan este protocolo de primera línea124y es un procedimiento seguro y eficaz. Los pacientes ideales a desensibilización muestran reacciones de hipersensibilidad inmediata tipo I, síndrome de liberación de citocinas, reacciones mixtas, o reacción de hipersensibilidad tardía tipo IV, excepto las reacciones adversas cutáneas graves.125 Cuadro 6
Cuadro 6 Desensibilización a paclitaxel por vía intravenosa en pacientes con cáncer de mama y anafilaxia moderada
| Paso | Solución | Infusión mL/h | Tiempo (min) | Volumen infundido (mL) | Dosis infundida (mg) | Dosis acumulada (mg) |
|---|---|---|---|---|---|---|
| 1 | 1 | 2.5 | 15 | 0.625 | 0.008 | 0.008 |
| 2 | 1 | 5 | 15 | 1.25 | 0.016 | 0.024 |
| 3 | 1 | 10 | 15 | 2.5 | 0.032 | 0.056 |
| 4 | 1 | 20 | 15 | 5 | 0.065 | 0.012 |
| 5 | 2 | 5 | 15 | 1.25 | 0.15 | 0.27 |
| 6 | 2 | 10 | 15 | 2.5 | 0.3 | 0.57 |
| 7 | 2 | 20 | 15 | 5 | 0.6 | 1.17 |
| 8 | 2 | 40 | 15 | 10 | 1.2 | 2.37 |
| 9 | 3 | 10 | 15 | 2.5 | 2.98 | 5.35 |
| 10 | 3 | 20 | 15 | 5 | 5.96 | 11.31 |
| 11 | 3 | 40 | 15 | 10 | 11.91 | 23.22 |
| 12 | 3 | 80 | 15 | 232.5 | 276.78 | 300mg |
| Tiempo total: 5.67 h |
Pronóstico
La seguridad y eficacia de la desensibilización para agentes quimioterapéuticos ha demostrado similar costo-beneficio que la administración estándar, y la eficacia del fármaco se conserva.126,127
Alergia a anticuerpos monoclonales
Los anticuerpos monoclonales son glucoproteínas producidas por las células B con capacidad de reconocer moléculas específicas, y son importantes en el diagnóstico y tratamiento de pacientes con enfermedades infecciosas, inmunológicas y neoplásicas.128
Clasificación
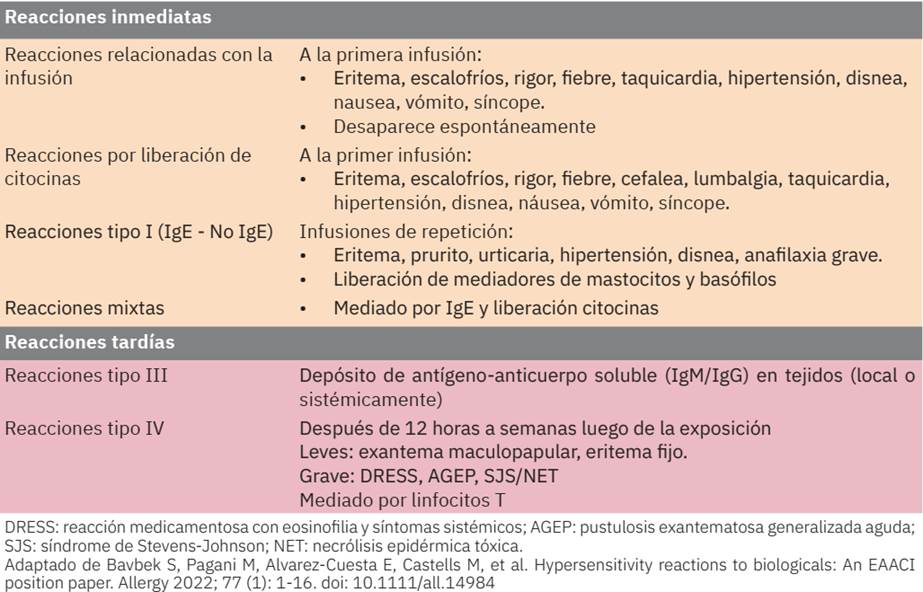
Hace poco se propuso una nueva clasificación mediante fenotipos, endotipos y biomarcadores.129,130Esta clasificación divide las reacciones de hipersensibilidad en: reacciones relacionadas con la infusión, reacciones de liberación de citoquinas, tipo I (igE/no- igE) y reacciones mixtas, que suelen ser inmediatas, y tipo III y IV, que son no inmediatas. Figura 2 131
Epidemiología
El aumento del tratamiento con anticuerpos monoclonales ha conllevado una mayor incidencia de reacciones de hipersensibilidad. Las reacciones inmediatas varían del 5-10% con rituximab, 2-3% con infliximab, 3-22% con cetuximab y 0.6-5% con trastuzumab.132
Manifestaciones clínicas
Las reacciones inmediatas ocurren en las primeras horas de la administración, en la primera o subsecuentes aplicaciones. Las reacciones tardías aparecen en las primeras dos semanas de la infusión. Las reacciones de hipersensibilidad pueden ser leves a graves, incluso potencialmente mortales. El síntoma predominante es la erupción cutánea, seguido de afectación del sistema respiratorio y cardiovascular. 131
Fisiopatología
La inmunogenicidad es la capacidad de estos fármacos para inducir una respuesta inmune contra el propio fármaco, dando lugar a anticuerpos anti-fármaco. Por esta razón, las reacciones inmediatas y retardadas pueden dividirse en reacciones mediadas y no mediadas por estos anticuerpos.133
Diagnóstico
Se han reportado pruebas cutáneas positivas en pacientes con reacciones de hipersensibilidad a rituximab, anti-TNF y trastuzumab. De resultar negativas, pueden efectuarse pruebas intradérmicas. El estudio de Isabwe y colaboradores, en el que realizaron pruebas cutáneas para 10 anticuerpos monoclonales en 58 pacientes, reportó resultados positivos en el 41% de los casos, sobre todo en pacientes con fenotipo I. La prueba cutánea por punción positiva se asoció con mayor severidad de la reacción inicial. 129Sin embargo, gran parte de las pruebas cutáneas no están estandarizadas y se han realizado en pequeños grupos de pacientes, por lo que es imposible obtener valores de sensibilidad y especificidad.134El diagnóstico mediante pruebas in vitro de las reacciones de hipersensibilidad inmediatas confirma la respuesta inmune caracterizada por anticuerpos anti-fármaco. Diversos estudios demuestran una alta relación entre la detección de IgE sérica y la positividad de las pruebas cutáneas en anticuerpos monoclonales, aunque una limitante es la falta de estandarización de estos procedimientos. La sensibilidad del ImmunoCAP varía según el agente, por ejemplo la sensibilidad de cetuximab varía del 68 al 92 % y la especificidad del 90 al 92 % según la gravedad de la reacción de hipersensibilidad; mientras que la IgE antiinfliximab en ImmunoCAP tiene una sensibilidad del 26% y especificidad del 90%. Esto porque no todas las reacciones de hipersensibilidad a los biológicos son mediadas por IgE. La prueba de provocacion por vía oral es el método de elección para el diagnóstico de reacciones de hipersensibilidad a anticuerpos monoclonales. Las pruebas diagnósticas para reacciones de hipersensibilidad tardía abarcan las pruebas de parche, pero su implementación se discute en pacientes con reacciones graves a medicamentos, por lo que en éstos es preferible llevar a cabo la prueba de transformación de linfocitos.131
Tratamiento
El objetivo es garantizar que el paciente pueda seguir consumiendo los fármacos de primera línea con seguridad. La desensibilización permite administrar de manera segura los medicamentos que causan las reacciones de hipersensibilidad, al proporcionar tolerancia inmunológica temporal.131
Conclusiones
El diagnóstico de reacciones alérgicas a fármacos es desafiante y requiere un enfoque cuidadoso, sin importar qué medicamento específico esté implicado. El diagnóstico sigue siendo, en gran parte, clínico, con la ayuda de ciertas pruebas disponibles para algunas clases de fármacos.135 Figura 3
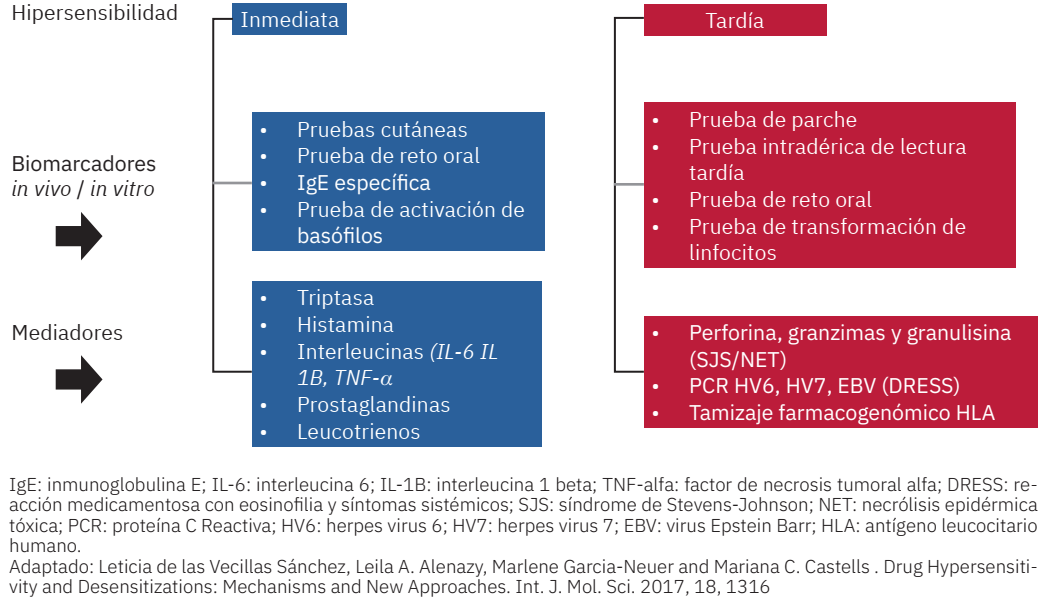
Figura 3 Biomarcadores y mediadores implicados en el diagnóstico de recciones de hipersensibilidad a medicamentos.
Comprender la epidemiología de las reacciones adversas a medicamentos en general sigue siendo una prioridad de investigación futura. La desensibilización permite continuar con el tratamiento de primera línea, sin prescribir otra alternativa igualmente eficaz, o cuando éste aumenta la esperanza y calidad de vida de los pacientes.
Debe aumentar la investigación básica colaborativa en la fisiopatología para comprender mejor este complejo conjunto de enfermedades asociadas o inducidas por exposiciones a medicamentos mediadas y no mediadas inmunológicamente.











 text new page (beta)
text new page (beta)