Introducción
Se define como enfermedades reumáticas autoinmunes a los trastornos de naturaleza autoinmune que afectan principalmente, pero no exclusivamente, las articulaciones y los músculos.1,2 Estas enfermedades reumáticas autoinmunes representan trastornos multisistémicos asociados a alta tasa de morbilidad y mortalidad, motivo por el cual son un problema importante de salud alrededor del mundo. A pesar de los avances en la medicina y el diagnóstico clínico, la causa de inicio de muchos de estos padecimientos continúa siendo desconocida y el conocimiento de los factores asociados a su exacerbación es limitado.1,3,4
Una de las hipótesis más aceptadas acerca del origen de estas enfermedades es que se deben a interacciones complejas entre factores genéticos y ambientales. Lo anterior conduce a una respuesta del tipo autoinmune inflamatoria que finalmente provoca los diversos tipos de enfermedades crónicas y autoinmunidad.1,5
Respecto a lo anterior, diversos reportes sugieren que infecciones previas representan una posible relación entre la pérdida de la tolerancia inmunológica y, por ende, el inicio de las enfermedades reumáticas autoinmunes, mientras que el desarrollo tardío de procesos alérgicos y reacciones de hipersensibilidad podría presentarse como comorbilidades asociadas a la exacerbación de estas.6,7,8,9
Las alergias y otros trastornos atópicos, incluidos la rinitis alérgica, el asma y la dermatitis atópica, son algunos de las afecciones crónicas más comunes que afectan a los seres humanos.10 Cifras de la Organización Mundial de la Salud afirman que existe un aumento constante en la prevalencia de enfermedades alérgicas en el mundo, con 30 a 40 % de la población global afectada por una o más enfermedades alérgicas.11
En este contexto, existen diversos mecanismos por los que una infección temprana puede alterar el sistema inmunológico. Estos incluyen la selección del repertorio de células B y células T y la inducción de la expresión de citocinas pro y antiinflamatorias.7 Por otra parte, se conoce que una dieta libre de gluten en pacientes con artritis reumatoide (AR) tiene propiedades antiinflamatorias y que las reacciones de hipersensibilidad ocasionadas por fármacos antirreumáticos son comunes en estos pacientes.12,13
En esta revisión analizaremos los aspectos básicos y generales de las enfermedades reumáticas autoinmunes y las alergias. También se profundizará sobre el posible vínculo entre las alergias como posible factor desencadenante de las enfermedades reumáticas autoinmunes y el desarrollo de procesos alérgicos y reacciones de hipersensibilidad a fármacos utilizados en el tratamiento de enfermedades reumáticas.
Métodos
Se realizó una revisión narrativa basada en evidencia de la literatura de aspectos básicos y generales de las enfermedades reumáticas autoinmunes y las alergias, la respuesta inmune contra alergias, inmunopatogénesis de las enfermedades reumáticas autoinmunes, alergias alimentarias en enfermedades reumáticas autoinmunes y reacciones de hipersensibilidad a fármacos utilizados en el tratamiento de enfermedades reumáticas. Se realizó la búsqueda de artículos publicados en PubMed de 2002 a 2021. Los términos utilizados en la búsqueda fueron los relacionados con los temas de interés como allergies, allergic, food allergies, rheumatic diseases, antirheumatic hypersensitivity, solas o combinadas con immune response, autoinmune, rheumatoid arthtritis, lupus y sjogren syndrome.
Aspectos básicos y generales de las alergias
El término alergia fue acuñado por Clemens von Pirquet en 1906 para describir la propensión de algunas personas a desarrollar signos y síntomas de reactividad o reacciones de hipersensibilidad cuando se exponen a determinadas sustancias.14 En la actualidad, se denominan enfermedades alérgicas (o atópicas) a las respuestas sintomáticas a antígenos ambientales, generalmente inofensivos, denominados alérgenos, cuya patogénesis se caracteriza por la población de células T cooperadoras 2 (células Th2), junto con el cambio de isotipo de las células B para generar inmunoglobulina tipo E (IgE) específica para los alérgenos.15,16,17
Dentro del término alergia se engloban diversos trastornos inmunológicos como la dermatitis atópica (también conocida como eccema), la rinoconjuntivitis alérgica, el asma alérgica y la alergia alimentaria.16 Estas enfermedades atópicas tienden a ocurrir en una progresión denominada marcha atópica, en la que la manifestación inicial de la enfermedad atópica en la infancia o la niñez temprana es a menudo dermatitis atópica, seguida por el desarrollo escalonado de alergia alimentaria, rinitis alérgica y asma alérgica.17 Aunque casi la mitad de la población urbana en todo el mundo es atópica (genéticamente predispuesta a producir anticuerpos IgE en suero) y la mayoría de las personas alérgicas son atópicas, es posible desarrollar alergias en ausencia de atopia; ejemplos comunes de esto son las alergias a los piquetes de avispas y abejas.15 Estudios epidemiológicos indican que la prevalencia de estos trastornos sigue aumentando alrededor del mundo, generalmente más elevada en los países desarrollados, con importantes consecuencias sanitarias y económicas.18,19
Respuesta inmune a las alergias
La respuesta inmune a alergias se caracteriza por la presencia de células como los mastocitos de células linfoides innatas tipo 2 (ILC2), basófilos, eosinófilos, así como células Th2 y células B productoras de IgE.20
Las reacciones alérgicas están bajo el control de eventos que ocurren secuencialmente después de la exposición al alérgeno (Figura 1):21,22
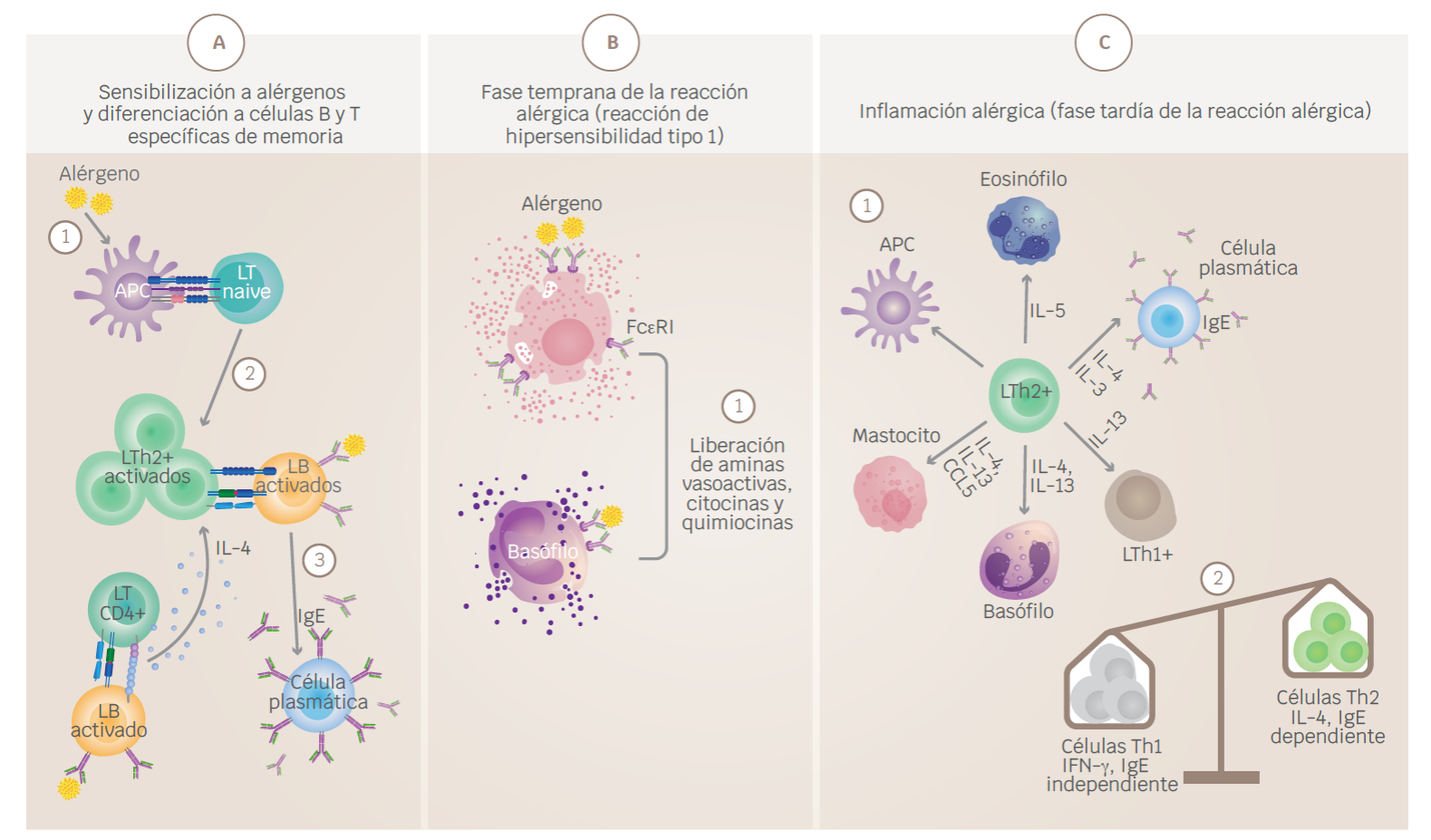
Figura 1 Inicio y desarrollo de las respuestas alérgicas. A) Sensibilización a alérgenos y desarrollo de células B y T específicas memoria. (1) La respuesta tiene inicio posterior a la exposición a un alérgeno, el cual será reconocido por las APC y presentado a las células T naive. (2) Esta interacción dará lugar a la diferenciación y expansión clonal de células T helper 2 (Th2). (3) Las células B que reconocen el alérgeno son activadas e interactúan con las células Th2, esta interacción favorece la diferenciación de las células B a células plasmáticas productoras de anticuerpos IgE. (4) La cooperación entre LTh y células B activadas favorece, además, el aumento en la expresión de citocinas como IL-4 y la diferenciación a células Th2. B) Fase temprana de la reacción alérgica (reacción de hipersensibilidad de tipo 1). (1) La IgE en conjunto con los antígenos forma complejos inmunes que se unen a los receptores de IgE de alta afinidad (FcεR1) en los basófilos y mastocitos, provocando la degranulación y liberación de mediadores proinflamatorios. C) Inflamación alérgica (fase tardía de la reacción alérgica). (1) Las exposiciones posteriores a alérgenos provocan el reclutamiento y activación de células inflamatorias y la liberación de mediadores inflamatorios. La presentación de antígenos local facilitada por IgE por las APC aumenta la activación de las células T. Los basófilos y mastocitos favorecen la exacerbación del proceso al expresar histamina, heparina y serotonina. Las células Th1 contribuyen también al proceso inflamatorio. Activación de mastocitos y basófilos, que liberan histamina, quimiocinas y otras citocinas, también contribuyen a la fase tardía de la reacción alérgica. (2) La transición de un estado de inflamación agudo a inflamación crónica está dominada por la activación de células proinflamatorias como LTh1. APC = célula presentadora de antígeno, IFNγ = interferón-γ, IL = interleucina, MHC = complejo mayor de histocompatibilidad, TNF = factor de necrosis tumoral. Modificada de Larché et al., 2006. Creado con BioRender.com
Reconocimiento por parte del sistema inmunológico.
Producción de IgE.
Interacción del alérgeno con células efectoras portadoras de receptores Fcε.
Esta respuesta tiene inicio con la interacción de los alérgenos con células presentadoras de antígenos (APC), las cuales posteriormente van a procesar y presentar el antígeno mediante el MHCII a células Th naive, las cuales se activarán y diferenciarán principalmente a células Th2, caracterizadas por sintetizar citocinas como IL-4, IL-5, IL-9 e IL-13.23,24,25 Una vez activadas, las células Th2 migrarán al sitio de inflamación y comenzarán a expresar las citocinas características de su perfil. La expresión de IL-4 induce la producción de IgE; posteriormente, la IgE en conjunto con los antígenos forman complejos inmunes que se unen a los receptores de IgE de alta afinidad (FcεR1) en los basófilos y mastocitos, provocando la degranulación y liberación de varios mediadores proinflamatorios, como histamina, heparina y serotonina, que a su vez son responsables de los síntomas de la respuesta alérgica temprana (aguda), incluida la broncoconstricción. Las exposiciones posteriores a alérgenos provocan el reclutamiento y activación de células inflamatorias y la liberación de mediadores, responsables de las respuestas alérgicas tardías. En este contexto, IL-5 es responsable de la activación de eosinófilos y su migración, lo cual favorece la inflamación en vías respiratorias. Por el contrario, IL-9 está más bien asociada con la activación de los mastocitos, mientras que IL-13 induce hiperplasia de células caliciformes, hipersecreción de moco e hiperreactividad del músculo liso.18,23
Enfermedades reumáticas autoinmunes
Las enfermedades reumáticas son una familia de más de 100 enfermedades crónicas y a menudo incapacitantes, caracterizadas por inflamación y pérdida de función, especialmente en las articulaciones, tendones, ligamentos, huesos y músculos. Algunos ejemplos de estos padecimientos son la AR, el lupus eritematoso sistémico (LES) y el síndrome de Sjögren (SS).1,26
Como fue mencionado anteriormente, las enfermedades alérgicas son principalmente mediadas por la respuesta del tipo Th2.20 La patogénesis de las enfermedades reumáticas autoinmunes está orquestada por las células Th1 y Th17 (AR) y Th2 en el caso del LES y SS.27,28,29
Artritis reumatoide
La AR es una enfermedad reumática de etiología desconocida, que se caracteriza por la inflamación articular, la cual puede desencadenar en daño al cartílago y resorción ósea, que en última instancia van a conducir a discapacidad irreversible.27,30
La patogénesis de la AR, manifestada en las articulaciones característica de esta enfermedad, refleja la inflamación de la membrana sinovial (sinovitis) como consecuencia de la respuesta autoinmune. La sinovitis se caracteriza por la infiltración y acumulación de células del sistema inmune y moléculas proinflamatorias en la membrana sinovial.27 En este proceso, las interacciones entre células B y células Th resultan en la activación y diferenciación de las células plasmáticas responsables de la producción de autoanticuerpos -principalmente factor reumatoide (FR) y anticuerpos contra péptidos citrulinados (ACPA)- estos últimos, capaces de reconocer péptidos propios estructurales como la vimentina citrulinada. Además, las células B activadas inducen la diferenciación de células T a células efectoras capaces de expresar citocinas proinflamatorias.31
Las células Th1 que producen citocinas proinflamatorias (IFN-γ e IL-2) son consideradas las principales efectoras en la patogénesis de la AR. Por su parte las células Th17 están también directamente asociadas con los mecanismos que promueven la inflamación por la secreción de IL-17, IL-21, IL-22 y TNF-α, que estimulan la diferenciación de los osteoclastos y promueven la destrucción de cartílago y hueso.32,33
Lupus eritematoso sistémico
De forma similar a la AR, la patogénesis del LES depende de la pérdida de tolerancia y la producción sostenida de autoanticuerpos, sus diferencias recaen en las poblaciones celulares predominantes en cada proceso patológico, así como en las manifestaciones inflamatorias sistémicas.28,34
El inicio y desarrollo del LES depende principalmente de la pérdida de tolerancia inmunológica y de que las células B mantengan una producción sostenida de autoanticuerpos; las células B son responsables de la producción de una serie de autoanticuerpos contra constituyentes solubles y celulares, como los antígenos nucleares (ANA).28,35
Los interferones (IFN) de tipo I y otras citocinas como BLyS/BAFF promueven la supervivencia y diferenciación de las células B y la pérdida de la tolerancia. Una vez activadas, las células B maduran, se expanden y comienzan a secretar anticuerpos, lo cual potencia la respuesta inmunitaria adaptativa. Los autoanticuerpos identificados en el LES son generalmente IgG de alta afinidad, lo que sugiere que han surgido en centros germinales, donde las células Th cooperan para el cambio de clase. Al igual que las células B, las células T presentan una hiperactivación generalizada y se ha descrito que los pacientes con LES presentan un perfil de citocinas de células T desequilibrado que se caracteriza por una disminución de IL-2 y un aumento de los niveles de IL-17.28
Debido a que la producción de autoanticuerpos es un sello distintivo en la patología del lupus, la positividad a ANA se ha propuesto como criterio para la clasificación del LES.36
Síndrome de Sjögren
El SS se puede clasificar en dos formas: síndrome de Sjögren primario (SSp), caracterizado por xerostomía (boca seca), queratoconjuntivitis seca (sequedad ocular) y otros trastornos sistemáticos sin una enfermedad autoinmune asociada: y síndrome de Sjögren secundario, caracterizado por queratoconjuntivitis y xerostomía asociada con un trastorno autoinmune, por ejemplo, AR o LES.29,37
La patogénesis de esta enfermedad implica un proceso inflamatorio que se caracteriza por la infiltración linfocítica en glándulas exocrinas y otros tejidos. Las respuestas inmunes en la glándula salival durante el SS comprenden la activación de respuestas inmunes innatas y adaptativas. Los tres principales factores importantes para el desarrollo del SS son la pérdida de tolerancia inmunológica; respaldado por niveles elevados de IFN, probablemente asociados con una infección viral previa. Posteriormente, ocurre el aumento de la apoptosis de las células acinares y de las células epiteliales de las glándulas salivares, lo cual provoca la activación de las células T y de las células asesinas naturales (NK) a través de citocinas proinflamatorias. A partir de entonces, se establecen focos linfocíticos con el reclutamiento de células B y APC.29
La disfunción de las glándulas exocrinas se produce junto con la presencia de autoanticuerpos. Los autoanticuerpos anti-Ro/SSA y anti-La/SSB así como citocinas del perfil Th2 como IL-10 están elevadas en la saliva de los pacientes con SS y se correlacionan con la gravedad de la enfermedad.37 A pesar de que las células B producen autoanticuerpos, el SS está dominado por células T en las primeras etapas de la enfermedad.29
La posible relación entre la patogénesis de enfermedades reumáticas autoinmunes y las alergias
Las reacciones alérgicas de tipo I son reacciones de hipersensibilidad clásica, impulsadas por células Th2 y mediadas principalmente por en el reconocimiento de IgE de alérgenos ambientales por las IgE. La exposición de individuos alérgicos a alérgenos exógenos conduce a una inflamación de tipo inmediata causada por degranulación de mastocitos a través de complejos inmunes de alérgenos/IgE y la liberación de mediadores inflamatorios, proteasas y citocinas proinflamatorias. En algunos casos, la inflamación alérgica puede ocurrir y persistir en ausencia de exposición a alérgenos exógenos y, paradójicamente, podría incluso ser similar a una reacción inflamatoria crónica mediada por células Th1 (Figura 2).38 A continuación, se describen algunos procesos alérgicos y sus mediadores, los cuales han sido previamente asociados con el desarrollo y exacerbación de enfermedades reumáticas autoinmunes.
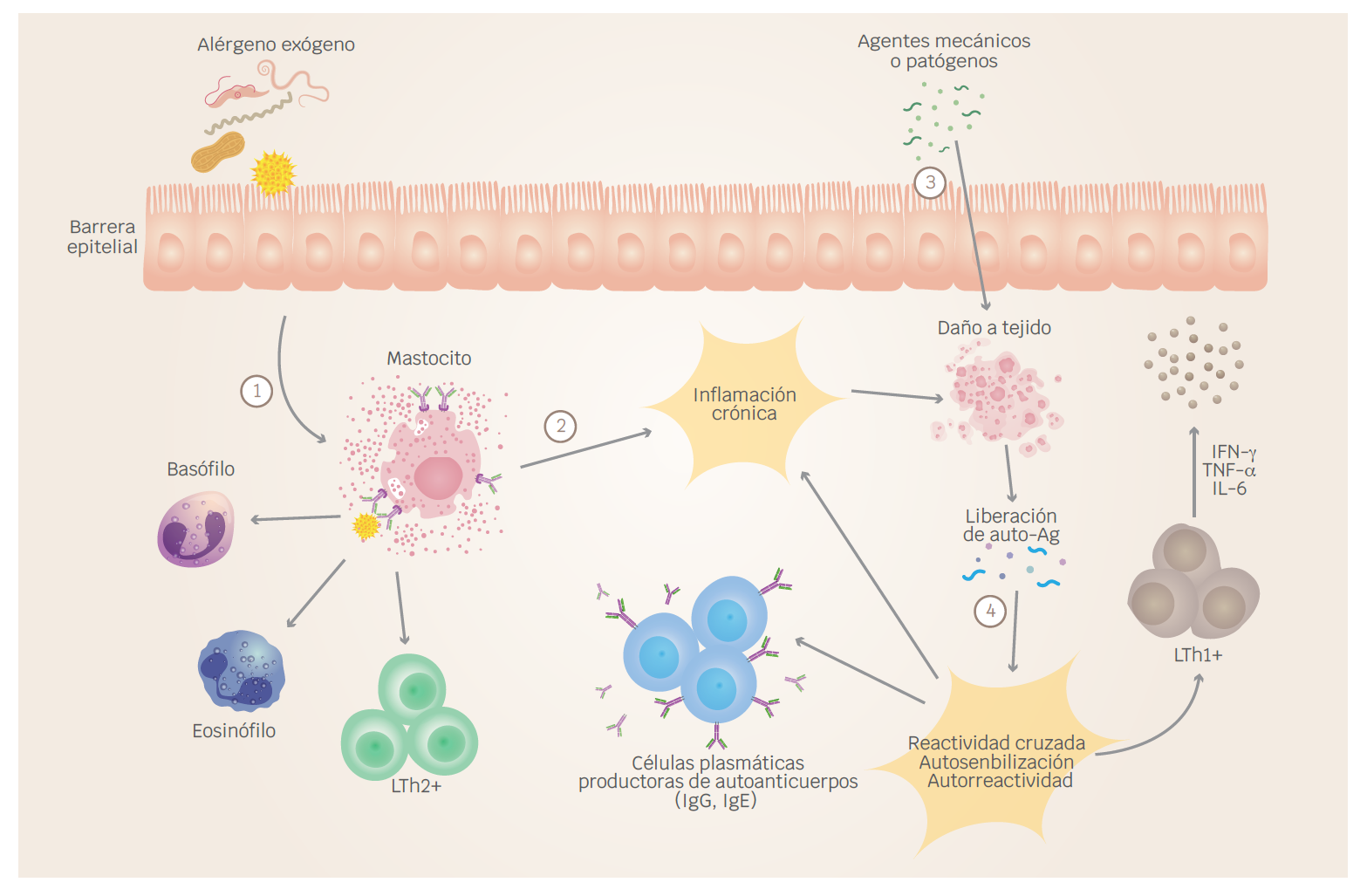
Figura 2 Posible asociación entre respuestas alérgicas y el desarrollo de autoinmunidad. (1) La exposición a alérgenos exógenos inicialmente conducirá a inflamación alérgica prolongada y liberación de mediadores proinflamatorios por las células involucradas. (2) El daño tisular puede ocurrir en personas atópicas antes y después de la sensibilización alérgica a alérgenos exógenos debido a factores mecánicos, fisicoquímicos o patógenos. (3) En pacientes sensibilizados, el contacto con alérgenos exógenos conduce a una inflamación alérgica, que causa daño tisular. (4) Como resultado del daño tisular debido a factores exógenos, se liberan autoantígenos que pueden causar autosensibilización, inflamación alérgica a través de mecanismos dependientes de IgE o activación de células Th1 que pueden conducir a daño tisular independiente de IgE y perturbación de la integridad epitelial. El daño de la barrera epitelial por mecanismos mediados por Th1 podría aumentar la penetración de alérgenos exógenos y la inflamación alérgica y facilitar la transición de patógenos a través de barreras epiteliales que promueven infecciones. Ag = antígeno, IFN-γ = interferón-γ, IL = interleucina, TNF = factor de necrosis tumoral. Modificada de Valenta et al., 2008. Creado con BioRender.com
Alergias alimentarias
La alergia alimentaria se define como “un efecto adverso para la salud que surge de una respuesta inmune específica producida de forma reproducible tras la exposición a un alimento determinado”. Estas reacciones son generalmente inmediatas y ocurren cada vez que se ingiere el alimento, incluso en pequeñas cantidades.39,40 Estos trastornos pueden desencadenar síntomas clínicos como trastornos gastrointestinales, urticaria e inflamación de las vías respiratorias, con una gravedad que varía de leve a potencialmente mortal.17 Además, está reportado que este tipo de alergias son muy frecuentes en la población (hasta 10% de afectados) y que su prevalencia alrededor del mundo ha incrementado en las últimas décadas, la cual es más elevada en niños en comparación con los adultos.41
Los principales alérgenos alimentarios son las glucoproteínas de 10 a 70 kDa, que abundan en los alimentos alergénicos. Los alérgenos alimentarios son generalmente solubles en agua y resistentes al calor, el ácido y la proteólisis, lo que les permite sensibilizar el tracto gastrointestinal del huésped.40 Dependiendo de los mecanismos inmunológicos fisiopatológicos detrás de una alergia alimentaria, estas se pueden clasificar como mediadas por IgE, no mediada por IgE (mediada por células) o mixtas (mediada por IgE y por células).39 Estos trastornos pueden desencadenar síntomas clínicos como los gastrointestinales, urticaria e inflamación de las vías respiratorias, con una gravedad que varía de leve a potencialmente mortal.17
Alergias alimentarias en enfermedades reumáticas autoinmunes
Las alergias alimentarias suelen estar mediadas por anticuerpos IgE dirigidos a proteínas específicas de alimentos; sin embargo, al igual que en enfermedades reumáticas autoinmunes, otros mecanismos inmunológicos mediados por células o citocinas involucradas también pueden desempeñar un papel importante. Las alergias alimentarias pueden ser la causa o el motivo de exacerbación de reacciones alérgicas agudas, como la anafilaxia, y de problemas crónicos de salud, como el asma y trastornos gastrointestinales. Este mismo fenómeno se ha observado en enfermedades reumáticas autoinmunes, lo cual podría ser explicado por los mecanismos inmunológicos compartidos entre estas patologías.42
Con base en la anterior, se han realizado diversos estudios cuyo objetivo ha sido asociar directamente el consumo de alimentos específicos con las características clínicas de las enfermedades reumáticas autoinmunes. A continuación, se mencionan algunos de los resultados más relevantes:
En un estudio realizado en pacientes con AR donde los pacientes fueron “retados” con distintos alérgenos se observó que las variables clínicas de rigidez, dolor, la evaluación global de la actividad de la enfermedad por parte del médico y el paciente, el índice de Ritchie, la proteína amiloide A sérica, la velocidad de sedimentación globular (VSG) y la proteína C reactiva (pCr) aumentaron tras los retos alimentarios.42 En otro estudio realizado en pacientes con SSp se evaluó la respuesta de la mucosa rectal después del reto con proteína de leche de vaca, con el fin de evaluar la posible relación entre su consumo con los síntomas intestinales que se observan en SSp. Los resultados demostraron que se desarrolló una respuesta inflamatoria de la mucosa rectal posterior a la exposición de estas proteínas en 38 % de los pacientes con SSp.43 En otro estudio de Hvatum realizado en 2006, en pacientes con AR se midieron los anticuerpos IgG, IgA e IgM contra los antígenos de la dieta (leche de vaca [alfa-lactoalbúmina, beta-lactoglobulina, caseína], cereales, huevo de gallina [ovoalbúmina], bacalao y carne de cerdo) en suero y líquido de perfusión del yeyuno para determinar la asociación entre la respuesta inmune sistémica y de mucosas. En este trabajo se concluyó que la producción de anticuerpos de reacción cruzada aumenta en el intestino de los pacientes con AR. Los problemas relacionados con la comida se reflejan como un efecto aditivo adverso de múltiples reacciones de hipersensibilidad mediadas, por ejemplo, por complejos inmunes que promueven reacciones autoinmunes en las articulaciones.44
Por otro lado, ciertos alimentos están asociados más bien con la disminución en los síntomas de estas enfermedades. Un ejemplo son los ácidos grasos, de los cuales el desequilibrio de los ácidos grasos saturados e insaturados, así como los ácidos grasos poliinsaturados n-6/n-3 tiene efectos sobre la homeostasis del sistema inmunológico. Respecto a la AR, existen reportes que indican que un incremento en la ingesta de ácidos grasos poliinsaturados n-3 se correlaciona negativamente con el dolor articular; de la misma manera, los niveles de estos ácidos grasos en líquido sinovial se correlacionan inversamente con la puntuación del dolor.45 Lo anterior se explica debido a la capacidad de los ácidos grasos poliinsaturados n-3 para reducir los mediadores inflamatorios, la quimiotaxis de los leucocitos y la expresión de moléculas de adhesión; además, está reportado que los pacientes con enfermedades reumáticas autoinmunes como AR, LES y el SS suelen tener alteraciones en el perfil de lípidos séricos con niveles más bajos de ácidos grasos poliinsaturados en suero.45
Otra condición que también se ha asociado con enfermedades reumáticas es la enfermedad celiaca. La enfermedad celiaca es una enteropatía autoinmune por exposición al gluten que ocurre en sujetos genéticamente predispuestos. Esta enfermedad se caracteriza por una respuesta inmune al gluten con la producción de autoanticuerpos (antitransglutaminasa tisular y antiendomisio), con infiltración del epitelio intestinal por células T (linfocitosis intraepitelial) que, cuando es grave, lleva a la atrofia de las vellosidades intestinales.46 Se estima que la incidencia de la enfermedad celiaca es de 1 % de la población mundial, también se reconoce que cualquier tipo de inflamación gastrointestinal puede generar artralgia o artritis secundaria que afecta más comúnmente a muñecas, rodillas y tobillos.47
IL-33, actor principal en alergias
La interleucina (IL) 33 es una citocina que también ha sido descrita como una “alarmina” que pertenece a la familia de IL-1. Esta citocina es expresada constitutivamente por células estructurales y de revestimiento que incluyen a los fibroblastos, a las células endoteliales y epiteliales de la piel, el tracto gastrointestinal y los pulmones.48,49
La IL-33 ejerce sus efectos sobre sus células diana (principalmente células T reguladoras y eosinófilos), uniéndose a un receptor heterodimérico compuesto por ST2, también conocido como IL-1RL1 y al correceptor denominado proteína accesoria del receptor de IL-1 (IL-1RAcP). El complejo IL-33/ST2/IL1RAcP induce la dimerización del dominio del receptor de interleucina de peaje, que conduce a la activación de la señalización intracelular a través del adaptador de la respuesta primaria de diferenciación mieloide 88, cinasa asociada al receptor de interleucina 1 y 4, y factores asociados con el receptor del factor de necrosis tumoral 6, que culmina en la activación de las proteínas cinasas activadas por mitógenos y los factores de transcripción del factor nuclear kappa B, promoviendo así la cascada de proteínas proinflamatorias.49,50
La IL-33 desempeña un papel crucial en la modulación del funcionamiento de las células inmunitarias en varias afecciones, como el asma y las enfermedades pulmonares.48,49 En este sentido, se conoce que la IL-33 favorece las respuestas del tipo Th2 y está involucrada en la inflamación de las vías respiratorias. Además, algunas variantes de un solo nucleótido (SNV) que favorecen la expresión de los genes IL-33 y ST2 se ha asociado con la susceptibilidad a enfermedades alérgicas como asma.50,51
IL-33 en enfermedades reumáticas autoinmunes
En años recientes se ha investigado el papel de esta citocina en enfermedades reumáticas por su capacidad como agente inmunomodulador de la respuesta inmune. Algunos de los efectos descritos para IL-33 en enfermedades reumáticas se describen a continuación.
Se ha demostrado que IL-33 contribuye a la patogénesis de la AR debido a su capacidad de incrementar la producción de mediadores inflamatorios, tales como citocinas y quimiocinas. En un estudio realizado por Xu et al. en 2008 se detectó la expresión de IL-33 en tejido sinovial de pacientes con AR, además se demostró que existe una relación entre ST2/IL-33 y la producción de IL-17 en un modelo murino de artritis inducida por colágeno, lo cual se sugiere que ocurre indirectamente por la capacidad de IL-33 de inducir la expresión de IL-1 e IL-6 en mastocitos. Con los hallazgos anteriores, se ha denominado a la IL-33 como un secretagogo importante de citocinas proinflamatorias que participan en el proceso patogénico de la AR.52
En otro estudio de 2010 realizado por Verri et al. se reportó que IL-33 está directamente asociada a la migración de neutrófilos, mientras que en ese mismo año otro grupo de investigadores estableció que los niveles séricos de IL-33 se encuentran incrementados en pacientes con AR, y que este incremento se relaciona con aumento en la producción de TNF-α.53,54
Años más tarde, Hong et al. encontraron una asociación similar y reportaron niveles séricos de IL-33 más elevados en pacientes con AR (294.9 ± 464.0pg/mL) que en controles sanos (96.0 ± 236.9pg/mL). Estos niveles también se encontraron incrementados en el líquido sinovial de los pacientes con AR en comparación con el de pacientes con osteoartritis. Aunado a esto, los niveles séricos de su receptor (sST2), fueron mayores en los pacientes con AR que en los controles sanos. Además, se encontró una correlación positiva entre los niveles de IL-33 con IL-1β (r=0.311, p=0.005), e IL-33 e IL-6 (r=0.264, p=0.017).55
Otro estudio realizado por Chen et al., en 2017 señala que la citocina IL-10 (principalmente inmunosupresora) se correlaciona inversamente con los niveles de IL-33 en un modelo murino de artritis inducida por de colágeno, además se observó que IL-10 tiene un efecto supresor sobre la producción de IL-33 en macrófagos y que los genes proinflamatorios estimulados por IL-33 se incrementan notablemente en ratones knockout IL-10 (-/-) con artritis inducida por colágeno.56
En un estudio publicado por Wu et al. en 2020 se evaluó la correlación de IL-33 con otras citocinas y quimiocinas en el suero y la sinovia; en este estudio se determinó in vitro la respuesta de los sinoviocitos similares a fibroblastos al tratamiento con diferentes concentraciones de IL-33. Los resultados mostraron una asociación de los niveles de IL-33 con múltiples citocinas y quimiocinas en el líquido sinovial, incluidas IL-6, IL-1β, IL-8, MIG e IP-10. Además, los experimentos in vitro confirmaron que la IL-33 también ejercía un efecto regulador dependiente de la dosis sobre la función del sinoviocito similar a fibroblasto.57
Al igual que en AR, la posible asociación entre la patogénesis del LES e IL-33 va de la mano con su capacidad de inducir la expresión de otras citocinas proinflamatorias, así como de su función como “alarmina”; también es conocida por su patrón molecular asociado a daño (DAMP), que se libera de las células necróticas para provocar daño local o inflamación sistémica. La IL-33 es una citocina bioactiva, que puede ser liberada a través de la necrosis celular para desencadenar la inflamación de forma autocrina o paracrina. Posterior a su expresión inicial, la producción de IL-33 se regula al alza en los tejidos inflamados, lo que contribuye a una mayor amplificación de las respuestas inflamatorias.58
Estudios recientes indican que SNV del gen de IL-33 se asocia a susceptibilidad de LES, así como a la expresión de la forma soluble de IL-33 y otros marcadores de inflamación. En un estudio realizado por Xu et al. se encontró también asociación del genotipo polimórfico (G/G) del SNV rs1929992 del gen de IL-33 con susceptibilidad a LES (p=0.017, RM=1.714, IC 95%). Con base en lo anterior, los autores concluyeron que esa variante podría ser un biomarcador para susceptibilidad a esta enfermedad en población china.59 En forma semejante, en otro estudio de Guo et al. se reportó que los niveles séricos de IL-33 se encuentran incrementados en pacientes con LES de China; en ese trabajo, además se encontró una asociación del alelo C de la variante rs1891385 con un riesgo significativamente mayor de LES en comparación con el alelo A (RM = 1.405, IC 95% = 1.052-1.875, p=0.021). Además, se encontró una fuerte asociación entre los niveles séricos de IL-33 y los valores elevados de pCr y VSG.60
Adicionalmente, en un trabajo realizado por Li et al. se demostró que el bloqueo de IL-33 podría ser efectivo como tratamiento para LES. En este estudio se evaluó en un modelo murino el bloqueo de IL-33 con un anticuerpo anti-IL-33 mediante inyección intraperitoneal y se comparó la supervivencia, marcadores de inflamación y daño renal con un grupo control. Los resultados de este estudio mostraron que los ratones tratados con el anticuerpo anti-IL-33 presentaron proteinuria reducida, así como niveles reducidos de anti-dsDNA en suero. De la mima manera, la nefritis, los depósitos de inmunocomplejos y los anticuerpos circulantes, además de la mortalidad, se redujeron significativamente con el tratamiento con anti-IL-33. Estos resultados demuestran contundentemente el papel de IL-33 en el desarrollo del LES.
Como en las enfermedades reumáticas autoinmunes mencionadas, en la fase aguda del SSp, la inmunidad innata es particularmente activa con desregulación de citocinas y quimiocinas proinflamatorias. En este sentido, la IL-33 ha sido estudiada como un posible factor asociado a la patogénesis de esta enfermedad por su papel en otras enfermedades inmunes y autoinmunes.
Existen reportes que marcan una asociación directa entre los niveles de IL-33 y el SSp. En un estudio por Awada et al. se reportó un incremento en los niveles elevados de IL-33 y los de la forma soluble del receptor ST2 en pacientes con SSp, en comparación son sujetos control y pacientes con LES. En este trabajo, además, se reportó que IL-33 actúa de forma sinérgica con IL-12 e IL-23 para promover la producción de IFN-γ y de esta manera favorecer el proceso inflamatorio en estos pacientes.61 Min Juang et al. reportaron resultados similares con respecto al incremento de los niveles séricos de IL-33 y ST2 en pacientes con SSp.62
Posteriormente, en 2016, se analizó la expresión de IL-33 y su receptor ST2 en pacientes con SSp y sujetos control, los resultados mostraron una hiperexpresión de ST2 en sueros de pacientes en comparación con sujetos sanos. Además, los niveles séricos de sST2 correlacionaron positivamente con el índice de actividad SSDAI (r=0.662, p=0.007).63
Reacciones de hipersensibilidad a fármacos y enfermedades reumáticas autoinmunes
En general, los pacientes con enfermedades reumáticas autoinmunes como la AR tienen más riesgo a padecer infecciones que la población general, y las complicaciones de la infección también son causas importantes de mortalidad y morbilidad en estos pacientes.64
De acuerdo con Chiu y Chen, las razones de una mayor tasa de infección en la AR pueden estar relacionadas con la inmovilidad asociada con la enfermedad activa, tabaquismo, la presencia de enfermedad pulmonar inflamatoria y una inmunosupresión causada por la enfermedad en sí o los medicamentos utilizados.64
Los fármacos antirreumáticos modificadores de la enfermedad (FARME) están indicados para el tratamiento de varias artritis inflamatorias, incluidas AR, LES y SSp, así como para el tratamiento de otras enfermedades del tejido conectivo y algunos cánceres.65 Por definición, los FARME son agentes inmunosupresores e inmunomoduladores y se clasifican como FARME convencionales o FARME biológicos. Algunos de los FARME convencionales más utilizados en el tratamiento de estas enfermedades son metotrexato, leflunomida, hidroxicloroquina y sulfasalazina.65
Otros fármacos ampliamente utilizados para el tratamiento de las enfermedades reumáticas son los corticosteroides y en contraparte se encuentran los fármacos antiinflamatorios no esteroideos (AINE).32,33 En estudios previos, todos los medicamentos mencionados han sido asociados con reacciones de hipersensibilidad, caracterizados por una respuesta inmune excesiva o patógena a antígenos propios o extraños, esto debido a que estos medicamentos actúan directa o indirectamente al suprimir la respuesta inmune por diversos mecanismos y, en casos aislados, por la formulación de estos mismos, ocasionando así mayor susceptibilidad a este tipo de reacciones (Figura 3).64,66
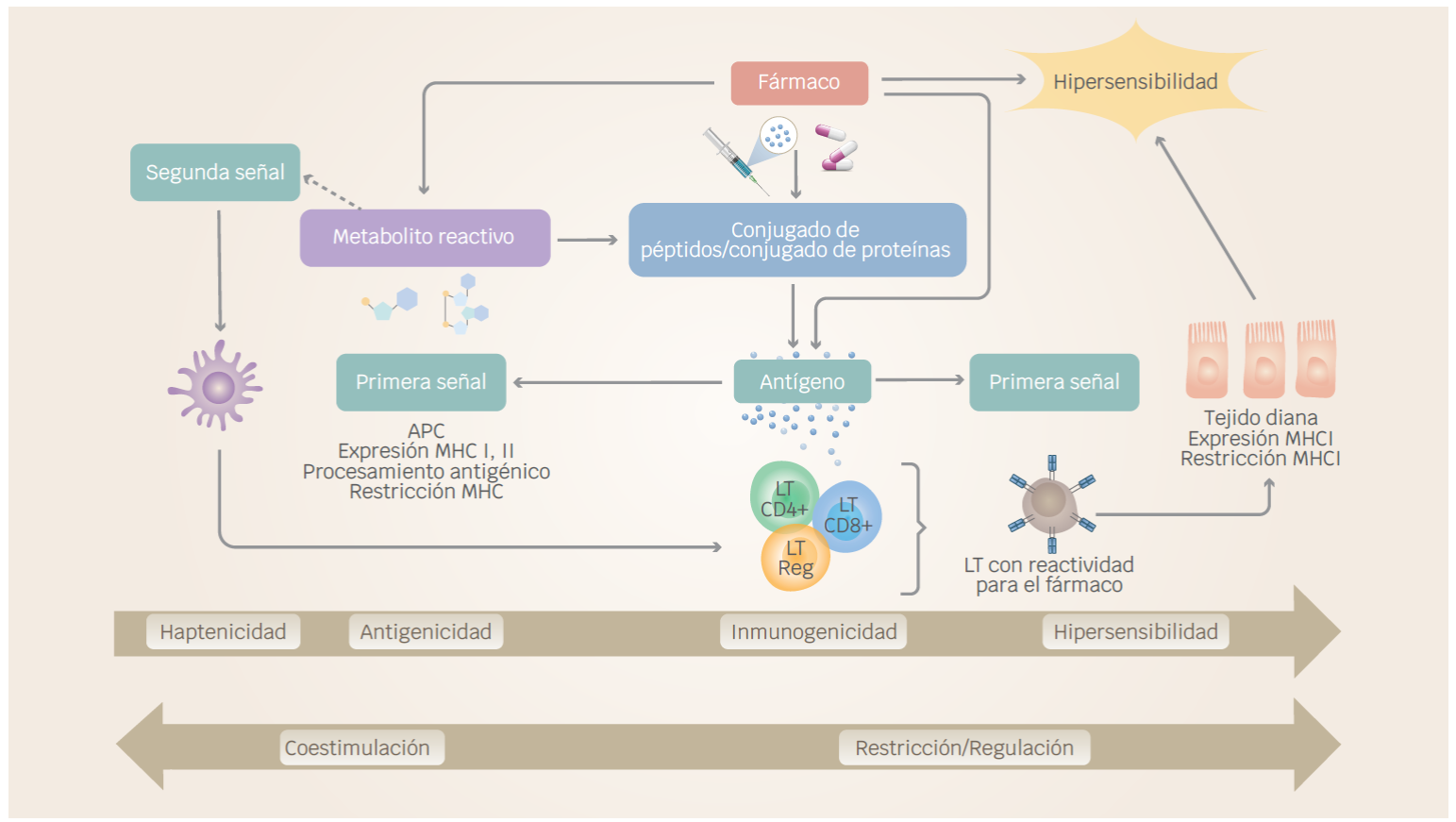
Figura 3 Reacciones de hipersensibilidad ocasionadas por fármacos. Múltiples eventos de iniciación molecular, incluidos la formación de metabolitos, conjugación del fármaco a proteína e interacción directa del fármaco y las moléculas del MHC, puede proporcionar la primera señal. Para que proceda una respuesta, habrá una regulación mediante coestimuladores (segunda señal) y moléculas coestimuladoras, lo que resulta en manifestaciones clínicas variables de hipersensibilidad a fármacos. Modificada de Valenta et al., 2008. Creada con BioRender.com
A continuación, se mencionan algunos de los estudios más relevantes:
En 2008, el grupo de Smitten realizó un estudio de cohorte retrospectivo (1999-2006) en el que se tuvo como objetivo determinar si los pacientes con AR tienen mayor riesgo a desarrollar infecciones y si este varía según el tratamiento de la AR. Los resultados mostraron que los individuos con AR que tenían prescritos diferentes esquemas de FARME presentaban un mayor riesgo de ser hospitalizados por infecciones en comparación con aquellos sin AR.67 En otro estudio de cohorte que siguió a 171 pacientes con AR que usaban leflunomida, la incidencia de infección grave fue de 3.3 % persona-año. Sin embargo, la mayoría de esos pacientes se encontraba en terapias combinadas con corticosteroides o metotrexato, que también están asociados a riesgo de infección.68 Recientemente, en el trabajo realizado en 2017 por Cildag y Senturk se buscó definir la frecuencia de las reacciones de hipersensibilidad ocasionadas por el tratamiento con sulfasalazina, las cuales se registraron en al menos 12 de ellos (8.8%).69
Los FARME no son los únicos medicamentos indicados para pacientes con enfermedades reumáticas; los corticosteroides y los AINE también desempeñan un papel importante en el tratamiento de estas enfermedades y, a su vez, están asociados al desarrollo de reacciones de hipersensibilidad. Respecto a los corticosteroides, se ha informado que las reacciones de hipersensibilidad mediadas por IgE son comunes, la mayoría de las veces debido a los excipientes en las formulaciones de los esteroides. En particular, dos excipientes, polietilenglicol y carboximetilcelulosa parecen de particular importancia, pero también se han informado casos de reacciones al polisorbato 80 y lactosa.70 Se estima que la prevalencia general de hipersensibilidad tipo I causada por el uso de esteroides es de 0.3 a 0.5%.71 Respecto a los AINE, se ha descrito también que estos son capaces de inducir una amplia gama de reacciones adversas relacionadas con sus propiedades farmacológicas.72
Conclusiones
En general, las enfermedades reumáticas autoinmunes tienen alta prevalencia en todo el mundo y son altamente incapacitantes para quienes las padecen. Una de las principales limitaciones en la actualidad para el manejo de estas enfermedades es que el factor desencadenante de muchas de ellas sigue siendo desconocido y el conocimiento de los factores asociados con su exacerbación es limitado.
En este contexto, se conoce que existen diversos mecanismos por los que una infección temprana puede alterar el sistema inmunológico. La exposición de individuos alérgicos a alérgenos exógenos conduce a una inflamación de tipo inmediata causada por degranulación de mastocitos a través de complejos inmunes de alérgenos/IgE y la liberación de mediadores inflamatorios, proteasas y citocinas proinflamatorias. En algunos casos, la inflamación alérgica puede ocurrir y persistir en ausencia de exposición a alérgenos exógenos y, paradójicamente, podría incluso ser similar a una reacción inflamatoria crónica mediada por Th1. Además, las reacciones de hipersensibilidad en respuesta a los efectos e incluso formulaciones de los fármacos utilizados para el tratamiento de estas enfermedades podría contribuir a la amplificación del proceso inflamatorio. Es necesario realizar más estudios con el fin de asociar contundentemente el papel de las alergias en el inicio y desarrollo de las enfermedades reumáticas autoinmunes.











 text new page (beta)
text new page (beta)



