Introducción
La urticaria se define como la presencia de eritema y edema de la capa superficial de la piel o las mucosas.1 Las lesiones individuales por lo general son muy pruriginosas y pueden variar en tamaño, desde pequeñas ronchas o habones hasta grandes placas; no pigmentan, no causan ardor y tienden a resolverse completamente entre las 12 y 48 horas.2 Con base en el tiempo de evolución, la urticaria se puede clasificar en aguda o crónica, así como en espontánea o inducible de acuerdo con la causa. Esta enfermedad se puede presentar concomitantemente con angioedema, edema de aparición súbita que afecta el tejido celular subcutáneo, las capas profundas de la dermis y la mucosa.3
La urticaria crónica se define como la presencia de habones, diariamente o durante la mayor parte de los días, durante más de seis semanas. Se puede clasificar como espontánea o inducible aproximadamente en 40 y 60 % de los casos, respectivamente.1,4 En la urticaria crónica inducible (UCI), los síntomas son desencadenados por estímulos físicos como aumento de la temperatura corporal (colinérgica), frío, presión o roce de la piel (facticia o dermografismo). La urticaria crónica idiopática o espontánea (UCE) se presenta en 0.5 a 1 % de los casos5 y puede ser altamente incapacitante.6
Para establecer el diagnóstico de urticaria crónica, lo más relevante es la historia clínica y el examen físico. Se debe considerar la historia familiar de urticaria o atopia, el tiempo de evolución, la frecuencia y variación diaria de los síntomas, la presentación durante los fines de semana, días festivos, vacaciones, viajes, etcétera; el tamaño y la forma de las lesiones, la asociación con síntomas subjetivos (prurito o ardor), la presentación concomitante con angioedema y los factores desencadenantes (ejercicio, factores físicos, consumo de antiinflamatorios no esteroideos [AINE], anticonceptivos orales y alimentos).1 La escala UAS7 (Urticaria Activity Score) se utiliza para clasificar el impacto de la sintomatología en los pacientes y evaluar la gravedad y actividad de la urticaria crónica de forma objetiva; representa la herramienta más empleada en el mundo.7
Las guías internacionales EAACI/GA²LEN/EDF/WAO indican que los antihistamínicos anti-H1 de segunda generación (anti-H1sg) constituyen el tratamiento de primera línea de la UCE, con eficacia en 45 a 60 % de los casos.1 Si los síntomas persisten por más de dos semanas a pesar del tratamiento, se puede aumentar la dosis estándar del anti-H1sg hasta un máximo de cuatro veces.1 Para los casos refractarios se recomienda el uso de omalizumab (anti-IgE) por al menos seis meses; si el control es inadecuado o los síntomas intolerables, se aconseja emplear ciclosporina.1
La literatura científica de caracterización de los pacientes con urticaria crónica es escasa y predominan los estudios retrospectivos mediante encuestas. Nuestro estudio de investigación tiene como objetivo describir el perfil clínico y de laboratorio de los pacientes diagnosticados con urticaria crónica en la consulta externa de alergología en un hospital de tercer nivel de atención del sistema de seguridad social de Costa Rica.
Métodos
La Unidad de Alergología del Hospital San Juan de Dios, de tercer nivel de atención del sistema de seguridad social de Costa Rica, se constituyó oficialmente en 2019; sin embargo, desde 2010 se recolectó la información de los pacientes valorados en la consulta externa, mediante una base de datos prospectiva y sistematizada en la cual se registraron variables clínicas, epidemiológicas y de laboratorio relevantes, con el fin de analizar las patologías atendidas y optimizar los recursos destinados a esta consulta.
Como criterios de selección se incluyeron todos los pacientes mayores de 13 años diagnosticados con urticaria crónica entre el 1 de enero de 2014 y el 31 de diciembre de 2018, con al menos dos registros en la consulta externa de la Unidad de Alergología. No se realizó ninguna exclusión basada en el sexo, etnia, clases especiales o participantes vulnerables.
Se realizó un estudio retrospectivo a partir de la base de datos de los pacientes registrados, incluyendo variables clínicas y epidemiológicas como edad, sexo, domicilio, tipo de urticaria, tiempo de evolución, comorbilidades asociadas y tiempo de seguimiento en la consulta externa de la Unidad de Alergología. Se registraron variables de laboratorio como recuento de los leucocitos totales, conteo de eosinófilos séricos, velocidad de eritrosedimientación (VES), proteína C reactiva (PCR), anticuerpos antinucleares, antitiroglobulina y antitiroperoxidasa, hormona estimulante de la tiroides (TSH), estudio coproparasitológico, pruebas de punción cutánea para alimentos y reportes de biopsia de piel. Se recolectó información referente al tratamiento utilizado en la primera y última consulta registradas (anti-H1sg: loratadina, cetirizina y fexofenadina; anti-H1 de primera generación [anti-H1 pg]: clorfenhidramina, hidoxizina, y difenhidramina), medicamentos inmunomoduladores (prednisona, metotrexate y ciclosporina) y anticuerpo monoclonal (omalizumab).
Para el análisis de los datos se utilizó estadística descriptiva, medidas de tendencia y de dispersión para las variables cuantitativas, así como distribuciones de frecuencia para las variables cualitativas. La comparación de las variables cuantitativas se realizó mediante análisis de varianza y prueba t para muestras independientes. Se utilizaron los programas Think Cell versión 10 y SPSS versión 23.
Este protocolo fue aprobado por el Comité Ético Científico del Hospital San Juan de Dios (CEC-HSJD-18-2018) conforme estándares éticos, valores bioéticos, los principios establecidos en la Declaración de Helsinki y la normativa nacional e internacional.
Resultados
Se analizaron los datos de 307 pacientes atendidos entre 2014 y 2018, de los cuales 160 se diagnosticaron con urticaria crónica; 80.6 % fue del sexo femenino, para una relación de 4:1 respecto al masculino. La edad media de los pacientes fue de 41.2 ± 15.5 años, con un rango de 13 y 78 años; 45.6 % tenía edad entre 30 y 49 años y 13.1 %, ≥ 60 años. El tiempo medio de evolución de los síntomas antes de consultar a la Unidad de Alergología fue de 3.1 ± 5.4 años, 1.3 años en los hombres y 3.6 años en las mujeres (p < 0.001), con un tiempo medio de seguimiento en la consulta de 2.3 ± 1.6 años, sin diferencia estadística entre los sexos (Cuadro 1).
Cuadro 1 Características generales de la población en estudio (N = 160)
| Edad media en años (media ± DE) | 41.2 ± 15.5 | |
| Sexo femenino | 41.8 | |
| Sexo masculino | 38.7 | |
| Características generales | n | % |
| Sexo | ||
| Femenino | 129 | 80.6 |
| Masculino | 31 | 19.4 |
| Lugar de domicilio | ||
| San José (capital) | 150 | 93.8 |
| Otro | 10 | 6.2 |
| Tiempo de evolución hasta la primera consulta (años) | ||
| < 1 | 60 | 37.5 |
| 1-5 | 63 | 39.4 |
| 6-10 | 8 | 5 |
| > 10 | 10 | 6.2 |
| Sin datos | 19 | 11.9 |
| Tiempo de evolución entre la primera y la última consulta (años) | ||
| < 1 | 42 | 26.3 |
| 1-5 | 113 | 70.6 |
| ≥ 6 | 1 | 0.6 |
| Sin datos | 4 | 2.5 |
| Presencia de angioedema | ||
| Sí | 43 | 26.9 |
| No | 117 | 73.1 |
Además del diagnóstico de urticaria crónica espontánea en la totalidad de los casos, 17.5 % (28 pacientes) presentó urticaria inducible: inducible facticia (n = 17), colinérgica (n = 8), inducible por frío (n = 2) e inducible facticia + colinérgica (n = 1); 26.9 % (43 pacientes) presentó angioedema concomitante (Figura 1).
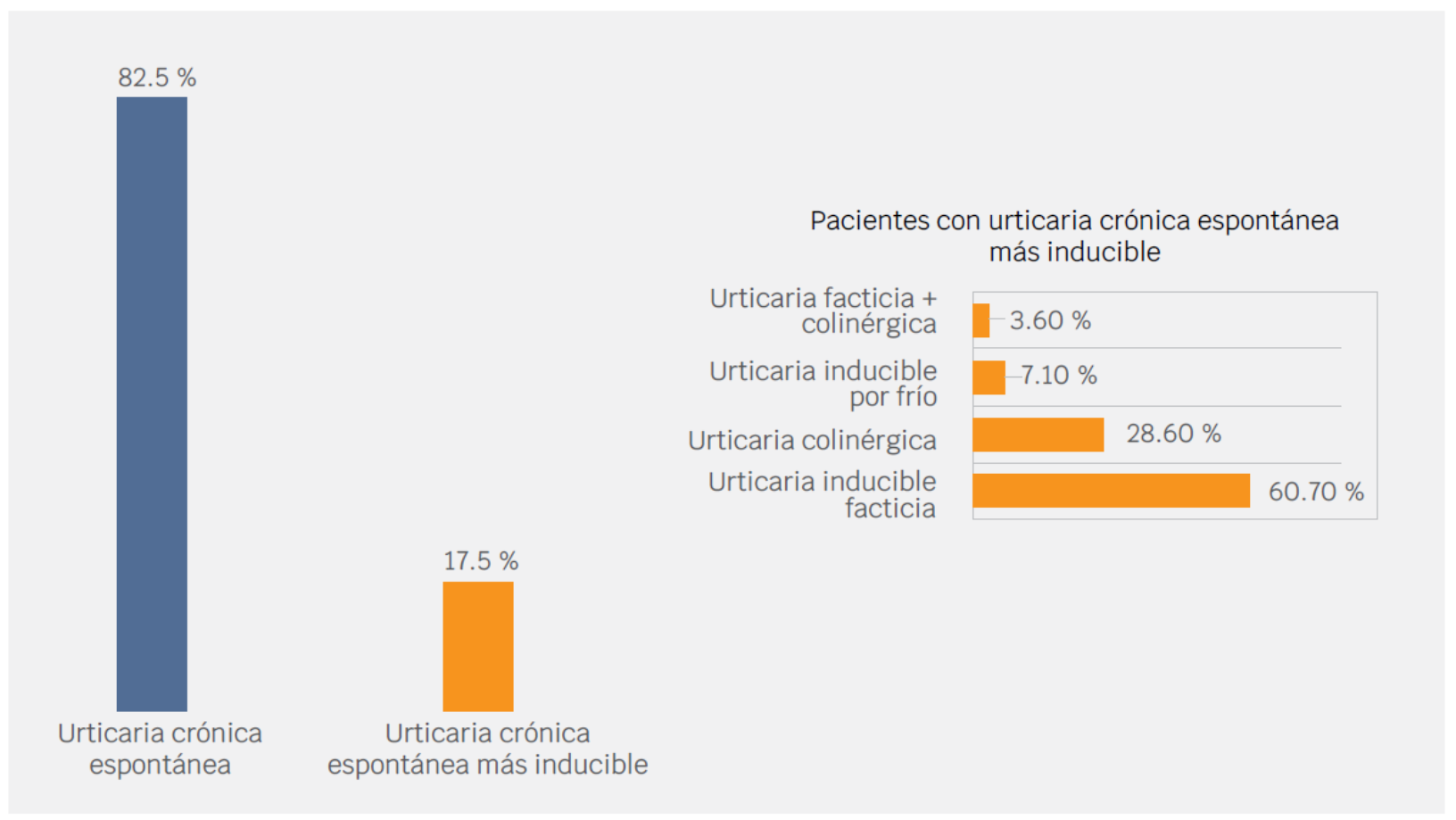
Fuente: Consulta externa de la Unidad de Alergología del Hospital San Juan de Dios, 2014-2018.
Figura 1 Tipos de urticaria crónica.
Entre las comorbilidades o enfermedades asociadas, las más frecuentes fueron la hipertensión arterial (16.3 % n = 26), rinitis alérgica (15 %, n = 24) e hipotiroidismo (11.3 %, n = 18), conforme se representa en la Figura 2.

Fuente: Consulta externa de la Unidad de Alergología del Hospital San Juan de Dios, 2014-2018.
Figura 2 Comorbilidades en pacientes con urticaria crónica.
En cuanto a los resultados de pruebas de laboratorio, la media de leucocitos fue de 7653 ± 2089 células/µL, eosinófilos 224 ± 190 células/µL, VES 12.4 ± 11.2 mL/hora y PCR 0.81 ± 0.79 mg/dL. Los niveles de complemento C3 y C4 estaban disminuidos en 1.3% y 5% de los casos, respectivamente. El 54.8% (n = 46/84) presentó anticuerpos antitiroperoxidasa; 15.5% (n = 13/84), antitiroglobulina; 11.4% (n = 12/105), anticuerpos antinucleares; 2.3% (n = 2/87), una prueba de punción cutánea positiva a alimentos y 26% (n = 26/100), un estudio de heces positivo: 21%, a Blastocystis hominis; 5%, a Endolimax nana; 5%, a Entomoeba spp.; y 4%, a Helicobacter pylori.
Respecto al tratamiento en la primera consulta, 54.4 % recibió monoterapia con anti-H1sg, 6.9 % con anti-H1pg y 38.7 %, ambos antihistamínicos en combinación. Se utilizó montelukast en 23.8 % de los casos y prednisona oral en 3.8 %.
En la última consulta registrada, 61.9 % recibió monoterapia con anti-H1sg; 3.7 %, anti-H1pg; y 34.3 %, ambos antihistamínicos en combinación. En 25.6 % se utilizó montelukast y en 0.6 %, prednisona oral (Cuadro 2). Cabe resaltar que la dosis y selección del tratamiento para el manejo de la urticaria crónica se realizaron según el criterio del médico tratante.
Cuadro 2 Tratamiento prescrito para el control de la urticaria crónica (N = 160)
| Tratamiento | Primera consulta | Última consulta | ||
| n | % | n | % | |
| Anti-H1 de segunda generación (anti-H1sg) | 87 | 54.4 | 99 | 61.9 |
| 1 dosis | 40 | 25 | 53 | 33.1 |
| >1 dosis | 47 | 29.3 | 46 | 28.8 |
| Anti-H1 de primera generación (anti-H1pg) | 11 | 6.9 | 6 | 3.7 |
| Antihistamínicos en combinación | 62 | 38.7 | 55 | 34.3 |
| Montelukast | 38 | 23.8 | 41 | 25.6 |
| Prednisona | 6 | 3.8 | 1 | 0.6 |
| Sin tratamiento | 0 | 0 | 26 | 16.2 |
Se evidenció que 21.3% (n = 34) utilizaba una dosis menor de anti-H1sg en la última consulta respecto a la primera, 20.6% (n = 33) requirió un aumento en la dosis y 58.1% (n = 93) no necesitó cambios. Cabe destacar que en la última consulta, en 16.9% (n = 27) se logró el control de la sintomatología mediante una dosis de anti-H1sg y 16.3% (n = 26) ya no requería el antihistamínico, para una media de tiempo de evolución de 2.4 ± 1.52 años, sin diferencia significativa entre sexos (p=0.304). Debido a la falta de datos en la escala UAS7 (solo ocho pacientes tenían registro en la primera y última consulta del estudio), no fue posible valorar la severidad y el control de la enfermedad mediante este método.
Para el manejo de los casos graves o refractarios se utilizó metotrexate, ciclosporina u omalizumab. El metotrexate se utilizó en 2.5% (n = 4), con una dosis media de 13.75mg/semana, una media de tiempo de tratamiento de 7 ± 6.4 meses en 1.9% (n = 3) y sin obtener respuesta en ninguno de los pacientes. En un paciente se inició este tratamiento en la última consulta, por lo que no se incluyó en el análisis anterior.
La ciclosporina se utilizó en 8.8% (n = 14), con una dosis media de 197.9mg/día, para una media de tiempo de tratamiento de 17.1 ± 18.5 meses. Se evidenció mejoría clínica en 1.3% (n = 2), 4.4 % (n = 7) fue refractario y 2.5% (n = 4) presentó intolerancia al tratamiento, que se tradujo en hipertensión arterial, tremor, hirsutismo y diarrea. Un paciente continuaba con este tratamiento en la última consulta registrada.
El omalizumab se utilizó en 2.5% (n = 4), con una dosis media de 300mg/mes, para una media de tiempo de tratamiento de 36.8 ± 15.5 meses; la totalidad continuaba con dicho tratamiento en la última consulta registrada.
De acuerdo con el análisis multivariado de las características clínicas y de laboratorio y la necesidad de uso de antihistamínicos, no se documentó una relación estadísticamente significativa con el sexo (p=0.728), la edad (p=0.54), otros tipos de urticarias inducibles (p=0.56), hipotiroidismo (p=0.158), eosinofilia (p=0.265), VES (p=0.445) o presencia de parásitos en heces (p=1.01). El uso de más de una dosis de anti-H1sg (p=0.034, RM = 0.42) o anti-H1pg (p=0.004, RM = 3.16) en la primera consulta se asoció a incremento en la dosis de anti-H1sg en la última consulta.
Discusión
La edad promedio de los pacientes fue similar a la reportada en otras publicaciones,8,9 así como la mayor prevalencia de mujeres (61.1 a 81 %), común en los estudios de urticaria crónica espontánea, probablemente asociada a la mayor incidencia de patologías autoinmunes en este sexo.10,11
El tiempo medio de evolución desde la presentación de los síntomas hasta la primera consulta fue de 3.1 años, lo cual podría traducir una deficiencia en la educación médica continua en el primer nivel de atención, situación que no solo se da a nivel nacional.8,12,13 Asimismo, puede evidenciar aspectos como la trayectoria que sigue un paciente desde la referencia hasta el diagnóstico y tratamiento, propios del sistema institucional, así como el tiempo de espera para la cita, la disponibilidad de espacio en la consulta especializada, el número de especialistas; o bien, los propios de la población, como la normalización de los síntomas, el lugar de residencia, entre otros. La búsqueda de atención médica más tempranamente por parte del sexo masculino pareciera ser un hallazgo cultural más que mediado por otros factores.
De los pacientes diagnosticados con urticaria crónica espontánea, 17.5 % presentó, además, urticaria inducible, principalmente facticia o dermografismo, hallazgo similar a lo reportado en otras latitudes.14,15 De manera semejante, Maurer et al. en el estudio comparativo AWARE reportaron 27.8 % de urticaria inducible en Centroamérica y Suramérica y 21 % en Europa.16
La presentación concomitante de UCE con angioedema en 26.9% de los casos resulta inferior a la reportada por Maurer et al. en Centroamérica, Suramérica (50.8%) y Europa (46.1%);16 y muy por debajo de lo reportado por Amin et al. en Estados Unidos (76.4%).17 Únicamente Lee et al. obtuvieron en Taiwán un dato inferior (4.4%).18 La baja prevalencia de angioedema en nuestro estudio podría corresponder a un subregistro; según evidenció el estudio ASSURE, existe una discrepancia del hallazgo de angioedema entre lo reportado por el médico tratante (41%) y lo reportado por el paciente mediante cuestionarios individuales (65.8%), con diferencia estadísticamente significativa.19
La prevalencia de comorbilidades asociadas como hipertensión arterial, diabetes mellitus, hipotiroidismo, atopia (rinitis alérgica, asma o dermatitis atópica) y exacerbación mediada por AINE es similar a la registrada en otras regiones.8,17
Según los resultados de laboratorio, el conteo de eosinófilos, VES, PCR y complemento C3 y C4 se encontraban dentro de rangos normales en la mayoría de los casos. En concordancia con las guías internacionales, dichos exámenes parecen ser innecesarios para el estudio de la urticaria crónica y no deben realizarse rutinariamente.20
Existe una asociación entre la urticaria crónica espontánea y la presencia de anticuerpos antitiroideos, hecho que también fue apreciado en nuestro estudio en 54.8% de los casos (46/84 pacientes). Se ha descrito que de 5 a 34% de los pacientes con urticaria crónica tiene anticuerpos antitiroideos positivos y de 5 a 10% presenta enfermedad tiroidea clínica o bioquímicamente.20,21 En el Registro Latinoamericano de Urticaria se documentó que en 9.2% de los individuos se registraron anticuerpos antitiroideos, proporción inferior a la que identificamos en nuestra población.9
El estudio coproparasitológico fue positivo en 26% de los casos (26/100 pacientes), porcentaje similar al encontrado en la población sana de nuestro hospital; Blastocystis hominis constituyó el parásito más frecuentemente aislado, seguido de Entomoeba coli y Endolimax nana.22 Gómez et al., en el Registro Latinoamericano de Urticaria, describieron estudios positivos en 9%.9 Mediante una revisión sistemática, Kolkhir et al. evidenciaron una prevalencia de 0 a 75.4 % de infecciones parasitarias en individuos con urticaria crónica y 10 % o más de infección en dos tercios de los estudios. Los microorganismos más frecuentemente aislados fueron Blastocystis hominis y Giardia spp.23 El beneficio del tratamiento de la parasitosis intestinal respecto a la mejoría de la sintomatología en la urticaria crónica aún no está claro.24,25,26
En cuanto a la prevalencia de Helicobacter pylori, Mogaddan et al. reportaron 36% en pacientes con urticaria crónica idiopática en comparación con 23% en pacientes sanos,27 prevalencia superior a la reportada en nuestra población de estudio (6%). Desafortunadamente, no contamos con estudios en nuestro país de Helicobacter pylori en población sana o con urticaria crónica.
Aproximadamente 20% de los pacientes manifestó padecer alergia alimentaria, pero solo en 1.4 a 2% estaba confirmada.28,29 En Corea, Chung et al. evidenciaron 1.1% de alergia alimentaria confirmada en los pacientes con urticaria crónica;29 en nuestro estudio, 2.3% (2/87 pacientes) fue positivo a prueba de punción cutánea con exposición a alimentos, sin correlación clínica. No se ha podido establecer una relación directa entre UCE y alergia alimentaria, por lo que las pruebas de punción cutánea o las pruebas séricas de IgE específica no deberían realizarse rutinariamente.29
Los anti-H1sg fueron el tratamiento más utilizado, tanto en monoterapia como en combinación con anti-H1pg o inhibidor de leucotrienos. En 16.9 % de los pacientes se logró el control de los síntomas con una dosis de anti-H1sg, proporción similar a la reportada por Marín Cabañas et al. (18%)30 y Gómez et al. (15%)9 e inferior a la informada por Curto Barredo et al. (31.8%).15 El uso de anti-H1pg y más de una dosis de anti-H1sg en la primera consulta se asociaron con aumento en la dosis requerida de anti-H1sg en la última consulta, hallazgos similares a los reportados por otros autores.15,20,31,32
En la última consulta registrada, 16.3% de los pacientes ya no requería tratamiento antihistamínico para el control de la sintomatología, proporción inferior a la reportada por Curto-Barredo et al. a un año de seguimiento (36%), a los dos años (67%) y a los cinco años (91.6%). Amin y Marín Cabañas señalan hallazgos similares;17,30 sin embargo, se requiere una muestra de mayor tamaño para confirmar o descartar este dato.
El 10.6% de los pacientes requirió medicamentos inmunomoduladores: la ciclosporina fue el más utilizado (8.8%), con una mejoría clínica en 14.2 % (dos pacientes). Las guías internacionales de urticaria de 2014 recomendaban este medicamento como fármaco de tercera línea,31 sin embargo, en 2017 pasó a ser de última línea.1 Kulthanan et al. utilizaron dosis muy bajas de ciclosporina (<2mg/kg/día), bajas (2 a 4mg/kg/día) y moderadas (4 a 5mg/kg/día), con las que obtuvieron respuesta en 54, 66 y 73%, respectivamente, superiores a la que registramos. Los pacientes que utilizaron metotrexate no obtuvieron respuesta al tratamiento, resultado concordante con lo reportado en la literatura, lo que sugiere que este medicamento no se debe prescribir para el manejo de la UCE.20,31,32,33,34
En nuestra población, omalizumab se utilizó como tratamiento de última línea de acuerdo con las guías internacionales de 2014, registrándose una mejoría en 100% de los casos. Marín Cabañas et al. utilizaron dicho tratamiento en 16% de los pacientes, obteniendo una mejoría de 100%: en 75% de los casos como medicamento de tercera línea tras la falla terapéutica con ciclosporina oral y en 25% de los casos como medicamento de cuarta línea.30 La evidencia en cuanto a la seguridad y eficacia del omalizumab es amplia,35,36,37 pero su uso es limitado. En el estudio comparativo AWARE, a pesar de que 76% de los pacientes en Europa y 83% en América requerían omalizumab, se utilizó únicamente en 21 y 11.4% respectivamente, lo que traduce una subutilización de este tratamiento, principalmente por su elevado costo.16 En el sistema de seguridad social de nuestro país, el uso de omalizumab está restringido a pacientes con resistencia documentada a ciclosporina oral que muestren deterioro en la calidad de vida (índice de calidad de vida [DLQI] y UAS7 > 16).
Conclusiones
La urticaria crónica espontánea influye en la calidad de vida de los pacientes, conlleva a un aumento en el consumo de los recursos de salud y es causa importante de ausentismo y bajo rendimiento laboral y escolar.2,6 El tratamiento de la urticaria tiene como objetivo principal el control de los síntomas y la mejoría en la calidad de vida; sin embargo, la UCE es autolimitada y hasta el momento no existen estudios que demuestren que un medicamento sea capaz de incidir en la evolución natural de la enfermedad.1,38
El análisis de nuestros datos, al igual que el de la literatura, apoya al concepto de que el diagnóstico de UCE es clínico, por lo que no se deberían realizar rutinariamente estudios de laboratorio ni pruebas de alergia, debido a que no tienen impacto en la evolución o el tratamiento. En cuanto al tratamiento de los pacientes con UCE, parece ser importante valorar el inicio de ciclosporina u omalizumab más tempranamente.
Posterior al análisis de este estudio y con base en las guías más recientes para esta patología, se estandarizó el diagnóstico y se optimizó el manejo y el tratamiento de la UCE según los recursos y capacidades disponibles en un hospital de tercer nivel de atención de seguridad social. Como resultado, actualmente empleamos rutinariamente escalas objetivas como el UAS7, Urticaria Control Test y el Cuestionario de Calidad de Vida en Urticaria (CU-Q2oL).
Al ser este un estudio de vida real en una región geográfica con limitadas publicaciones sobre esta patología, confiamos que la información provista pueda contribuir a mejorar la calidad de vida de los pacientes con urticaria crónica mediante el diagnóstico oportuno y el tratamiento eficaz y efectivo.











 text new page (beta)
text new page (beta)



