Introducción
Las lesiones dérmicas originadas por agentes químicos comúnmente presentes en el hogar, área de trabajo y el entorno circundante pueden causar problemas de salud a corto y largo plazo, además de estar asociadas a secuelas que limitan la calidad de vida, especialmente si no reciben un manejo oportuno.
El mecanismo de lesión y las complicaciones locales o sistémicas de las quemaduras químicas dependerán del tipo de compuesto al que se estuvo expuesto. Las sustancias químicas más frecuentes son:
Ácidos: pH menor de siete (ácido sulfúrico, nítrico, fluorhídrico, clorhídrico, acético, fórmico, fosfórico, fenoles y ácido cloroacético).
Álcalis: pH mayor de siete (hidróxido de sodio y potasio, hidróxido de calcio, hipoclorito de sodio y calcio, amoniaco, fosfatos, silicatos, carbonato de sodio, hidruro de litio).1
Compuestos orgánicos e inorgánicos.
Las quemaduras químicas son una forma poco frecuente de lesión. De acuerdo con el informe de 2015 de National Burn Respiratory of American Burn Association representaron 3.4% de los pacientes ingresados en hospitales en un periodo comprendido de 2004 a 2015.2
En un estudio retrospectivo realizado en China de 2001 a 2010 del cual se encontraron 615 pacientes con quemaduras químicas, 91.4% fueron hombres, 8.6% mujeres, edad media de 32 ± 12, el área de quemadura osciló entre 1-95%, 93% de los casos presentaron lesiones en el área de trabajo, de los cuales 405/572 resultaron lesionados en empresas privadas, el ácido fue la sustancia química más común con 48.6%. Las extremidades y la cabeza fueron las áreas más afectadas.3
El ácido fluorhídrico es una sustancia que tiene aplicaciones industriales y domésticas, se utiliza en limpieza de metales y piedras, en la industria del vidrio, la fabricación de componentes electrónicos, como removedor de óxido, etcétera.
El uso múltiple de este químico aumenta la incidencia de casos asociados a lesiones derivadas del contacto con el mismo, ya sea por ingesta accidental, contacto directo en región ocular y dérmica e incluso por inhalación.4
El mecanismo de lesión se centra en la rápida absorción, así como en la interacción con la membrana celular que condiciona la formación de complejos de flúor que precipitan, originando lesión tisular, tóxico natural celular que inhibe sistemas enzimáticos. A su vez genera depleción de los niveles de calcio y magnesio, provocando hipocalcemia e hipomagnesemia. Tiene como afinidad la unión con iones de potasio desencadenando irritación miocárdica y arritmias asociadas a hipercalemia.
Las manifestaciones clínicas están determinadas por la vía de ingreso, cantidad, concentración, duración de exposición y resistencia del tejido expuesto.5,6
Ácido fluorhídrico
El fluoruro de hidrógeno es un líquido incoloro, por debajo de 19.4 oC, o un gas incoloro, formado por un átomo de hidrógeno y un átomo de flúor (Figura 1).
Genera gases fuertes y es fácilmente disoluble en agua en sus diversos estados; en su estado líquido el fluoruro de hidrógeno recibe el nombre de ácido fluorhídrico. Se considera un ácido débil, en extremo dañino debido a su alta capacidad para penetrar los tejidos (Figura 2).7
Se forma por la reacción química del fluoruro de calcio (CaF2) con el ácido sulfúrico:
Aplicaciones
El fluoruro de hidrógeno se utiliza ampliamente en el ámbito industrial, 60% se usa en la fabricación de sistemas de refrigeración, congelación y aire acondicionado, el resto en herbicidas, fármacos, catalizador en la alquilación de gasolina de alto octanaje, productos de cocina de acero inoxidable, aluminio, plásticos, componentes eléctricos y focos incandescentes, en forma de ácido para grabar vidrio y esmalte, reactores nucleares de alta potencia, entre otros.8
En las formulaciones domésticas se encuentran concentraciones menores de 20%, típicamente 6-12%. Existen diferentes productos con distintas concentraciones, los cuales se enumeran en la Tabla 1.9
Tabla 1: Productos que contienen fluoruro de hidrógeno y sus respectivas concentraciones.
| Usos industriales | Productos de consumo |
|---|---|
| Propulsores | Limpiadores de ruedas cromados |
| Aluminio | Zep-A-Lume, < 5% |
| Plásticos | Eagle One Mag Cleaner For |
| Solventes | Rough Cast Alloy Wheels, 1.6% |
| Insecticidas | Ali Brite, 0-10% |
| Fertilizantes | Removedores de óxido |
| Gasolina de alto octanaje | Rustgo, 12% |
| Semiconductores | Whink Rust Stain Remover, 1.5-3.5% |
| Drogas y tintes | Limpiadores de aire acondicionado |
| Grabado de materiales | Con-Coil, 9.69% |
| Limpiadores de paredes | |
| Sure Klean Restoration Cleaner, 10% | |
| Limpiadores de aluminio | |
| Luma Brite 1000, < 7% | |
| Aluma Bright, 5-10% | |
| North Woods Trailer Brite, < 10% |
Mecanismo de lesión
Existen varias vías de exposición del ácido fluorhídrico con el cuerpo humano: contacto con la piel incluyendo exposición ocular, inhalación e ingestión, enfocadas en el contacto con la piel. Se describen dos mecanismos generales: lesión directa y sistémica.
1. Lesión directa
El mecanismo de lesión depende del tiempo de exposición de la piel y la concentración del producto (Tabla 2). Se han descrito lesiones tisulares de aparición inmediata al entrar en contacto con ácido fluorhídrico en concentraciones de 70%.10 Concentraciones menores de 20% se asocian a la aparición de lesiones posterior a las 24 horas (Tabla 3).11
Tabla 2: Relación entre tiempo de exposición con ácido fluorhídrico y lesión cutánea.
| Duración de exposición (min) | Morfología microscópica |
|---|---|
| 1 | Inicio del ataque en la parte superficial de la epidermis |
| 2 | Lesión de la capa basal de la epidermis |
| 3 | Epidermis completamente dañada (parte superficial de la dermis: dermis papilar) |
| 4 | Epidermis completamente dañada, lesión clara de la dermis papilar |
| 5 | Epidermis completamente dañada, comienzo del ataque de la dermis reticular |
Tabla 3: Relación concentración, tiempo y sintomatología posterior a la exposición dérmica con ácido fluorhídrico.
| Concentración de ácido fluorhídrico | Efecto |
|---|---|
| Menos de 20% | El eritema y el dolor pueden demorarse hasta 24 horas y a menudo no se informa hasta que el daño tisular es extremo. En un estudio, 7% de HF produjo síntomas en una a varias horas, 12% de HF en menos de una hora y 14.5% de HF inmediatamente |
| De 20 a 50% | El eritema y el dolor pueden demorarse de una a ocho horas y a menudo no se informa hasta que el daño tisular es extremo |
| Mayores de 50% | Produce ardor, eritema y daño tisular inmediatos |
HF = fluoruro de hidrógeno.
Múltiples reacciones químicas (Tabla 4) se han asociado al contacto directo.
Tabla 4: Mecanismo de lesión y efecto asociado al contacto con ácido fluorhídrico.
| Mecanismo | Efecto |
|---|---|
| Lesión cáustica | La liberación de los iones de hidrógeno resulta en un daño visible asociado a destrucción, ulceración y necrosis posterior al contacto |
| Necrosis licuefactiva | El ion de flúor viaja a través de las zonas profundas de la piel destruyendo nervios, vasos sanguíneos y tejidos blandos |
| Quelación | El ion fluoruro se une al calcio y magnesio localizados a nivel intracelular, resultando en hipocalcemia e hipomagnesemia, con afectación secundaria de potasio condicionando hipercalemia |
En concentraciones suficientemente altas libera iones de hidrógeno, lo que lleva a la destrucción visible del tejido, las de baja concentración no muestran una destrucción corrosiva inmediata presentándose lesiones dérmicas en cuestión de horas, además de efectos sistémicos tardíos.
Corrosividad. Al entrar en contacto con la epidermis se desencadena un proceso de disociación formándose iones hidrógeno (H+) y fluoruro (F+); la activación del catión H+ del ácido es el responsable de generar corrosión tisular local, secundario a desnaturalización de proteínas de la membrana citoplasmática por acción enzimática, liberando su contenido intracelular, formando una «masa líquida viscosa», perdiendo la arquitectura normal, cambios que se observan en necrosis licuefactiva.12
Toxicidad local. El ácido fluorhídrico se considera un ácido altamente lipofílico y penetra con facilidad a través de la piel hacia los tejidos más profundos.
Penetra por difusión a la membrana celular en su forma compuesta y en su forma disociada. El ion fluoruro genera lesión tisular progresiva, encontrándose cambios histopatológicos asociados con núcleos picnóticos y citoplasma acidófilo a nivel de la epidermis, dermis papilar y reticular (necrosis coagulativa).
A nivel intracelular el ácido fluorhídrico se disocia, siendo el ion fluoruro el más tóxico, acumulándose en su interior, se ha descrito como un «veneno protoplasmático» que causa inhibición de las vías aerobia y anaerobia del ciclo celular.
Genera anomalías electrolíticas intracelulares por quelación, formando sales insolubles al unirse a los cationes Ca++ y Mg++, además de uniones débiles con Na+ y K+, que producen muerte celular y necrosis a medida que se ve interrumpido el metabolismo celular por inhibición enzimática, incluidas las enzimas del metabolismo glucolítico, las fosfatasas y la colinesterasa, la inhibición de la glucosa celular, fosforilación y posterior glucólisis, inhibición de la respiración celular (Figura 3).13-15
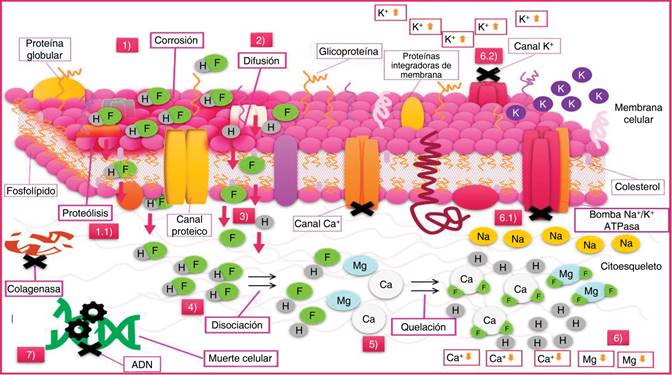
Figura 3: Mecanismo de lesión intracelular del ácido fluorhídrico. Al entrar en contacto con la membrana celular se inicia un proceso químico corrosivo (1), el cual genera proteólisis modificando la estructura celular (1.1), por mecanismo de difusión (2) en forma compuesta y disociada, penetra a través de la membrana hasta el espacio intracelular (3), continúa disociándose (4) resultando en iones de hidrógeno y fluoruro, los cuales por quelación (5) forman compuestos insolubles en contacto con iones de calcio y magnesio, disminuyendo su concentración intracelular (6), lo que conlleva a bloqueo de canales de calcio, inactivación de la bomba sodio-potasio ATPasa (6.1) que impiden el paso de potasio al interior de la célula, aumentando su concentración extracelular (6.2). Como consecuencia de lesión directa a nivel de la membrana y del intercambio iónico, se inhiben mecanismos de reparación por acción de las colagenasas y a nivel del ADN (7), condicionando muerte celular.
El agotamiento progresivo del calcio y magnesio intracelular provoca la inhibición de la bomba sodio-potasio ATPasa, lo que da como resultado alteraciones en la permeabilidad de la membrana celular relacionada a la interrupción del intercambio del potasio que conduce a la hipercalemia local.16
La lesión en la epidermis y dermis incluye afectación vascular y nerviosa, que independientemente de la extensión condiciona la aparición de dolor intenso por sensibilización periférica (K+, H+, ATP, leucotrienos, etcétera).
2. Lesión sistémica
Toxicidad sistémica. La hipocalcemia, hipofosfatemia e hipercalemia son la traducción sistémica de alteraciones electrolíticas a nivel intracelular; sin embargo, se ha observado que el ion fluoruro es absorbido en el torrente sanguíneo, se transporta a todos los órganos del cuerpo en proporción a su vascularización y concentración en la sangre.17
La deposición del fluoruro se ha observado y cuantificado en sangre periférica, orina, humor vítreo, hígado, riñón, pulmones, corazón, cerebro, contenido gástrico y en hueso, la concentración en los tejidos depende en mayor medida de la concentración, edad, tipo de exposición condicionando lesión celular directa.18
En la literatura se postula que estas anomalías son el resultado de al menos otras dos acciones celulares del ion fluoruro que generan inactivación de la bomba de Na+/K+ ATPasa, que contribuye a la acumulación de sodio intracelular y potasio extracelular además de la activación de un intercambiador de iones Na+/Ca++ que da como resultado la acumulación intracelular de calcio, desencadenando inactivación de canales de potasio dependiente de calcio que a su vez media la salida de potasio.19
Hipocalcemia. La hipocalcemia es la alteración que se reporta con más frecuencia a nivel sérico, secundaria a la formación de sales insolubles por quelación intracelular. La fisiología básica de la mecánica cardiaca es la interacción de los puentes cruzados, que se asocia con la actividad de la enzima trifosfato de adenosina de las miofibrillas donde el calcio actúa como cofactor, por lo tanto, se considera un regulador importante en la función contráctil ventricular, obteniendo un papel primordial en el potencial de acción cardiaco para la automaticidad del marcapaso cardiaco, la contracción, relajación cardiaca y vascular. Tanto la contracción como la relajación del músculo cardiaco están regulados por cambios en la concentración de calcio a nivel de las proteínas contráctiles.20
La secuencia normal y la contracción sincrónica de las aurículas y los ventrículos requieren la activación rápida de grupos de células cardiacas que deben permitir cambios rápidos en la frecuencia cardiaca y también responder a los cambios en el tono autónomo. El potencial de acción cardiaco representa los cambios iónicos para que pueda desencadenarse el efecto de contractibilidad y relación del músculo cardiaco, viéndose afectada la fase 2, donde se encuentra el intercambio iónico dependiente de calcio (Figura 4).21

Figura 4: Representación esquemática de los fenómenos iónicos que ocurren en la célula miocárdica y que dan origen a su actividad eléctrica, así como las fases en las que éstos ocurren. Las flechas indican el flujo de iones a través de la membrana, las cuales se ven interrumpidas (X ) al encontrarse alteraciones de éstos a nivel intracelular y extracelular condicionando trastorno de la contractibilidad y fuerza de la contracción miocárdica.
Una disminución leve puede verse reflejada a este nivel, condicionando alteraciones del ritmo, hasta una disfunción severa que origine la aparición de arritmias letales, reportándose casos de taquicardia ventricular, fibrilación ventricular, daño miocárdico y falla cardiaca congestiva.22
La traducción electrocardiográfica más común de hipocalcemia es la prolongación del intervalo QT (Figura 5) como resultado del alargamiento del segmento ST, ocasionalmente, la hipocalcemia puede manifestarse con elevación del segmento ST, simulando un evento isquémico a nivel miocárdico.23

Figura 5: Registro electrocardiográfico con prolongación segmento QT en DII en un paciente con quemadura por ácido fluorhídrico e hipocalcemia.
Hipomagnesemia. El magnesio es un componente esencial de las estructuras del ácido desoxirribonucleico (ADN) y ácido ribonucleico (ARN) a nivel celular. Tiene un papel en la unión de cadenas de polinucleótidos, principalmente a través del ARN de transferencia (t-ARN) que participa en la estabilización de su estructura. Forma enlaces fuertes para mantener la estructura del ADN; es requerido por el ADN y ARN polimerasas, es un factor importante en los mecanismos de reparación del ADN.
A nivel de la membrana celular desempeña un papel importante en el movimiento del sodio y potasio, por ende, su modificación intracelular influye en el transporte de estos iones.
En la hipomagnesemia, la presentación clínica puede variar desde un estado asintomático hasta arritmias potencialmente mortales. Las manifestaciones importantes están asociadas con alteraciones neuromusculares: debilidad muscular, temblores, convulsiones y parestesias, anomalías cardiovasculares como torsade de pointes, fibrilación ventricular e hipertensión; y anomalías metabólicas como hipopotasemia e hipocalcemia.24
Hipercalemia. Esta alteración electrolítica es secundaria al bloqueo de la bomba de Na+/K+ ATPasa que impide la movilización intracelular y extracelular de iones Na+ y K+ respectivamente, modificando la concentración de éstos en cada espacio.
Es una anormalidad electrolítica posiblemente desfavorable para el organismo, se asocia con variaciones considerables entre las concentraciones intracelulares y extracelulares, de tal manera que el gradiente de potasio intracelular disminuye cuando aumenta el potasio extracelular, reduciendo el potencial de membrana en reposo. Sin embargo, aumenta la permeabilidad de la membrana, reduce su resistencia, incrementa la corriente de repolarización y acorta el potencial de acción transmembrana. Clínicamente rara vez se puede presentar debilidad progresiva, parálisis flácida, parestesias y reflejos musculares alterados. La traducción más importante está asociada con la aparición de trastornos del ritmo o de la conducción cardiaca.25
La concentración de potasio a nivel sérico anteriormente se asociaba a cambios electrocardiográficos dependientes; sin embargo, se ha observado que en elevaciones leves de manera aguda se registran cambios sustanciales, a diferencia de pacientes que presentan alteración crónica, muestran electrocardiogramas con alteraciones inespecíficas e incluso puede mantenerse normal. Las características del electrocardiograma de la hiperpotasemia incluyen: onda P pequeña o ausente, intervalo PR prolongado, onda R aumentada, QRS ancho, ondas T picuda.26
Tratamiento de las quemaduras
El manejo de las lesiones generadas por el contacto con ácido fluorhídrico tiene un gran impacto en su evolución si se realiza de manera inmediata. La atención prehospitalaria es fundamental y de gran trascendencia si se efectúa de manera correcta y con prontitud, ya que puede modificar de primera instancia la evolución de la lesión. El tratamiento médico específico está centrado en frenar el mecanismo de lesión con el fin de mitigar la afectación local y evitar las complicaciones sistémicas.
El tratamiento médico se basa en la administración de soluciones preparadas, siendo el calcio su principal componente. Esto como medida en respuesta a los cambios intracelulares generados por el ácido fluorhídrico. Si bien el dolor no es referencia de la extensión de la lesión, reportes de casos refieren pacientes con dolor intenso, por lo que la administración de fármacos encaminados para su manejo es uno de los objetivos.
Quemaduras cutáneas
Actualmente existen soluciones químicas utilizadas como medida para contrarrestar los efectos del ácido fluorhídrico a nivel dérmico (Hexafluorine®), con mejor efecto que la administración de solución salina o combinada con gluconato de calcio en cualquier concentración.
La importancia de la administración de gluconato de calcio por vía intravenosa e intraarterial radica en la evolución de la lesión así como de la traducción sistémica de los cambios bioquímicos a nivel celular.
Si el dolor persiste durante más de 30 minutos después de la aplicación del gel, se sugiere la infiltración subcutánea de gluconato de calcio de 2.5 a 5%, a una dosis de 0.5 mL por cm2 de superficie quemada extendiéndose 0.5 cm más allá del margen del tejido afectado. Se debe considerar que la aplicación subcutánea puede generar irritación de los tejidos.27,28
En 1978 por primera vez se utilizó la administración intraarterial guiada por angiografía, en la cual se suministraba gluconato de calcio al 4% 500 mL en cuatro horas con repetición cada 12 para contrarrestar efectos sistémicos, observándose efectos secundarios asociados con lesiones vasculares, nervios periféricos, etcétera.
Se describió el método de Bier en el cual se realiza de manera inicial una exanguinación de la extremidad con posterior administración de gluconato de calcio al 10% -diluido en 20 mL de solución cloruro de sodio al 0.9%- suministrando 5 mL en 15-20 minutos por medio de un catéter localizado en el dorso de la mano; se hace referencia de la disminución de dolor como punto de éxito.29
El tratamiento para quemadura por ácido fluorhídrico debe ser individualizado, de tal manera que esté enfocado en disminuir la extensión de la lesión local así como en evitar efectos sistémicos. Sin embargo, las modalidades de tratamiento antes mencionado no presentan especificad para resolución total del daño resultante de la exposición a este compuesto químico.
Conclusiones
El mecanismo de lesión a nivel dérmico generado por el ácido fluorhídrico es similar a cualquier otro ácido. No obstante, esta sustancia química se caracteriza por condicionar un efecto corrosivo y a su vez protoplasmático severo, además de una gran variedad de efectos sistémicos, por lo que es de suma importancia la determinación de las características del químico como su concentración, así como el tiempo de exposición, para brindar un manejo oportuno y sistemático que evite complicaciones fatales. La base terapéutica de esta patología es el gluconato de calcio administrado por diversas vías, cada una de ellas con sus complicaciones esperadas; sin embargo, la evaluación primaria y secundaria normará la opción terapéutica más adecuada para contrarrestar sus efectos.
Al ser una de las quemaduras con complicaciones locales y sistémicas de gran magnitud, se espera manejo conjunto en áreas especializadas.











 nueva página del texto (beta)
nueva página del texto (beta)




