1. Introducción
El Colegio Mexicano de Medicina Crítica (COMMEC), preocupado por la llegada a nuestro país de COVID-19 y por su consiguiente expansión, ha reunido a los expertos del Colegio en diversas áreas de interés, las cuales pueden ser de utilidad para los médicos intensivistas y no intensivistas para que puedan recibir y manejar a pacientes graves con esta enfermedad.
Problema. El COVID-19 es una enfermedad viral emergente, que primero fue identificada en China, en la provincia de Wuhan en diciembre del 2019, y los primeros casos fueron identificados como neumonía de causa desconocida; en febrero de 2020, la Organización Mundial de la Salud la describió como COVID-19 (del acrónimo inglés: coronavirus disease 2019) y la enfermedad fue declarada una emergencia internacional el día 30 de enero de 2020. Inicialmente, el virus fue llamado 2019-nCoV y, posteriormente, renombrado como SARS-coV-2, ya que el virus es muy similar al causante del síndrome respiratorio agudo grave (SARS, por sus siglas en inglés); se trata de un virus de cadena simple de ARN que, visto en microscopia electrónica, tiene la apariencia de corona por presencia de glucoproteínas en su envoltura. La subfamilia Orthocoronavirinae clasifica a los coronavirus en los siguientes cuatro géneros: alfacoronavirus (alphaCoV), betacoronavirus (betaCoV), deltacoronavirus (deltaCoV) y gammacoronavirus (gammaCoV). Los coronavirus pueden causar enfermedades en animales como camellos, gatos y murciélagos.
Existen siete coronavirus humanos:
HCoVs (co-circulation of four human coronaviruses), que pueden infectar a humanos. Éstos son: HCoV-OC43, HCoV-HKU1 (betaCoVs), HCoV-229E y HCoV-NL63 (alphaCoVs), los cuales pueden ser responsables de 5% de las enfermedades respiratorias con 2% de la población como portador sano.
SARS-CoV, MERS-CoV y SARS-coV-2 (betaCoV).
El virus es termosensible y es inactivado por solventes lipídicos; puede ser transmitido por gotas y por aerosoles, y tiene un periodo de incubación de dos días a dos semanas. También se ha propuesto la transmisión por contacto.1
IMPORTANTE: Las guías y protocolos de manejo deben interpretarse de forma individualizada para cada paciente y siempre deberá prevalecer el juicio clínico. Las recomendaciones pueden variar según los avances en el conocimiento de la enfermedad y la situación epidemiológica en cada país y en el mundo.
El presente documento tiene la finalidad de guiar a los médicos intensivistas y no intensivistas de las Unidades de Cuidados Intensivos de nuestro país en el manejo de cuidados intensivos de los pacientes con COVID-19; ello para lograr un mejor tratamiento del paciente y para mejorar los niveles de prevención y control de la infección, con el fin de proteger al personal de la salud y a la comunidad.
El COMMEC está realizando un registro a nivel nacional para conocer el manejo de los pacientes graves con COVID-19 en la mayor parte de las Unidades de Terapia Intensiva (UTI), por lo que hacemos una invitación para que las UTI que aún no se han registrado lo hagan en el siguiente enlace:
https://commeconline.com/registro-uc/.
El COMMEC también ha iniciado, desde el año pasado, el registro de todas las UTI del país, con la finalidad de conocer, por parte del personal que en ellas labora, cuáles son las unidades, qué tipo de unidad es, cuántas camas, cuántos ventiladores y cuántos médicos intensivistas trabajan en ellas. Los invitamos a que registren sus unidades en el siguiente enlace:
https://commeconline.com/reg-utimex99/public/
Debido a esta pandemia, el Gobierno de México ha puesto al médico intensivista como pieza clave en el manejo del paciente grave durante la ventilación mecánica, al suplir, además, con otras especialidades la falta relativa de médicos intensivistas que normalmente también atienden pacientes críticos. El COMMEC trabajará hombro con hombro con estas especialidades y además se ha sumado a la capacitación de médicos de especialidades que no atienden pacientes críticos para que aprendan los procedimientos. Por su lado, el COMMEC está preocupado por el daño que COVID-19 le está causando al personal de la salud, tanto por su contagio y muerte como por las agresiones físicas de parte de la comunidad. Por esto, ha solicitado en forma enérgica a las autoridades correspondientes el suministro continuo de equipos de protección para todo el personal de salud que atiende a estos pacientes. A esta causa se le han sumado otros colegios y agrupaciones médicas. El menaje completo puede leerlo desde el siguiente enlace:
https://commec.org/wp-content/uploads/2020/04/Mensaje-sociedades-me%CC%81dicas.pdf.pdf
Finalmente, el COMMEC, preocupado por los pacientes graves y por el personal de áreas críticas, insistirá al Gobierno Federal, Estatal y Municipal que, además del surtimiento continuo de Equipos de Protección Personal (EPP) y que vele por la seguridad del personal de la salud, que las instalaciones de las UTI cumplan con los requerimientos mínimos para poder manejar a los pacientes infectados por COVID-19, o sea, que todas las camas de UTI que tendrán pacientes con COVID-19 deben contar con ventilación independiente en cada cubículo (cama), ya sea con ventilación natural o con ventilación mixta (híbrida), además de agregarles circuitos de presión negativa.
2. Bioseguridad en áreas críticas. Medidas y equipo de protección
Los procedimientos de bajo riesgo de transmisión vírica son:
Colocación de tubo de Guedel.
Colocación de mascarilla facial de oxigenoterapia con filtro espiratorio.
Compresión torácica.
Desfibrilación, cardioversión y colocación de marcapasos transcutáneo.
Inserción y canalización de la vía venosa o arterial.
Administración de fármacos o fluidos intravenosos.
Los procedimientos de alto riesgo de transmisión vírica son:
Aerosolterapia y nebulización.
Puntas nasales de alto flujo.
Ventilación manual con mascarilla.
Ventilación no invasiva CPAP/BiPAP.
Intubación orotraqueal.
Traqueotomía quirúrgica > percutánea.
Broncoscopia, gastroscopia.
Aspiración de secreciones.
Resucitación cardiopulmonar.
Los procedimientos susceptibles de generar aerosoles y las estrategias sugeridas para reducir su riesgo en caso de ser estrictamente necesario son:
Aspiración de secreciones respiratorias:
Aerosolterapia y nebulización:
Evitarla si es posible.
Emplee la cámara espaciadora y el dispositivo MDI (inhalador de dosis medida, por sus siglas en inglés).
Toma de muestras respiratorias:
Lavado broncoalveolar:
Oxigenoterapia de alto flujo:
Ventilación no invasiva (VNI):
Evítela si es posible.
En caso necesario, asegure el sellado adecuado de la interfase.
Uso de VNI con doble tubuladura y filtros de alta eficacia.
Ventilación manual con mascarilla y bolsa autoinflable:
Evítela si es posible.
En caso necesario, utilice el filtro de alta eficiencia que impida la contaminación vírica entre la bolsa autoinflable y la mascarilla, sin hiperventilar y evitando fugas.
Intubación:
Se utilizarán tubos endotraqueales con balón para evitar las fugas, con una presión balón < 25 cm H2O.
Si es necesario, se preoxigenará con mascarilla reservorio de O2, en vez de ventilación con bolsa autoinflable y se realizará con una secuencia rápida de intubación y por el personal experto que minimice el tiempo y el número de intentos del procedimiento de intubación.
Anticipe en la medida de lo posible.
Uso de tubos con aspiración subglótica.
Ventilación mecánica (VM)
Se pondrán los filtros de alta eficiencia que impidan la contaminación vírica tanto en la rama inspiratoria como en la espiratoria.
Se usará el sistema de aspiración cerrada de secreciones.
Uso de intercambiador de calor y humedad con filtro de alta eficacia que impida la contaminación vírica, en vez de humidificación activa.
Evite desconexiones.
Resucitación cardiopulmonar
La influencia de estas estrategias no está suficientemente demostrada, pero están recomendadas en otras infecciones con mecanismo de transmisión similar.
Hay que definir las áreas de aislamiento, separar las camas con pacientes infectados por COVID-19 y no infectados por COVID-19. También, se debe convertir los cuartos abiertos en cerrados, de preferencia con ventilación natural o ventilación mixta (híbrida), agregando circuitos de presión negativa. Los cuartos con presión negativa deben cumplir con los estándares establecidos de gradiente negativo de presión de 10 Pa, circulación de aire independiente, 12 renovaciones de aire/hora, filtro HEPA (por sus siglas en inglés: High Efficiency Particulate Air) y esclusa (antesala). En caso de no tener esclusa, se recomienda crear una pseudoesclusa a fin de realizar un manejo más seguro de los equipos de protección individual (EPI) y de los residuos de riesgo. De no estar disponible este tipo de habitación, se atenderá al paciente en una de uso individual, con ventilación natural o climatización independiente. La puerta de la habitación deberá permanecer siempre cerrada.
Debe existir una unidad manejadora de aire independiente para cada cubículo.
Se recomienda la correcta y reciente validación de estos entornos para una confiable y segura operación de las áreas de pacientes aislados e infectados.
Existen aspectos importantes que se deben considerar en la aplicación de un protocolo. A manera de decálogo, son:
Un protocolo funciona sólo si se aplica al pie de la letra, ya que es necesario cumplir con los pasos que él mismo indica para su exitoso resultado.
El EPP más caro no necesariamente es el más efectivo.
La capacitación es la clave, misma que deberá enfatizarse en todas las áreas y en los recursos humanos de la UTI.
Hay varios protocolos, adopta el que se pueda realizar en tu área.
Supervisa y evalúa el desempeño del personal.
El trabajador de salud es el que hará la diferencia en el resultado, cuídalo.
Durante la pandemia identifica lo que no funciona y deséchalo.
El personal de intendencia tiene un rol preponderante ya que la limpieza y descontaminación son su principal vocación.
No debe haber excepciones, sin importar el rango o autoridad.
Acepta sugerencias de gente con más experiencia.
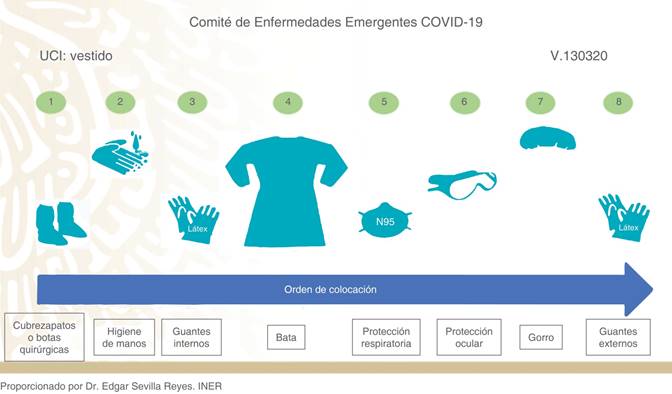
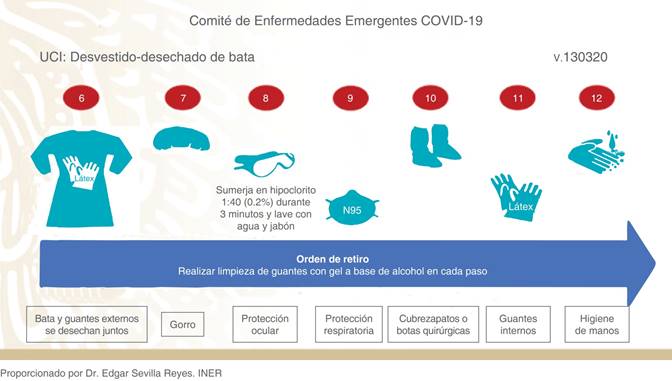
Colocación (donning) y retirada (doffing) del EPP. Para la retirada del equipo es fundamental hacerlo de una forma calmada y despacio, evitando movimientos bruscos y bajo la supervisión de un compañero entrenado. Se recomienda el uso de una lista de comprobación (lista de verificación) de todo el procedimiento. Se debe realizar lo más apartado posible del paciente. Debe haber disponible un contenedor grande para desechar los EPI con desinfectante a base de alcohol para manos y superficies. Puede ser útil habilitar una sala «sucia» para retirarse el equipo, con espacio suficiente.2
Tabla 1: Recomendaciones de la OMS del Equipo de Protección Personal (EPP).
| Personal | Actividad | Tipo de EPP |
|---|---|---|
| Trabajador de la salud | Cuidado directo del paciente infectado con COVID-19 | • Mascarilla médica |
| • Pijama quirúrgica | ||
| • Guantes | ||
| • Protección ocular | ||
| Procedimiento generador de aerosoles | • Mascarilla N95 | |
| • Pijama quirúrgica | ||
| • Guantes | ||
| • Protección ocular | ||
| • Bata | ||
| • Botas |
Tabla modificada de: Uso racional de EPP 27 de febrero del 2020 (Rational use of personal protective equipment for coronavirus disease 2019) (COVID-19). Disponible en: https://www.who.int.
3. Reconversión hospitalaria (adaptando nuestro hospital y nuestra UCI)
Se le conoce así al proceso que da como resultado una mayor disponibilidad de camas de atención a pacientes críticamente enfermos, al utilizar, en general, las áreas de hospitalización y atención de una misma unidad hospitalaria. La reconversión puede tener como origen diversas situaciones: accidentes, desastres naturales o emergencias epidemiológicas de origen infeccioso.
El proceso debe realizarse de manera gradual, tratando de impactar en el menor grado posible al resto del funcionamiento de un hospital, por ejemplo, las consultas y cirugías programadas; también, dependiendo del grado de complejidad de la emergencia, se podrá incluir la suspensión súbita de los servicios no urgentes y redirigir los urgentes.
Cada sistema debe definir las etapas de reconversión según la situación particular, sin embargo, las constantes de todos los programas son:
a) La planeación necesaria antes de iniciar la primera etapa (que debe suceder antes de existir incluso el origen de la reconversión) incluye, pero no se limita a ello, la verificación de la capacidad del sistema eléctrico y de administración de gases medicinales y la definición de su capacidad máxima, así como las tomas de oxígeno y aire existentes en todo el hospital; el conocimiento del inventario y el funcionamiento de los ventiladores y monitores y de los sistemas de referencia que permitirán asegurar la continuidad de la atención de las demás patologías que atiende la unidad hospitalaria en cuestión.
b) Definir las capacidades máximas de atención graduadas según el estado de emergencia que impacta al sistema.
Marco jurídico
Bajo los lineamientos de las guías de práctica clínica, la constitución política y la normatividad hospitalaria vigente en nuestro país.3
Criterios de reconversión hospitalaria COVID-19
Las autoridades responsables de los hospitales deberán conformar un Comité COVID-19, el cual será responsable de la reconversión hospitalaria y tendrá las siguientes funciones:
Conformación del Comité COVID-19 en el que se deberá integrar el personal directivo de las áreas críticas y de soporte para la atención de pacientes con enfermedad por virus SARS-CoV2.
Determinación de la capacidad instalada basal y ampliada con base en el método de cálculo referido en el capítulo correspondiente de los presentes lineamientos.
Diseño de un plan de continuidad de operaciones para la reconversión hospitalaria.
Dar cumplimiento a los lineamientos para la reconversión hospitalaria COVID-19.
Capacitación del personal de salud en los procedimientos médicos y algoritmos de respuesta, así como la evaluación de las competencias del profesional respecto de la atención de pacientes críticos.
Capacitación del personal en bioseguridad hospitalaria, uso del equipo de protección personal y vigilancia de las medidas de prevención y control de infecciones durante la detección, atención y traslado de casos sospechosos o confirmados por enfermedad del virus SARS-CoV2.
Designar un área y personal específico para el tamizaje de profesionales que permita evaluar el estado de salud física, mental y emocional de los profesionales de la salud y demás trabajadores involucrados en la atención, gestión y apoyo de pacientes. El tamizaje deberá incluir evaluación de temperatura y aspectos relacionados con agotamiento (burnout), trauma vicario o desgaste por compasión, uso y abuso de sustancias nocivas para la salud, depresión mayor, trastornos de ansiedad y riesgo suicida.3
Fases de la reconversión hospitalaria
Fase 1. Capacidad instalada basal y ampliada: se deberá utilizar la totalidad de camas de la UCI con la totalidad de la capacidad de los ventiladores útiles, del sistema eléctrico y de gases medicinales. Se debe aprovechar la capacidad máxima de apoyo de sistemas, suspendiendo la consulta externa, clínicas ambulatorias y cirugía programada. El personal de salud de estas áreas se deberá redistribuir como apoyo a la reconversión hospitalaria.
Fase 2. Reconversión hospitalaria: al agotar la capacidad instalada de la fase 1, se deberán ubicar a los pacientes críticos en otros servicios como los de terapia intermedia, recuperación quirúrgica, otras terapias, corta estancia y otras áreas de hospitalización; las camas deberán contar con la capacidad de soportar ventilador, incluyendo tomas de oxígeno y aire, así como presión.
Fase 3. Expansión: de persistir la demanda de atención y ocupar las áreas de la fase 2, se ocupará la totalidad de camas, respetando las unidades de reanimación. Se pueden habilitar espacios públicos no hospitalarios.3
Acceso a los establecimientos
• Todas las unidades médicas deben colocar un filtro en el acceso a la unidad donde se ofrezca alcohol gel y se permita la separación desde la entrada de los flujos de atención de pacientes con y sin síntomas respiratorios.
• Se colocará un área denominada triaje respiratorio, donde se hará la identificación y priorización para la atención de los pacientes con síntomas respiratorios.
• El personal que atiende el triaje deberá estar debidamente protegido con los dispositivos necesarios (EPP).
• Se asegurará que exista información y flujos de triaje en todas las puertas de entrada del hospital y se capacitará a todo el personal para aplicarlo.3
Atención en los consultorios
En las unidades médicas de primer y segundo nivel, se destinarán salas de espera separadas y consultorios para la atención de pacientes con problemas respiratorios que previamente hayan pasado por el triaje respiratorio. En estos consultorios el personal de salud deberá estar debidamente protegido con los dispositivos necesarios (EPP).
Se deberá realizar limpieza del consultorio, la cual estará enfocada en las zonas de mayor contacto y equipo que tocó al paciente entre cada uno de los casos atendidos, siguiendo los lineamientos específicos de prevención de infecciones.3
Atención en hospitalización
Suspensión de ingresos por condiciones electivas.
Suspensión escalonada de otros servicios médicos hospitalarios.
Liberación de camas de hospitalización de aquellos pacientes cuya situación de salud no requiera una intervención inmediata, se encuentren estables y en condiciones de egreso.
Preparación para aumentar la capacidad de camas de hospitalización de manera progresiva.
Preparación de áreas críticas.
Preparación de personal médico.
Capacitación y aseguramiento del uso correcto y racional de EPP.
Preparación en la definición de procedimientos asistenciales.
Preparación de insumos.
Los centros hospitalarios deberán definir un centro de operaciones y designar un comité integrado por personal médico administrativo y personal de salud experto en cuidados críticos, infectología y epidemiología hospitalaria, que tenga la capacidad para tomar decisiones, coordinar la preparación y la reconversión hospitalaria y emitir las recomendaciones necesarias.
Se mantendrá el reporte de vigilancia epidemiológica de manera oportuna y actualizada en las plataformas correspondientes.
Todos los pacientes que requieran hospitalización se mantendrán con precauciones de aislamiento por contacto y gotas durante su estancia hasta su alta, así como también se mantendrán las precauciones de la vía aérea en procedimientos que generen aerosoles.
Los ingresos a las zonas designadas se podrán realizar a cualquier hora con la finalidad de mantener libre el área de urgencias.
Se evitará, en la medida de lo posible, la rotación del personal de las áreas de atención de los pacientes, con la finalidad de limitar la exposición nosocomial.
Se limitarán las visitas hospitalarias a un familiar máximo por paciente e incluso se considerará la suspensión de la misma.
Se informarán diariamente los datos de gestión de camas y ventiladores al comando central para realizar la planeación.1
Reorganización de la consulta externa
Conforme a las necesidades, se podría suspender y reagendar la consulta programada; si procede, se podrá optar por la consulta u orientación telefónica.3
Tabla 2:
| Servicios que pueden posponerse y reprogramarse | Servicios que podrían considerarse para suspender | Servicios que no se pueden suspender |
|---|---|---|
| • Consulta externa de especialidades para pacientes con enfermedades crónicas controladas | • Medicina física y rehabilitación | • Hemodiálisis |
| • Cirugía electiva ambulatoria y no ambulatoria, excepto en pacientes oncológicos | • Rehabilitación. Se suspenden los tratamientos grupales, los tratamientos en tanque terapéutico y la hidroterapia | • Quimioterapia |
| • Estudios auxiliares de diagnóstico (laboratorio, radiología, electrodiagnóstico) para pacientes ambulatorios | • Estrategias educativas y grupales de promoción y prevención a la salud | • Banco de sangre |
| • Atención de pacientes en clínicas de heridas y estomas de pacientes no complicados | • Terapia psicológica grupal | • Urgencias |
| • Endoscopia electiva | • Hospitalización por urgencias o procedimientos críticos por padecimientos diferentes a COVID-19 | |
| • Cualquier tipo de estudio programado no urgente | • Unidad de Cuidados Intensivos para padecimientos diferentes a COVID-19 | |
| • Laboratorio de análisis clínicos | ||
| • Imagenología | ||
| • Unidad tocoquirúrgica | ||
| • Cirugía sensible a tiempo | ||
| • Tratamiento sensible a tiempo |
Áreas de apoyo
La actividad deberá mantenerse constante con la finalidad de asegurar la adecuada atención de los pacientes hospitalizados; se debe considerar como áreas de apoyo: trabajo social, laboratorio clínico, imagenología, microbiología, cocina, entre otros.3
Cuidados intensivos
Se instaurará un sistema piramidal para la atención de los pacientes con cuidados críticos; así, un especialista de Terapia Intensiva asesorará a otros médicos a cargo de la atención de estos pacientes.3
Valoración de la capacidad instalada y alcance de la reconversión
El Comité COVID-19 deberá realizar una autoevaluación a fin de valorar el estado funcional de las instalaciones eléctricas, hidrosanitarias, de los gases medicinales, la cisterna y la ventilación en áreas críticas, con el objetivo de evaluar la factibilidad de reconversión en función de su infraestructura e instalaciones. La cédula de autoevaluación se encontrará en la página: https://coronavirus.gob.mx.
4. Identificación. Triaje inicial de pacientes potencialmente graves
Las infecciones no hospitalarias del tracto respiratorio son generadas mayormente por virus respiratorios. En México, las epidemias estacionales de gripe ocurren cada otoño, invierno y primavera. Las infecciones virales pueden manifestarse de diversas formas, desde una infección asintomática, enfermedad no complicada con o sin fiebre, hasta complicaciones como neumonía o síndrome de insuficiencia respiratoria aguda (SIRA).
La información disponible que describe la presentación clínica de pacientes con COVID-19 confirmada es aún limitada. Debido a la variedad de síntomas respiratorios en las infecciones del tracto respiratorio, así como al alto porcentaje de pacientes graves con diagnóstico de COVID-19 que presentan fiebre (83-98%),4,5 el diagnóstico operacional clínico de gravedad, tanto para influenza AH1N1-pdm 2009 como para SARS-coV-2, se requiere documentar la fiebre en conjunto con los criterios de la definición operacional, los cuales fueron modificados el 24 de marzo de 2020 al ingresar a la fase II y fueron descritos en el Lineamiento estandarizado para la vigilancia epidemiológica y por laboratorio de COVID-19, aprobado por el Comité Nacional para la Vigilancia Epidemiológica (CONAVE).6
Definiciones operacionales para caso sospechoso:
Persona de cualquier edad que en los últimos siete días haya presentado al menos dos de los siguientes signos y síntomas: tos, fiebre o cefalea,* acompañadas de al menos uno de los siguientes signos o síntomas:
Disnea (dato de gravedad)
Artralgias
Mialgias
Odinofagia/ardor faríngeo
Rinorrea
Conjuntivitis
Dolor torácico
* En menores de cinco años, la irritabilidad puede sustituir a la cefalea.
Nota: la anosmia, la hiposmia y la pérdida del sentido del gusto (disgeusia) deben ser consideradas como síntomas importantes, no así la rinorrea, que es síntoma de gripe o influenza.
Caso confirmado
Persona que cumpla con la definición operacional de caso sospechoso y que cuente con diagnóstico confirmado por la Red Nacional de Laboratorios de Salud Pública reconocidos por el InDRE (Instituto de Diagnóstico y Referencia Epidemiológicos).§
Las instituciones que conforman el Comité Nacional para la Vigilancia Epidemiológica (CONAVE) avalan el siguiente porcentaje de muestreo para la vigilancia epidemiológica de COVID-19:
Casos sospechosos con síntomas leves: 10% (ambulatorios).§§
Casos sospechosos con sintomatología grave: 100% (dificultad respiratoria).
Tomar el 100% de muestras a los pacientes graves que cumplan con la definición de infección respiratoria aguda grave (IRAG) de todas las unidades médicas del país.
Considere que en cualquier momento puede identificarse un paciente potencialmente grave; para lo anterior considere el siguiente algoritmo adaptado de los lineamientos clínicos estandarizados, publicados por la Dirección Nacional de Epidemiología.7,8
Guía para la atención de enfermedades respiratorias
Tabla 3:
| Triaje respiratorio | |
|---|---|
| Síntomas | Puntos |
| Fiebre (> 38 oC o más) | 5 |
| Tos seca | 5 |
| Dolor de cabeza | 5 |
| Dificultad para respirar | 20 |
| Dolor articular | 1 |
| Dolor muscular | 1 |
| Dolor de garganta | 1 |
| Escurrimiento nasal | 1 |
| Conjuntivitis | 1 |
| Dolor torácico | 1 |
Tabla 5:
| Criterios de actuación | |
|---|---|
| Verde | Aislamiento en casa durante 14 días |
| Amarillo | Valoración médica en centro COVID. Aislamiento en casa durante 14 días |
| Rojo | Valoración hospitalaria |
5. Criterios de gravedad. Criterios de neumonía grave
Los informes iniciales sugieren que el SARS coV-2 está asociado con una enfermedad grave que requiere cuidados intensivos en aproximadamente 5% de las infecciones documentadas. La atención de cuidados intensivos será un componente integral de la respuesta global a esta infección emergente.
La mediana de duración entre el inicio de los síntomas y el ingreso a la UCI ha sido reportada de 9 a 10 días, lo que sugiere un deterioro gradual en la mayoría de los casos. La condición para requerir cuidados intensivos ha sido el soporte respiratorio; en dos tercios de los pacientes se han encontrado criterios para el síndrome de dificultad respiratoria aguda (SIRA).
Los factores de riesgo de enfermedad grave siguen siendo inciertos, aunque la edad avanzada y la comorbilidad han surgido como posibles factores importantes.
La relevancia de conocer los criterios de neumonía grave radica en el inicio inmediato del tratamiento con la finalidad de mejorar la supervivencia.
Reportes de la literatura internacional han identificado varios factores de riesgo de muerte en adultos hospitalizados, en particular la edad avanzada, así como los niveles de dímero D superiores a 1,000 ng/mL y una puntuación de SOFA elevada desde su ingreso.
Los criterios de gravedad relacionados con la enfermedad COVID-19 se analizan desde el punto de vista demográfico y por los hallazgos de laboratorio. La edad avanzada es un criterio de gravedad (> 60 años), así como las comorbilidades, pero la hipertensión arterial es la más común, seguida de diabetes mellitus y enfermedad coronaria. En cuanto a los hallazgos de laboratorio, los criterios son: niveles elevados de leucocitos, ALT, DHL, troponina I ultrasensible, CPK, dímero D, ferritina sérica, IL-6, prolongación del tiempo de protrombina, aumento de creatinina y procalcitonina, así como linfopenia.
La manifestación clínica de COVID-19 puede ser variada, desde casos asintomáticos o leves hasta situaciones tan graves como la insuficiencia respiratoria aguda, mediada con datos consistentes de neumonía.
Existen escalas de evaluación pronóstica como son: SCAP (severe community-acquired pneumonia), que tiene una sensibilidad de 92% y especificidad de 73% con área bajo la curva (AUC) de 0.83; la escala CURB-65, que tiene una sensibilidad de 68%, especificidad de 86% con AUC 0.78; la escala PSI (pneumonia severity index) con una sensibilidad de 95%, especificidad de 68% con AUC de 0.81. De estas escalas abordaremos la CURB-65, que es más práctica:
Tabla 6:
| Variable | Puntaje |
|---|---|
| Confusión | 1 |
| Urea > 42 mg/dL al ingreso | 1 |
| Frecuencia respiratoria ≥ 30 por minuto | 1 |
| Presión arterial sistólica ≤ 90 mmHg o diastólica ≤ 60 mmHg | 1 |
| Edad ≥ 65 años | 1 |
Cada variable tiene un punto. Riesgo grave: 3 o 4 puntos; riesgo moderado: 1 o 2 puntos; riesgo bajo: 0 puntos
La insuficiencia respiratoria aguda se clasifica de acuerdo con los criterios de Berlín, que se anexan en la Tabla siguiente:
Tabla 7:
| Inicio | Cuadro clínico de inicio durante la semana previa |
|---|---|
| Radiografía | Infiltrados bilaterales no explicados por derrames pleurales, colapso lobar o presencia de nódulos |
| Origen del edema | Insuficiencia respiratoria no explicada por falla cardiaca o sobrecarga de líquidos |
| Relación PaO2/FiO2 | Leve: PaO2/FiO2 > 200 a ≤ 300 mmHg, con PEEP ≥ 5 cm H2O |
| Moderado: PaO2/FiO2 >100 a ≤ 200 mmHg, con PEEP ≥ 5 cm H2O | |
| Grave: PaO2/FiO2 < 100 con PEEP ≥ 5 cm H2O. |
El tratamiento de insuficiencia respiratoria aguda se basa en, dependiendo de su gravedad, desde el uso de oxígeno suplementario hasta el uso de dispositivos invasivos e, incluso, el uso de oxigenación por membrana extracorpórea (ECMO, por sus siglas en inglés) en situaciones refractarias.9-12
6. Utilidad de las pruebas diagnósticas
El diagnóstico de esta infección viral consiste en tres pilares:
El estudio epidemiológico.
Las manifestaciones clínicas.
El complemento diagnóstico. Reacción en cadena de la polimerasa con transcriptasa reversa (PCR-RT).13
La PCR-RT es el estándar de oro para las infecciones virales similares. El SARS-coV-2 presenta retos en el diagnóstico debido a su prolongado periodo de incubación (dos semanas), seguido de cinco días de eliminación viral antes de presentar síntomas, tiempo en el que el enfermo asintomático es una fuente de contagio. Por ello, la importancia del diagnóstico temprano y las medidas de contención oportunas.14
Es muy importante conocer el día de inicio de los síntomas, ya que la PCR-RT se negativiza en muestras nasofaríngeas a partir del día ocho desde el inicio de los síntomas. A partir de ello y hasta aproximadamente el día 22 sólo sería positiva en muestras de esputo (vías aéreas inferiores) o heces. Esto significa que a partir del día siete del inicio de los síntomas, idealmente, la muestra para PCR-RT debería tomarse de esputo o de heces, y habría que utilizar como complemento un test de detección de anticuerpos IgM/IgG.
El test de anticuerpos IgM/IgG se va haciendo progresivamente positivo a lo largo de los días desde el inicio de los síntomas; a partir del séptimo día es positivo en 50% de los pacientes, el décimo día en 70% y el décimo cuarto día desde el inicio de los síntomas en 100% de los pacientes.
El test de anticuerpos IgM/IgG se considera importante en los casos siguientes:
Pacientes que acuden con enfermedad evolucionada y con más de siete días de síntomas.
Pacientes con síntomas y PCR negativa.
Estudio de personas en contacto y personal sanitario.
Dado lo anterior, se entiende la posibilidad de falsos negativos con PCR-RT, aunado a ello y, por su alta disponibilidad, los estudios de imagen también constituyen un apoyo importante en el diagnóstico; hasta ahora los hallazgos tomográficos son los más ampliamente descritos. No obstante, la realización de TC implica la necesidad de descontaminación de áreas y equipos con cada paciente, inhabilitando las salas de radiodiagnóstico por tiempos prolongados, lo que limita su uso como estudio de rutina; no obstante, de estar disponible se considerará una excelente herramienta de apoyo en el diagnóstico.
Los hallazgos tomográficos en pacientes con COVID-19 se han clasificado en: típicos, es decir, que hay opacidades múltiples en vidrio esmerilado de distribución periférica y basal, engrosamiento vascular, patrón empedrado o adoquín desordenado (crazy paving); hallazgos atípicos, es decir, opacidades en vidrio despulido parahiliares, apicales y linfadenopatía y hallazgos muy atípicos, o en otras palabras, cavitaciones, calcificaciones, patrón nodular, árbol en gemación, masas y engrosamiento pleural. Con base en ello, surgió la clasificación CO-RADS, la cual es un sistema de notificación estandarizado para pacientes con sospecha de infección por COVID-19; ésta asigna un nivel de sospecha para la enfermedad según los hallazgos encontrados en la imagen por TC. Éstos van desde muy bajo, CO-RADS 1, hasta muy alto, CO-RADS 5, y CO-RADS 6 que corresponde a pacientes con hallazgos típicos y PCR positivo.
Tabla 8: Nivel de sospecha por puntaje CO-RADS según los hallazgos tomográficos.
| Escala CO-RADS | ||
|---|---|---|
| Clasificación | Sospecha | Hallazgos tomográficos |
| CO-RADS 1 | No | Normal o sin anormalidades infecciosas |
| CO-RADS 2 | Baja | Anormalidades consistentes con infecciones que no son COVID-19 |
| CO-RADS 3 | Indeterminada | Indeterminado o no concluyente |
| CO-RADS 4 | Alta | Anormalidades sospechosas de COVID-19 |
| CO-RADS 5 | Muy alta | Hallazgos típicos de COVID-19 |
| CO-RADS 6 | PCR positiva | |
Esta escala fue desarrollada para un entorno de prevalencia de moderada a alta y con el fin de clasificar y reportar casos sospechosos; debe considerarse el tiempo de evolución de la enfermedad recordando que en etapas tempranas no hay cambios imagenológicos en la mayoría de los casos. Éstos han sido reportados con mayor frecuencia entre 10 y 13 días después del inicio de los síntomas.15
Por su parte, se ha correlacionado la sensibilidad de PCR-RT con la radiografía portátil de tórax, y se ha encontrado 91 y 69%, respectivamente. La PCR-RT no se encuentra siempre disponible y el resultado puede demorar incluso días; la tomografía computada, además de que no está disponible en todos los centros, presenta las desventajas logísticas ya descritas, por lo que se ha considerado a la radiografía portátil de tórax como una alternativa para el abordaje inicial o triaje de los pacientes con COVID-19.
Los hallazgos radiográficos sugestivos de COVID-19 son: opacidades focales con claro aumento de la densidad y con márgenes menos definidos que un nódulo; patrón intersticial focal o difusa y patrón alveolo-intersticial focal o difuso.
Para cuantificar la afectación pulmonar, se calculó una puntuación de gravedad adaptando y simplificando la puntuación de la evaluación radiográfica del edema pulmonar (RALE) propuesta por Warren y colaboradores. Se consideran ocho puntos según la extensión radiológica de la afectación pulmonar. Para su cálculo se divide visualmente en cuatro partes cada pulmón, partiendo del hilio pulmonar como punto medio. Cada cuadro resultante corresponderá a 25% del parénquima pulmonar y cada pulmón se puntuará de 0 a 4 según el porcentaje de extensión de las consolidaciones o radioopacidades.16 Se explica gráficamente en la Figuras 4 y 5, así como en la Tablas 9 y 10.

Figura 4: Representación de la escala RALE adaptada. La división de cada pulmón en cuadrantes representa 25%, 1 punto que al final se suma para obtener el puntaje acerca de la gravedad.
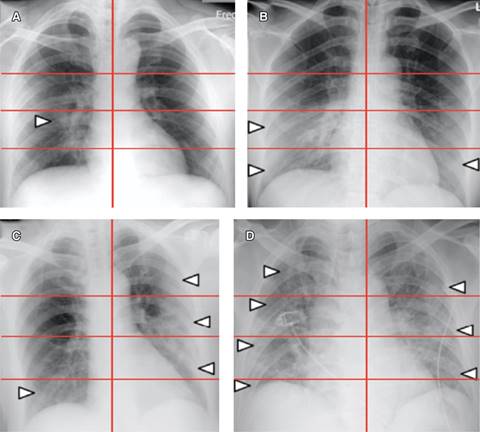
Figura 5: Ejemplos. A1 cuadrante del pulmón derecho 25%; 1 punto: leve. B2 cuadrante del pulmón derecho 50% + 1 cuadrante del pulmón izquierdo 25%; 3 puntos: moderado. C1 cuadrante del pulmón derecho 25% + 3 cuadrantes del pulmón izquierdo 75%; 4 puntos: moderado. D4 cuadrante del pulmón derecho 100% + 3 cuadrantes del pulmón izquierdo 75%; 7 puntos: severo.
Tabla 9:
| Escala de evaluación radiográfica del edema pulmonar (RALE) adaptada. | |
|---|---|
| Puntos | Porcentaje |
| 0 | 0 |
| 1 | 25 |
| 2 | 25-5’ |
| 3 | 5’-75 |
| 4 | 4 > 75 |
Porcentaje y puntaje correspondiente al número de cuadrantes con infiltrado o consolidación en cada pulmón
Tabla 10:
| Escala de evaluación radiográfica del edema pulmonar (RALE) adaptada. | |
|---|---|
| Puntos | Gravedad |
| 0 | Normal |
| 1-2 | Leve |
| 3-6 | Moderada |
| > 6 | Severa |
Gravedad radiológica determinada por puntaje
Al igual que como comentamos respecto de los hallazgos tomográficos, se debe tomar en cuenta el tiempo de inicio de los síntomas en relación con la aparición de los hallazgos radiográficos.
7. Criterios de ingreso a UTI
Criterios de ingreso. El juicio clínico no puede ser sustituido por escalas de gravedad, pero éstas pueden ser útiles para su enfoque inicial. El hospital deberá contar con un sistema para diferenciar los casos en que, por sus condiciones de vida y preferencias, no sean candidatos para solicitar el ingreso a la UTI. Un ejemplo se encuentra en las guías publicadas por NICE.17
Los enfermos ingresan a la UTI de acuerdo con las siguientes prioridades (adaptado de: SCCM. Guidelines for ICU Admission, Discharge, and Triaje18):
Prioridad I. Enfermos críticos inestables que requieren tratamiento y monitoreo intensivo, los cuales no se pueden ofrecer fuera de la UTI. Generalmente los tratamientos incluyen soporte ventilatorio, infusión de medicamentos vasoactivos, etcétera. Generalmente no se establecen límites de actuación para los enfermos en prioridad I. Ejemplos de esta categoría de enfermos incluyen a los postoperados o enfermos que requieren soporte ventilatorio por falla respiratoria aguda y pacientes inestables hemodinámicamente o en choque, los cuales reciben monitoreo invasivo y/o medicamentos vasoactivos.
Prioridad II. Enfermos que requieren de monitoreo intensivo y pueden potencialmente necesitar una intervención inmediata. Generalmente no tienen límites de actuación. Ejemplos de esta categoría incluyen a pacientes con condiciones comórbidas crónicas o quienes desarrollan enfermedad médica o quirúrgica grave. En el contexto del COVID-19, se incluyen a pacientes que no estén intubados pero que tengan altos requerimientos de O2.
Prioridad III. Enfermos críticos inestables que tienen una posibilidad reducida de recuperación debido a una enfermedad subyacente o a la naturaleza de su enfermedad aguda. Estos enfermos pueden recibir tratamiento intensivo para su enfermedad aguda, pero pueden establecerse límites de actuación como no intubación o no RCP. Ejemplos de esta categoría incluyen a pacientes con enfermedades neoplásicas metastásicas complicadas con infección, taponamiento cardiaco u obstrucción de vía aérea.
Prioridad IV. Enfermos que generalmente no son candidatos para ingresar a la UTI. El ingreso de estos enfermos debería ser analizado individualmente, bajo circunstancias especiales y a discreción del Jefe del Servicio. Estos enfermos pueden ser ubicados en las siguientes categorías:
A) No se anticipa un beneficio o el beneficio es muy pequeño al atenderlo en la UTI, debido a su bajo riesgo de recibir una intervención activa que no se pueda dar de manera segura fuera de la UTI (demasiado bien para beneficiarse del cuidado en la UTI). Ejemplos de esta categoría son los enfermos con cirugía vascular periférica, cetoacidosis diabética hemodinámicamente estables, falla cardiaca congestiva leve, enfermo consciente con sobredosis de medicamentos, etcétera.
B) Paciente con enfermedad irreversible y terminal que enfrenta una muerte inminente (demasiado enfermo como para beneficiarse del cuidado en la UTI). Por ejemplo, daño cerebral grave irreversible, falla multiorgánica irreversible, cáncer metastásico que no responde a quimioterapia o terapia de radiación (a menos que el enfermo esté en un protocolo de tratamiento específico), enfermos con capacidad de tomar decisiones y que no desean monitoreo o cuidado intensivo y que van a recibir solamente cuidado paliativo y pacientes con muerte encefálica.
La decisión de ingreso siempre buscará ser, en la medida en que las circunstancias lo permitan, individualizada y compartida con los demás médicos, enfermo y sus familiares.19
Tabla 11: Esquema de decisiones de ingresos a la UTI en situación de crisis.
| Esquema de decisiones de ingresos a la UTI en situación de crisis. | |
|---|---|
| Ingreso a la Unidad de Terapia Intensiva | Ingreso a la Unidad de Cuidados Intermedios* |
| Prioridad I | Prioridad II |
| No ingreso a la Unidad de Terapia Intensiva | |
| Prioridad III y IV | |
* Si en el hospital no hubiera Unidad de Cuidados Intermedios o su equivalente, ingresarán a la Unidad de Terapia Intensiva.
8. Terapia respiratoria en pacientes con COVID-19
Objetivo
Implementar medidas para el correcto manejo del soporte respiratorio en pacientes con diagnóstico de COVID-19
Recomendaciones
Medidas preventivas, equipo de protección y aislamiento.
Manejo de insuficiencia respiratoria.
Mecanismos de entrega de oxígeno convencionales:
Si el paciente requiere más de 8 litros por minuto, colocar dispositivo Venturi para mantener las saturaciones entre 90-94%.23
Ventilación mecánica no invasiva:
La ventilación no invasiva se utilizó para disminuir la necesidad de intubación con un porcentaje de éxito de 40 a 80% en SARS, en MERS de 30 a 40% y en influenza de 30%.
Ha sido descrita como un procedimiento que genera aerosoles, sin embargo, la evidencia no es contundente, habrá que considerar los tipos de circuitos que se utilizaron y las mascarillas (de una y de dos ramas).
La ventilación mecánica no invasiva se debe administrar con ventiladores de cuidado crítico y con doble circuito (mascarilla no respirada). Puede utilizarse como estrategia inicial en pacientes con PaO2/FiO2 igual o mayor a 200 y pacientes con EPOC e insuficiencia cardiaca agregada (COVID-19).22,24-28
Puntas nasales de alto flujo:
Medicamentos:
Broncodilatadores: se recomienda utilizar dispositivos de dosis medida con espaciador siempre que sea posible en pacientes con COVID-19.
Esteroides: No se recomienda el uso de esteroides inhalados en pacientes con diagnóstico de COVID-19; se podrá valorar en caso de que el paciente presente patología de base que lo amerite.
En caso de utilizar antibióticos nebulizados, adminístrelos con dispositivo de malla vibrante y en circuito cerrado.29
Humidificación de la vía aérea:
-
Se puede utilizar cualquier sistema de humidificación disponible con las siguientes consideraciones y precauciones:
Tabla 12:
Humidificación pasiva (HME/HMEF) Humidificación activa Cambiar según recomendaciones de la AARC, generalmente cada 24 a 48 horas Evitar desconexión de circuito innecesaria No utilizar si el paciente tiene secreciones espesas o hipotermia Vigilar condensación en circuito Cambiar el circuito cada siete días o cuando esté visiblemente sucio
-
Filtros:
Intubación del paciente con COVID-19:
Véase capítulo 18. Traslado seguro de pacientes con COVID-19
Ventiladores de cuidados críticos para múltiples pacientes:
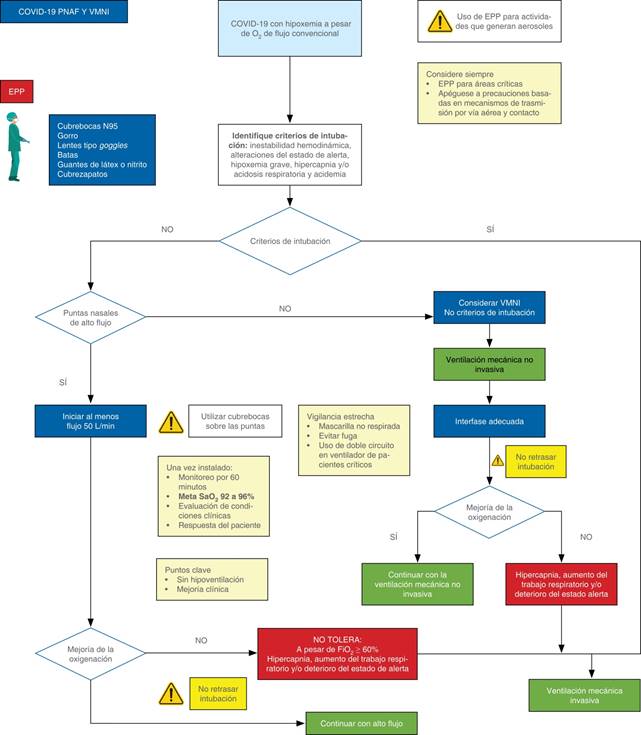
9. Recomendaciones para el uso de oxígeno de alto flujo1
No está indicado el uso de oxígeno de alto flujo de manera rutinaria, sólo se recomienda en los siguientes casos seleccionados:
Cuando no se dispone de otra opción; siempre se deben considerar las medidas necesarias de protección individual para el personal de salud.
Cuando no mejora la saturación con oxigenoterapia convencional y no se cumplen los criterios para intubación, siempre se deben considerar las medidas necesarias de protección individual para el personal de salud.
En los casos de adultos infectados con COVID-19 e insuficiencia respiratoria hipoxémica aguda a pesar de la terapia del oxígeno convencional, sugerimos usar puntas nasales de alto flujo (PNAF) sobre la oxigenoterapia convencional y cuando no esté disponible otra opción, por ejemplo, por recursos limitados en una pandemia.
Su uso sólo se realizará siempre y cuando:
Se cuente con los equipos de protección personal adecuado.
Se tenga la capacitación en el manejo de estos equipos por parte del personal involucrado.
Se pueda reducir al máximo la dispersión generalizada del aire exhalado; de esta manera, se disminuye el riesgo de transmisión en el aire, siempre que se cuente con las siguientes medidas:
Que se garantice el sellado máximo de la interfaz (cánulas grandes).
Que se reduzca el flujo de O2 al mínimo necesario.
Que se coloque al paciente un cubrebocas con la cánula de O2, debajo del mismo.
Que haya una ubicación adecuada del paciente, ya sea una habitación con presión negativa si está disponible o una habitación cerrada.
Monitoreo durante su uso
Una vez instalado, se recomienda una monitorización estrecha de las condiciones clínicas y de la respuesta del paciente (compromiso respiratorio); también se recomienda no retrasar la intubación orotraqueal si es necesario.
Contraindicaciones: se contraindica en pacientes con inestabilidad hemodinámica, fallo multiorgánico, en pacientes con alteración del estado de alerta e hipercapnia; también en donde no se cuente con las medidas de protección personal necesarias para COVID-19 y no se tenga capacitación para el uso PNAF (Figura 6).30
10. Ventilación mecánica no invasiva (VMNI)
1. COVID-19 está asociado con síntomas graves como la insuficiencia respiratoria tipo 1 rápidamente progresiva. Los pacientes que han recibido un ensayo con VMNI como soporte respiratorio tienen un mal pronóstico. Por lo anterior, la VMNI tiene un papel limitado en el soporte respiratorio en pacientes graves con COVID-19.
2. El riesgo de dispersión del virus al personal de salud es mayor con el uso de VMNI y puntas nasales de alto flujo (PNAF) que con el uso de oxígeno suplementario administrado de forma convencional.
3. Si el uso de VMNI no puede evitarse (por ejemplo, falta de camas en terapia intensiva o falta de ventiladores mecánicos invasivos), se sugiere el uso PNAF, debido a que se ha reportado una menor área de aerosolización. En estos casos, la recomendación es que los pacientes ingresen a una habitación con presión negativa.
4. De forma general, se sugiere evitar PNAF o VMNI. Cada caso deberá ser individualizado y se debe considerar que el retraso de la intubación empeora el pronóstico de los pacientes.
5. No se recomienda el uso de PNAF o VMNI en pacientes graves con COVID-19.31
11. Consideraciones durante la intubación en pacientes graves con COVID-19
La intubación traqueal es un procedimiento potencialmente de alto riesgo para el experto de la vía aérea, particularmente porque se expone a una carga viral alta, y aún más si la transmisión es directa y está asociado con una enfermedad más grave. Por esta razón, se deben tomar todas las precauciones necesarias.
En la Tabla 13, se menciona el equipo de protección personal (EPP) o de aislamiento de sustancias corporales (ASC) para el personal de salud. Independientemente de la gravedad clínica de la enfermedad, debemos tener en cuenta estos tres rubros:
Tabla 13: Equipo de Protección Personal (EPP) para el personal de salud.
| 1 | La higiene de las manos es fundamental |
| 2 | Protección ocular de montura integral o protector facial completo |
| 3 | Mascarilla de alta eficacia (FFP2 o FFP3), o mascarilla facial N95 de 3 micras |
| 4 | Es importante resaltar que la mascarilla de la careta no ofrece protección para las partículas en aerosol del virus |
| 5 | Botas resistentes o impermeables a fluidos. Protección ocular con extensión lateral, careta completa y filtros o cubrebocas tipo N95; también se deben utilizar cubiertas para el cabello o capuchas (trajes completos de aislamiento). Se recomienda utilizar guantes de manga larga; se puede utilizar cinta colocada de manera vertical para mantener los guantes adheridos a la bata (no utilizarlos de manera circunferencial, ya que esto hace más difícil la manipulación y eliminación de estos insumos) |
| 6 | La protección del calzado puede aumentar el riesgo de autocontaminación, por lo que deben evitarse de manera inicial |
| 7 | El calzado debe ser impermeable y debe ser susceptible a descontaminación |
| 8 | Los overoles con capucha de preferencia deben ser usados como capa interior debajo del EPP |
| 9 | Utilizar doble guante |
| 10 | Si está disponible, una alternativa es utilizar sistemas de respiradores purificadores de aire para procedimientos con generación de aerosoles como la intubación endotraqueal (RPAP) |
| 11 | Sin dispositivos más costosos y con mayor factor de protección que el N95; sin embargo, deben estar disponibles en caso de que se requiera una intervención más prolongada con el paciente |
| 12 | Se ha documentado que hay infección del personal de salud aun utilizando N95, sobre todo en situaciones prolongadas, por lo que en escenarios de alto riesgo se prefieren los sistemas RPAP |
Seguro para el personal y el paciente.
Preciso para evitar técnicas poco confiables, desconocidas o repetidas.
Rápido y oportuno, sin prisas ni demoras.
Lista de verificación y capacitación del factor humano para el manejo de la vía área del paciente con COVID-19
La siguiente lista de verificación de intubación traqueal está diseñada y modificada para ayudar a la preparación; ésta debe verificarse antes de ingresar a la habitación del paciente con COVID-19. Se deben tener en cuenta los siguientes objetivos en orden prioritario:
Seguridad del equipo de salud.
Aislar de manera efectiva al paciente infectado.
Establecer las técnicas más efectivas al momento de abordar e instrumentar la vía área.
Resolver la insuficiencia respiratoria.
Evitar el contagio a los demás miembros del equipo de salud y a los otros pacientes (Figura 7).
Es importante centrarse en la seguridad, la rapidez, la fiabilidad y el éxito del primer intento de la intubación, ya que los múltiples intentos incrementan el riesgo de diseminación en el personal de salud.32
Consideraciones previas a la intubación:
Lo más segura y efectiva posible.
Menor exposición a líquidos corporales del paciente, en especial gotas y/o aerosoles.
Menor diseminación de secreciones del paciente al área de trabajo.
El menor tiempo posible con el mínimo número de complicaciones.
Los instrumentos deben ser desechables, o en caso de no serlo, lo más aislados posibles de contacto con el paciente.
Se debe hacer énfasis en que los portadores deben ser lo más expertos posibles para garantizar el mínimo de complicaciones.
Disminuir al máximo el personal requerido para la atención del paciente.
Previo al manejo de la vía aérea:
Trate a cada paciente como potencial propagador de COVID-19.
El personal que esté en contacto con el paciente durante el manejo de la vía aérea y la intubación deberá seguir de manera puntual y estricta las instrucciones para el uso y colocación del EPP.
Suspender la cirugía electiva en pacientes con COVID-19 (esto incluye pacientes con tos o síntomas de resfriado sin fiebre).
Evaluación exhaustiva de la vía aérea para evitar el uso de múltiples dispositivos de vía aérea y exposición prolongada.33
Lavado exhaustivo de manos antes o después de estar con el paciente, o antes de realizar cualquier procedimiento.
Tener listo en carro de vía aérea y/o todos los dispositivos necesarios para su manejo; en ésta se incluye videolaringoscopio.34
Se recomienda el uso de equipo desechable para el manejo de la vía aérea, en caso de contar con él.
Reúna a todo el equipo de trabajo para planificar el abordaje de vía aérea. En lo posible, desarrolle un protocolo de atención relacionado con éste.
En lo posible, organice un equipo de manejo de vía aérea del paciente con COVID-19.
Refuerce las prácticas estrictas de control de infecciones; esto incluye recordar que al equipo integral de limpieza se le asignen trajes PPE especiales.
Limpiar continuamente y con base en la normatividad las superficies de trabajo, la máquina de anestesia y otros fómites.
Durante el manejo de la vía aérea:
Utilice técnicas confiables que funcionen incluso cuando se encuentre con dificultades.
Monitoreo completo.
No se deben usar nebulizaciones y es necesario evitar todas aquellas maniobras que favorezcan la generación de gotas o aerosoles; destacan el alto flujo de oxígeno, la ventilación no invasiva, la ventilación con mascarilla a una mano, la aspiración de secreciones con sistema abierto o la aplicación de nebulizaciones y/o aerosoles.
Considerar intubación de secuencia rápida. La presión del cricoides cuando un asistente capacitado pueda aplicarlo.
Se recomienda, acorde con los recursos hospitalarios, el uso de filtros HEPA. El filtro es capaz de atrapar 99.5% de partículas de más de 0.003 micras de diámetro, en una habitación de 50 metros cuadrados y con un flujo de aire de 190 metros cúbicos por hora.
La técnica elegida puede diferir de acuerdo con las prácticas y equipos locales.
Preoxigenación con una máscara bien ajustada y un Mapleson C o circuito anestésico. Se debe evitar en todo momento la generación de aerosoles. Para ello, se puede usar técnica de dos manos con aislamiento de la cara del paciente y un asistente que ventile con la bolsa reservorio; la ventilación con mascarilla deberá realizarse a baja presión y flujos bajos de oxígeno y con un sistema cerrado.35
En caso de que el paciente mantenga una adecuada saturación de la hemoglobina, la preoxigenación se puede llevar a cabo con flujo de oxígeno por puntas nasales que no rebase 6 L/minuto.
No utilizar presión positiva al momento de la preoxigenación, pues genera una gran cantidad de aerosoles.
No utilizar altos flujo de oxígeno > 6 L, ya que genera aerosoles.
No utilizar ventilación no invasiva, a menos que se tengan los filtros y aditamentos adecuados, y sólo si el paciente se encuentra en un cuarto de presión negativa que haga 12 recambios de aire por hora.36
Es importante evitar los aerosoles al momento de la intubación/extubación a la aspiración de secreciones.
De preferencia, la aspiración de secreciones debe realizarse por un sistema cerrado.
No se recomienda traqueostomía, salvo en situaciones emergentes.
No se debe usar mascarilla bolsa-reservorio.
Se recomienda el uso de un laringoscopio desechable. En caso de no disponer de este dispositivo, deberá usar un laringoscopio tradicional, el cual, después de utilizarlo, deberá depositarse en una bolsa plástica sellada y enviarse a esterilizar en óxido de etileno a temperatura no mayor a 60oC.
Se recomienda videolaringoscopia con palas desechables para intubación traqueal.
En caso de emergencia, se deberá usar el dispositivo de vía aérea supraglótica de segunda generación para el rescate de la vía aérea.
No se recomienda el uso de dispositivos supraglóticos.37
Coloque un filtro HME (intercambiador de calor y humedad) entre el montaje de la sonda orotraqueal y el circuito en todo momento.
Para evitar el colapso cardiovascular, se recomienda ketamina 1-2 mg/kg-1, lidocaína 1-1.5% vía intravenosa (disminuye 30%). Es importante mencionar la prevención de broncoconstricción refleja, característica en estos pacientes en estado grave, la cual puede utilizarse también en infusión 1-3 mg/kg hora, y disminuir la reactividad de la vía área.38
Cuando se emplea bloqueo neuromuscular, se debe usar 1.2 mg/kg de rocuronio o 1.5 mg/kg de succinilcolina, y que además no tenga datos de hipercalemia.
Se debe usar vasopresor/inotrópico de acuerdo con el estado hemodinámico de cada paciente.
Neumotaponamiento, calibrado con manómetro, de la sonda orotraqueal para asegurar las vías respiratorias antes de comenzar la ventilación y, en lo posible, evitar la generación de aerosoles.
Confirme la intubación traqueal con capnografía y ultrasonido. Evitar en lo posible el uso de estetoscopio; si lo utiliza, asegúrese de su estricta limpieza y esterilización.
En caso de que la vía aérea sea fallida y difícil, se recomienda utilizar el algoritmo recomendado en las Figuras 8 y 9.
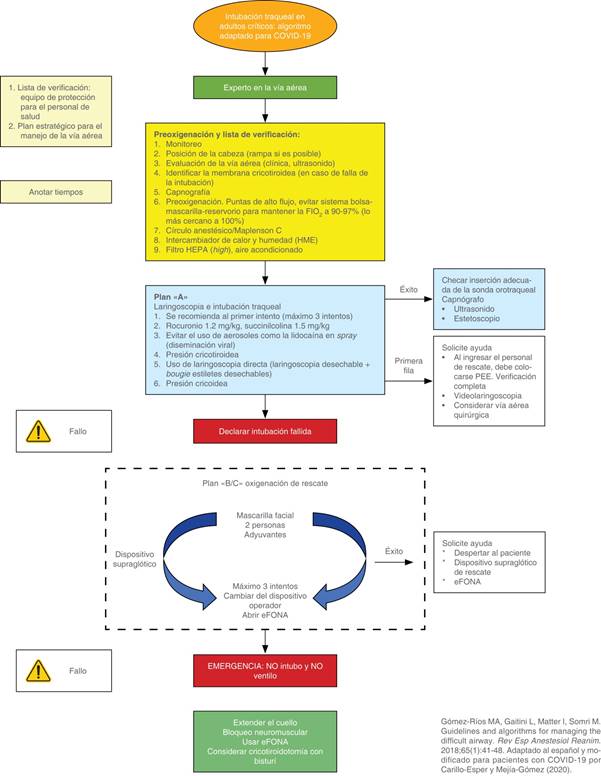
Figura 8: Algoritmo de actuación de abordaje de la vía aérea difícil de urgencia para pacientes con COVID-19.
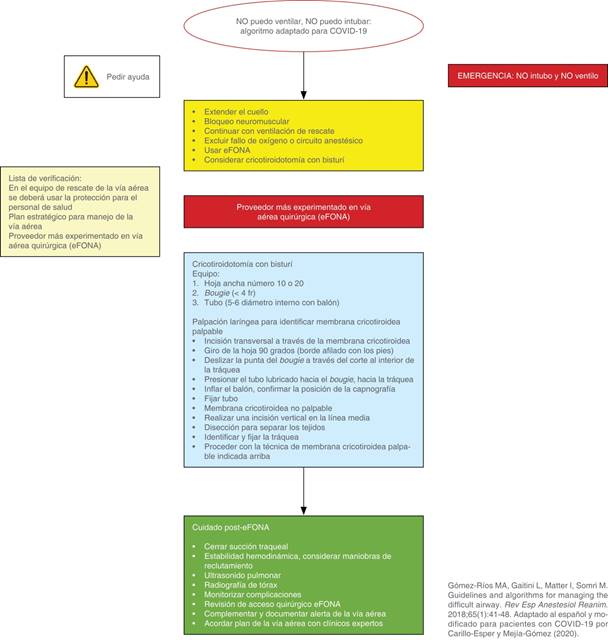
Figura 9: Algoritmo de actuación de abordaje de la vía aérea difícil de urgencia para pacientes con COVID-19.
Coloque una sonda nasogástrica después de que se complete la intubación y se establezca la ventilación de manera segura.
Se recomienda el uso de filtros HEPA en la unión del tubo endotraqueal con el circuito de la maquina de anestesia y/o ventilador mecánico, así como la rama espiratoria del circuito.39
Posterior al manejo de la vía aérea:
La ropa y material desechable utilizados durante el procedimiento deberán depositarse en bolsas y en contenedores de material biológico infectocontagioso para su tratamiento y eliminación.
Se deberá seguir estrictamente el proceso del retiro del EPP.
Descontamine el equipo reutilizable por completo acorde con la normatividad establecida.
Después de salir de la habitación, asegúrese de que la eliminación del EPP sea meticulosa.40
La sala deberá estar limpia 20 minutos después de la intubación traqueal (o último procedimiento que pudo haber generado aerosoles).
Si hubo dificultad a la intubación, el plan de vía aérea difícil debe notificarse y comunicarse a todo el equipo.
Durante la extubación:
Considere la extubación en un cuarto especial para minimizar la exposición.
Tome las mismas precauciones que durante la intubación.
Deseche inmediatamente el dispositivo de la vía aérea en el contenedor después de su uso.41
12. Broncoscopia
A pesar de obtener a través del lavado bronquioloalveolar por técnica broncoscópica el mayor poder diagnóstico de rRT-PCR para SARS-CoV-2 (> 90%) y que sea mínimamente invasor, no recomendamos su uso rutinario por requerir personal especializado con experiencia y equipo sofisticado y costoso, además de ser de alto riesgo para el contagio del personal de la salud dentro del contexto del COVID-19, como se ha mencionado, al generar aerosoles y producir tos durante y después de realizado el procedimiento; el método de toma de muestras de elección será siempre el hisopado nasofaríngeo.
Sin embargo, podrá requerirse en casos complicados con distrés respiratorio agudo bajo ventilación mecánica con PEEP (indicaciones emergentes, urgentes y programadas)42 ante la falla terapéutica con avance del proceso neumónico e hipoxemia, donde sea deseable la pronta identificación de patógenos sobreagregados para la realización de ajuste de antimicrobianos, así como las indicaciones terapéuticas habituales (atelectasias, tapones mucosos y hemoptisis que no mejoran con las medidas usuales). En ese caso, deberá realizarse de manera programada preferentemente por un experto y en cuartos de cuidados intensivos que cuenten con sistemas de presión negativa bajo sedación, a fin de minimizar el reflejo de la tos; esto se puede realizar a través de un tubo endotraqueal del núm. 8 o superior (en el que se cerciorará antes la técnica de inflado del globo) y previo ajuste en el modo y los parámetros del ventilador de manera habitual en este procedimiento bajo ventilación mecánica. Deberá asegurarse, como siempre, la técnica estéril del procedimiento y cerciorarse de que, tanto el médico broncoscopista como el personal de apoyo alrededor de la cabecera del enfermo, cuenten con todas las medidas de seguridad personal (gorros, googles herméticos y/o escudos faciales, cubrebocas de alta eficiencia N95, doble bata, la externa de manga larga e impermeable, doble guante y calzado cerrado y, de ser posible, con una campana broncoscópica Rosseli).
13. Control de temperatura en paciente crítico con COVID-19
La información disponible que describe la presentación clínica de pacientes con COVID-19 es aún limitada. Debido a la variedad de síntomas respiratorios en las infecciones del tracto respiratorio, así como al alto porcentaje de pacientes graves con diagnóstico de COVID-19 que presentan fiebre (83-98%),43,44 el diagnóstico operacional clínico de gravedad, tanto para influenza AH1N1-pdm 2009 como para SARS CoV2, requiere que se documente la fiebre.45 Guan y colaboradores reportaron que en 44% de los pacientes se identificó fiebre mayor de 39.5 °C de pacientes con COVID-19 a su ingreso hospitalario y en 89% de los casos durante su estancia hospitalaria.
Wang Y y su equipo44 describieron que entre 77 y 98% de los pacientes desarrollan fiebre durante su hospitalización y, durante la fase más crítica, alcanzará su nivel máximo entre el cuarto y quinto día, con más de 40 °C sin respuesta al uso de antipiréticos parenterales (paracetamol), o su uso se restringe por alteraciones en las pruebas de función hepática, siendo relacionada con una elevación de marcadores bioquímicos humorales como IL por la respuesta inflamatoria sistémica por pirógenos endógenos más que por una respuesta a agentes externos.
La mayoría de las recomendaciones se enfoca en las estrategias de ventilación y uso de fármacos dirigidos contra COVID-19. Sin embargo, se ha hecho poco énfasis en el control de la temperatura. La fiebre desencadena una serie de cambios en el organismo. Por cada grado de aumento de la temperatura, se eleva 10% el metabolismo basal, y con ello, el organismo se vuelva más reactivo, sobre todo bioquímicamente, lo que representa un gasto considerable de energía.
Actualmente, en aquellos pacientes en quienes no se logró control de la temperatura con antipiréticos a dosis máxima se emplea como medida final el control por medios físicos (externos), ya sean compresas húmedas o hielo (con los consecuentes efectos deletéreos por el temblor por falta de regulación controlada de los cambios de temperatura). En un grupo de pacientes con COVID-19, en 38% se emplean métodos de contacto de regulación de temperatura con dispositivos de gel transferencia térmica con protocolo de normotermia, observando control de las temperatura y menores complicaciones, como temblor e hipopotasemia. Las arritmias (bradicardia), entre otras, en el grupo de normotermia son menores en comparación con los pacientes en quienes no se controla la fiebre o se realiza con otras técnicas (Figura 11).
14. Estrategias terapéuticas para infección por COVID-19
A finales de diciembre de 2019, se registró un brote de una enfermedad emergente denominada COVID-19 causada por un nuevo coronavirus (llamado SARS-CoV-2), el cual inició su presencia en la ciudad de Wuhan, China, y se propagó rápidamente hacia el resto del mundo, condicionando un gran problema de salud. Ésta fue declarada por la OMS como la sexta emergencia de salud pública de preocupación internacional, ante lo cual se generó un gran reto para el sistema de salud, debido al desconocimiento del comportamiento de esta nueva enfermedad.
De manera inicial, se han utilizado distintos agentes antivirales, principalmente oseltamivir (75 mg vía oral cada 12 h), ganciclovir (0.25 g vía intravenosa cada 12 h) y lopinavir/ritonavir (400/100 mg vía oral cada 12 h), además de otros inhibidores de neuraminidasa, análogos de nucleósidos, inhibidores de la síntesis de ADN, así como diversos antibióticos y antifúngicos empíricos, hidroxicloroquina/cloroquina, inmunoglobulina intravenosa, esteroides sistémicos y hasta medicina tradicional china, sin existir hasta el momento una evidencia clara sobre el tratamiento efectivo para COVID-19.46
Remdesivir
En un estudio reciente, se evaluó la eficacia antiviral de cinco fármacos aprobados por la FDA (por sus siglas en inglés: Food and Drug Administration): ribavirina, penciclovir, nitazoxanida, nafamostat, cloroquina, y dos fármacos antivirales de amplio espectro: remdesivir y favipiravir contra un aislamiento de SARS-Cov-2 in vitro. Con la mayoría de los fármacos estudiados, se requirieron altas concentraciones para reducir la infección viral; dichas concentraciones en diversos antivirales no se consiguen con la dosis oral recomendada, por el contrario, particularmente con el remdesivir y la hidroxicloroquina/cloroquina se logró bloquear la infección viral a una concentración micromolar baja y un alto índice de selectividad.47
El remdesivir es un análogo de adenosina que se incorpora a las cadenas de ARN viral nacientes y da como resultado la terminación prematura. Por esta razón, se considera como un medicamento antiviral contra una amplia gama de infecciones por virus de ARN (incluido SARS/MERS-CoV) y, actualmente, se encuentra en desarrollo clínico para el tratamiento de la infección por el virus del Ébola, manejándose una dosis para infusión intravenosa de 10 mg/kg. Se ha demostrado que el remdesivir y la cloroquina son altamente efectivos en la inhibición de la infección in vitro de SARS-CoV-2; además, los datos preliminares muestran que se puede inhibir la infección del virus de manera eficiente en una línea celular humana (células Huh-7 de cáncer de hígado humano) que es sensible a SARS-CoV-2, lo cual sugiere un uso prometedor en personas que padecen la nueva enfermedad por coronavirus.48
Los criterios actuales para el uso de remdesivir mediante un protocolo de investigación son enfermedades pulmonares moderas a severas y en pacientes críticos; asimismo, no está recomendado en embarazo y debe administrarse con filtración glomerular menor a 50 mL/min, así como elevación de transaminasas cinco veces por arriba del límite normal.
Tabla 14:
| Factor de riesgo | Puntaje |
|---|---|
| Edad ≥ 68 años | 1 |
| Sexo femenino | 1 |
| Diurético de asa | 1 |
| Potasio sérico ≤ 3.5 mEq/L | 2 |
| Intervalo QT ≥ 450 ms al ingreso | 2 |
| Infarto agudo al miocardio | 2 |
| ≥ 2 fármacos que prolongan el intervalo QT | 3 |
| Sepsis | 3 |
| Falla cardiaca | 3 |
| Fármaco que prolonga el intervalo QT | 3 |
| Máximo puntaje de riesgo | 21 |
Cloroquina e hidroxicloroquina
La cloroquina se ha utilizado a nivel mundial como parte de la lista de medicamentos esenciales de la OMS para diversas patologías, siendo un producto de bajo costo y con un perfil de seguridad clínica bien establecido.49 Ésta ha sido utilizada inclusive a dosis muy altas (hasta 600 mg/día) para tratar enfermedades autoinmunes;48 sin embargo, su eficacia y seguridad para el tratamiento de pacientes con COVID-19 por SARS-CoV-2 no se había establecido previamente. El uso de cloroquina está incluido en las pautas de tratamiento de la Comisión Nacional de Salud de China y, según los informes, se asoció con una menor progresión de la enfermedad y una menor duración de los síntomas.50
La cloroquina se ha descrito con efectos in vitro, pues se sabe que bloquea la infección por virus al aumentar el pH endosómico requerido para la fusión virus/célula, además de interactuar en la inhibición de la eliminación del recubrimiento y/o la alteración de las modificaciones postraduccionales de las proteínas recién sintetizadas, especialmente al interferir con la glucosilación de los receptores celulares en muchos virus, específicamente en el SARS-CoV.
Se ha estudiado el papel de la cloroquina y la hidroxicloroquina en el tratamiento de pacientes COVID-19, encontrándose una reducción significativa de la carga viral con una dosis recomendada de hidroxicloroquina de 600 mg cada 24 h (concentración sérica de 0.46 μg/mL +0.2), con lo cual, posterior a analizar la carga viral después de seis días, se encontró una cura viral en 70% de los pacientes tratados con hidroxicloroquina en comparación con 12.5% en el grupo control.51
Además de su acción antiviral, la cloroquina tiene una actividad inmunomoduladora que puede aumentar sinérgicamente su efecto antiviral in vivo. Después de la administración oral, se distribuye ampliamente en todo el cuerpo, incluyendo a nivel pulmonar.52
Se ha demostrado que la hidroxicloroquina (un análogo de la cloroquina) tiene una actividad anti-SARS-CoV in vitro. El perfil de seguridad clínica de la hidroxicloroquina es mejor que el de la cloroquina (durante el uso a largo plazo) y permite una dosis diaria más alta, además de menor incidencia de interacciones farmacológicas.53
Los últimos dos estudios franceses han demostrado una adecuada respuesta clínica y en niveles de carga viral en tracto respiratorio con hidroxicloroquina a dosis de 200 mg cada 8 horas por 10 días en combinación con el macrólido azitromicina, que puede ser un tratamiento potencial con diversos mecanismos de acción en el control de COVID-19.
Recientemente, se publicaron dos reportes preliminares de ensayos clínicos en China; uno de ellos en Shanghái, con 30 pacientes aleatorizados 1:1 a recibir tratamiento convencional en comparación con hidroxicloroquina 400 mg/día durante cinco días. Se concluyó que el uso de hidroxicloroquina no fue mejor que el tratamiento convencional en la respuesta clínica y virológica radiológica al séptimo día. Este reporte inició con un número muy pequeño de pacientes, lo cual nos deja información decepcionante.54 El otro estudio en Wuhan, China, incluyó 62 pacientes con neumonía leve (SaO2/SPO2 ratio > 93% o PaO2/FIO2 ratio > 300 mmHg), en donde se aleatorizaron 1:1 con 31 pacientes a recibir cinco días hidroxicloroquina (400 mg/d) de forma adicional al cuidado estándar. A la evaluación del quinto día, 25 de 31 pacientes (80.6%) tuvieron mejoría clínica comparado con sólo 17 de 31 pacientes (54.8%) del grupo control. Dos pacientes tuvieron reacciones adversas leves en el grupo hidroxicloroquina (cefalea y reacción cutánea).55
Azitromicina
Además, al comparar el efecto del tratamiento con hidroxicloroquina como monoterapia y el efecto de la hidroxicloroquina en combinación con azitromicina, fue significativamente más eficiente el uso combinado de ambos fármacos para la eliminación del virus en pacientes con COVID-19. Los estudios franceses hablan de dosis de 500 mg al día por cinco días y el más grande de ellos de 500 mg al día/dosis de carga, seguido de 250 mg al día durante cinco a siete días.53 Ambas drogas incrementan el intervalo QT, sobre todo la azitromicina, por lo que se recomienda evaluar el beneficio anticipado sobre el riesgo de su uso. El Colegio Americano de Cardiología recomienda un sistema de puntuación con base en los factores de riesgo preexistentes, como la edad, el infarto miocárdico previo, el nivel de potasio, entre otros, para clasificar el riesgo en bajo, moderado y alto. También se propone el monitoreo electrocardiográfico continuo con criterios para reducir o discontinuar el tratamiento.56
Tabla 15: Escala de riesgo para fármacos asociados con la prolongación del intervalo QT.11
| Riesgo | Puntaje |
|---|---|
| Bajo | ≤ 6 |
| Moderado | 7-10 |
| Alto | ≥ 11 |
Inhibidores de proteasa: lopinavir-ritonavir
Los medicamentos inhibidores de proteasa que actualmente se usan para el tratamiento del VIH se han vuelto una opción terapéutica en ensayos clínicos ante la aparición del nuevo coronavirus denominado SARS-CoV-2 causante de COVID-19. En un ensayo aleatorizado y controlado que se realizó en pacientes hospitalizados por COVID-19, con saturación de oxígeno menor o igual a 94% y relación de la presión parcial de oxígeno (PaO2) a la fracción de oxígeno inspirado (FiO2) de menos de 300 mmHg, quienes fueron aleatorizados en proporción de 1:1 a recibir 400 y 100 mg de lopinavir y ritonavir, respectivamente, dos veces al día durante 14 días en comparación con la atención estándar en el grupo control, no se asoció con una diferencia significativa en el tiempo a la mejoría clínica ni en la mortalidad en comparación con el grupo que recibió la atención estándar.57
El lopinavir/ritonavir ha demostrado eficacia in vitro con betacoronavirus, principalmente para el tratamiento de SARS y MERS (síndrome respiratorio de Oriente Medio), por lo que se ha considerado un potencial terapéutico contra SARS-CoV-2 causante de COVID-19 y, a pesar de que en el artículo reciente de The New England Journal of Medicine no demostró un beneficio claro, se están llevando a nivel internacional diversos protocolos con este medicamento.
Una gran limitante de este medicamento son sus múltiples toxicidades e interacciones farmacológicas, por lo que debe usarse con precaución, sobre todo en pacientes de UCI en conjunción con uso de esteroides o falla hepática.
Otro inhibidor de proteasa con mejor perfil de seguridad es darunavir en combinación con ritonavir o cobicistat; sin embargo, éste no se ha recomendado, ya que se ha observado que las concentraciones in vitro para inhibir la replicación celular de SARS-CvOv-2 y otros coronavirus es extremadamente alta y no se alcanzaría dicha concentración con las dosis autorizadas actualmente en el tratamiento de VIH.
Otros
Algunos medicamentos no son considerados para su uso porque existe información sobre su inefectividad. Al respecto, ribavirina e interferón (rIFNα2a, rIFNα2b o rIFNβ1a) fueron utilizados en un estudio observacional multicéntrico para tratar MERS-CoV. La terapia fue utilizada en pacientes críticamente enfermos, pero no se asoció con la disminución de la mortalidad a 90 días o una más rápida eliminación de MERS-CoV ARN.58
Dentro de la fisiopatología del COVID-19 en pacientes críticamente enfermos se han descrito síndrome de liberación de citocinas con niveles elevados de IL-6, por lo que se han usado en algunos estudios clínicos inhibidores de IL-6, los cuales aparentemente tienen buenos resultados, sobre todo con el inhibidor del receptor de IL-6 tocilizumab.59,60 De igual manera, se ha descrito el uso de ivermectina para el tratamiento de esta enfermedad, sin contar hasta el momento con evidencia fuerte que justifique su recomendación.
Conclusión
En la actualidad, no se cuenta con evidencia clara que proporcione fármacos específicos y aprobados por la FDA para el tratamiento de COVID-19, por lo que hasta este momento la base del manejo se enfoca en medidas de sostén y ajuste, dependiendo de las necesidades del paciente. No podemos dejar de mencionar que se están llevando a cabo diversos estudios, no obstante, en la literatura internacional hay deficiencias metodológicas y un numero limitado de pacientes.
Tabla 16: Protocolos de tratamiento usado en la bibliografía internacional para pacientes en hospitales con 2019-nCoV, de acuerdo con su estado crítico o cuando existe una sospecha razonable debido a su clínica y antecedentes epidemiológicos.
| Enfermedad moderada | Sulfato de hidroxicloroquina: |
| 400 mg vía oral cada 12 horas el primer día | |
| 200 mg vía oral cada 8 horas por 10 días | |
| Azitromicina 500 mg el primer día seguido de 250 mg por día durante 4 días | |
| Remdesivir (obtener uso compasivo) | |
| Dosis de carga de 200 mg vía intravenosa el primer día | |
| Mantenimiento 100 mg vía intravenosa al día desde día 2 al día | |
| Enfermedad severa | Lopinavir/ritonavir 2 tabletas de 200/50 mg vía oral cada 12 horas |
| Sulfato de hidroxicloroquina | |
| 400 mg vía oral cada 12 horas el primer día | |
| 400 mg vía oral cada 8 horas por 10 días | |
| + | |
| Azitromicina 500 mg el primer día, seguido de 250 mg por día durante 4 días | |
| Remdesivir (obtener uso compasivo) | |
| Dosis de carga de 200 mg vía intravenosa el primer día, manteniendo 100 mg vía intravenosa al día, desde el día 2 al día 10 | |
| Lopinavir/ritonavir 2 tabletas de 200/50 mg vía oral cada 12 horas |
• Evaluar el potencial sinergismo de todas las drogas utilizadas sobre el alargamiento del intervalo QT (se recomienda seguir las pautas del Colegio Americano de Cardiología para uso y vigilancia).56
• Las recomendaciones terapéuticas son de acuerdo con la información actual y con la disponibilidad de los medicamentos en nuestro país.
• En pacientes con uso de lopinavir/ritonavir la diarrea es un efecto adverso frecuente, por lo que no está indicado en pacientes con diarrea severa por COVID-19. Se recomienda administrar con alimentos y vigilar las interacciones en la página de Liverpool: https://www.hiv-druginteractions.org/.
No sobrepasar la dosis de hidroxicloroquina de 6.5 mg/kg/día y de cloroquina 5 mg/kg/día.
Tabla 17: Abordaje clínico y tratamiento para COVID-19.
| Características | Tratamiento sugerido |
|---|---|
| Caso sospechoso o confirmado asintomático. | • Vigilancia por el posible desarrollo de síntomas. Evitar ibuprofeno o cualquier AINE |
| • Aislamiento por 14 días en su domicilio | |
| Caso sospechoso o confirmado con síntomas leves, menores de 60 años de edad y sin comorbilidades | • Tratamiento sintomático en domicilio, incluyendo hidratación y descanso más aislamiento por 14 días |
| • Debe estar atento ante el posible agravamiento de síntomas (tos, disnea, taquipnea y dificultad respiratoria) | |
| • Oseltamivir si cumple con criterios de influenza | |
| Caso sospechoso o confirmado, con síntomas, sin criterios de ingreso, pero mayor de 60 años de edad o con morbilidad significativa | • Tratamiento sintomático más aislamiento en domicilio por 14 días |
| • Cloroquina más azitromicina (vigilar EKG), o claritromicina en lugar de azitromicina | |
| • Debe estar atento ante el posible agravamiento de síntomas (tos, disnea, taquipnea y dificultad respiratoria) | |
| • Uso de tromboprofilaxis e inmunomoduladores a decisión del médico | |
| Caso sospechoso o confirmado, con datos clínicos de neumonía y sin criterios de gravedad (CURB-65 ≤ 2 puntos), SOFA < 2 | • Tratamiento sintomático más aislamiento en domicilio e informar datos de gravedad para acudir nuevamente a hospital (tos, disnea, taquipnea y dificultad respiratoria) |
| • Cloroquina más azitromicina (vigilar EKG), o claritromicina en lugar de azitromicina | |
| • Manejo de neumonía comunitaria VO | |
| • Uso de tromboprofilaxis e inmunomoduladores a decisión del médico | |
| Caso sospechoso o confirmado con neumonía y criterios de gravedad (CURB-65 > 2 PUNTOS, SOFA > 2), saturación de oxígeno < 90% + FR > 30x’ o neumonía leve con dímero D de más de 1,000 ng/mL | • Hospitalizar |
| • Cloroquina más azitromicina (vigilar EKG), o claritromicina en lugar de azitromicina | |
| • Heparina de bajo peso molecular (HBPM) a dosis anticoagulantes | |
| • Manejo de neumonía comunitaria | |
| • Uso de inmunomoduladores | |
| • Esteroide a decisión del médico | |
| Progresión clínica (falla orgánica múltiple) y requerimiento de cuidados intensivos | • Adicionar: Tocilizumab |
Estudios de laboratorio recomendados al ingreso y seguimiento: BHC, QS3, VSG, PCR, DHL, CPK, procalcitonina, transaminasas, gasometría con lactato, dímero D, ferritina y volver a revalorar.
Radiología: Telerradiografía de tórax y revalorar con portátil diario; de no poderse, se debe realizar ultrasonido pulmonar.
Valorar CURB 65 1 punto por cada característica presente:
Confusión.
Urea > 30 mg/dL.
Frecuencia respiratoria > 30.
Tensión arterial sistólica < y/o diastólica < 60 mmHg.
Edad > 65 años
Tabla 18:
| Puntuación | % de mortalidad | Recomendación |
|---|---|---|
| 0 | 0.6 | Bajo riesgo, tratamiento ambulatorio |
| 1 | 2.7 | Bajo riesgo, tratamiento ambulatorio |
| 2 | 6.8 | Riesgo intermedio, hospitalización de corta estancia o tratamiento ambulatorio con supervisión estricta |
| 3 | 14.0 | Neumonía grave, considerar hospitalización |
| 4 | 27.8 | Neumonía severa, considerar hospitalización |
| 5 | 57.0 | Neumonía muy grave, considerar ingreso a la Unidad de Cuidados Intensivos |
Los diversos esquemas de tratamiento para las pacientes por infección de COVID-219 sugeridos en la literatura científica son los siguientes (Tablas 19 y 20).
Tabla 19.
| Clave (cuadro básico) | Insumo | Presentación | Uso | Tiempo | Cantidad para un paciente | Precauciones |
|---|---|---|---|---|---|---|
| 010.000.2030.00 | Fosfato de cloroquina | Tabletas de 150 mg, caja con 1,000 tabletas | 450 mg vía oral cada 12 h dos dosis y continuar con 300 mg vía oral cada 12 h | 5-10 días | 14-42 tabletas | Vigilar intervalo QT y glucemia. Precaución al combinar con quinolonas y macrólidos |
| Sin clave | Hidroxicloroquina | Tabletas de 200 mg, caja con 20 tabletas | 400 mg vía oral cada 12 h por dos dosis y continuar 200 mg vía oral cada 12 h | 5-10 días | 12-22 tabletas (1-2 cajas) | Vigilar intervalo QT y glucemia. Precaución al combinar con quinolonas y macrólidos |
| 010.000.2132.00 | Claritromicina | Tabletas 250 mg, caja con 10 tabletas | 250 mg vía oral cada 8-12 h | 5-10 días | 20-30 tabletas (2-3 cajas) | No usar durante el embarazo |
| 010.000.1969.01 | Azitromicina | Tabletas de 500 mg, caja con 4 tabletas | 500 mg vía oral cada 24 h de impregnación y luego 250 mg vía oral cada 24 h | 5-7 días | 3-4 tabletas (1 caja) | Vigilar el intervalo QT. Precaución al combinar con cloroquina |
| 010.000.5288.00 | Lopinavir/ritonavir | 200 mg/50 mg tabletas, frasco con 120 tabletas | 400/100 mg vía oral cada 12 h | 15 días | 60 tabletas (1/2 frasco) | Vigilar PFH y lactato |
| 010.000.5106.00 | Atorvastastina | Tabletas de 20 mg, caja con 10 tabletas | 40 mg | 15 días | 30 tabletas (3 cajas) | No usar durante el embarazo |
| 010.000.4516.00 | Tocilizumab | Solución inyectable 200 mg/10 mL, caja con un frasco ámpula | 8 mg/kg de peso ideal (máximo 800 mg) cada 12 h | 2-3 dosis | 6-9 frascos | Medición de IL-6 previo a su inicio |
| 010.000.5250.01 | Interferón beta 1-B recombinante humano | Frascos ámpula con 0.25 mg/mL. Caja con 15 frascos y 15 jeringas prellenadas con 1.2 mL de diluyente | Aplicar 1 mL subcutáneo cada tercer día | 7 dosis | 7 jeringas/frascos (1/2 caja) | Medición de IL-6 previo a su inicio |
| 010.000.5221.00 | Peginterferón Alfa 2B | Pluma con liofilizado contiene: 180 μg. Envase con pluma y cartucho con 0.5 mL (3 μg/kg) | Aplicar 1/2 mL subcutáneo cada semana | 2 dosis | 2 jeringas (2 cajas) | Medición de IL-6 previo a su inicio |
| Sin clave | Remdesivir | Solución inyectable 100 mg | 200 mg vía intravenosa de impregnación una dosis, luego 100 mg vía intravenosa cada 24 h por 9 días. (10 mg/kg) | 10 días | 11 dosis de 100 mg | Adaptive COVID-19 Treatment Trial |
| Sin clave | Favipiravir | 600 mg | 1600 mg de impregnación, continuar 600 mg vía oral cada 8 h | 10 días | 30 tabletas de 600 mg |
Tabla 20.
| Fármaco | Seguro | Interacciones | No administrar |
|---|---|---|---|
| Antibióticos | Paracetamol, AINE, buprenorfina, tapentadol | Tramadol/petidina, oxicodona, morfina | |
| Fentanilo (reducir dosis) | |||
| Antiarrítmicos | Atenolol | B-bloqueantes (mejor bisoprolol) | Amiodarona, ivabradina (aumentan el QT) |
| Digoxina, verapamil, diltiazem (reducir dosis) | |||
| Antihipertensivo/diurético | Captopril, enalapril, espironolactona, furosemida, tiazidas | Losartán, torasemide, sacubitril | Eplerenona |
| Amlodipino (disminuye disponibilidad 50%) | |||
| Doxazolina, reducir dosis | |||
| ACO/ plaquetarios | AAS, HBPM, heparina, prasugrel | Acenocumarina, dabigatran (11 mg cada 12 h) | NACO (reducir dosis 50%) |
| Warfarina, edoxaban (30 mg/dia) | Clopidogrel (< 44% agregación plaquetaria) | ||
| Ticagrelor | |||
| Gastrointestinales | Omeprazol, metoclopramida, cimetidina | Ondansetrón (prolonga QT) | Domperidona (alarga QT, tox C-V) |
| Anticonvulsivantes | Gabapentina, pregabalina, levetiracetam, topiramato, lacosamida | Reducir dosis: | |
| Clonazepam, fenobarbital, fenitoina, lamotrigina, ácido valproico (mania), arbamacepina | |||
| Antibioticoterapia | Amoxicilina, ampicilina cefalosporinas, cloxacilina, pipe/tazo, carbapenémicos, linezolid, vancomicina, TMP/SMZ | Alarga QT; azitromicina, eritromicina, levofloxacino, ciproflox, moxifloxacino | |
| Disminuir dosis; clindamicina, claritromicina | |||
| Metronidazol (no vía oral) | |||
| Antifúngicos | Anfotericina B, xaspofungina, fluconazol (alarga el QT con HDQ), Nistatina | Disminuir dosis; itraconazol, ketoconazol | Voriconazol |
| Psicofármacos | Lorazepam | Disminuir dosis; alprazolam, cloradepato, diazepam, olanzapina, zolpidem, paroxetina, mirtazapina | Quetiapina, haloperidol, Risperidona |
| Lormetazepam | Alarga QT; clorpromazina, levomeptomazina, trazoona, sertralina, mirstazapina, fluoxetina, amitriptilina | Midazolam vía oral, citalopram | |
| Escitalopram | |||
| Duloxetina | Clozapina (TB agranulocitosis) | ||
| Otros | Nitratos | Tamsulosina (riesgo hipotensión) | Ranolazina |
| Oseltamivir/aciclovir, levotiroxina, loratadina, bifosfonatos, alopurinol, sumatriptan | Levodopa/carbidopa (disquinesias), rasagilina | Colchicina (si es necesario, disminuir dosis) | |
| Antidiabéticos | Insulina, metformina empaglifozina, inhibidores DPP4, liraglutide | Glicazida | Hidroxicina (alarga QT), rifampicina |
| Glipizida | |||
| Repaglinida | |||
| Reducir dosis | |||
| Broncodilatadores | Ipratropio, glicopirronio, indacaterol, salbutamol, montelukast | Salmeterol | Budesonida |
| Formoterol (prolonga QT) | Efecto sistémico | ||
| Hipolipemiantes | Pitavastatina, pravastatina, ezetimiba, fenofibrato | Atorvastatina, rosuvastatina | Simvastatina, lopivastatina, miopatía |
| Reducir dosis |
Interacciones medicamentosas
15. Evaluación por ultrasonido
Justificación
El ultrasonido pulmonar (USP) ofrece resultados similares a la tomografía de tórax y superiores a la radiografía de tórax en la evaluación de neumonía y SIRA.
Un estudio a la cabecera del enfermo evita traslados innecesarios. Puede ser un filtro de selección de pacientes que deban trasladarse a tomografía.
La capacitación es sencilla, y la adquisición de imágenes interpretables es reproducible.
Reduce el riesgo de exposición al virus y tiene un bajo costo.61-64
Técnica
• Utilizar un transductor convexo 2-5 Mhz, sectorial o microconvexo con ajuste preseleccionado para pulmón o abdomen. También es útil el transductor lineal de alta frecuencia (> 5 MHz) para evaluar la línea pleural.
• Explorar con el transductor en orientación cefalocaudal al menos en seis regiones en cada hemitórax: anterosuperior e inferior (sobre la línea media clavicular), laterosuperior e inferior (en línea axilar media) y posterosuperior e inferior (por detrás de línea axilar posterior).
• Identificar los límites anatómicos desde la línea pleural hasta el diafragma en regiones inferiores. Una vez identificado un espacio intercostal, se puede girar el transductor sobre el espacio intercostal para evaluar una mayor superficie pleural.
Desinfección del equipo
• Siempre que sea posible y esté disponible, use fundas de transductor y Cables.
• Utilizar el desinfectante que refiera la recomendación de la marca del equipo utilizado. En COVID, la recomendación es usar soluciones a base de hipoclorito sódico al 0.05% o alcohol al 70%. También se puede visitar la lista de desinfectantes autorizados por la Agencia de Protección del Medio Ambiente (EPA, por sus siglas en inglés) de los Estados Unidos en transductores, Cables y cualquier superficie tocada.
• Realice una limpieza completa de los sistemas US entre pacientes.
• Los dispositivos de mano son mucho más fáciles de desinfectar que los carros, por lo que son preferibles.
Signos ultrasonográficos
Debemos recordar que las imágenes obtenidas por ultrasonografía pulmonar corresponden a las regiones que enfoca el transductor sobre la superficie pulmonar (Figura 12).
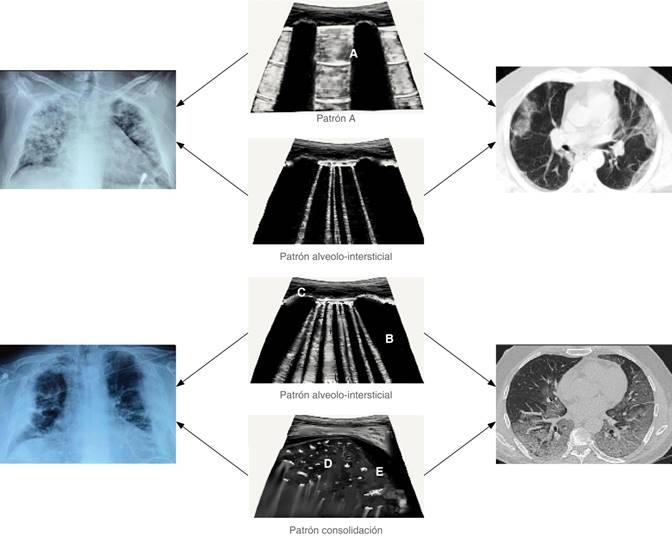
Figura 12: Correlación de imágenes pulmonares radiológicas, ultrasonográficas y tomográficas en pacientes con infección por COVID-19. Los esquemas ultrasonográficos muestran el patrón A con las líneas horizontales (A), patrón B con las líneas verticales que borran a las horizontales (B), con engrosamiento y fragmentación pleural (C) y la hepatización del pulmón que sugiere una consolidación translobar (D) con un mínimo derrame pleural (E).
Pulmón de aspecto normal
Deslizamiento pleural. Deslizamiento de las pleuras parietal y visceral con los movimientos respiratorios; se trata de aquellos elementos para identificar la línea pleural: 1) línea hiperecoica por debajo de las costillas; 2) movimiento ondulante que sigue la respiración, y 3) presencia de artefactos por debajo que dan diferentes imágenes.
«Signo de la playa». El movimiento pulmonar en modo M. Se aprecia la diferencia entre el patrón lineal que semeja ondas localizado por arriba de la línea pleural (continua, ondulante e hiperecoica) y un patrón granular semejante a la arena que se encuentra por debajo.
Líneas A. Son artefactos originados en la interfase pleura-aire y se caracterizan por ser imágenes hiperecoicas horizontales, estáticas y con repeticiones a intervalos regulares (reverberancia).
Un patrón ultrasonográfico normal (patrón A) está constituido en el modo bidimensional por la presencia de deslizamiento pleural y líneas A; en modo M, por la presencia del signo de la playa (Figura 13). En pacientes con infección pulmonar por COVID-19, puede presentarse en algunas zonas pulmonares, debido al carácter multifocal de esta patología. También es frecuente observarlas durante la remisión de la patología en la fase de convalecencia. De esta manera, podría ser un criterio para confirmar la posibilidad de continuar el destete ventilatorio. Debemos recordar que, en pacientes en prono, la presencia de patrón A confirmará la apertura alveolar en las zonas posteriores del pulmón; sin embargo, no descartaría la posibilidad de sobredistensión pulmonar.

Figura 13: Se aprecian los diferentes patrones ultrasonográficos y las características de severidad según el compromiso de la afectación pulmonar. Cabe resaltar que en un mismo paciente es posible presentar dos o más etapas de evolución debido al compromiso multifocal y periférico característico de la infección COVID-19.
Signos ultrasonográficos patológicos
Síndrome alveolointersticial. Las líneas A son reemplazadas por artefactos con imagen de cola de cometa llamadas líneas B, que inician en la línea pleural, son hiperecoicas, bien definidas y extendidas hasta el final de la pantalla. Más de tres líneas B entre cada espacio intercostal reflejan el engrosamiento del espacio interlobulillar (intersticio pulmonar) y, a mayor cantidad de líneas B, se correlaciona directamente con la intensidad del compromiso intersticial. El aumento en la cantidad de líneas B, el engrosamiento pleural, la fragmentación pleural pueden ser una transición hacia la consolidación que produce la atelectasia y la neumonía.
Consolidación. Se encuentra con ausencia de deslizamiento pleural y puede existir o no un espacio anecoico, el cual corresponde a derrame pleural y la presencia del parénquima pulmonar «hepatizado» (no es artefacto, es imagen real), con puntos hiperecogénicos que pueden tener aire (entrada de aire) o no (condensación translobar). Se presenta en una extensión focal o multifocal (anterior/lateral/dorsal), regularmente monolateral, pero puede llegar a ser bilateral.
Conclusiones
Es evidente que en pacientes con neumonía o SIRA por COVID-19, el USP puede reemplazar el uso del estetoscopio, debido a que este último tiene inconvenientes en la esterilización apropiada, y su uso conlleva riesgo de contaminación por la cercanía del instrumento con la cara del operador. El uso diario en los mismos pacientes permite además el conocimiento de la evolución de la enfermedad al distinguir los cambios de patrones de imagen en la superficie de los pulmones.65-67
Aunque es mandatorio interpretar la imagen en el contexto de la clínica del paciente, hemos observado que en esta patología no necesariamente se correlacionan. Se requieren estudios de mayor cantidad de muestra y calidad metodológica, además de costo-efectividad para confirmar estas ventajas.
16. Apoyo hemodinámico (manejo de líquido, inotrópico y vasopresor)
Apoyo hemodinámico en el choque séptico:
Prevalencia del choque: 1 a 35%.
Daño miocárdico: 7 a 23%.
Factores de riesgo: edad avanzada, comorbilidades (diabetes mellitus, enfermedad cardiovascular), linfopenia y dímero D elevado.
Diagnóstico:
Sepsis: infección por SARS-CoV-2 altamente sospechada o confirmada, más un incremento de 2 o más puntos en la calificación de SOFA.
Choque séptico: enfermo con sepsis en quien, a pesar de la reanimación con líquidos, es necesario usar vasopresores para mantener una presión arterial media ≥ 65 mmHg y un lactato sérico > 2 mmol/L (Figura 14).
Apoyo hemodinámico en Síndrome de Insuficiencia Respiratoria Progresiva Aguda (SIRPA)
En caso de hipotensión, es recomendable un reto de vasopresores antes que un reto de volumen.
Principio fisiológico. Los pacientes con COVID-19 pueden desarrollar Síndrome de Insuficiencia Respiratoria Progresiva Aguda (SIRPA), el cual tiene cuatro momentos críticos68 a nivel hemodinámico hasta donde sabemos. El primero de ellos es una vasoconstricción pulmonar hipóxica (VCPH), la cual puede ocasionar hipertensión pulmonar y, a su vez, disfunción del ventrículo derecho. Estas dos últimas situaciones pueden hacer que el paciente sea muy poco tolerante a cargas de volumen intravascular.
No es recomendable hacer ninguna prueba estática o dinámica de respuesta a volumen por dos motivos: en primer lugar, los pacientes con algún grado de hipertensión pulmonar difícilmente son respondedores a volumen. Segundo y más importante, todas las pruebas dinámicas y/o estáticas de respondedor a volumen carecen de validez fisiológica en escenarios de hipertensión pulmonar. De hecho, la variabilidad de la presión de pulso puede verse aumentada como dato de disfunción de ventrículo derecho y no como un dato de respuesta a volumen. Es recomendable seguir el protocolo FACTT (Fluid and Catheter Treatment Trial) simplificado de restricción de volumen y empleo de diurético:
Tabla 21:
| 1 | Descontinúe los fluidos de mantenimiento |
| 2 | Dilución de medicamentos en la menor cantidad compatible posible |
| 3 | No limite los requerimientos de nutrición enteral |
| 4 | Utilice vasopresores en cas de PAM < 60 mmHg |
Tabla 22:
| PAM > 60 mmHg | ||
|---|---|---|
| PVC (mmHg) | Diuresis < 0.5 mL/kg/h | Diuresis < 0.5 mL/kg/h |
| > 8 | Furosemida* 3 mg/h en infusión; revalorar en 1 h | Furosemida** 20 mg; revalorar en 4 h |
| 4-8 | Ringer lactato 15 mL/kg; revalorar en 1 h | Furosemida** 20 mg; revalorar en 4 h |
| < 4mmHg | Ringer lactato 15 mL/kg; revalorar en 1 h | Revalorar en 4 h |
* Si el paciente se encuentra recibiendo esa dosis o mayor, duplique la dosis hasta un máximo de 24 mg/h.
** Si el paciente ha recibido esa dosis de bolo o mayor duplique la dosis hasta un máximo de 160 mg.
No exceda la dosis total de 620 mg/día de furosemida. Ante una valor de creatinina sérica ≥ 3 mg/dL durante el protocolo, evalúe la necesidad de hemodiálisis.
Si se cuenta con el recurso, es recomendable una evaluación ecocardiográfica y ecopulmonar realizada por personal con adecuado entrenamiento.
El manejo hemodinámico de estos pacientes se determina adecuado si se reduce el grado de hipertensión pulmonar y/o disminuye el tamaño del ventrículo derecho como respuesta a cada intervención.
Es recomendable sospechar la presencia de cor pulmonale (hipertensión pulmonar) mediante la escala de la ARDS (por sus siglas en inglés: acute respiratory distress syndrome) (Tabla 23).
Tabla 23: Escala pronóstica de cor pulmonale durante SIRPA.
| Parámetro | Puntos |
|---|---|
| Neumonía como causa de SIRPA | 1 |
| Meseta-PEEP > 18 cmH2O | 1 |
| PaO2/FiO2 < 150 | 1 |
| PaCO2 > 48 mmHg | 1 |
| Total | 0-4 |
La presencia de > 2 puntos en la Escala pronóstica de cor pulmonale (Tabla 23) debe advertir algún grado de hipertensión pulmonar, y los pacientes que lo presenten constituyen el grupo de mayor mortalidad en pacientes con SIRA. En estos pacientes, debe mantenerse el equilibrio de PaCO2 < 48 mmHg junto con una presión meseta < 27 cmH2O y una relación meseta-PEEP < 18 cmH2O, las cuales deben considerarse como parte de la estrategia hemodinámica de protección del ventrículo derecho.
Sospecha de hipoperfusión
Criterios clínicos:
Escala de piel marmórea > 2.
Llenado capilar > 4 segundos en rodillas; > 2.5 segundos en el dedo índice.
Eventos de hipotermia; temperatura < 36 °C.
Índice de choque (frecuencia cardiaca/presión arterial sistólica > 1).
Criterios gasométricos de bajo gasto:
Saturación venosa central de oxígeno (SvcO2) < 65%.
Gap venoarterial de CO2 = presión venosa de CO2 (PvCO2)-presión arterial de CO2 PacO2 > 6 mmHg.
Ante un criterio clínico más un criterio gasométrico o tres criterios clínicos (o los dos gasométricos), la probabilidad de hipoperfusión es muy alta. Frente a estos casos, se deben seguir los algoritmos de las Figuras 15 y 16 como una guía de abordaje. En caso de que el monitoreo ecocardiográfico o mínimamente invasivo no sea suficiente, en especial en los casos donde se consideren inodilatadores de la arteria pulmonar, sugerimos el monitoreo mediante catéter de arteria pulmonar.
Figura 16: Algoritmo de abordaje hipotensión con hipoperfusión. VVP : Variabilidad de pulso, VP : Variabilidad plestimográfica, GapVaCO2: Gap venosoarterial de CO.
Notas del manejo hemodinámico: Los pacientes de este tipo, casi en su totalidad, están hipervolémicos, con algún grado de hipertensión pulmonar y con disfunción de ventrículo derecho por vasoconstricción pulmonar hipóxica. En esos casos, es recomendable restringir el aporte hídrico a estos pacientes, y por el contrario, no es recomendable usar retos de volumen intravascular.69
También se recomienda forzar diuresis para mantener un balance negativo:
Infusión intravenosa de furosemida 100 mg en 24 horas.
Hidroclorotiazida 100 mg por sonda enteral/espironolactona 100 mg por sonda enteral.
Acetazolamida 250 mg intravenoso o por sonda enteral.
Reto de vasopresor: ante eventos de desaturación que se acompañen con disminución de la PAM, es recomendable un reto de vasopresor y, si el aumento de la presión arterial media mejora la oxigenación, usar norepinefrina para mantener PAM de 75 a 85 mmHg. Asimismo, es recomendable considerar una triple estrategia hemodinámica:
17. Ventilación mecánica invasiva (pronación, sedación y parálisis)
Puntos fisiológicos. COVID-19 se presenta como una enfermedad cuyo mecanismo de hipoxemia es trastorno V/Q del tipo del cortocircuito, junto con la vasoconstricción pulmonar hipóxica con adecuada distensibilidad pulmonar estática.
Durante los primeros minutos:
Modalidad. Recomendamos elegir por centro un único mecanismo de ciclado mecánico, sea por volumen o presión, en la que todos trabajen de forma similar.
Volumen corriente. Recomendamos usar volúmenes corrientes bajos de 6 mL por kg de peso predicho por ARDSnet.88
Frecuencia respiratoria inicial de 15-20 respiraciones por minuto con una meta inicial de PaCO2 < 50 mmHg. Asimismo, recomendamos mantener la meta de presión meseta ≤ 30 cmH2O. Flujo inicial 60 L/min, y luego ajustarla para evitar la presencia de auto-PEEP y/o relación inversa (2:1).
Rampa descendente. El FiO2 a 100% debe disminuirse lo más pronto posible dentro de la primera hora. No recomendamos descensos rápidos de la FiO2 mayores de 15% cada 15 minutos. Recomendamos la meta inicial de SaO2 > 88% la primera hora, posteriormente la meta PaO2/FiO2 será > 150 mmHg o su equivalencia en SaO2/FiO2 > 190 en las primeras seis horas. Además, es necesario hacer una prueba inicial de PEEP con niveles de 10 cmH2O buscando las metas de SaO2 > 88% en la primera hora y/o PaO2/FiO2 > 150 mmHg (o su equivalencia en SaO2/FiO2 > 190) en las primeras tres horas. Si la SaO2 < 88% en la primera hora y/o PaO2/FiO2 < 150 mmHg o su equivalencia en SaO2/FiO2 < 190 en las primeras tres horas, recomendamos reto de PEEP con 15 cmH2O para lograr las metas de oxigenación PaO2/FiO2 > 150 mmHg, o su equivalencia en SaO2/FiO2 > 190, en las siguientes tres horas.
En caso de SaO2 < 88% en la primera hora y/o PaO2/FiO2 < 150 mmHg (o su equivalencia en SaO2/FiO2 < 190) en las primeras seis horas, sugerimos evaluar la posición prono89 o realizar una leve maniobra de reclutamiento alveolar si se tiene experiencia en ella.90
Leve maniobra de reclutamiento alveolar. Protocolo exprés: colocar PEEP en 20 cmH2O por dos minutos y descender 2 cmH2O cada dos minutos hasta encontrar la PEEP que dé una presión meseta de 30 cmH2O.
Véase la siguiente Tabla:
Tabla 24.
| PEEP | Presión meseta |
|---|---|
| 20 por 2 minutos | Anotar meseta |
| 18 por 2 minutos | Anotar meseta |
| 16 por 2 minutos | Anotar meseta |
| 14 por 2 minutos | Anotar meseta |
Colocar la PEEP que mantenga una presión meseta ≤ 30 cmH2O. Por ejemplo:
En este caso, PEEP se detendría en 16 cmH2O. Si no se logran las metas de oxigenación y se cuenta con los recursos técnicos, humanos y tiempo, recomendamos colocar al paciente en posición prono. También recomendamos, si se cuenta con el recurso y la experiencia, colocar la línea arterial. Si no se cuenta con línea arterial, sugerimos gasometría venosa para evaluar PaCO2 venoso y pH venoso junto con el monitoreo de SaO2/FiO2.
No recomendamos gasometría por turno u otra indicación rutinaria. Recomendamos únicamente solicitar gasometría explícitamente por cambios drásticos en la condición clínica, así como gasometría (arterial/venosa) a los 15 minutos después de iniciar los parámetros ventilatorios una vez lograda SpO2 > 88%. No recomendamos múltiples punciones para toma de gasometrías arteriales.
Si el pH es 7.3 y/o PCO2 < 50 mmHg, no recomendamos hacer cambios en la ventilación mecánica y revalorar en la siguiente hora. Si el pH es < 7.3 y la PCO2 > 50 mmHg, recomendamos un aumento del volumen corriente de 25 mL o el volumen que mantenga una presión meseta en 30 cmH2O. Para ello, se puede emplear la siguiente Tabla:
Por ejemplo:
Tabla 27:
| Volumen corriente (en mL) | Presión meseta |
|---|---|
| 450 | 28 |
| 475 | 30 |
| 500 (regresar a nivel anterior) | 31 (regresar al nivel anterior) |
De no lograr la meta de pH y/o PaCO2, recomendamos aumentar la frecuencia respiratoria a cuatro respiraciones respecto del basal, hasta lograr la meta de pH = 7.3 o llegar a 30 de frecuencia respiratoria. Es decir, debemos hacer una prueba con 24 respiratoria, 28 respiratoria, 30 respiratoria. Si el aumento de la frecuencia respiratoria y el discreto aumento del volumen corriente no logran las metas, recomendamos cambiar la meta hasta tolerar un pH ≥ 7.1.
Recomendamos que las primeras 48 horas el paciente permanezca con un RASS de ≤ 2. En caso de ser necesario, use la posición prono o maniobra de leve de reclutamiento alveolar; sugerimos también la infusión continua de relajante muscular por 48 horas. En caso de realizar posición prona, recomendamos mantenerla por intervalos no menores de 24 horas.
Recomendamos enérgicamente no realizar disminuciones de PEEP mayores de 1 cmH2O cada 8 horas y/o > 2 cmH2O en 12 h y no disminuir parámetros de PEEP mientras el paciente permanezca en posición prono. También no debemos disminuir el apoyo hasta 24 horas después de revertida posición prono y hasta que el paciente continúe con mejoría clínica.
Recomendamos no disminuir el apoyo basado únicamente en mejoría de parámetros de oxigenación; también debemos considerar alguno de los anteriores:
• Mejoría de estudios de imagen como ultrasonido y/o tomografía cuando sea posible.
• Disminución del espacio muerto medido por la fórmula de Sinha de eficiencia ventilatoria (EV). No se debe iniciar descenso de apoyo mecánico hasta lograr disminuir aporte de oxígeno y disminución del corto circuito.
18. ECMO en pacientes con COVID-19. Consideraciones en una pandemia
Acorde con los recursos de oxigenación por membrana extracorpórea (ECMO, por sus siglas en inglés), proponemos que cada centro planee continuar activo e indique qué cantidad de pacientes podrán recibir durante la crisis (número de máquinas disponibles, membranas, cánulas, otros equipos, médico, enfermería y perfusionistas), así como qué tipo de población es la que planean recibir (asegurados, afiliados, particulares, etcétera).91
No se recomienda tener casos ECMO fuera de los hospitales con un programa certificado y con una experiencia menor a tres años. De forma ideal, se debiera tener más de 20 casos de ECMO VV al año.
No se considera por el momento modificar los criterios de candidato a ECMO aceptados en la actualidad (véase:https://www.elso.org/Resources/Guidelines.aspx). Si un hospital considera tener casos de ECMO durante esta crisis, recomendamos identificar los casos lo más pronto posible. No recomendamos evaluar casos con más de seis días de ventilación mecánica, lo que incluye ventilación no invasiva.
Asimismo, recomendamos considerar la futilidad de estas maniobras ante pacientes con alta mortalidad predicha por escala RESP en ECMO VV (véase:http://www.respscore.com/) y escala SAVE para ECMO VA (véase:http://www.save-score.com/).
No recomendamos el intento de solicitar nuevos recursos para abrir o mantener programas de ECMO a los centros (adquirir más máquinas, membranas, material, etcétera), lo que pudiera desviar los recursos necesarios en otras áreas.92,93











 text new page (beta)
text new page (beta)