Introducción
El síndrome de insuficiencia respiratoria progresiva aguda (SIRPA) es una enfermedad potencialmente mortal, que se caracteriza por una lesión pulmonar inflamatoria y que clínicamente se manifiesta por hipoxia y disminución de la distensibilidad pulmonar.1
El SIRPA se puede desarrollar en el contexto de neumonía (35-50% de los casos), en sepsis de origen no pulmonar (30%), en aspiración de contenido gástrico (10%) y en trauma (10%).2 Varios otros escenarios menos comunes están asociados con el desarrollo de SIRPA, incluidos pancreatitis aguda, trasfusiones, inhalación de humo, entre otras causas.3
El SIRPA fue descrito por primera vez en 1967,4 y desde entonces distintos estudios han abordado los múltiples aspectos clínicos, tales como patogénesis, factores de riesgo y tratamiento. Sin embargo, a pesar de la intensa investigación, sólo se han descrito algunas terapias efectivas para el tratamiento del SIRPA. El abordaje terapéutico éste se basa en una estrategia multimodal que combina tanto estrategias no farmacológicas (ventilación basada en metas de protección alveolar o posición prono) como intervenciones farmacológicas, principalmente dirigidas al tratamiento de la causa subyacente.5
En la literatura se han reportado varias intervenciones farmacológicas para el abordaje del SIRPA, independientemente de su causa. De éstas, sólo el uso de bloqueadores neuromusculares (BNM) ha demostrado mejorar el pronóstico de los pacientes que presentan SIRPA.6 Sin embargo, literatura publicada más reciente ha cuestionado la utilidad de la terapia. En este sentido, según Moss y colaboradores,7 el uso de BNM no tiene beneficio en el tratamiento del SIRPA.
Teniendo en cuenta lo discordante de la evidencia, es necesario esclarecer el papel de los BNM en el tratamiento del SIRPA. Estos fármacos se utilizan con frecuencia en las Unidades de Terapia Intensiva,8 se ha reportado que entre 25% y 85% de los pacientes con SIRPA inscritos en distintos estudios recibieron BNM.9-12
La indicación exacta de los BNM en el tratamiento del SIRPA aún está por aclararse. Las primeras publicaciones sobre BNM fueron reportes de casos que obtuvieron mejoría en la relación PaO2 / FiO2.13-17 Hasta donde es de nuestro conocimiento, se han publicado tres meta-análisis sobre el tema.18-20 Sin embargo, en ninguno de los estudios previos se cita la evidencia más reciente.
Las propuestas sobre el mecanismo por el cual los BNM son beneficiosos en SIRPA son diversas: disminución en el biotrauma,21 en el consumo de oxígeno22-24 y en la presión transpulmonar.25-29
Material y métodos
Objetivos
Evaluar la eficacia y seguridad del tratamiento con bloqueadores neuromusculares en pacientes críticos con síndrome de insuficiencia respiratoria progresiva aguda.
Diseño del estudio
Estudio tipo revisión sistemática y metaanálisis basado en estudios clínicos controlados y aleatorizados.
Estudios incluidos
Todos los estudios clínicos aleatorizados (randomized controlled clinical trials) que comparen la administración de bloqueadores neuromusculares en pacientes con síndrome de insuficiencia respiratoria progresiva aguda (según las definiciones más recientes30,31) contra los siguientes manejos: 1. «Placebo» y 2. «No-tratamiento».
Se definió como «no-tratamiento» al grupo control, en el cual se intenta que los elementos terapéuticos sean idénticos a los recibidos por el grupo experimental, exceptuando la administración del agente a ser investigado, en este caso los BNM.
No se restringió la búsqueda según el tipo, la duración o la dosis del BNM. Asimismo, fueron excluidos estudios en animales y estudios no controlados y aleatorizados. Excluimos también a niños, mujeres embarazadas y pacientes que no tuvieron diagnóstico de SIRPA.
No fue requerido el consentimiento informado o aprobación del consejo de ética para este estudio, dado que su realización se basó en estudios publicados previamente.
Estrategia de búsqueda y evaluación de la calidad de los artículos
Se realizaron búsquedas en las siguientes fuentes de cada base de datos hasta la fecha especificada (no existieron restricciones en el idioma de las publicaciones):
Registro Cochrane Central de Estudios Controlados (CENTRAL) a través del Registro Cochrane de Estudios en Línea (CRSO) (hasta el 8 de junio de 2019).
MEDLINE Ovid (Epub Ahead of Print, In-Process & Other Non-Indexed Citations, Ovid MEDLINE (R) Daily y Ovid MEDLINE (R); desde 1946 hasta el 8 de junio de 2019).
Embase Ovid (desde 1974 hasta el 8 de junio de 2019).
LILACS (base de datos de información sobre ciencias de la salud en América Latina y el Caribe; desde 1982 hasta el 8 de junio de 2019).
ClinicalTrials.gov (https://www.clinicaltrials.gov) (hasta el 8 de junio de 2019).
Plataforma de Registro Internacional de Estudios Clínicos (ICTRP) de la Organización Mundial de la Salud (https://www.who.int/trialsearch/) (hasta el 8 de junio de 2019).
Se utilizaron los siguientes términos clave en inglés para la realización de la búsqueda: «acute respiratory distress syndrome», «adult respiratory distress syndrome», «shock lung», «non-cardiogenic pulmonary edema», «ARDS», y «neuromuscular blocking agents», «neuromuscular blockade».
Se planeó identificar otros estudios potencialmente elegibles o publicaciones auxiliares mediante la búsqueda en las listas de referencias de los estudios incluidos, revisiones sistemáticas y metaanálisis. Además, se contactó con los autores de los estudios incluidos para identificar cualquier estudio adicional que se pudo haber pasado por alto. No se utilizaron resúmenes, ni resúmenes de congresos para la extracción de datos porque esta fuente de información no cumple con los requisitos de los estándares consolidados de reporte de estudios (CONSORT).32
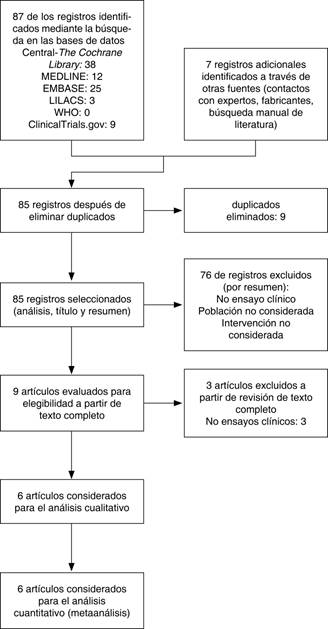
Dos autores de la revisión (AA y CR) analizaron de forma independiente el título y/o el resumen de cada registro recuperado, para determinar qué estudios deberían evaluarse más a fondo. Se estudiaron a profundidad los artículos en su texto completo de todos los registros potencialmente relevantes, incluyendo materiales suplementarios y Anexos. Resolvimos cualquier discrepancia por consenso o recurriendo a un tercer autor de la revisión (GC); si no se pudo resolver un desacuerdo, clasificamos el estudio como «estudios en espera de clasificación» y se estableció contacto con los autores de los estudios para obtener una aclaración. Presentamos un diagrama de flujo PRISMA adaptado para mostrar el proceso de selección de estudios (Figura 1).
Para la evolución de los estudios elegibles, los revisores (AA y CR) extrajeron los datos de forma independiente utilizando un formulario previamente acordado. Se resolvieron las discrepancias mediante discusión o, en caso necesario, consultamos al tercer autor de la revisión (GC). Ingresamos los datos en el software Review Manager (RevMan 2015). Cuando la información sobre cualquiera de los puntos anteriores no estaba clara, intentamos contactar a los autores de los estudios originales para que nos proporcionaran más detalles.
De los estudios, se recolectaron los datos referentes a mortalidad, efectos adversos, grado de disfunción orgánica, parámetros ventilatorios y de oxigenación.
Los revisores evaluaron de forma independiente el «riesgo de sesgo» de cada estudio incluido. Resolvimos los desacuerdos por consenso o consultando a un tercer autor de la revisión (CG).
Asimismo, utilizamos la herramienta de evaluación Cochrane «Riesgo de sesgo 2»,33,34 asignando evaluaciones de riesgo de sesgo bajo, alto o poco claro. Evaluamos los elementos de sesgo individuales como se describe en el Manual Cochrane para Revisiones Sistemáticas de Intervenciones, de acuerdo con los criterios y las categorizaciones asociadas.
Análisis estadístico
Se realizó el análisis estadístico mediante el software Review Manager (RevMan 2015). Se calculó el riesgo relativo (RR) con intervalos de confianza (IC) de 95% para las variables dicotómicas. Se empleó la diferencia de medias (DM) para las variables continuas.
Evaluamos la heterogeneidad estadística en cada mediante el uso de las variables estadísticas T², I² y χ², con un valor bajo de p (< 0.10) en la prueba de χ² para heterogeneidad.
Se utilizó un metaanálisis de efectos fijos para combinar los datos cuando era razonable suponer que los estudios estaban estimando el mismo efecto subyacente del tratamiento; es decir, cuando los estudios están examinando la misma intervención, con poblaciones y métodos suficientemente similares. Si hubo heterogeneidad clínica suficiente para esperar que los efectos del tratamiento subyacente difirieran entre los estudios o si se detectó una heterogeneidad estadística sustancial, se utilizó un metaanálisis de efectos aleatorios. Cuando utilizamos análisis de efectos aleatorios, los resultados se presentan como el efecto promedio del tratamiento con intervalos de confianza de 95% y las estimaciones de T2 e I2.
Resultados
Ochenta y siete estudios fueron identificados como potencialmente elegibles para su inclusión en esta revisión. Un total de 1,565 pacientes con SIRA participaron en los seis estudios finalmente incluidos, los cuales comparaban el bloqueo neuromuscular con placebo o ninguna intervención.
Un total de 698 participantes fueron asignados aleatoriamente al grupo de bloqueo neuromuscular. El grupo de comparación fue de 885 participantes: 162 en tratamiento con placebo y 723 en el grupo sin tratamiento. Sólo un estudio usó placebo como comparador.32
Respecto a la localización geográfica: una investigación se realizó en un centro en China,35 cuatro estudios se realizaron en múltiples centros en Francia32,36-38 y un estudio se realizó en 13 centros en EUA.7
Los estudios se realizaron de 2004 a 2018. La duración de las intervenciones varió de 487,32,36-38 a 72 horas.35 La duración del seguimiento varió desde hasta el alta de la UCI36-38 hasta 12 meses.7 Ningún estudio finalizó antes de su fecha preespecificada.
La edad media de los participantes varió desde los 56 años en Moss 2019 hasta los 66 años en Guervilly 2017. Las características basales demográficas fueron similares entre los grupos de tratamiento en la mayoría de los estudios. La media de SAPS II varió de 4436 a 49 puntos.32 La puntuación SOFA varió de 9.538 a 15.4 puntos.35 La lesión pulmonar directa fue el principal mecanismo de SIRPA en todos los estudios y la causa principal de la lesión pulmonar directa fue neumonía en la mayoría de los estudios (incluye neumonía por aspiración, adquirida en la comunidad, nosocomial y asociada con el ventilador). Sólo un estudio no informó la causa principal de lesión pulmonar directa.32
Los criterios de diagnóstico para SIRPA diferían entre los estudios. Tres trabajos utilizaron la definición de consenso estadounidense-europea.32,36,37 Tres trabajos utilizaron la definición de Berlín.7,35,38 Un estudio utilizó Vecuronio35 mientras que el resto utilizaron cisatracurio.
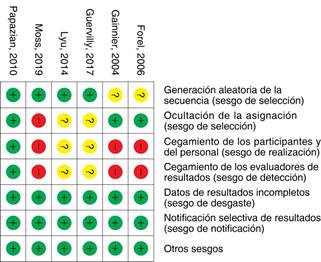
Evaluación de riesgo de sesgo
Se utilizó la herramienta Cochrane para evaluación y resumen de riesgo de sesgos. Un estudio se clasificó como de bajo riesgo de sesgo y el resto de los estudios se clasificaron como alto riesgo o sesgo poco claro (Figura 2).
Desenlaces clínicos
Mortalidad
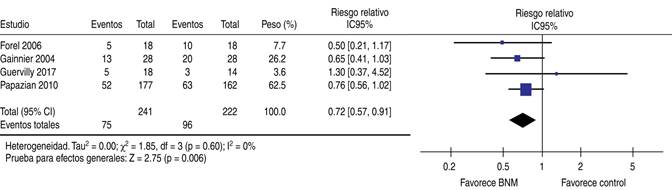
En comparación con el grupo con placebo o sin tratamiento, el bloqueo neuromuscular temprano se asoció con una reducción significativa de la mortalidad por cualquier causa (RR 0.84, IC de 95%: 0.74 a 0.95, seis ECA [Tabla 1]) y en el riesgo de mortalidad en la UCI (RR 0.72; IC de 95%: 0.57 a 0.91, cuatro ECA, 463 participantes).
Tabla 1: Resumen de la evidencia para desenlace, mortalidad por cualquier causa donde se evidencia una disminución en la mortalidad. Diferencias estadísticamente significativas.
| Núm. de pacientes | Efecto | Certeza | Importancia | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Núm. de estudios | Diseño del estudio | Riesgo de sesgo | Inconsistencia | Evidencia directa | Imprecisión | Otras consideraciones | Bloqueo neuromuscular | Placebo o sin algún tratamiento | Relativo (IC 65%) | Absoluto (IC 65%) | |||
| Mortalidad por cualquier causa | |||||||||||||
| 6 | Ensayos aleatorizados | No grave | Grave a | No grave | No grave | Ninguna b | 603/1,691 (35.7%) | 673/1,660 (40.5%) | RR 0.84 (0.74 a 0.95) | 65 por 1,000 (de 105 a 20) | Moderado | Crítico | |
a Encontramos heterogeneidad sustancial (I2 es mayor a 30%).
b Sesgo de publicación detectado por funnel plot.
El bloqueo neuromuscular se asoció con una reducción no significativa en la mortalidad de 21 a 28 días, así como de 60 a 90 días (Figura 3).
Efectos adversos
En comparación con el grupo con placebo o sin tratamiento, el bloqueo neuromuscular temprano se asoció con menos eventos de barotrauma en comparación con el grupo sin tratamiento o con placebo (RR 0.55; IC de 95%: 0.35 a 0.85, cuatro ECA) con diferencia significativa.
Hubo menos eventos de neumotórax en el bloqueo neuromuscular en comparación al grupo sin tratamiento o placebo (RR 0.46, IC de 95%: 0.28 a 0.77, cuatro ECA) con diferencia significativa.
No hubo diferencias en la debilidad adquirida en la UCI34 por el alta entre los grupos (RR 1.06, IC de 95%: 0.86 a 1.32, cuatro ECA).
Mejora de los parámetros respiratorios
En comparación con el grupo con placebo o sin tratamiento, el bloqueo neuromuscular se asoció con una mejora significativa en PaO2/FiO2 (11.02 mmHg, IC de 95%: 5.38 a 16.66, cuatro ECA). En comparación con el grupo con placebo o sin tratamiento, el bloqueo neuromuscular se asoció una mejora significativa en el grupo de bloqueo neuromuscular de PaO2/FiO2 a las 48 horas en comparación con placebo (21.18 mmHg, IC de 95%: -0.17 a 42.53, p = 0,05, tres ECA).
En comparación con el grupo con placebo o sin tratamiento, el bloqueo neuromuscular se asoció con una reducción significativa en la PEEP (-0.40 cmH2O, IC de 95%: -0.65 a -0.15, cuatro ECA).
Discusión
Nuestros resultados mostraron que el uso de BNM es beneficioso para pacientes con SIRPA con ventilación mecánica. El presente metaanálisis que incluyó seis estudios, demostró que el uso de BNM disminuye la mortalidad por cualquier causa y la mortalidad en la UCI en este grupo de pacientes. Además, los BNM mejoran la oxigenación y disminuyen la incidencia de barotrauma y neumotórax, sin aumentar la incidencia de debilidad adquirida en la terapia intensiva. Con base a nuestros resultados, recomendamos el uso de BNM para pacientes con SIRPA moderado a severo que necesitan ventilación mecánica.
Investigación previa y mecanismos de acción
La infusión de bloqueador neuromuscular de manera continua para el tratamiento del síndrome de insuficiencia respiratoria progresiva aguda se convirtió en una práctica común, después de que el estudio realizado por Papazian (2010)32 demostrara reducción de la mortalidad. Distintos trabajos realizados por el mismo grupo de investigadores encontraron resultados que apoyaban el uso de BNM. Sin embargo, el trabajo más reciente y más grande, Moss (2019)7 no encontró ningún beneficio en su uso.
Aún existen dudas razonables sobre cuál debe ser el papel de los BNM, puesto que cada estudio tiene deficiencias metodológicas importantes que se deben considerar. Respecto al análisis estadístico, es importante señalar que el estudio de Papazian, los autores utilizaron la «mortalidad hospitalaria medida a los 90 días» como desenlace primario. Sin embargo, tanto el resumen como el resto del manuscrito reporta «mortalidad a 90 días» como resultado primario. La distinción es importante porque la «mortalidad a los 90 días» (es decir, evaluar si un paciente está vivo o muerto a los 90 días después de la aleatorización, independientemente de su ubicación) es una medida de resultado más sólida que la «mortalidad hospitalaria medida a los 90 días» (es decir, evaluar la mortalidad sólo durante la estadía en el hospital dentro de los primeros 90 días de la aleatorización), ya que este último no tiene en cuenta a los pacientes que podrían haber muerto después del alta hospitalaria dentro de los primeros 90 días.39
Del mismo modo, en el estudio de Papazian,32 las curvas de mortalidad comienzan a separarse después de aproximadamente 18 días después de la aleatorización. Aún no se ha podido entender del todo este lapso que tarda en presentarse los efectos benéficos de los agentes bloqueadores neuromusculares y las teorías que proponen su explicación resultan controversiales. Por ejemplo, se ha hecho hincapié en el potencial efecto antiinflamatorio directo de los BNM, aunque esto parece poco probable dada la falta de efecto sobre la mortalidad de agentes antiinflamatorios mucho más potentes en estudios previos.31 Por un lado, es poco probable que la mejoría en la oxigenación sea la principal explicación de los resultados positivos del estudio de Papazian, ya que las mediciones de intercambio de gases fueron en términos prácticos, esencialmente las mismas en el grupo control y experimental durante el periodo de administración del agente de bloqueo neuromuscular.
Por otro lado, el estudio de Moss se detuvo temprano por futilidad después de demostrar que era obvio que no había beneficio del bloqueo neuromuscular en los pacientes con SIRPA. Los autores sugieren que la evolución en las mejoras en la atención en terapia intensiva, en específico la reducción de la sedación, dieron como resultado un resultado negativo en relación con los estudios publicados anteriormente. Entonces se podría deducir que el bloqueo neuromuscular salva vidas en la misma intensidad en que la sedación profunda es letal: la sedación más ligera en el brazo de control debería haber salvado un número alto de vidas para borrar los beneficios de supervivencia de los BNM. Sin embargo, este complicado razonamiento será difícilmente la causa de las diferencias en mortalidad; de hecho, existe una diferencia fundamental entre ambos estudios: casi la mitad de los pacientes en los análisis franceses, incluido el de Papazian, fueron colocados en posición prono, mientras que sólo 16% de los pacientes en el estudio de Moss fueron pronados. Por razones que no están muy claras, los centros estadounidenses han tardado en adoptar la práctica de la posición prono.40,41 En este estudio de Moss, se dejó a discreción del médico tratante individual, y en cinco de seis pacientes, no utilizaron la opción.
Se desconoce si el bloqueo neuromuscular temprano es más efectivo aunado al posicionamiento en prono, pero es una posible explicación para los resultados tan diferentes de los estudios franceses y americanos. Resultaría útil un estudio que compare la utilidad de los BNM en un contexto de estandarización de la posición en prono.
Fortalezas y limitaciones del estudio
La fortaleza de nuestro metaanálisis es que se incorporaron datos de seis ECA. Es el metaanálisis más grande realizado hasta la fecha sobre este tema en el mundo. En la pirámide de la medicina basada en la evidencia, una revisión sistemática de ensayos controlados se encuentra en la parte superior. Hasta donde tenemos conocimiento, éste es el metaanálisis más grande en terapia intensiva realizado por un grupo de investigación mexicano.
La mayor limitación del estudio es el grado de sesgo de las publicaciones originales que impactan en el desarrollo de nuestro estudio.
Conclusiones
Esta revisión sugiere que el bloqueo neuromuscular temprano produce una reducción en la mortalidad por cualquier causa y en la UCI en pacientes con SIRPA moderado a severo.
Del mismo modo, no encontramos un aumento en los efectos adversos en pacientes tratados con bloqueo neuromuscular, de hecho, se evidenció disminución en la incidencia de neumotórax en los pacientes tratados con bloqueadores neuromusculares, sin aumento en la debilidad adquirida en la terapia intensiva.











 text new page (beta)
text new page (beta)