Introducción
Hace cincuenta años, Ashbaugh y sus colegas describieron a 12 sujetos con taquipnea, hipoxemia refractaria y opacidades difusas en las radiografías de tórax después de infección o trauma; se observaron membranas hialinas prominentes alineadas en los espacios alveolares de los pulmones en seis de los siete pacientes que fallecieron, hallazgos que se consideraron específicos para el síndrome de dificultad respiratoria del recién nacido, por lo que se propuso el término síndrome de dificultad respiratoria (SIRA) en adultos (posteriormente modificado a agudo). En los últimos años, se han logrado dos progresos sustanciales en la atención de los pacientes afectados y los que están en riesgo de padecer el trastorno, con reducciones tanto en la incidencia como en la mortalidad. Sin embargo, el SIRA sigue siendo un síndrome relativamente común y letal. En un estudio internacional reciente con 29,144 personas, 10% de todos ellos, ingresados a la Unidad de Cuidados Intensivos (UCI) y 23% de los pacientes ventilados mecánicamente tenían SIRA. La mortalidad en el subgrupo de pacientes con SIRA grave fue de 46% y los que sobreviven corrieron un alto riesgo de deterioro cognitivo, depresión, trastorno de estrés postraumático y debilidad muscular esquelética persistente.1,2
El síndrome de dificultad respiratoria aguda es una forma de edema pulmonar no cardiogénico, debido a una lesión alveolar secundaria a un proceso inflamatorio que puede ser de origen pulmonar o sistémico. Este síndrome se caracteriza por una hipoxemia aguda refractaria con infiltrados pulmonares bilaterales en las imágenes de tórax, que no se deben exclusivamente a insuficiencia cardiaca. Como todo síndrome, se caracteriza por la presencia de varios criterios. La definición de Berlín, que se publicó en 2012, fue validada en más de 4,000 datos de pacientes; sobre la base de la hipoxemia, el síndrome de dificultad respiratoria aguda se clasifica como leve (relación de la presión parcial del oxígeno arterial/fracción inspirada de oxígeno [PaO2/FiO2] de 200-300 mmHg), moderado (PaO2/FiO2 100-200 mmHg) o severo (PaO2/FiO2 menor de 100 mmHg).
Las actualizaciones más importantes a la definición son referentes a la presión positiva mínima al final de la espiración (PEEP) de 5 cm H2O. El PEEP puede aumentar la oxigenación, y este es un criterio clave del síndrome, el reconocimiento de éste no puede diagnosticarse en presencia de insuficiencia cardiaca; un requisito para una nueva insuficiencia respiratoria o un empeoramiento de la enfermedad respiratoria crónica, dentro de los siete días, así como la inclusión de la TC de tórax como una forma alternativa de obtención de imágenes para la demostración de infiltrados pulmonares.3
Epidemiología
El SIRA sigue siendo muy frecuente, en la actualidad, en la era de la protección pulmonar, la incidencia estimada es de 34 casos por cada 100,000 por año en los EUA y alrededor de cinco a siete en Europa. Su epidemiología es quizá inferior en estudios reportados en sistemas de salud menos desarrollados, en los cuales, como resultado de las limitaciones de recursos, pocos alcanzan la definición actual para el diagnóstico, a pesar de que 4% de todos los ingresos hospitalarios tienen un estado clínico similar al del síndrome de dificultad respiratoria aguda.4 Siete por ciento de los pacientes en la Unidad de Cuidados Intensivos (UCI) y 16% de los que reciben ventilación mecánica tienen síndrome de dificultad respiratoria aguda.5
Según la supervivencia del grupo control en ensayos controlados aleatorios publicados en los últimos tres años, a los 28 días la mortalidad está alrededor de 20-40%. La mortalidad a los 12 meses es de 15-20%, en gran parte debido a las comorbilidades más que a los efectos residuales del síndrome de insuficiencia respiratoria aguda.6 El estudio LUNGSAFE demostró que el síndrome sigue siendo común y tiene una mortalidad de alrededor de 40%. Aunque en general, los sobrevivientes de la UCI no tienen una reducción en la calidad de vida relacionada con la salud, la recuperación completa a menudo es limitada en los que tenían síndrome de dificultad respiratoria aguda.7
Muchos tienen desgaste muscular, limitación por debilidad y enfermedades neuropsiquiátricas, que incluyen deterioro cognitivo, ansiedad, depresión y trastorno de estrés postraumático.8
La incidencia y los resultados del SIRA no han sido reportados en los países en vías de desarrollo. Aunque la definición de Berlín se ha desarrollado teniendo en cuenta recursos materiales, puede no permitir la identificación de aquéllos con fisiopatología de SIRA en entornos con recursos limitados debido a la inaccesibilidad de ventiladores mecánicos, gases arteriales y radiografía de tórax. Estas limitaciones llevaron al desarrollo de nuevos criterios en 2016 en Kigali, Ruanda; en dicha propuesta se modificaron dos de los cuatro criterios de Berlín, proponiendo como estudio de imagen la realización de USG pulmonar en lugar de TAC simple, y en segundo lugar se propuso el modificar el uso de gases arteriales por la oximetría de pulso para sustituir el índice PaO2/FiO2 por el índice SpO2/FiO2 y con esto disminuir la subestimación y el subtratamiento de aquéllos con SIRA en muchos países.9
Diagnóstico
La definición de Berlín revisada aún tiene limitaciones (Tabla 1), la obtención de imágenes secuenciales a través de la radiografía de tórax y la TC proporciona medidas cualitativas de la evolución de la enfermedad, así como también proporciona medidas cuantitativas específicas de edema, aireación y capacidad de reclutamiento. El agua extravascular del pulmón, que refleja el grado de edema pulmonar, puede medirse con un monitor PiCCO (Pulse Contour Cardiac Output) y se asocia con mortalidad en pacientes con SIRA. Del mismo modo, la ecografía pulmonar puede utilizarse para estimar el agua pulmonar extravascular y para permitir la diferenciación del síndrome del edema pulmonar cardiogénico.10
Tabla 1: Criterios de Berlín para diagnóstico de SIRA y criterios propuestos según la modificación de Kigali.
| Criterios de Berlín | Cambios con recursos limitados | Modificación de Kigali | |
|---|---|---|---|
| Tiempo | Dentro de una semana de un insulto clínico conocido o síntomas respiratorios nuevos o que empeoran | Ninguno | Dentro de una semana de un insulto clínico conocido o síntomas respiratorios nuevos o que empeoran. |
| Oxigenación | PaO2/FiO2 menor de 300 | Limitación de Gases arteriales | SpO2/FiO2: menor de 315 |
| PEEP igual o mayor de 5 cmH2O | |||
| Imagen de Tórax | Las opacidades bilaterales no se explican completamente por derrames, colapso lobular/pulmonar o nódulos por radiografía de tórax o TAC | Limitación de radiografías o tomografía computada | Las opacidades bilaterales no se explican completamente por derrames, colapso lobular/pulmonar o nódulos por radiografía de tórax o ultrasonido |
| Origen del edema | Insuficiencia respiratoria no explicada completamente por insuficiencia cardiaca o sobrecarga de líquidos. Necesidad de una evaluación objetiva (p. ej. ecocardiografía) para excluir el edema hidrostático si no hay presente ningún factor de riesgo | Ninguno | Insuficiencia respiratoria no explicada completamente por insuficiencia cardiaca o sobrecarga de líquidos. Necesidad de una evaluación objetiva (p. ej. ecocardiografía) para excluir el edema hidrostático si no hay presente ningún factor de riesgo |
La relación PaO2/FiO2 es una medida de oxigenación que se usa para clasificar el síndrome de dificultad respiratoria aguda como leve, moderado o severo. Aunque es fácil de calcular, es una medida imperfecta debido a su variabilidad con la diferencia de PEEP y los volúmenes corrientes. El índice de oxigenación, el producto de la presión media de la vía aérea y la FiO2, dividido por la PaO2, es una alternativa a la PaO2/FiO2 y podría ser superior, ya que incluye la presión media de la vía aérea, que refleja PEEP. La distensibilidad del sistema respiratorio ayuda a controlar la mecánica pulmonar, aunque no se incluyó en la definición de Berlín porque carecía de valor discriminatorio adicional.
La necesidad de presión positiva al final de espiración (PEEP) en la definición de SIRA sigue siendo controvertida.11 Se puede obtener una estimación validada de PaO2/FiO2 a partir de SpO2/FiO2 utilizando oximetría de pulso14 y el ultrasonido ha sido validado como sustituto de la radiografía de tórax en SIRA.12
Se aplicaron criterios modificados para determinar la incidencia hospitalaria de SIRA en un hospital de Kigali, Ruanda, con el objetivo de aproximarse a los criterios de Berlín, pero sin un requerimiento de PEEP, así como con un límite de hipoxia definido por SpO2/FiO2 menor o igual a 315 y el uso de ultrasonido de pulmón o radiografía de tórax para la determinación de las opacidades bilaterales. El diseño y configuración de la investigación se realizó mediante un estudio de cohorte, observacional y prospectivo en el Hospital Universitario Docente de Kigali.
El resultado primario fue la determinación de la incidencia de SIRA entre todos los hospitalizados, también se describió la incidencia de hipoxia, la distribución del sexo, la media de edad, la etiología, el tiempo de desarrollo del SIRA y la tasa de mortalidad. Se propuso la modificación de Kigali a la definición de Berlín, en la cual se encuentran las siguientes modificaciones: falta de un requisito de PEEP, corte de oxigenación de SpO2/FiO2 menor o igual a 315 y uso de ultrasonido pulmonar o radiografía de tórax para la determinación de opacidades bilaterales (Tabla 1).13
Tabla 2: Variables estudiadas.
| Variable | Tipo | Definición operacional | Escala de medición | Calificación |
|---|---|---|---|---|
| SIRA | Independiente | Serie de criterios por clasificación de Berlín o modificación de Kigali que diagnostican síndrome de insuficiencia respiratoria del adulto | Cualitativa nominal | Sí/No |
| Diagnóstico de SIRA por Kigali | Dependiente | Serie de criterios que definen SIRA: | Cualitativa nominal | Sí/No |
| Tiempo de evolución del cuadro, estudio de imagen pulmonar, origen del edema pulmonar y oxigenación: SpO2/FiO2: menor de 315 mmHg | ||||
| Diagnóstico de SIRA por Berlín | Dependiente | Serie de criterios que definen SIRA: | Cualitativa nominal | Sí/No |
| Tiempo de evolución del cuadro, estudio de imagen pulmonar, origen del edema pulmonar y oxigenación: Sa2/FiO2, PEEP igual o mayor de 5 cmH2O | ||||
| Tiempo de evolución de la lesión inicial | Dependiente | Tiempo de inicio del cuadro clínico o síntomas respiratorios nuevos o que empeoran | Cuantitativa discreta | Días |
| Tiempo de realización de USG (ultrasonido) en Kigali | Dependiente | Tiempo que toma la realización del ultrasonido pulmonar desde el ingreso | Cuantitativa discreta | Horas/minutos |
| Patrón del USG | Dependiente | Patrón observado durante la realización del ultrasonido pulmonar | Cualitativa Nominal | B1: Patrón alveolar |
| B2: Patrón alveolo-intersticial | ||||
| C: Consolidación | ||||
| N: Normal | ||||
| BNP | Dependiente | Péptido medido mediante laboratorio cuyos valores no indican falla cardiaca presente o no, tomado de resultado de laboratorio | Cuantitativa discreta | Pg/mL |
| SpO2/FiO2 | Dependiente | Índice que resulta al dividir la SpO2 tomada del monitor entre FiO2 tomada del ventilador | Cuantitativa discreta | mmHg |
| Ventilación mecánica | Dependiente | Reemplazo transitorio de la función ventilatoria cuando ésta es ineficaz, corroborado visualmente | Cualitativa nominal | Sí/No |
| PEEP | Dependiente | Cantidad de presión positiva al final de la inspiración proporcionada por el ventilador, tomada del mismo | Cuantitativa discreta | cmH2O |
| Tiempo para completar criterios de Kigali | Dependiente | Cantidad de horas que toma completar los 4 puntos para realizar o no el diagnóstico de SIRA | Cuantitativa continua | Horas/minutos |
| SOFA | Dependiente | Sistema de evaluación de fallo orgánico, se calculará a través de la hoja de enfermería y resultados de laboratorio al ingreso | Cuantitativa discreta | Puntaje |
| Imagen utilizada por Berlín | Dependiente | Tipo de estudio de imagen realizado para cubrir el tercer punto de la clasificación de Berlín | Cualitativa nominal | Radiografía |
| Tomografía | ||||
| Tiempo de realización de estudio de Imagen por Berlín | Dependiente | Tiempo en horas que toma la realización del estudio de imagen para cubrir el tercer punto de la clasificación de Berlín | Cuantitativa discreta | Horas/minutos |
| SpO2 ingreso | Dependiente | Porcentaje de saturación de oxígeno registrado por oxímetro de pulso, tomado de monitor | Cuantitativa discreta | % |
| Clasificación de SIRA por Berlín (Acorde a PaO2/FiO2) | Dependiente | Índice que resulta al dividir la PaO2 tomada de la GASA entre FiO2 tomada del ventilador, el cual se ordena de manera jerárquica acorde a valores | Cualitativa ordinal | Leve: 200-300 |
| Moderado: 100-200 | ||||
| Severo: Menos de 100 | ||||
| PaO2/FiO2 | Dependiente | Índice que resulta al dividir la SaO2 tomada de la GASA entre FiO2 tomada del ventilador | Cuantitativa discreta | mmHg |
| Tiempo para completar criterios de Berlín | Dependiente | Cantidad de horas que toma completar los 4 puntos para realizar o no el diagnóstico de SIRA | Cuantitativa continua | Horas/minutos |
| Etiología del SIRA | Dependiente | Lugar donde inicia el proceso que afecta al parénquima pulmonar y desencadena SIRA | Cualitativa nominal | Infecciosa pulmonar |
| Infecciosa extrapulmonar | ||||
| Traumática | ||||
| Otra | ||||
| Mortalidad | Dependiente | Egreso de la terapia intensiva por defunción de cualquier causa | Cualitativa nominal | Sí |
| No | ||||
| Sexo | Control | Características sexuales observadas en el sujeto de estudio | Cualitativa nominal | Hombre |
| Mujer | ||||
| Edad | Control | Años cumplidos hasta la fecha de ingreso al estudio | Cuantitativa discreta | Años cumplidos |
| Peso | Control | Estimación calculada entre el peso y la talla al cuadrado | Cualitativa nominal | Normal |
| Sobrepeso | ||||
| Obesidad Grado 1 | ||||
| Obesidad Grado 2 | ||||
| Obesidad Grado 3 | ||||
| Comorbilidades | Dependiente | Enfermedades presentes conocidas por el paciente o los familiares, plasmadas en el expediente clínico | Cualitativa nominal | Diabetes mellitus tipo 2 |
| Hipertensión arterial sistémica | ||||
| Hipotiroidismo | ||||
| ERC | ||||
| EPOC |
Tratamiento
Ventilación mecánica
En el estudio ARMA, que fue publicado en 2000 por el grupo ARDSnet, se utilizaron dos estrategias ventilatorias en 861 pacientes ventilados mecánicamente con síndrome de dificultad respiratoria aguda: la tradicional de mantener 12 mL/kg en combinación con una presión meseta de la vía aérea menor de 50 cmH2O versus la estrategia de protección pulmonar con un volumen corriente inferior de 6 mL/kg en combinación con una presión meseta de 30 cmH2O o menor. En el primer grupo, el estudio se suspendió de forma prematura porque no se logró una adecuada oxigenación; sin embargo, aquéllos con volúmenes corrientes bajos se asoció con una reducción absoluta de 8.8% (IC del 95%: 4-15.3) en la mortalidad (39.8% frente a 31.0%; p = 0.007) y significativamente más días libres de ventilación (10 versus 12; p = 0.007).
La ventilación con protección pulmonar se asocia con mejores resultados si se usa de manera anticipada en el curso del síndrome de dificultad respiratoria aguda y con una reducción en la mortalidad a los dos años.14
La PEEP previene el colapso de la unidad pulmonar al final del ciclo respiratorio. Los efectos beneficiosos incluyen el mantenimiento de la capacidad residual funcional, una mejor distensibilidad y una mayor presión media de la vía aérea, lo que resulta en disminución de los cortocircuitos, reducción de atelectasias y biotrauma. Las ventajas deben sopesarse contra los efectos de la presión intratorácica elevada, es decir, disminución del retorno venoso e incremento de la postcarga ventricular derecha. Se han descrito numerosos métodos para establecer el nivel de PEEP, incluida la manometría con balón esofágico. El ensayo controlado aleatorizado de EPVent, en donde la PEEP guiada por globo esofágico se comparó contra el uso de la Tabla ARDSnet PEEP-FiO2, lo que demuestra que la PEEP guiada por esófago proporcionaba una mayor oxigenación y distensibilidad, lo que se tradujo en una PEEP mayor (18 cmH2O frente a 12 cmH2O en el primer día) y una disminución de la mortalidad ajustada asociada a los 28 días (RR 0.46, IC 95% 0.19-1.0; p = 0.049).
La presión de conducción, definida como la diferencia entre la meseta y las presiones espiratorias finales, se ha sugerido como el mediador de los efectos beneficiosos de los tres componentes principales de la ventilación protectora pulmonar: bajo volumen corriente, baja presión meseta y PEEP elevada. La presión de conducción podría ayudar a calibrar la presión mecánica entregada por el ventilador a la capacidad residual funcional. Aunque el volumen corriente de 6 mL/kg se reconoce como ventilación de volumen corriente bajo, éste es el volumen corriente normal en la mayoría de las especies de mamíferos. A medida que el volumen pulmonar funcional disponible cae en el síndrome de dificultad respiratoria aguda como resultado del colapso y la consolidación, quizás el volumen corriente entregado también debería disminuir. Cabe destacar que estos datos de manejo de presiones son de naturaleza observacional y necesitan una confirmación en un estudio prospectivo y un límite superior para la presión de conducción de 15 cmH2O podría ser apropiado.15
Manejos adyuvantes de soporte respiratorio
Posicionamiento prono
La colocación de alguien propenso mientras recibe ventilación mecánica invasiva proporciona muchas ventajas fisiológicas para el tratamiento de la hipoxemia refractaria, incluida la redistribución de la consolidación de las áreas dorsales a ventrales del pulmón, la eliminación del peso del corazón y el mediastino del pulmón, ventilación alveolar mejorada, reducción de la derivación con aumento de la oxigenación y reducción de la producción de citocinas inflamatorias pulmonares. El estudio PROSEVA fue diseñado para abordar y aclarar las virtudes y deficiencias de esta terapia adyuvante, en éste se incluyeron 466 casos con síndrome de dificultad respiratoria aguda severa (que se definió como una PaO2/FiO2 menor de 150 mmHg y una FiO2 de 60% o mayor) que recibían ventilación con protección pulmonar, fueron asignados de manera aleatoria a la posición supina o sesiones diarias de posición prona que duran al menos 16 horas. La ventilación con posición prono se asoció con una reducción de la mortalidad a los 28 días en comparación con la ventilación supina (32.8% frente a 16.0%, p < 0.001; HR 0.44, IC 95% 0.29-0.67). No hubo complicaciones adicionales asociadas con el posicionamiento prono, aunque todos los centros involucrados tenían experiencia con esta técnica.16
Bloqueo neuromuscular
En la hipoxemia del síndrome de insuficiencia respiratoria aguda grave se necesita un apoyo ventilatorio intensivo, lo que puede condicionar riesgo en el desarrollo de una lesión pulmonar inducida por el ventilador. La parálisis elimina el esfuerzo endógeno, mejora la mecánica respiratoria y reduce el consumo de oxígeno. En el estudio ACCURSY se comparó parálisis inducida por cisatracurio con placebo en 340 sujetos con síndrome de insuficiencia respiratoria aguda severa de forma prematura. El bloqueo neuromuscular durante 48 horas dio como resultado el aumento de la PaO2/FiO2 con respecto a la inicial, así como aumento de la presión de meseta, con una reducción de la mortalidad a los 90 días (0.68, 95% CI 0.48-0.98; p = 0.04). Es importante destacar que la frecuencia de complicaciones, incluida la miopatía asociada a bloqueo neuromuscular, no difirió entre los grupos.17
Material y métodos
Área clínica, diseño observacional, descriptivo, transversal y comparativo con universo finito; todos los participantes fueron ingresados en la Unidad de Cuidados Intensivos del Hospital General «La Villa» durante el periodo comprendido del 01 de enero de 2018 al 30 de mayo de 2018.
Criterios de inclusión: pacientes de ambos sexos. Pacientes mayores de 18 años. Pacientes con saturación por oximetría menor a 90%. Pacientes con diagnóstico de SIRA.
Criterios de exclusión: pacientes con insuficiencia cardiaca previa o falla cardiaca aguda. Pacientes con patología pulmonar previa. Pacientes que se trasladen a otra unidad. Pacientes que soliciten egreso voluntario. Pacientes con datos incompletos en hoja de recolección.
Se incluyeron a todos los ingresados al servicio de terapia intensiva, quienes presentaron hipoxemia por oximetría de pulso al ingreso, se realizaron los procedimientos especificados a continuación:
Toma de muestras y procesamiento: al ingreso, tras la realización de asepsia y antisepsia, se procedió a toma de muestras que consistió en gasometría arterial periférica, se llevó a cabo anticoagulación de la muestra con heparina no fraccionada humidificando de manera cuidadosa el émbolo y la jeringa, evitando dejar heparina libre en el interior; en caso de existir burbujas en el interior de la muestra se realizó su extracción inmediata evitando agitarla. Una vez realizada la extracción de muestra se transportó al laboratorio en red de frío, sin dejar pasar más de 10 minutos entre la extracción de la muestra y su análisis para evitar el descenso de la PO2 y el aumento de la PCO2.
Se realizó el análisis gasométrico de la muestra en el equipo de gasómetro GEM premier 3000.
Se aplicaron los criterios de Kigali ya especificados en el marco teórico al ingreso y se realizó USG pulmonar con transductor convexo de 3.5 mHz en cuatro zonas: superior e inferior, anterior y superior, e inferior posterior para determinar uno de los cuatro patrones ultrasonográficos presentes; asimismo, al aplicar los criterios de Berlín, se solicitó estudio de imagen disponible (radiografía de tórax o tomografía pulmonar simple).
Al ingreso se solicitó a todos los pacientes BNP como indicador de falla cardiaca aguda y se realizó exclusión de aquéllos que presentaron niveles mayores de 100 pg/mL.
Aplicación de cuestionarios y recolección de datos: el estudio fue observacional, descriptivo, transversal y comparativo, no se realizó intervención alguna en el tratamiento previo al ingreso, ni durante su estancia en el servicio de terapia intensiva, se incluyó a todos los que no presentaron criterios de exclusión. Se les realizó un cuestionario estructurado para investigar variables demográficas y clínicas relacionadas con la enfermedad, así como para llevar un registro estructurado para documentar las variables gasométricas (SaO2) y bioquímicas (BNP) de importancia para el presente estudio. (Hoja de recolección de datos).
Los datos recabados fueron protegidos por la Ley General de Salud, la Ley Federal de Protección de Datos Personales en Posesión de los Particulares, descrito en la reforma de los artículos 3, fracciones II y VII, y XXXIII.
Estadística: se calcularon las medidas de tendencia central y dispersión en las variables continuas, en las nominales las frecuencias y proporciones. Para evaluar el tipo de distribución de las variables continuas se utilizó la prueba de Shapiro-Wilks, para comparar los grupos de variables categóricas y dos medias se usaron las pruebas de ANOVA, además se realizó regresión lineal y r de Pearson para determinar la correlación. El nivel de significancia se consideró < 0.05 (dos colas). Se utilizó el programa de análisis estadístico informático (Statistical Package for Social Sciences-SPSS) versión 23 y el paquete estadístico Minitab 15.
Aspectos éticos: de acuerdo al Reglamento de la Ley General de Salud en materia de Investigación para la Salud. Título Segundo: de los aspectos éticos de la investigación en seres humanos Capítulo II, Art. 17, es una «Investigación con riesgo mínimo».
Por lo tanto, el estudio se realizó de acuerdo con los requerimientos legales y regulatorios, y de acuerdo con los principios generales establecidos por las Pautas Éticas Internacionales para la Investigación Biomédica en Seres Humanos (Consejo de Organizaciones Internacionales de las Ciencias Médicas, 2002), los Lineamientos para la Buena Práctica Clínica (Conferencia Internacional sobre Armonización 1996) y la Declaración de Helsinki (Asociación Médica Mundial 2008).
Resultados
Con la intención de determinar si la escala Kigali es confiable, y que representa un método alternativo de diagnóstico de síndrome de insuficiencia respiratoria aguda, se realizó una comparación estadística con los datos de una escala validada y usada en el campo clínico (Berlín). El marco muestral involucró a todos los admitidos a UCI durante el periodo de cuatro meses entre enero a mayo de 2018. El primer filtro consistió en la detección de todos aquéllos con hipoxemia e insuficiencia respiratoria de cualquier tipo.
Se captaron un total de 42 personas con hipoxemia, se excluyeron tres por falta de datos en relación al tiempo de realización del USG, después cinco más por presentar falla cardiaca por BNP mayor de 100 pg/mL. Se incluyeron en el análisis un total de 34 casos, los cuales fueron diagnosticados con SIRA a su ingreso a la UCI usando para su diagnóstico la escala Berlín y Kigali.
Características demográficas y clínicas
Sexo, edad, IMC: se estudiaron un total de 34 pacientes, 18 (51%) fueron hombres y 17 (49%) fueron mujeres. El IMC se distribuyó de la siguiente manera: ocho pacientes con peso normal (24%), 16 más con sobrepeso (47%), seis casos con obesidad grado I (17%), cuatro con obesidad grado II (12%) y ninguno con obesidad grado III o mayor.
Comorbilidades: se encontró al menos una comorbilidad en 55.9% de los casos (19), 44.1% restante no presentaban comorbilidades agregadas al ingreso (15). Dentro de aquéllos con comorbilidades, se encontró que 32.3% de los casos (11) presentaban al menos dos de ellas, las de mayor prevalencia fueron diabetes mellitus tipo 2 (DM2) e hipertensión arterial sistémica (HAS).
Las comorbilidades presentes se dividieron de la siguiente manera: 13 pacientes con DM2 (38.2%), 11 con HAS (29.4%), cuatro con hipotiroidismo (11.7%) y dos con enfermedad renal crónica (5.8%). No se presentó ningún caso de EPOC.
Etiología del SIRA
Acorde al factor desencadenante de SIRA, la distribución fue de la siguiente manera: infección pulmonar 47% (16), infección extrapulmonar 29% (10) y asociada a trauma 24% (8).
Saturación periférica: la saturación periférica al ingreso fue el primer paso para determinar si se aplicaban los criterios para diagnosticar SIRA en un paciente con media de 85.8% (DE: 82.9-88.7%).
Para el diagnóstico de SIRA se utilizaron la escala de Kigali y de Berlín y se crearon dos grupos de datos. El primero correspondía exclusivamente a los valores de SaO2, que provienen de los pacientes diagnosticados con SIRA mediante la escala Berlín, con una media de 85.1% (SD: 82.2-88%). El segundo grupo con valores de SpO2 obtenidos de los pacientes diagnosticados con la escala Kigali, con una media de 85.8% (SD: 82.9-88.7%). A un nivel de confianza del 95% se encontró que no hay una diferencia significativa entre los valores de SaO2 y SpO2 del grupo diagnosticado con Berlín y Kigali, respectivamente.
Ventilación mecánica y nivel de PEEP: 100% de los ingresados se encontraban con ventilación mecánica. El nivel de PEEP promedio fue de 8.4 cmH2O (DE: 6-10.8 cmH2O). La distribución acorde al nivel de PEEP: siete casos (20.5%) con un nivel de PEEP de 5 cmH2O; uno (2.9%) con 6 cmH2O; dos (5.8%) con 7 cmH2O; nueve (26.4%) con 8 cmH2O; cuatro (11.7%) con 9 cmH2O; tres (8.8%) con 11 cmH2O; tres (8.8%) con 11 cmH2O; tres (8.8%) con 12 cmH2O y dos (5.8%) con 13 cmH2O.
Características de las variables para el diagnóstico
Tiempo de evolución de la lesión inicial al desarrollo de SIRA: el tiempo de evolución de la lesión inicial y el desarrollo SIRA fue en promedio de 2.3 días (DE: 1.1-3.5) y una distribución con predominio en el día uno (29.4%), día dos (35.2%), día tres (17.6%), día cuatro (5.8%) y día cinco (11.7%), con cero casos el día seis y siete.
Péptido natriurético cerebral (BNP): el BNP se utilizó para evidenciar edema pulmonar de origen cardiogénico. La media de BNP en los 34 pacientes que ingresaron al estudio fue de 84.2 pg/mL (DE: 72-96.4 pg/mL); mientras que cinco pacientes presentaron BNP mayor de 100 pg/mL que se excluyeron del estudio.
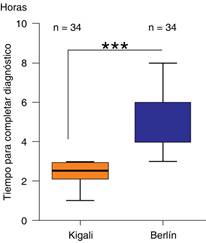
Diagnóstico de SIRA por modificación de KIGALI: los 34 pacientes ingresados al estudio (100%) cumplieron los criterios de Kigali, el tiempo medio para completar dichos criterios diagnósticos fue de 2:20 horas (DE: 2:0-2:40).
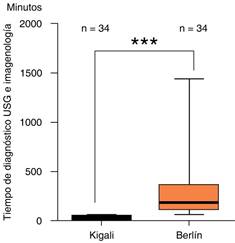
El estudio de imagen utilizado para evidenciar opacidades pulmonares bilaterales fue el ultrasonido pulmonar, el cual tuvo un tiempo medio de realización de 33.8 minutos (DE: 17.4-50.2).
Los patrones de ultrasonido observados se dividieron de la siguiente manera: patrón B1 (múltiples líneas B espaciadas de 7 mm) o patrón alveolar: cinco pacientes (14.7%). Patrón B2 (múltiples líneas B coalescentes, espaciadas de 3 mm) o patrón alveolo-intersticial: 25 casos (73.5%). Patrón C o patrón de consolidación: 12 pacientes (35%).
Cabe señalar que ocho casos (23.5%), presentaron un patrón mixto con predominio del B2 y C.
SpO2/FiO2.
El total de los ingresados cumplieron el criterio de Kigali referente a una SpO2/FiO2 menor de 315; la media de SpO2/FiO2 fue de 146.8 (DE: 105.2-188.4). El nivel de PEEP en los criterios de Kigali no debe ser igual o mayor de 5 cmH2O para considerar este criterio como válido; sin embargo, el nivel medio de PEEP utilizado fue de 8.4 cm H2O (6.0-10.8).
Diagnóstico de SIRA por criterios de Berlín: en los 34 pacientes con criterios de Berlín ingresados al estudio fue de 100%. El tiempo medio para completar los criterios diagnósticos fue de 4:35 horas (DE: ± 1:20).
Los estudios de imagen utilizados para demostrar la presencia de opacidades pulmonares bilaterales fueron la TAC pulmonar simple y la radiografía de tórax. Se realizó TAC simple en 18 pacientes (52.9%) y radiografía de tórax en 16 (47.1%).
El tiempo medio de realización del estudio de imagen inicial, tanto para el estudio tomográfico como para la radiografía de tórax fue de 2:50 horas (DE: ± 1:35).
PaO2/FiO2: La PaO2/FiO2 en quienes se aplicaron los criterios de Berlín tuvo una media de 83.6 (DE: ± 21.4), al ser clasificados por gravedad se encontró que: 21 pacientes (61.7%) se encontraban con SIRA severo y 13 casos (38.2%) con SIRA moderado. No se detectaron casos de SIRA leve y un valor de α = 0.05, lo que muestra que el tiempo de respuesta es significativamente diferente. El tiempo de USG es alrededor de diez veces más rápido con una media de 33.8 minutos (DE: ± 16) con respecto a la tomografía y/o radiografía de tórax, mismos que presentaron una media de 449 minutos (DE: ± 641). Esta información representa una ventaja en el uso de la escala Kigali en el diagnóstico de SIRA, ya que el valor de p fue menor de 0.05, con significancia estadística en cuanto al método utilizado para realizar el diagnóstico de imagen; por lo tanto, el USG en este rubro de la modificación de Kigali es más efectivo Figura 1.
Comparación del tiempo promedio para completar el diagnóstico con los criterios de Berlín versus la modificación de Kigali
Se aplicó la prueba de ANOVA para realizar la comparación de la efectividad medida en el tiempo requerido para completar los criterios de Berlín versus los de Kigali; se encontró una media de tiempo para completar los criterios diagnósticos de Kigali de 2.4 horas (DE: ± 0.45 minutos) y una media de 4.7 horas (DE: ± 1.4) para completar los criterios diagnósticos de Berlín, al realizar el análisis de varianza con un IC de 95% se determinó un valor de α = 0.05.
Comparamos a través de un análisis de varianza de una vía si el tiempo promedio de respuesta por el método Kigali tiene cambios significativos con respecto a nuestro método de referencia (Berlín). Se utilizó como método estadístico la prueba p-value y se encontró que hay una diferencia significativa (valor de p < 0.05) entre los tiempos de diagnósticos de ambos criterios. Fue menor el tiempo para los criterios de Kigali en comparación al tiempo en los criterios de Berlín, por lo que se estableció diferencia estadísticamente significativa entre ambos y se concluyó que los criterios modificados de Kigali son más eficaces (Figura 2).
Correlación entre la SpO2/FiO2 y la PaO2/FiO2
Con la intención de identificar alguna asociación entre el índice SpO2/FiO2 y el índice PaO2/FiO2, y demostrar alguna correlación que nos permita evidenciar que ambos valores pueden ser excelentes parámetros de referencia que complementan el diagnóstico de SIRA, se realizó un estudio de correlación de las variables de interés. Para ello, se utilizó el coeficiente de correlación de Pearson y se observó que hubo una relación directa y casi proporcional (r de 0.99 con un IC de 95%: 0.9825-09957), lo que en principio sugiere que estos datos toman el mismo camino en su interpretación y, por lo tanto, uno no es inferior al otro en el contexto clínico (Figura 3).
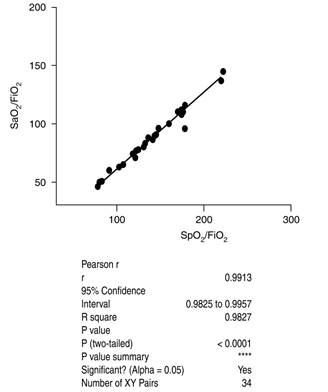
Figura 3: Análisis de correlación entre los valores de SpO2/FiO2 y PaO2/FiO2 de todos los pacientes involucrados en el estudio estadístico. Cálculo de los valores del análisis con valor de p < 0.05 muestra la correlación directa y el signo del coeficiente de Pearson refleja la dirección de la asociación bajo estudio.
Basados en el análisis de correlación de Pearson entre los valores de SpO2/FiO2 y PaO2/FiO2, se sugiere la creación de una escala nominal de SpO2/FiO2 que permita categorizar como leve, moderado y severo la condición médica de los pacientes con SIRA, de una manera análoga a la clasificación propuesta por la escala Berlín.
Los datos con los que contamos sólo pudieron clasificar a aquéllos en severo y moderado, por lo que la clasificación de leve tendría que ser propuesta cuando tengamos más información o a través de la extrapolación de los datos, como se indica más adelante. Se realizó un análisis de regresión lineal para obtener la ecuación de la recta.
Ecuación de regresión
La ecuación de regresión es:
SpO2/FiO2 = 7.99 + 1.50 PaO2/FiO2
Sustituyendo el valor límite de 100 para límite entre moderado y severo.
SpO2/FiO2 = 7.99 + 1.5* (100) = 158.
Este primer resultado supone la existencia de una relación lineal y proporcional entre SpO2/FiO2 y PaO2/FiO2 un valor menor a 158 de SpO2/FiO2 es suficiente para clasificar como severo.
Este mismo ejercicio para valores de 200 y de 300.
SpO2/FiO2 = 7.99 + 1.5* (200) = 308. Con valores entre 158 y 308 clasificaríamos a los pacientes como moderados.
SpO2/FiO2 = 7.99 + 1.5* (300) = 458. Con valores mayores a 458 clasificaríamos a los pacientes como leves. Aunque esta última es obtenida de manera teórica por extrapolación de datos, ya que no presentamos pacientes con SIRA leve por Berlín. Un estudio con personas cuyos valores de PaO2/FiO2 estuvieron entre 200-300, y sus respectivos valores de SpO2/FiO2, podría revelar con mayor precisión el valor para SIRA leve.
De tal manera que proponemos la escala de gravedad por SpO2/FiO2 para Kigali que se muestra en la Tabla 1.
SOFA y mortalidad
Se realizó la escala de SOFA a todos los ingresados, obteniéndose como media 12 puntos (DE ± 1.9) con una mortalidad promedio de 40-50%, ya que la mayoría ingresaron como SIRA severo (61.9%).
Hubo 11 defunciones con un total de 32.3%, 23 (67.3%) se egresaron a hospitalización, sin llevar a cabo algún otro tipo de seguimiento.
Discusión
El síndrome de insuficiencia respiratoria es una patología que en la actualidad se define por los criterios de Berlín, al ser la única propuesta aceptada y validada en 2012.18
En cuanto a la epidemiología del SIRA, en la investigación se mostró una media de edad de 45 años (DE: 36-54 años), comparado con el estudio multicéntrico más grande de características epidemiológicas del SIRA en 50 UCI alrededor del mundo, el cual muestra un predominio de edad de 61.5 años (DE: 60.9-62.1); sin embargo, este último se realizó en países desarrollados, en los cuales la media de edad es mayor con respecto a nuestro país. Además, en este estudio multicéntrico se reportó un predominio en el sexo masculino de 62%, lo que difiere de los datos de este estudio, ya que no se encontraron diferencias entre ambos sexos: 51% en hombres y 49% en mujeres; esto también puede diferir por el número de ingresados en el estudio previamente referido, ya que ingresaron más de 3,000 personas versus los 34 de la presente investigación, aunado a que éste no es un estudio epidemiológico.1
Otra variable epidemiológica medida en el estudio fue el IMC el cual tuvo un predominio en los rasgos de sobrepeso y obesidad grado 1, no es comparable con el estudio de Bellani y su equipo, ya que ellos midieron peso en kilogramos con una media de 78kg;1 sin embargo, estas cifras no se alejan de las cifras de la Federación Mexicana de Diabetes que ubica al sobrepeso en la población entre 38.8-42.5%.19
Las comorbilidades en este estudio también fueron evaluadas, con predominio de DM2 (38.2%) e HAS (29.4%), Bellani y colaboradores encontraron una prevalencia de DM2 de 21.7%, lo que evidencia 10 puntos porcentuales más en la población estudiada; en cuanto a otras comorbilidades y su predominio en SIRA no hay datos disponibles.
La etiología del SIRA en este estudio se distribuyó de la siguiente manera: infección pulmonar 47%, infección extrapulmonar 29% y asociada a trauma 24%; Bellani y su grupo encontraron un foco infeccioso pulmonar en 59.4% de los casos, un foco extrapulmonar en 16% y asociado a trauma en 4.2%. Los datos de estas investigaciones son similares al ser comparados; sin embargo, destaca el mayor número de casos asociados a trauma, relacionado a que la unidad hospitalaria en donde se llevó a cabo la investigación es centro de referencia para aquéllos con trauma.1
Con la intención de determinar si los criterios modificados por Kigali son confiables y representan un método alternativo de diagnóstico de SIRA, se realizó una comparación estadística con los datos de los criterios validados con anterioridad y utilizados de manera amplia en el campo clínico (Berlín).18
El método Kigali ha resultado susceptible de implementación en algunas regiones donde los requerimientos clínicos y el equipamiento médico no son los adecuados por la disponibilidad, dicho de otro modo, la búsqueda de nuevas alternativas ha llevado a usar nuevos parámetros de diagnóstico, siempre que cumplan con la capacidad de respuesta igual o mejor al método estándar. La evaluación planteada para determinar la eficacia de los criterios modificados por Kigali versus los criterios de Berlín fue el tiempo que tomó completar los criterios de ambos estudios para diagnosticar SIRA. No existe un estudio igual que compare la eficacia de estos dos criterios diagnósticos; lo más cercano es el estudio llevado a cabo por Riviello y colaboradores quienes proponen los criterios, pero no realizan una comparación contra los de Berlín, ya que no contaban en su unidad hospitalaria con los recursos gasométricos ni tomográficos necesarios.4
Con el objetivo de conferir viabilidad a los criterios de Kigali, se propuso la medición del tiempo requerido para el diagnóstico en comparación con el método estándar (Berlín). Nuestro estudio demostró significancia estadística en cuanto a los tiempos de realización diagnóstica de Kigali versus Berlín con tiempos de 2.4 horas (DE: ± 0.45 min) y 4.7 horas (DE: ± 1.4) respectivamente; por lo que los criterios de Kigali demostraron mayor efectividad para realizar el diagnóstico de manera más rápida, sin que existan evaluaciones similares en algún estudio previo.
Recordemos que entre los principales cambios en los criterios de Kigali con respecto a los de Berlín encontramos, en primer lugar, la realización del estudio de imagen, lo cual propone al ultrasonido pulmonar como método alternativo; y en segundo lugar el uso de la SpO2/FiO2 para sustituir la PaO2/FiO2 y realizar una monitorización continua y precisa como la de una gasometría sin realizar la misma, para poder disminuir costos y optimizar el uso de la oximetría de pulso.4
Los resultados aquí mostrados con respecto al uso de USG pulmonar versus los estudios de imagen estándar (Rx y TAC), evidenciaron significancia estadística en cuanto a los tiempos de realización, con una media para el USG de 33.8 minutos (DE: ± 16) y los métodos de imagen estándar una media de 449 minutos (DE: ± 641), lo que representa una disminución de tiempo 10 veces menor para el USG; dicha situación se ha evidenciado en estudios previos de Lichtenstein y su grupo.20 Cabe señalar que los artefactos de línea B difusos son sugestivas de SIRA, pero la aparición de edema pulmonar cardiogénico se puede superponer, el cual puede ser descartado con un ecocardiograma o mediante la determinación de BNP. Dicha situación no es exclusiva del USG, ya que el patrón radiográfico de SIRA en la radiografía de tórax y TAC también es indistinguible del edema pulmonar cardiogénico.21
Se ha comparado la sensibilidad (93-98%) y especificidad (78-100%) del USG como método diagnóstico alterno,25 con respecto a la radiografía de tórax; diversos estudios como el de Lichtenstein, Xirouchaki, y Endo sugieren que la radiografía de tórax podría ser insuficiente para detectar alteraciones pulmonares en las etapas iniciales de la enfermedad, de estos, la TAC es el método estándar; aunque no es factible su realización en todas la unidades por falta de recursos. Cabe destacar que el USG pulmonar no es inferior al estudio tomográfico.22
En cuanto al uso de gasometría u oximetría de pulso, se buscó realizar una asociación entre la relación SpO2/FiO2 y la relación PaO2/FiO2, lo cual nos permitió en el presente estudio realizar una correlación que nos muestra que ambos valores son excelentes parámetros de referencia y que complementan el diagnóstico de SIRA. Se utilizó el coeficiente de correlación de Pearson y observamos que hay una relación directa y casi proporcional (R = 0.99), lo cual nos permite utilizar cualquiera de ellos de forma indistinta, con la intención de realizar un monitoreo continuo y detectar de forma temprana el empeoramiento o la mejoría de la enfermedad. Se ha demostrado esta misma correlación en algunos estudios realizados con animales y en la actualidad se utiliza en niños, en los cuales se concluye que la relación SpO2/FiO2 es un sustituto confiable no invasivo de la relación PaO2/FiO2 para identificar a los niños con ALI o SIRA con la ventaja de reemplazar el muestreo invasivo de sangre arterial, mediante oximetría de pulso no invasiva.23
Los estudios realizados en adultos al comparar esta correlación son escasos, el más relevante se presentó en 2007 en la revista CHEST, en el cual se realizó la conclusión de que la SpO2/FiO2 y la PaO2/FiO2 guardan una correlación lineal y una puede utilizarse como sustituto de la otra, con disminución de costos y el número de complicaciones relacionadas con la toma de gasometrías.24
Asimismo, en el año 2017 se realizó una tesis en la UCI del Hospital General «La Villa», la cual demostró la correlación entre la SpO2/FiO2 y la PaO2/FiO2 en aquéllos con trauma de tórax, lo cual coincide con los resultados de esta investigación y muestra que esta correlación es un buen método para el monitoreo respiratorio no invasivo.25
La utilidad de estos índices estriba en que se usan para evaluar el grado de insuficiencia respiratoria y daño pulmonar agudo como criterio pronóstico para SIRA, así como para modificar paulatinamente la conducta de apoyo ventilatorio y optimizar dicho soporte. Es por ello que la determinación de alteraciones del índice SpO2/FiO2 es muy importante, si a la vez se correlaciona con PaO2.
Con el presente estudio y sus resultados se propone, con base en la SpO2/FiO2, clasificar la gravedad del SIRA en leve, moderado y severo a través de una regresión logística de los datos de la PaO2/FiO2; sin embargo, como no contamos con casos con SIRA leve en este estudio, este último dato se tuvo que hacer de forma teórica extrapolando los resultados, por lo tanto este dato es el de menor poder estadístico y puede variar cuando se realicen más investigaciones que sí incluyan SIRA leve.
Nuestra propuesta queda de la siguiente manera para SIRA leve: 310-460, moderado: 160-310 y severo: menor de 160, estos datos son muy similares al análisis realizado por Rice y colaboradores, quienes proponen una clasificación para leve con valores de 235-315, sin haber incluido casos con SIRA moderado y severo en su estudio, por lo que no se pueden comparar estos últimos valores.24
La aportación propuesta puede dar pie a la realización de más investigaciones y la utilización cada vez mayor de este método menos invasivo.
Por último, la media de SOFA de los ingresados a este análisis fue alta con valor medio de 12 puntos con mortalidades calculadas de 40 a 50%; sin embargo, al final del estudio la mortalidad fue de 32.3%, la cual al ser comparada con estudios internacionales es muy similar con aquéllos que describen características epidemiológicas del SIRA, con una media de 39.6%.7
La facilidad de la determinación del índice SpO2/FiO2 es de gran importancia gracias al acceso que se tiene a los oxímetros de pulso, esta medición puede incorporar a la monitorización, incluso realizada por el personal de enfermería. Lo reportado en este trabajo y en investigaciones previas nos da acceso a la monitorización continua de la función pulmonar, lo cual facilita el diagnóstico de SIRA de manera temprana para dar tratamiento oportuno y optimizar el manejo ya establecido para este síndrome.
Investigaciones recientes, como Kigali, nos muestran la importancia de la disminución de procesos invasivos en los ingresados a la UCI, como es el caso del uso de SpO2/FiO2 y del USG pulmonar en pacientes con SIRA, por lo que, es de vital importancia demostrar que este tipo de métodos de monitorización no invasiva son viables para el diagnóstico y tratamiento, al mejorar la calidad en la atención, no sólo en servicio de UCI, sino en todos los servicios hospitalarios; asimismo, los criterios modificados por Kigali muestran una eficacia mayor en la disminución de tiempos para la realización de un diagnóstico de forma más temprana.4
Conclusiones
Los criterios de Kigali fueron más efectivos que los de Berlín para el diagnóstico de SIRA. Se comparó el tiempo para completar los criterios diagnósticos por la modificación de Kigali versus los criterios de Berlín, se encontró una media de tiempo para completar los criterios de Kigali de 2.4 h (DE: ± 0.45 minutos) y una media de 4.7 h (DE: ± 1.4) para los de Berlín. Se comparó el tiempo de realización de USG en Kigali versus tiempo de realización del estudio de imagen por Berlín (tomografía y/o Rx), se encontró una media al realizar el estudio de imagen inicial, tanto para el estudio tomográfico como para la radiografía de tórax de 6:35 horas (DE: ±9:55) y una media de realización de 33.8 minutos (DE: 17.4-50.2) para Kigali. Se correlacionaron los índices SpO2/FiO2 y PaO2/FiO2, y se encontró una correlación lineal casi perfecta con una r de Pearson de 0.99. Se propuso una nueva clasificación de SIRA acorde a SpO2/FiO2, la cual es para leve de 460-310, moderado: 310-160 y severo: menor de 160. Se encontró que el IMC más frecuente en la población estudiada fue el sobrepeso y la obesidad grado I.
Las comorbilidades más frecuentes fueron la DM2 e HAS. La etiología más frecuente de SIRA en este estudio fue la infección pulmonar con 47%.











 text new page (beta)
text new page (beta)