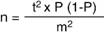Introducción
El síndrome de Distress Respiratorio Agudo (SDRA) es una enfermedad caracterizada por la presencia de alteraciones a nivel del endotelio y epitelio alveolares, secundarios a la respuesta inflamatoria sistémica, que a este nivel se produce por la activación neutrofílica a través de la activación plaquetaria, además de la activación y producción de mediadores de la inflamación como el FNT, MMP8, MMP9, moléculas de adhesión, activación del factor nuclear Kappa Beta, entre otros. Es así, que a través de la acetilación de la ciclooxigenasa producida por la aspirina se ha demostrado disminuir la producción de estos mediadores a nivel pulmonar, disminuyendo de esta forma el proceso inflamatorio llamado Lesión Pulmonar Aguda, que posteriormente se convierte en SDRA.
Los resultados obtenidos en diferentes estudios no han sido estadísticamente significativos, sin embargo aún están en proceso otros protocolos de investigación en diversos países para determinar el papel que juega la aspirina en la Sepsis y el SDRA.
El presente estudio trató de intervenir en este proceso fisiopatológico utilizando la aspirina como tratamiento coadyuvante al tratamiento estándar del SDRA, en donde a través de un consentimiento informado se inició el tratamiento por vía oral a través de una sonda orogástrica por el lapso de 10 días con una dosis de 100 mg/día, tratando de evidenciar si realmente existe mejoría en los pacientes con un SDRA establecido, ya que en estudios previos se logró demostrar la utilidad de la aspirina como profilaxis para evitar la aparición del SDRA en pacientes internados por sepsis y neumonías.
Material y métodos
Enfoque cuantitativo
Tipo de estudio: Ensayo clínico experimental, prospectivo aleatorizado simple, realizado en la Unidad de Cuidados Intensivos durante el periodo comprendido del 01 diciembre de 2015 al 30 de junio de 2016.
Metodología
Se incluyeron los pacientes que ingresaron en la UCI y que reunían los criterios para diagnóstico de SDRA independientemente de la severidad, según los criterios de Berlín. Se dividieron en dos grupos de manera aleatoria. Al grupo aspirina se le administraron 100 mg de ácido acetilsalicílico durante un lapso de 10 días, además del tratamiento estándar para SDRA y el grupo sin aspirina no recibió ácido acetilsalicílico, sólo tratamiento estándar para SDRA.
Muestra:
t = Fiabilidad a 95% (1.96)
P = La prevalencia estimada de la patología es de 25%
m = Margen de error de 0.5%
n = 277
Grupo A: 138 pacientes
Grupo B: 138 pacientes
Grupo A: con aspirina. Recibió tratamiento con aspirina 100 mg vía enteral por un lapso de 10 días, además del tratamiento estándar para SDRA.
Grupo B: sin aspirina. No se le administró aspirina, pero sí recibió tratamiento estándar para SDRA.
Criterios de inclusión: Pacientes mayores de 18 años de edad independientemente del género. Pacientes con diagnóstico de SDRA leve, moderado y grave según los criterios de Berlín. Pacientes bajo ventilación mecánica invasiva. Pacientes que firmaron consentimiento informado.
Criterios de no inclusión: Pacientes embarazadas. Pacientes en tratamiento con estatinas u otro antiagregante plaquetario durante las últimas cuatro semanas.
Criterios de exclusión: Pacientes fallecidos durante el periodo de estudio. Pacientes que retiren consentimiento informado. Pacientes con recuento plaquetario menor de 50,000 plaquetas. Pacientes con signos clínicos evidentes de sangrado. Pacientes con úlcera gástrica activa o sangrado digestivo. Pacientes con antecedente de alergia a la aspirina o cualquier otro antiinflamatorio no esteroideo inhibidor de prostaglandinas. Pacientes con historia de asma bronquial en tratamiento. Pacientes con historia de alteraciones hematológicas conocidas como hemofilia o cualquier otro desorden hemorrágico. Pacientes sin vía enteral expedita (por ejemplo, obstrucción intestinal).
Resultados
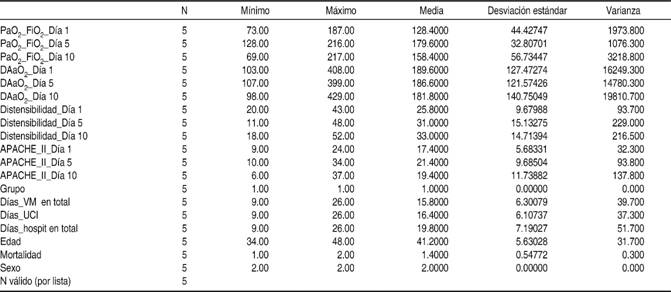
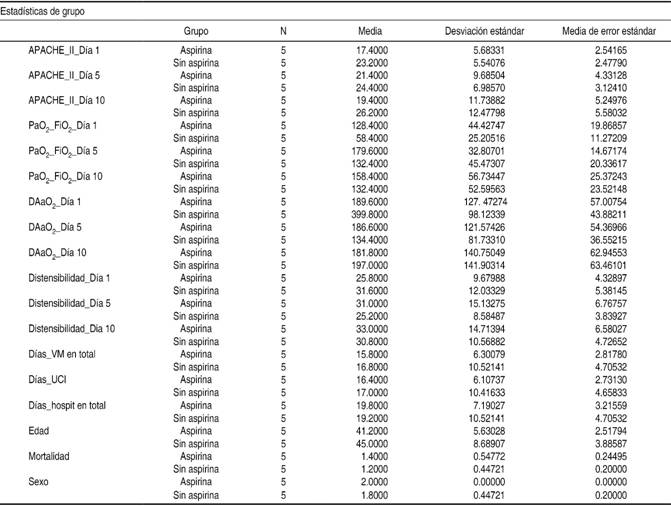
Grupo aspirina. Los pacientes tenían edades de 34, 37, 43, 44 y 48 años (media = 41.2). La mortalidad fue de 60% (n = 3) y todos fueron del sexo masculino.
Grupo sin aspirina. Las edades de los pacientes fueron 39, 40, 41, 45 y 60 años (media = 45). La mortalidad fue de 80% (n =4). Respecto al sexo, uno era femenino y cuatro masculinos.
En el Cuadro I se muestran los estadísticos descriptivos de las variables involucradas para el grupo aspirina y en el Cuadro II los correspondientes al grupo sin aspirina.
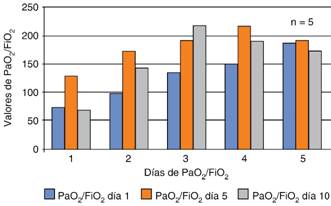
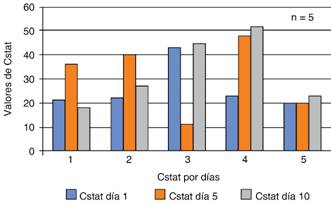
Se realizó el análisis a través de la prueba t de Student para variables independientes (Cuadros III y IV), analizando la homogeneidad de la varianza por medio de la prueba de Levene con valor p > 0.05, por lo cual se consideran todas las variables con homogeneidad de varianzas, con 8 grados de libertad. No se evidencia significancia estadística entre el uso de aspirina y el grupo control para mejorar la PaO2/FiO2 (valor p = 0.097 al día cinco de tratamiento; y una p = 0.474 al día 10, con IC 95%), DAaO2 (valor p = 0.449 al día cinco de tratamiento; y un valor p = 0.869 al día 10, con IC 95%), distensibilidad (Cstat) (valor p = 0.425 al día uno de tratamiento; valor p = 0.477 al día cinco de tratamiento; valor p = 0.793 al día 10, con IC 95%) y su relación con el nivel de APACHE II en ambos grupos (valor p = 0.141 al día uno, valor p = 0.590 al día cinco, valor p = 0.401 al día 10 de tratamiento, con IC 95%), excepto al inicio del tratamiento (día uno) en las variables PaO2/FiO2 y DAaO2 con valor p = 0.015 y 0.019, respectivamente, con IC 95%.
Con respecto a los días de ventilación mecánica (valor p = 0.860, IC 95%) días de estancia en la Unidad de Terapia Intensiva (valor p = 0.914, con IC 95%) y días de estancia hospitalaria (valor p = 0.919, IC 95%). No se observó significancia estadística entre ambos grupos. La mortalidad tampoco evidencia significancia estadística para considerar el tratamiento con aspirina coadyuvante en la disminución de esta variable (valor p = 0.545, IC 95%).
Discusión
El síndrome de distrés respiratorio agudo se caracteriza por presentar daño de la pared epitelial-endotelial alveolar, resultando en una afluencia neutrofílica y edema pulmonar. La activación plaquetaria y secundariamente la captura de neutrófilos desempeñan un papel importante en la propagación de la inflamación del SDRA. Varios estudios en animales han demostrado que la aspirina reduce el edema pulmonar y la lesión pulmonar aguda (LPA). En estudios observacionales pacientes en tratamiento con aspirina antes de su internación hospitalaria tuvieron menos riesgo de desarrollar SDRA.
U Imran Hamid et al. publicaron en 2014 uno de los primeros estudios referentes a la acción antiinflamatoria de la aspirina en el SDRA, en el cual se estudiaron 33 pacientes divididos en tres grupos (aspirina: 75 mg, aspirina: 1,200 mg y un grupo placebo); en dicho estudio se administró aspirina siete días antes de la inhalación de lipopolisacarido (LPS) (50 microgramos), posteriormente se realizó BAL a seis horas de la inhalación del LPS, evidenciándose disminución de los marcadores de inflamación: TNFalfa, MMP8, MMP9, IL6; sin embargo, aún se cuestionaba la acción de la aspirina en pacientes con SDRA establecido. De igual manera The Lung Injury Prevention Study with Aspirin (LIPS-A), un estudio multicéntrico doble ciego randomizado se encargó de probar la eficacia de la aspirina como tratamiento previo a la presencia de SDRA como tal.
En octubre de 2015 se publicó el artículo: Aspirin therapy in patients with acute respiratory distress syndrome (ARDS) is associated with reduced intensive care unit mortality: a prospective analysis en el que se efectuó un estudio de intervención con el uso de aspirina anterior a la UCI así como en pacientes con diagnóstico establecido de SDRA, comprobando la eficacia de la aspirina en la reducción de mortalidad en la UCI, siendo éste el primer estudio que lo demuestra.
En nuestro estudio se obtuvieron 10 pacientes (cinco en el grupo aspirina y cinco en el grupo sin aspirina) en quienes se realizó la evaluación de diferentes variables gasométricas (PaO2/FiO2, DAaO2) y no gasométricas (distensibilidad y la relación de los valores de APACHE II) para determinar si el uso de la aspirina modifica estas variables a través de su acción fisiopatológica ya mencionada. Fue posible evidenciar que el uso de 100 mg de aspirina en pacientes con SDRA (sin importar su gravedad) no disminuyó estadísticamente la tasa de mortalidad, aunque por grupos pudo constatarse que del total de los pacientes del grupo aspirina (n = 5), dos sobrevivieron (60%, n = 2) hasta el alta hospitalaria. De los pacientes en tratamiento con aspirina se evidenció una media de días de ventilación mecánica de 15.8 y de 16.8 para los pacientes sin aspirina, sin valores estadísticos significativos entre ambos grupos, con una media de días de internación en la UCI de 16.4 para el grupo aspirina y de 17 días para el grupo sin aspirina (sin significancia estadística en ambos grupos). De igual forma no se demostró reducción de los días de estancia hospitalaria al comparar ambos grupos. Al comparar la gravedad clínica de ambos grupos, pudo observarse que los pacientes más graves se encontraban en el grupo sin aspirina, en el que 80% (n = 4) murieron.

Figura 5: Días de ventilación mecánica, días de estancia en UCI y días de hospitalización en grupo aspirina.
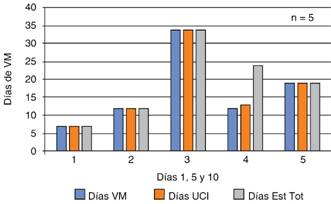
Figura 6: Días de ventilación mecánica, días de estancia en UCI y días de hospitalización en grupo sin aspirina.
Si bien los hechos del mecanismo de acción fisiopatológica de la aspirina están bien determinados, no fue posible demostrar que la acción de este fármaco beneficie a los pacientes con SDRA.
No obstante, en la actualidad se están llevando a cabo estudios de investigación del uso de la aspirina tanto en sepsis como en SDRA: en Australia, el estudio antisepsis (aspirina para inhibir sepsis ACTRN12613000349741) evaluará si 100 mg de aspirina diarios por cinco o siete años podrán disminuir la severidad de la sepsis, así como reducir el ingreso en la UCI y mejorar la mortalidad. En Brasil se efectúa un estudio fase 2 denominado aspirina para el tratamiento de sepsis (NCT01784159) en el que se administran 200 mg de aspirina a pacientes con falla multiorgánica evaluando el score SOFA y los días de ventilación mecánica. El Grupo de Ensayos de Enfermedades Críticas en Estados Unidos (USCIITG) está conduciendo un estudio multicéntrico, aleatorizado doble ciego con la hipótesis de que el tratamiento temprano con aspirina prevendrá SDRA (prevención de la lesión pulmonar aguda con aspirina). Otro estudio que se realiza en el Reino Unido de tipo prospectivo aleatorizado fase 2 denominado aspirina como tratamiento para SDRA (STAR trial NCT02326350), en el cual se administra aspirina dentro de las primeras 72 horas de diagnóstico de SDRA a dosis de 75 mg diarios y a otro grupo placebo por un máximo de 14 días. El objetivo del estudio es medir el índice de oxigenación a los siete días.
Conclusiones
El uso de la aspirina en pacientes con SDRA establecido, independientemente de su gravedad, no disminuye la mortalidad, ni acorta los días de estancia en la UCI o de estancia hospitalaria, como tampoco reduce los días de ventilación mecánica, ni mejora la PaO2/FiO2, la DAaO2 o la Cstat.











 text new page (beta)
text new page (beta)