ABREVIATURAS
A |
sitio aminoacil |
aa |
aminoácidos |
ACAT |
acil-CoA:colesterol aciltransferasa |
ADH |
hormona antidiurética |
ADN |
desoxirribonucleico |
ARNm |
ribonucleico mensajero |
ARNt |
ribonucleico de transferencia |
ATP |
adenosina trifosfato |
C3H3O3 |
piruvato |
Ca3(PO4)2 |
fosfato tricálcico |
CCT CTP |
fosfocolina citidil transferasa |
CO2 |
dióxido de carbono |
DAG |
diacilglicerol |
DGAT |
acil-CoA:diacilglicerol aciltransferasa |
E1 |
estrona |
E2 |
17 β-estradiol |
E3 |
estriol |
FAS I |
ácido graso sintasa I |
GH |
hormona del crecimiento |
GPAT |
glicerol-3-fosfato aciltransferasa |
HCO3 |
anión hidrógenocarbonato |
LFLAT |
lisofosfolípido aciltransferasa |
NADPH |
nicotinamida adenina dinucleótido fosfato |
O=C-N-H |
enlace peptídico |
OXT |
oxitocina |
P |
sitio peptidil |
p.p |
posparto |
P4 |
progesterona |
PAP |
fosfatasa de ácido fosfatídico |
PLA |
fosfolipasa A |
Plin |
perilipina |
PRL |
prolactina |
TAG |
triacilgliceroles |
UAA |
uracilo-adenina-adenina |
UAG |
uracilo-adenina-guanina |
UGA |
uracilo-guanina-adenina |
INTRODUCCIÓN
La leche de cabra se ha posicionado como un elemento importante de la alimentación humana (Bauman et al., 2006). Su relevancia nutricional radica fundamentalmente en dos componentes: i) la fracción lipídica, formada por ácidos grasos (Harvatine et al., 2009) y ii) la fracción proteica, donde se distinguen las caseínas, las proteínas del lactosuero y las proteínas de la membrana del glóbulo graso (Swaisgood, 2003). El contenido nutricional de la leche de cabra supera al propio de la leche de vaca en lo que respecta al contenido de proteínas (leche de cabra: 3.40 g/100 mL-1 vs leche de vaca: 3.30 g/100 mL-1) y de grasas (leche de cabra: 4.30 g/100 mL-1 vs leche de vaca: 3.95 g/100 mL-1) (Davidson & Stabenfeldt, 2020). Las actuales tendencias en producción y consumo de leche, favorecen la concentración lipídica y proteica sobre la cantidad de L o kg de leche producidos (Manterola, 2011), atendiendo los hábitos alimenticios de una creciente población urbana (Vidal, 2013). Las empresas captadoras de leche de cabra destinan este producto principalmente a la elaboración de quesos (National Chamber of Industrial Milk, 2021). Por esta razón, es necesario incrementar nuestra comprensión sobre el metabolismo involucrado en la producción de leche de cabra y sus contenidos lipídicos y proteicos (Heid & Keenan, 2005; Kumar et al., 2009). Por lo tanto, esta revisión analiza la anatomía e histología de la glándula mamaria. Su desarrollo como órgano productor de leche a través de cuatro etapas: i) mamogénesis, ii) lactogénesis, iii) galactopoyesis, y iv) involución. Continuando con la eyección de la leche y su control hormonal, y para fundamentar la bioquímica básica de la síntesis de lípidos y proteínas de leche, al final se presenta información sobre los procesos de lipogénesis y proteogenesis láctea.
I. Anatomía e histología de la glándula mamaria
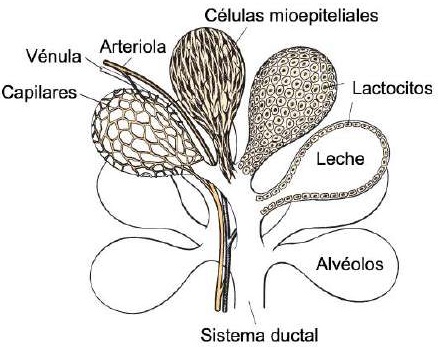
Las cabras poseen dos glándulas mamarias independientes, su localización en el cuerpo del animal es inguinal y presentan forma de: i) pera o tipo alargada, ii) oval o tipo Alpino, y iii) globular o tipo Saanen (Menzies, 2021). Desde el punto de vista histológico, cada glándula mamaria está compuesta por dos tejidos: i) el parénquima cuyo origen es el ectodermo embrionario, y que incluye lactocitos o exocrinocitos lácteos y células mioepiteliales (Lawhead & Baker, 2017), y ii) el estroma cuyo origen es el mesodermo embrionario, y que incluye vasos sanguíneos, vasos linfáticos, tejido adiposo, tejido conjuntivo y tejido nervioso (Baljit, 2017).
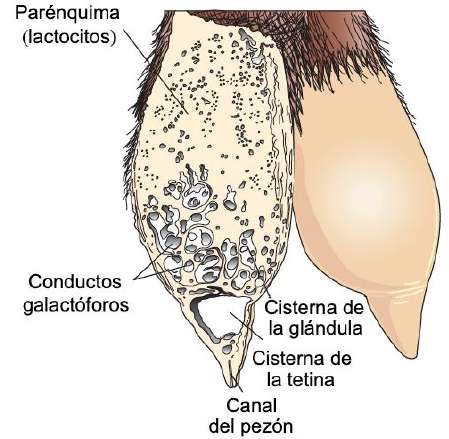
El parénquima se desarrolla a través de la proliferación de lactocitos que surgen del cordón mamario primario (Menzies, 2021). Los lactocitos presentan receptores para prolactina (PRL) (Baljit, 2017), y eventualmente forman estructuras circulares huecas con una longitud de 100 a 500 µm llamadas alvéolos (Lawhead & Baker, 2017). La pared externa de cada alvéolo está rodeada por capilares arteriales y capilares venosos junto a una capa de células mioepiteliales con receptores para oxitocina (OXT) (Davidson & Stabenfeldt, 2020). La estructura interna de la glándula mamaria está formada por: i) parénquima, ii) conductos galactóforos: intra e inter lobulares y lobulillares dependiendo de su conexión dentro de la glándula mamaria (Reese et al., 2020), iii) lóbulos glandulares (Figura 1), formados por lobulillos con 150 a 220 alvéolos lácteos, iv) células mioepiteliales, v) vénulas, vi) arteriolas, vii) capilares, viii) cisternas de la glándula (Figura 2), ix) cisterna de la tetina y x) canal del pezón (Davidson & Stabenfeldt, 2020).
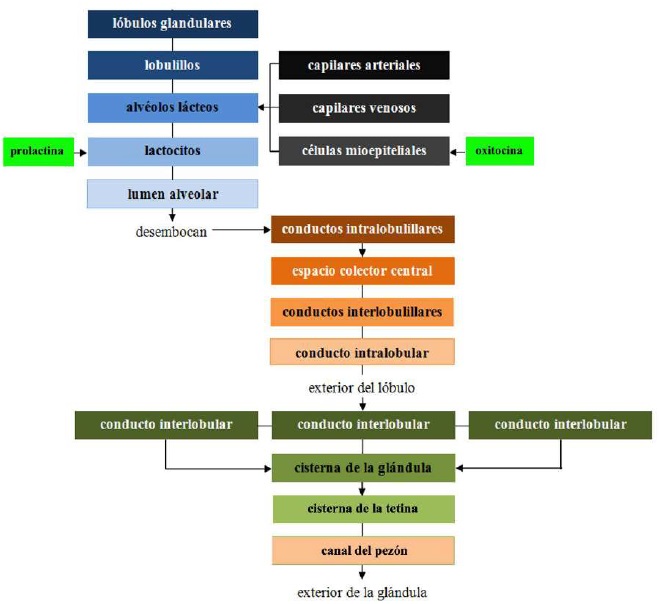
La irrigación de la glándula mamaria se lleva a cabo por la arteria pudenda externa, que pasa a través del canal inguinal y se divide en ramas craneales y caudales (Davidson & Stabenfeldt, 2020). La circulación venosa se realiza principalmente por el círculo venoso formado por la vena pudenda externa, la vena epigástrica superficial caudal y la vena perineal (Lérias et al., 2014). La inervación de la glándula mamaria se lleva a cabo principalmente por fibras nerviosas simpáticas en los primeros y segundos nervios lumbares y los nervios inguinales, su función es el control del flujo sanguíneo en la ubre y la inervación del tejido muscular liso que rodea los conductos galactóforos, los músculos de la cisterna de la glándula, los músculos de la cisterna de la tetina y el canal del pezón (Dee & Magee, 2018). La leche contenida en el interior del lumen alveolar se vacía en pequeños conductos intralobulillares (Figura 3) que desembocan en un espacio colector central, del cual emergen los conductos interlobulillares (Davidson & Stabenfeldt, 2020).
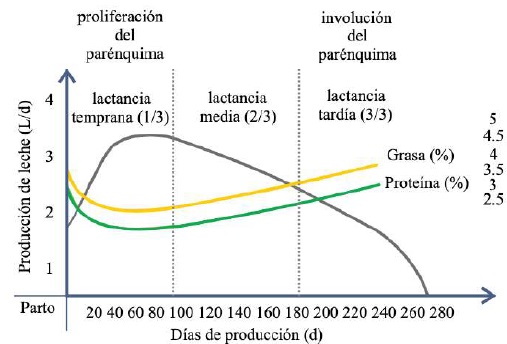
Dentro del lóbulo los conductos interlobulillares se unen para formar un conducto intralobular, que al salir del lóbulo adquiere el nombre de conducto interlobular; estos conductos pueden desembocar directamente en la cisterna de la glándula o unirse a otros conductos interlobulares antes de llegar a ella (Dee & Magee, 2018). Reece & Rowe (2017b) señalaron que el sistema ductal conecta la cisterna de la glándula con la cisterna de la tetina, lo que permite que la leche pase desde el área de formación hasta el área de entrega o canal del pezón. La cisterna de la glándula en los caprinos es de mayor volumen en comparación con la de los bovinos, y permite albergar casi el 70% de la leche producida entre cada ordeño (Martínez & Suárez, 2018). La anatomía e histología de la glándula mamaria se modifican a lo largo de la lactancia, por cambios asociados principalmente con el sistema neuroendocrino (Dee & Magee, 2018). Por lo tanto, se presentan tres etapas en la biología mamaria, caracterizadas por los ciclos de gestación/lactancia: i) proliferación, ii) secreción e iii) involución (Lawhead & Baker, 2017). Aunque la mayor parte de la proliferación ocurre durante la gestación y la mayor parte de la involución ocurre después de la producción de leche, ambas etapas se superponen: la proliferación del parénquima continúa durante la lactancia temprana (1/3 de lactancia) y su involución comienza durante la lactancia tardía (3/3 de lactancia) (Lérias et al., 2014). Evento que en cabras se alcanza de 180 a 280 d, con un pico de producción entre las 8 y 12 semanas posparto (p.p.) (Menzies, 2021) (Figura 4).
Reese et al. (2020) indicaron que cuando la glándula mamaria se encuentra en estado de reposo, los lactocitos presentan una apariencia cúbica, mientras que cuando la glándula mamaria se encuentra en producción láctea su forma es cilíndrica (Davidson & Stabenfeldt, 2020). Además, es importante señalar que una mayor producción láctea presenta una correlación negativa con la grasa y proteína de leche, es decir, una disminución en los L de leche es equivalente a un mayor contenido de sólidos lácteos y viceversa (Martínez & Suárez, 2018).
II. Desarrollo de la glándula mamaria
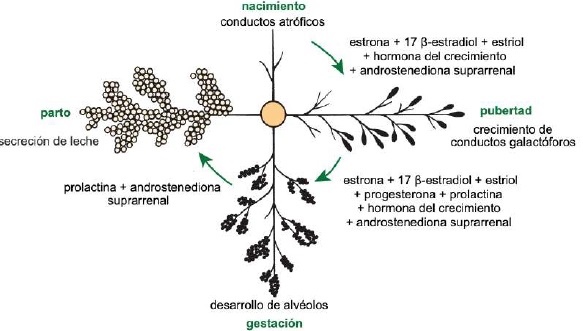
La lactancia se lleva a cabo a través de un ciclo que consta de cuatro etapas: i) mamogénesis, ii) lactogénesis, iii) galactopoyesis, y iv) involución (Baljit, 2017). La mamogénesis inicia durante la vida fetal en el ectodermo embrionario, formando la banda mamaria en la región inguinal después de 30 d de concepción (Reese et al., 2020), la glándula mamaria a los dos meses y la cisterna del pezón a los tres meses de vida fetal (Lawhead & Baker, 2017).
Del nacimiento a la pubertad, la glándula mamaria presenta un crecimiento isométrico con aumento de tejido conjuntivo y deposición de grasa (Dee & Magee, 2018). La actividad ovárica cíclica da como resultado la producción de estrógenos p. ej., estrona (E 1), 17 β-estradiol (E 2) y estriol (E 3). Los E1, E2 y E3 (Reece & Rowe, 2017a) (Figura 5), junto con la hormona del crecimiento (GH) y androstenediona suprarrenal, son responsables del crecimiento de conductos galactóforos (Maldonado et al., 2018). Al respecto Lérias et al. (2014) manifestaron que la utilización de implantes de plástico con estrógenos p. ej., E1, E2 y E3, estimula directa y localmente el crecimiento de los conductos galactóforos y por el contrario la aplicación de implantes con actividad antiestrogénica, inhibe el crecimiento de los conductos galactóforos dentro de áreas circunscritas (Reese et al., 2020).
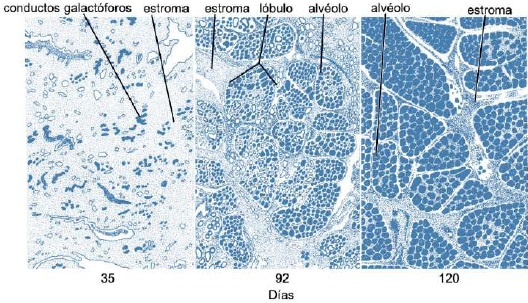
Después de la pubertad, la glándula mamaria presenta un crecimiento alométrico (Goff, 2015) y con cada estro se presenta un ligero desarrollo de alvéolos influenciado por E1, E2 y E3, progesterona (P 4) (Reece & Rowe, 2017a), PRL, GH y androstenediona suprarrenal (Lawhead & Baker, 2017). Información que concuerda con lo reportado por Reece & Rowe (2017b)quienes señalaron una estimulación sinérgica de PRL, androstenediona, E1, E2 y E3, y P4 sobre el crecimiento de la glándula mamaria y el desarrollo lóbulo alveolar (Neville et al., 2002). La mayor parte del crecimiento del parénquima sucede durante la gestación (Goff, 2015), inducido por P4, PRL y androstenediona suprarrenal (Reese et al., 2020). En el día 35 (Figura 6) abunda el estroma, al día 92 se forman lóbulos glandulares con varios lobulillos agrupados; la secreción láctea está presente en el interior del lumen alveolar en algunos lóbulos, y todavía hay estroma considerable, al día 10 los lobulillos de los alvéolos están casi completamente desarrollados (Svennersten & Olsson, 2005); los alvéolos están llenos de secreción láctea y el estroma se reduce a bandas delgadas (Lawhead & Baker, 2017).
Fuente: (Dee & Magee, 2018).
Figura 6 Parénquima de la glándula mamaria caprina durante la gestación
Después del parto y con la expulsión de la placenta, caen los niveles de P4 iniciando la lactogénesis (Saipin et al., 2020). La fase inicial de la lactación se caracteriza por la regulación positiva de la producción de leche, la proliferación celular, y una disminución en el proceso de apoptosis en la glándula mamaria (Henna et al., 2021). Durante este proceso interviene el tejido endocrino adenohipofisario con la secreción de PRL en sus células lactotropas (Dee & Magee, 2018). La PRL es un péptido de 199 aminoácidos (aa) y masa atómica de 23,000 Da, que se une a sus receptores de la familia tirosina-quinasa localizados en los lactocitos y activa transductores de señal y activadores de transcripción asociados con la proliferación, diferenciación, y lactogénesis (Lawhead & Baker, 2017). Por lo tanto, la PRL es indispensable en la producción láctea (Svennersten & Olsson, 2005). Con relación al tema, una investigación que pretendía evaluar el efecto de la inhibición a largo plazo de PRL, reportó que la administración por nueve semanas de un agonista dopaminérgico llamado quinagolida disminuyó la producción de leche, confirmando la importancia de PRL en el funcionamiento de la glándula mamaria (Lacasse et al., 2011).
III. Eyección de la leche
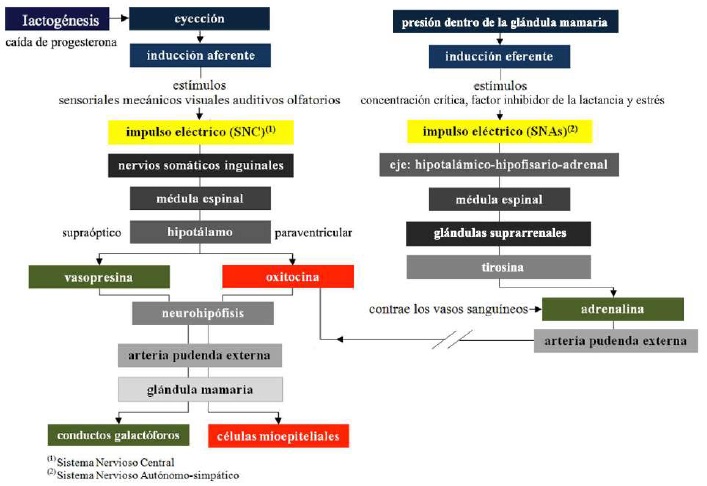
La leche de la cisterna (70% de la leche producida entre cada ordeño), se puede extraer independiente de procesos hormonales, por un mecanismo pasivo (solo por gravedad) (Menzies, 2021). Por su parte, la eyección de la leche alveolar comienza con una inducción aferente (Lérias et al., 2014), mediante células sensoriales en la piel de los pezones y la base de la ubre (Martínez & Suárez, 2018) y estímulos mecánicos en el pezón (Reece & Rowe, 2017b). También puede ser desencadenada por estímulos visuales p. ej., ordeño de otras hembras, estímulos auditivos p. ej., ruido de cubetas o la máquina de ordeño, estímulos olfatorios p. ej., la propia leche, e inclusive llegar a convertirse en un reflejo condicionado (Lawhead & Baker, 2017).
El reflejo eyectolácteo, se convierte en un impulso eléctrico que asciende por los nervios somáticos inguinales a la médula espinal (Figura 7), llegando hasta el núcleo paraventricular del hipotálamo (Davidson & Stabenfeldt, 2020), donde se producen potenciales de acción en pulsos intermitentes, que liberan OXT [péptido de 9 aa (cisteínatirosina-isoleucina-glutamina-asparagina-cisteína-prolina-leucina-glicina)] (Svennersten & Olsson, 2005) almacenado en la neurohipófisis (Dee & Magee, 2018).
El impulso eléctrico que asciende por los nervios somáticos inguinales a la médula espinal, también llega al núcleo supraóptico del hipotálamo (Reese et al., 2020), donde se producen potenciales de acción en pulsos intermitentes, que liberan a la hormona antidiurética (ADH) también llamada vasopresina [péptido de 9 aa (cisteína-tirosinafenilalanina-glutamina-asparagina-cisteína-prolina-arginina-glicina)] almacenado en la neurohipófisis (Thul et al., 2020).
Ambas hormonas viajan por la arteria pudenda externa hacia la glándula mamaria (Davidson & Stabenfeldt, 2020). Las principales funciones de OXT en la glándula mamaria son: i) provocar la contracción de las células mioepiteliales que rodean los alvéolos, para vaciar la leche de los lactocitos al lumen alveolar (Belo & Bruckmaier, 2010), y ii) provocar la contracción de los conductos galactóforos intra e inter lobulares, forzando el flujo de la leche hacia la cisterna de la glándula (Neville et al., 2002; Svennersten & Olsson, 2005).
Por su parte, la ADH actúa sobre el músculo liso vascular provocando vasoconstricción y cambios de presión osmótica y oncótica en los conductos galactóforos facilitando la salida de la leche (Goff, 2015). El aumento de la presión dentro de la glándula mamaria es evidente al minuto del reflejo eyectolácteo, ya que la leche es expulsada de los alvéolos y los conductos galactóforos debido a la contracción de las células mioepiteliales (Lérias et al., 2014). El término utilizado en los mamíferos para describir este fenómeno es “bajada” de leche (Davidson & Stabenfeldt, 2020).
El flujo de la leche incrementa el tamaño de la cisterna de la glándula, originando un aumento de presión (Lawhead & Baker, 2017). Por lo que la velocidad de eyección presenta un control autocrino a nivel glandular por el factor inhibidor de la lactancia (Dee & Magee, 2018). Esta proteína es producida por los mismos lactocitos del parénquima glandular y es secretada junto con la leche en los alvéolos lácteos (Davidson & Stabenfeldt, 2020). Al respecto Bruckmaier & Wellnitz (2008) indicaron que el factor inhibidor de la lactancia presenta dos modos de acción: i) se acumula en la leche hasta alcanzar una concentración crítica que inhibe la eyección, y ii) cuando la leche se acumula dentro de un alvéolo lácteo, extiende su superficie exponiendo los receptores potenciales para el factor inhibidor de la lactancia, permitiendo su acoplamiento y activando la inhibición.
De manera simultánea, el reflejo eyectolácteo puede inhibirse temporalmente por la liberación en el torrente sanguíneo de adrenalina también llamada epinefrina (Svennersten & Olsson, 2005) (Figura 7), como resultado del aumento de presión que genera estrés (Reese et al., 2020). La adrenalina contrae los vasos sanguíneos entre ellos la arteria pudenda externa, imposibilitando la llegada de OXT a las células mioepiteliales que rodean los alvéolos lácteos e inhibiendo indirectamente su contracción (Reece & Rowe, 2017b).
El período de mantenimiento o galactopoyesis, ocurre cuando la constante succión en el pezón continúa estimulando la producción de leche (Bruckmaier & Wellnitz, 2008), las principales hormonas que controlan esta etapa fisiológica son la PRL y la GH (Lawhead & Baker, 2017). Ambas hormonas son importantes para la galactopoyesis, pero una predomina en importancia con respecto a la otra dependiendo de la especie (Baljit, 2017). En los roedores al igual que en los seres humanos la PRL es más importante y en los rumiantes la GH tiene una participación más activa (Goff, 2015).
IV. Lipogénesis láctea
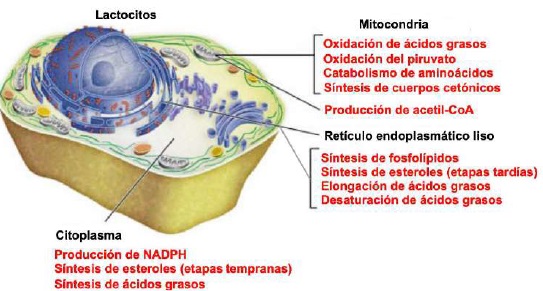
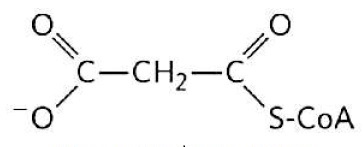
La lipogénesis láctea se desarrolla en diferentes compartimentos celulares (Gartner, 2018). Inicia en la mitocondria de los lactocitos (Friedman & Nunnari, 2014), con la producción de acetil-CoA a partir de la oxidación de ácidos grasos (Nelson & Cox, 2017b), de la oxidación de piruvato (C 3 H 3 O 3) (McDonald et al., 2011) y del catabolismo de los esqueletos carbonados de los aa (Rodwell, 2018) (Figura 8).
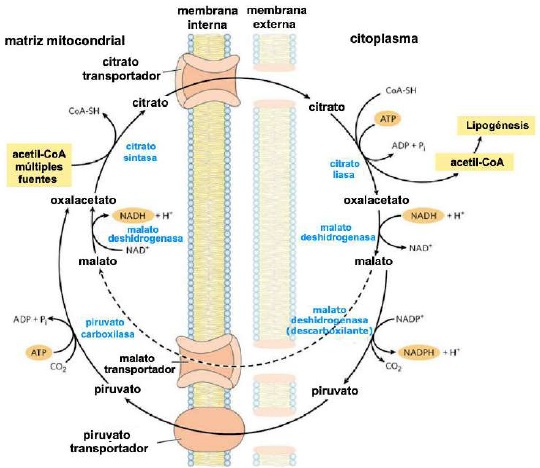
Al igual que otras rutas metabólicas, la síntesis de ácidos grasos es endergónica y reductora (Botham & Mayes, 2018b). Por lo tanto, el proceso utiliza adenosina trifosfato (ATP) como fuente de energía (Botham & Mayes, 2018a) y nicotinamida adenina dinucleótido fosfato (NADPH) como transportador de electrones reducido (Madigan et al., 2019a). En consecuencia, la síntesis de ácidos grasos continua en el citoplasma (Appleton et al., 2013d), donde el NADPH está disponible para la síntesis reductora [es decir, donde la relación (NADPH)/(NADP+) es alta] (Cooper, 2019a). Sin embargo, la membrana mitocondrial interna es impermeable al paso de acetil-CoA (Ellis et al., 2015; Mas, 2018), por lo que una lanzadera para transferencia de acetil-CoA (grupos acetilo) desde la matriz mitocondrial al citoplasma es requerida (Nunes et al., 2013) (Figura 9).
El acetil-CoA intra-mitocondrial reacciona primero con el oxaloacetato para formar citrato (Nelson & Cox, 2017a), en la reacción del ciclo del ácido cítrico catalizada por citrato sintasa (Appleton et al., 2013b). El citrato pasa a través de la membrana mitocondrial en su transportador (Nunes et al., 2013). En el citoplasma, la ruptura del citrato catalizada por citrato liasa regenera acetil-CoA y oxaloacetato en una reacción dependiente de ATP (Ellis et al., 2015; Verschueren et al., 2019). El oxaloacetato no puede regresar directamente a la matriz mitocondrial, ya que no existe un transportador para él (Nelson & Cox, 2017a). Por lo que, malato deshidrogenasa cataliza su reducción a malato, y éste pasa a través de la membrana mitocondrial en su transportador (Nunes et al., 2013).
En la matriz mitocondrial, malato se re-oxida a oxalacetato catalizado por malato deshidrogenasa para completar la lanzadera (Friedman & Nunnari, 2014). El piruvato producido es enviado a la mitocondria por su transportador, y luego convertido nuevamente en oxaloacetato catalizado por piruvato carboxilasa (Nelson & Cox, 2017a). En el ciclo resultante, se consumen dos moléculas de ATP (por citrato liasa y piruvato carboxilasa) por cada molécula de acetil-CoA suministrada para la lipogénesis láctea (Appleton et al., 2013c).
En el citoplasma la biosíntesis de los ácidos grasos comienza con la participación de un intermediario de tres carbonos llamado malonil-CoA (Mas, 2018) (Figura 10).
La formación de malonil-CoA es a partir de acetil-CoA en un proceso irreversible catalizado por la biotina carboxilasa (Nunes et al., 2013). En esta reacción de dos pasos un grupo carboxilo derivado del anión hidrógenocarbonato (HCO 3 -), se une a un nitrógeno del anillo de la biotina en una reacción dependiente de ATP (Botham & Mayes, 2018a), activando el dióxido de carbono (CO 2) (Mas, 2018). El grupo biotinilo sirve como portador temporal de CO2 (Nelson & Cox, 2017a), y parte de la proteína transportadora y el brazo largo y flexible de biotina giran para transportar el CO2 activado desde de la biotina al acetil-CoA produciendo malonil-CoA (Cooper, 2019a).
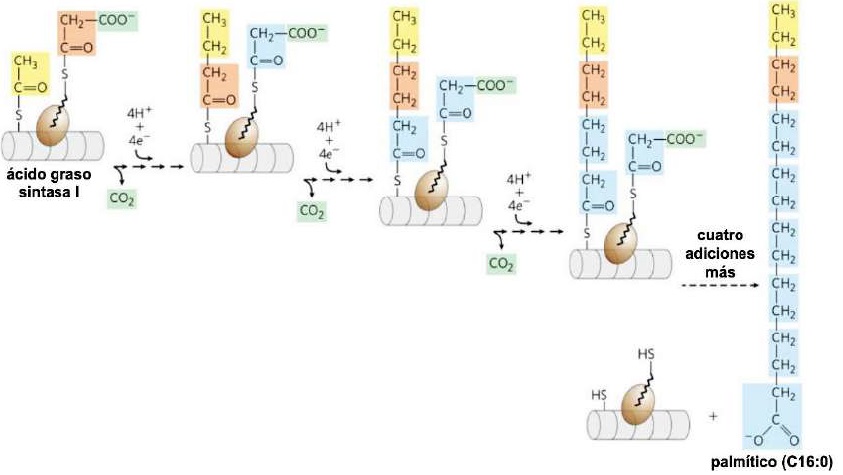
A partir de malonil-CoA la lipogénesis se realiza mediante el complejo proteico ácido graso sintasa I (FAS I) (Suburu et al., 2014). Este sistema realiza síntesis, reducción, deshidratación y de nuevo reducción concentrando grupos de malonil-CoA con acetilCoA, con pérdida de CO2 en cada paso (Belew et al., 2019). Después de cada adición de dos carbonos, las reducciones convierten la cadena en crecimiento en un ácido graso de cuatro, luego seis, luego ocho carbonos, y así sucesivamente (Song et al., 2018) (Figura 11). La síntesis de ácidos grasos en FAS I siempre alcanza los 16 carbonos (palmítico, C16:0) y no se liberan intermediarios (Chandel, 2021).
El palmítico, abandona el FAS I y puede ingresar en el retículo endoplasmático (Olarte et al., 2020), para ser elongado (acoplando nuevos carbonos para alargar la cadena) (Balla et al., 2019) y desaturado (introduciendo enlaces dobles cis entre sus carbonos) para formar ácidos grasos poliinsaturados (Rowland & Voeltz, 2012). En este momento el parénquima de la glándula mamaria experimenta una diferenciación funcional y morfológica denominada lactogénesis I (Reese et al., 2020; Menzies, 2021), e inicia la acumulación de microgotas lipídicas (Ashdown & Done, 2011). Estas gotitas se obtienen de AGNE, liberados de lipoproteínas circulantes por la lipoproteína lipasa ubicada en el lecho vascular de la glándula mamaria (Davidson & Stabenfeldt, 2020) o por ácidos grasos circulantes derivados del tejido adiposo unidos a ALB (Fox et al., 2015).
Después del parto comienza la lactogénesis II (Baljit, 2017), este proceso requiere: i) coordinación y activación de ácidos grasos por acil-CoA sintetasas (Fernandez & Ellis, 2020), ii) síntesis de novo de ácidos grasos de cadena media a partir de GLU (Jones, 2016; Cooper, 2019a), y iii) síntesis de lípidos neutros p. ej., triacilglicerol (TAG), ésteres de COL y diacilglicerol (DAG) (Sanhueza et al., 2012; Nelson & Cox, 2017b), que proporcionan una unión para proteínas accesorias (Reece & Rowe, 2017b), p. ej., CTP:fosfocolina citidil transferasa (CCT) y perilipinas (Plin) (Henry et al., 2015).
En general, se piensa que los glóbulos de grasa láctea se forman a partir de microdominios tubulares del retículo endoplasmático liso (Pol et al., 2014). Sin embargo, a diferencia de otras células lipogénicas p. ej., hepatocitos y células de la corteza suprarrenal (Saheki & De Camilli, 2017), el parénquima de la glándula mamaria está muy enriquecido en retículo endoplasmático rugoso con enzimas para la síntesis de lípidos neutros (Sturley & Hussain, 2012).
Este proceso inicia con la esterificación de ácidos grasos a una molécula de glicerol para formar TAG (Tortora et al., 2019), en cuatro reacciones catalizadas por miembros de glicerol-3-fosfato aciltransferasa (GPAT), fosfatasa de ácido fosfatídico (PAP) y familias de enzimas acil-CoA:diacilglicerol aciltransferasa (DGAT) (Monks et al., 2020). El paso final en este camino es la esterificación de DAG en TAG (Chandel, 2021). Por su parte, la síntesis de ésteres de COL está mediada por acil-CoA:colesterol aciltransferasa (ACAT) (Sanhueza et al., 2012).
Una vez estructurados estos elementos se incorporan al glóbulo graso (Figura 12), junto a carotenoides, vitaminas liposolubles y fosfatidilcolina (Mas, 2018). Dos vías principales contribuyen a la síntesis de fosfatidilcolina: i) la vía de Kennedy para la síntesis de novo de fosfolípidos, reacción catalizada por CCT y ii) el ciclo de Lands (Appleton et al., 2013d; John et al., 2022). En este último se lleva a cabo la remodelación de los fosfolípidos en la membrana del glóbulo graso en reacciones de desacilación/reacilación (Henry et al., 2015; Guoyao, 2017a), catalizadas por fosfolipasa A (PLA) y lisofosfolípido aciltransferasa (LFLAT) (Seoane et al., 2018). Botham & Mayes (2018b) establecieron que, gracias a estos fosfolípidos, las colas apolares se proyectan hacia los glicéridos y las cabezas polares se proyectan hacia el agua.
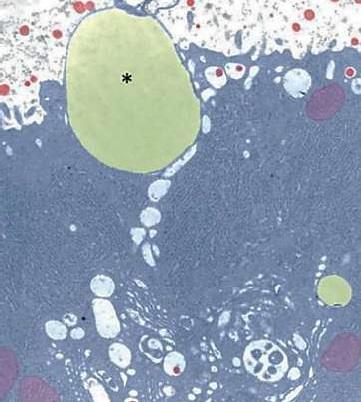
Fuente: (Dee & Magee, 2018).
Figura 12 Micrografía electrónica de un glóbulo de grasa láctea (asterisco) acoplada a la membrana plasmática apical; micelas de caseína (rojo)
La regulación de la lipólisis parece ser la función principal de las cinco proteínas Plin (Lundquist et al., 2020), quienes impiden el acceso de lipasas al glóbulo graso (Zhang & Liu, 2019). A diferencia de las lipoproteínas, los lípidos lácteos no se empaquetan en vesículas en el aparato de Golgi (Wilson et al., 2011), ni se secretan mediante un mecanismo exocitario (Lowe, 2011). Por el contrario, avanzan de manera unidireccional hacia el polo apical del lactocito (Davidson & Stabenfeldt, 2020) y una vez ahí, pasan al lumen alveolar mediante un mecanismo apocrino (Figura 12), en forma de glóbulos de grasa láctea cubiertos por Plin (Lundquist et al., 2020), para continuar su tránsito hacia los conductos intralobulillares y desembocar en un espacio colector central (Davidson & Stabenfeldt, 2020).
V. Proteogénesis láctea
Habitualmente una porción de la proteína alimenticia resiste la proteólisis bacteriana en el rumen y pasa al abomaso sin ser catabolizada (Appleton et al., 2013a), junto con bacterias ruminales adheridas en el alimento fermentado (Guoyao, 2017b). Las células acinares del páncreas traducen hidrolasas p. ej., peptidasa o proteasa, aminotransferasa y nucleasa (Philipps, 2018). En el duodeno, estas enzimas empapan el bolo alimenticio y sus proteínas pierden sus enlaces peptídicos por hidrólisis (Lozano et al., 2005). Este proceso, libera los aa de su estructura polimérica para ser absorbidos a nivel intestinal (Piña & Flores, 2018), transportados al hígado y redirigidos hacia el citoplasma de los lactocitos (Ahern, 2019).
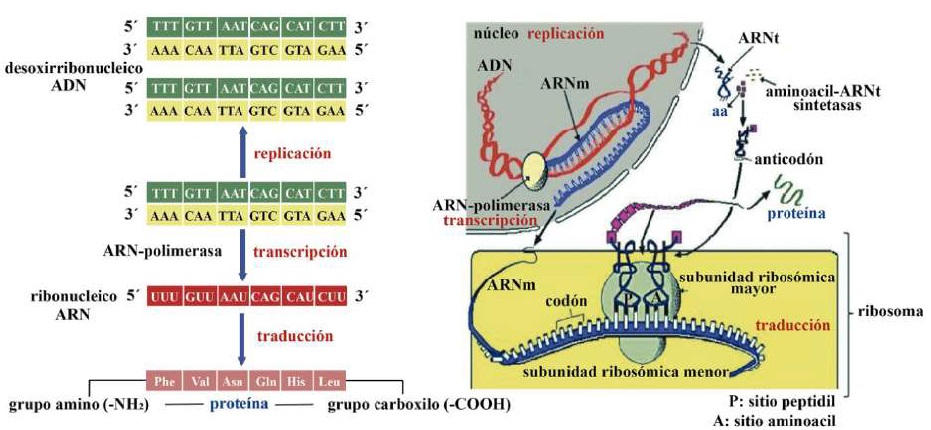
La proteogénesis láctea comienza en el núcleo del lactocito con la transcripción del ácido ribonucleico de transferencia (ARNt) (Madigan et al., 2019b). La ARN-polimerasa efectúa la transcripción del ácido ribonucleico mensajero (ARNm) (Cooper, 2019b), a partir de un segmento de ácido desoxirribonucleico (ADN) que sirve como molde (Singh & Rajeev, 2020). Este segmento de ADN contiene exones (regiones codificantes) e intrones (regiones no codificantes) (Nelson & Cox, 2017c). Antes de salir del núcleo, los segmentos que corresponden a los intrones se cortan (Weil, 2018b) y los segmentos que corresponden a los exones codificantes se empalman (Madigan et al., 2019b). A continuación, ARNt y ARNm salen del núcleo e ingresan al citoplasma (Weil, 2018a). En este momento se promueve la traducción proteica en los ribosomas con tres pasos principales: i) iniciación, ii) elongación y iii) terminación (Nelson & Cox, 2017c) (Figura 13).
El ARNt transporta los aa del citoplasma hacia los ribosomas (Weil, 2018b) y para garantizar que el ARNt lleve los aa correctos, cada ARNt contiene una secuencia específica de tres bases nitrogenadas llamada anticodón (Lozano et al., 2005). En el caso del ARNm su secuencia específica de tres bases nitrogenadas se llama codón (Angov, 2011). Los ribosomas contenidos en los lactocitos del parénquima glandular son los organelos encargados de la traducción de los diferentes tipos de caseínas p. ej., αS1CN, αS2-CN, β-CN, y κ-CN (Doherty & Doudna, 2000). Un lactocito puede tener miles de ribosomas (Ingolia, 2014), y su número aumenta con la proliferación del parénquima glandular durante la lactancia temprana (1/3 de lactancia) (Reese et al., 2020) y su involución comienza durante la lactancia tardía (3/3 de lactancia) junto con la disminución de leche (Davidson & Stabenfeldt, 2020).
Cada ribosoma consta de dos subunidades el sitio peptidil (P) y el sitio aminoacil (A) (Ingolia, 2014), que se asocian para el emparejamiento de bases codón-anticodón (Weil, 2018a) y se disocian durante la terminación de la traducción (Swaisgood, 2003). El sitio A es donde se acopla el primer ARNt cargado de aa (Madigan et al., 2019b). El sitio P es donde la cadena polipeptídica en crecimiento se une al ARNt anterior (Piña & Flores, 2018). Durante la formación del enlace peptídico (O=C-N-H) la cadena en crecimiento se mueve hacia el ARNt en el sitio A (Nelson & Cox, 2017c). Después de la elongación el ARNt que contiene el polipéptido se transloca del sitio A al sitio P (Madigan et al., 2019b), liberando así el sitio A para un nuevo ARNt cargado de aa (Lozano et al., 2005) (Figura 13). En cada translocación, el ribosoma avanza tres nucleótidos (un codón) a lo largo del ARNm (Appleton et al., 2013a), exponiendo un nuevo codón en el sitio A (Weil, 2018a).
La precisión en la translocación es esencial para la exactitud de la proteogénesis láctea (Weil, 2018a). Es decir, el ribosoma debe moverse exactamente un codón en cada paso o la fidelidad de la traducción se vería comprometida (Angov, 2011).
La traducción proteica termina cuando el ribosoma alcanza un codón de finalización p. ej., uracilo-adenina-guanina (UAG), uracilo-adenina-adenina (UAA) y uracilo-guaninaadenina (UGA) (Weil, 2018a), ya que ningún ARNt se une a un codón de estos (Piña & Flores, 2018). En su lugar, los factores de liberación reconocen a UAG, UAA y UGA
(Nelson & Cox, 2017c) y separan el polipéptido adjunto del ARNt final (Lozano et al., 2005), liberando las caseínas terminadas (Davidson & Stabenfeldt, 2020). A continuación, se libera el ARNm y puede volver a ser leído por otros ribosomas (Madigan et al., 2019bb), y las subunidades ribosómicas se disocian y quedan libres para formar nuevos complejos de iniciación y repetir el proceso (Pacheco et al., 2021). Por último, en el aparato de Golgi, se realiza la glucosilación de las caseínas (unión con lactosa) (Wilson et al., 2011) y durante su desplazamiento a través del citoplasma se acopla fosfato tricálcico [Ca 3 (PO 4 ) 2] y otros iones para formar una estructura llamada micela (Reese et al., 2020), que será exportada al lumen alveolar (Dee & Magee, 2018), para continuar su tránsito hacia los conductos intralobulillares y desembocar en un espacio colector central (Davidson & Stabenfeldt, 2020).
La fracción proteica se divide en 20% para proteínas solubles o del suero donde destacan: i) β-lactoglobulina (unión de retinol y ácidos grasos y posible antioxidante) (McKerchar et al., 2023), ii) α-lactoalbúmina (producción de lactosa, transporte de calcio, inmunomodulador y anticancerígeno) (Diao et al., 2022), iii) inmunoglobulinas IgA, IgM e IgG (protección inmunitaria) (Nayik et al., 2022), iv) lactoferrina (antibacteriano, antioxidante, inmunomodulador, absorción de hierro y anticancerígeno) (Sansi et al., 2022), y v) lactoperoxidasa (antibacteriano) (Lérias et al., 2014). Todas las proteínas solubles presentan una mayor proporción de leucina, isoleucina y valina (Ahern, 2019).
El 80% de la fracción proteica corresponde a las proteínas insolubles o caseínas cuya función es transportar y aglutinar minerales, principalmente calcio y fósforo (Dhasmana et al., 2022). La concentración de αs1-caseína y αs2-caseína es menor en la leche de cabra que en la leche de vaca, la fracción de β-caseína es mayor y la cantidad de y κcaseína es igual al de la leche de vaca (Saikia et al., 2022). La αs-caseína es la principal proteína que se encuentra en la leche de vaca, mientras que el principal factor proteico que se encuentra en la leche de cabra es la β-caseína (Dhasmana et al., 2022). Todas las proteínas insolubles presentan una mayor proporción de histidina, metionina y fenilalanina (Ahern, 2019).
CONCLUSIONES
En los últimos años, el cambio en la comercialización de la leche hacia una estructura de precios estandarizada a partir de la concentración lipídica y proteica requiere un mayor conocimiento de los procesos anatómicos y fisiológicos que ocurren en la glándula mamaria. Las cabras parecen ser la especie menos afectada con respecto a la tensión emocional y la eyección de la leche. El 70% de la leche producida entre cada ordeño se puede extraer independiente de los procesos hormonales, por las características morfológicas y fisiológicas propias de la glándula mamaria caprina. El desarrollo de la glándula mamaria a través de sus cuatro etapas: i) mamogénesis, ii) lactogénesis, iii) galactopoyesis, y iv) involución, determina todos los aspectos del comportamiento del parénquima glandular lácteo. Los lactocitos poseen una elevada complejidad metabólica y una robusta organización microscópica para desarrollar sus sistemas de extracción, aprovechamiento de polisacáridos, lípidos y proteínas y transformación en grasa y proteína láctea. El conocimiento de los procesos anabólicos y catabólicos de estas moléculas permitirá comprender la bioquímica básica de la producción de leche.











 text in
text in