Introducción
Según la FAO, existe una producción anual global de arroz de 741 millones de toneladas, la cual genera, aproximadamente, 148 millones de toneladas de cascarilla, que representan el 20% del peso del grano (Chandrasekhar et al., 2003).
El estado de Morelos se ubica entre los siete mayores productores de arroz en México, con más de 13 mil toneladas en 2017 (Álvarez et al., 2018). Siendo reconocida especialmente la región central, por la calidad de su arroz, con una mayor longitud que ronda los 10.8 mm, una anchura cercana a los 3.0 mm, y un espesor aproximado de 2.0 mm, con un peso mayor a los 36 g en mil semillas al 14% de humedad. Por otra parte, este grano tiene un color predominante del pericarpio, crema claro y sin olor, además de una alta calidad molinera y culinaria, conjugada con una gran adaptabilidad a las condiciones del territorio morelense. Tales atributos han permitido que las variedades de arroz Morelos A92, Morelos A98 y Morelos 2010, concentradas en los molinos de Cuautla, Jojutla y Puente de Ixtla, en Morelos, sean los únicos arroces cultivados, cosechados y envasados, incluidos en la Denominación de Origen, “Buenavista”, “Soberano” y “Perseverancia de Jojutla” (Salcedo et al., 2012).
La cascarilla de arroz es una materia prima de biomasa con alto potencial para la fabricación de productos de valor agregado. Es precisamente uno de los residuos agrícolas, que se encuentra disponible en los arrozales en grandes cantidades y es un residuo industrial originado por la trilla del arroz y un contaminante ocasional (Ludueña et al., 2011).
Dicha cáscara se considera un desperdicio, compuesto por aproximadamente 35% de celulosa, 25% de hemicelulosas, 20% de lignina, 17% de ceniza (principalmente 94% de sílice en peso) y 3% de cera (Bhardwaj et al., 2014). La recolección y eliminación de la cáscara de arroz es difícil y generalmente bajo una agricultura sustentable, los pequeños productores prefieren su dispersión en campo junto a la paja, o simplemente lo queman como fuente de energía. Esta práctica, junto con otras acciones agropecuarias intensivas, como la cría de ganado y el uso de fertilizantes, emiten el mayor porcentaje de CH4 provenientes de actividades antropogénicas (Sinha y Singh, 2020). En aquellos territorios con áreas intensivas, el arroz es llevado a molinar y la cascarilla se almacena a granel en grandes cantidades, con muy bajo peso específico (100 kg m-3), se convierte en un contaminante ambiental que por su composición y alto contenido de sílice (SiO2), se hace indigerible para el consumo animal. Constituye un desecho agroindustrial liberado al medio ambiente en alrededor de nueve millones de toneladas por año. Con un elevado costo, un impacto perjudicial para el medio ambiente y un contaminante de las fuentes de agua. Aunque a veces se ha manejado como combustible, es un material totalmente inadecuado para este uso, por su elevada resistencia al fuego, conviertiéndolo en basura (Tong et al., 2018).
Durante el siglo XXI se le ha dado mucha importancia a los composites reforzados con fibras naturales, y han ganado atracción debido a su naturaleza ecológica y biodegradable. Teniendo como base la celulosa, polímero natural abundante, extraíble de plantas o de materiales vegetales, o de residuos agroindustriales, con buenas propiedades mecánicas como alta resistencia a la tracción y elasticidad (Phanthong et al., 2018 y Kaur et al., 2018).
La celulosa está constituida por hemicelulosa, lignina, pectina y cera, en la pared de la célula vegetal natural. La celulosa cristalina está incrustada con estas sustancias, que dificultan la obtención pura de este polisacárido (Rachtanapun et al., 2012). Actualmente, los residuos agrícolas celulósicos son materiales que pueden ser sostenibles, verdes y respetuosos con el medio ambiente (Maleki et al., 2017), han sido ampliamente desarrollados para la extracción de nanocelulosa (Zhou et al., 2013 y Johar et al., 2012). Esta nanopartícula ha sido obtenida de diversas fuentes, desde fibras de madera, hasta desechos agroindustriales (Satyanarayana et al., 2009 y Flauzino et al., 2013), como también de la propia cáscara de arroz (Ludueña et al., 2011; Rosa et al., 2012). Para lograrlo se han utilizado varios procesos para extraer nanofibras altamente purificadas de materiales celulósicos. Estos métodos incluyen tratamientos mecánicos, como criotrituración (Chakraborty et al., 2005), trituración (Abe et al. 2007) y homogeneización a alta presión (Nakagaito y Yano, 2004), tratamientos químicos, como la hidrólisis ácida (Araki et al., 2000; Liu et al., 2010), tratamientos biológicos, como la hidrólisis asistida por enzimas (Hayashi et al., 2005; Henriksson et al., 2007), oxidación mediada por TEMPO (Iwamoto et al., 2010; Saito et al., 2009) y métodos sintéticos y de electrohilado (Frenot et al., 2007), así como por la combinación de varios de los métodos antes mencionados. Más recientemente, Rezanezha et al. (2013) mostraron evidencias de un ligero efecto sobre la descomposición térmica de la nanocelulosa con empleo de tratamiento ultrasónico.
Por lo anteriormente expuesto, el objetivo de este trabajo fue la obtención y caracterización de celulosa a partir de la cascarilla de arroz (Oryza sativa L.), Var. “Morelos A-2010”, usando un tratamiento alcalino con NaOH, un blanqueamiento, un pretratamiento ácido con HCL y, por último, una hidrólisis ácida para la síntesis de nanocelulosa y tratamiento ultrasónico.
Materiales y métodos
Material vegetal
Se visitó el molino de arroz de Cuautla durante el 2020, el cual produce la marca ‘Buena Vista’, en el estado de Morelos; ahí se obtuvo la muestra de cascarilla de arroz variedad “Morelos A-2010”, como materia prima para la síntesis.
La cáscara de arroz se lavó rigurosamente con agitación a temperatura de 65 ºC durante 1.30 h, con agua destilada para eliminar materiales extraños. Acto seguido, se secó y se almacenó en un recipiente de cristal hermético para evitar contaminaciones de microrganismos. Para el ensayo, la cascarilla fue triturada convirtiéndola en partículas más finas, para lo cual se utilizó una licuadora común, y luego un tamizado con 5, 10, 30 y 50 mallas, conformándose cuatro tratamientos y tres replicas (Santos y Silva, 2019).
Caracterización de cascarilla
En la caracterización de la cascarilla de arroz se aplicaron diferentes fórmulas (Tabla 1), las que posteriormente fueron comparadas con la literatura para verificar el contenido presente en el material de partida (Santos y Silva, 2019).
Tabla 1 Caracterización de cascarilla de arroz Var. “Morelos A-2010” procedente del molino de Cuautla, Morelos, con elementos, fórmulas y condiciones de los ensayos realizados.
| Contenido | Fórmula para cálculo (%) | Condiciones del ensayo |
|---|---|---|
| Lignina |
|
1
g 15 mL H2SO4 72% 12 h (72%) al 3% 360 mL de agua destilada. |
| Hemicelulosa | % Hemicelulosa = % Holocelulosa - % Celulosa | Cálculo diferencial |
| Holocelulosa |
|
2 g 63 mL de clorito de sodio 0.94%, 7 gotas de ácido acético glacial, baño María a 80 °C |
| Ceniza |
|
2 g mufla por 2 horas a 600 °C |
| Humedad |
|
2 g 103° ± 2 °C |
| Sílice |
|
10 ml de
ácido clorhídrico (HCl) 4 N |
| Celulosa |
|
1 g de
holocelulosa 5 mL de NaOH 2.5 mL de hidróxido de sodio al 17.5%. |
Fuente: Elaboración de los autores.
Cinética de la reacción del proceso de obtención de celulosa
Se partió de 30 g de cascarilla de arroz con 300 ml de NaOH al 5% de concentración, en una relación cascarilla/solución de 1/10, una vez iniciado el proceso de cocción, se retiró una muestra de la mezcla cada 20 minutos, hasta completar cinco muestras, a estas muestras obtenidas se les determinó el contenido de holocelulosa y, por consiguiente, el contenido de celulosa. Según cálculo diferencial (Tabla 1), se dio seguimiento a la obtención y orden de la reacción (Santos y Silva, 2019). La cinética fue expresada en un gráfico, con velocidad instantánea respecto a la concentración y tiempo, donde la pendiente resultante correspondió al orden de la reacción, representando la regresión mediante una línea de ajuste y tendencia R2 (Santos y Silva, 2019).
Extracción de celulosa
En esta primera etapa, se trabajó siguiendo un flujo previsto para la obtención de la celulosa, según protocolos descritos para tratamientos químicos alcalinos (NaOH 5%) (Hossain et al., 2018), blanqueado (NaClO2) al 1% (Kaur et al., 2018) y pretratamiento ácido (HCl) al 0.65% (Jiang et al., 2008).
Hidrólisis ácida
Una vez caracterizada la calidad de la celulosa, se procedió a realizar la hidrólisis ácida para lograr su reducción y obtención de nanocelulosa. Para el tratamiento de hidrólisis, se empleó ácido sulfúrico (H2SO4) al 64%, con una relación celulosa/ácido de 1/10 (p/p) de concentración, con tiempo de reacción de 45 min a 45 ºC de temperatura, y agitación constante (Santos y Silva, 2019). Esta mezcla fue transferida y tratada en un baño ultrasónico a 30 (KHZ) de amplitud, para lograr separar la parte cristalina de la amorfa (Rezanezhad et al., 2013; Hossain et al., 2018)
Espectroscopía infrarroja con transformada de Fourier (FTIR)
Se realizó un análisis espectroscópico FTIR con transformada de Fourier sobre la fibra tratada para evidenciar el efecto de los tratamientos sobre la hemicelulosa y lignina contenida en la fibra. Se empleó un equipo de espectroscopía FTIR marca Perkin Elmer modelo spectrum two empleando 16 barridos en un rango de 600-3800 cm-1.
Las muestras de celulosa obtenida en los tratamientos fueron comparadas con la celulosa cristalina comercial mediante espectroscopía infrarroja con transformada de Fourier (FTIR).
Microscopía electrónica de barrido (SEM)
Se realizó un análisis morfológico empleando microscopía electrónica de barrido (SEM) con un equipo marca JEOL modelo JSM-6010 LA en la que las muestras se preparan al vacío recubiertas con oro para evitar la carga estática y operadas a 20 kV. El análisis morfológico se realizó tanto en la superficie como los finales de la fibra y de los nanocristales. Las condiciones de trabajo fueron descritas por Álvarez et al. (2014) y Santos y Silva (2019).
Calorimetría diferencial de barrido (DSC)
El análisis térmico DSC fue llevado a cabo en colaboración de la Universidad Autónoma de Hidalgo (Instituto de Ciencias Agropecuarias, Tulancingo, Hgo.). El proceso de cristalización de estos materiales fue evaluado por DSC, las muestras se sellaron en cápsulas de aluminio de 40 mL, y fueron llevados de -40 a 180 ºC a una velocidad de calentamiento de 5 ºC/min. (Álvarez et al., 2014).
Resultados y discusión
Caracterización de cascarilla de arroz como material de partida
Mediante el procesamiento descrito en la Figura 1, se realizó el análisis de cenizas y macromoleculares características del material de partida. Como se muestra en la Tabla 2, los mayores porcentajes presentes en la cascarilla de arroz son la holocelulosa (53.8%) y el sílice (70.6%). Lo cual coincide con varios autores como Santos y Silva (2019), Vargas et al. (2013) y Peñaranda et al. (2017), mismos que hallaron hasta 91 y 96%, respectivamente.

Fuente: Elaboración de los autores.
Figura 1 Procedimiento llevado a cabo en el Dpto. DEPI del Instituto Tecnológico Zacatepec (ITZ), para caracterizar la cascarilla de arroz Var. “Morelos A-2010 con la que se obtuvo la celulosa.
Tabla 2 Datos experimentales obtenidos en la caracterización de componentes importantes de la cascarilla Var. “Morelos A-2010” y comparados con la literatura.
| Componente | Experimentación | Reportado | Referencias |
|---|---|---|---|
| Lignina | 7.68% | 6.27-23% | (Johar et al., 2012; Vargas et al., 2013; Santos y Silva., 2019; Peñaranda et al., 2017) |
| Hemicelulosa | 16.98% | 31-33% | (Johar et al., 2012; Santos y Silva., 2019; Peñaranda et al., 2017) |
| Holocelulosa | 53.8% | 56-91.14% | (Vargas et al., 2013) |
| Ceniza | 21.92% | 21-25% | (Vargas et al., 2013) |
| Humedad | 5.72% | 6-9% | (Vargas et al., 2013) |
| Sílice | 70.62% | 86.9-92% | (Santos y Silva; 2019; Vargas et al., 2013; Peñaranda et al., 2017) |
| Celulosa | 36.82% | 19.3-36% | (Johar et al., 2012; Vargas et al., 2013; Santos y Silva., 2019; Peñaranda et al., 2017; An et al., 2020) |
Fuente: Elaboración de los autores.
Por otra parte, se observó que los componentes orgánicos de mayor interés como la lignina (7.68%) y la celulosa (36.82%) tienen porcentajes considerables y son similares a los de otros materiales lignocelulósicos utilizados en la formación de poliuretanos como se ha mencionado. Coincidieron, también, en que la cascarilla de arroz no está caracterizada, como el grano y que las variaciones en la composición dependen de los tipos de arroz y de las diferentes zonas geográficas originarias de los materiales utilizados (Vargas et al., 2013). Detectándose que, en este caso, la cascarilla de arroz Var. “Morelos A-2010” tuvo un alto contenido de celulosa, lo cual representa un excelente material como residuo agroindustrial para la síntesis de nanocelulosa.
Obtención de celulosa
En la Figura 2 se muestran imágenes con las características de la celulosa obtenida. El rendimiento estuvo en correspondencia con el tamaño del grano después de tamizar el material, donde se favoreció el rendimiento a favor del (T2) y (T3) con tamaño de partícula 10 y 30 mallas, respectivamente, los que se diferencian de los demás en las tres fases del proceso. Cuando el grano fue muy grueso como en (T1) o muy fino como en (T4), no favorece el porcentaje, el rendimiento promedio de celulosa estuvo entre 29-41%, coincidiendo con lo reportado por Peñaranda et al. (2017) en cascarilla de arroz con rendimientos de celulosa entre 28-36% (Khan et al., 2020). Otros reportan que la composición química de la cáscara, la fibra de celulosa extraída y su desempeño permiten obtener de la celulosa rangos de hasta 52% con grano largo, 41% en grano medio, y, 39% con grano pequeño (Rashid y Duttab, 2020).

Nota: A la izquierda placa con celulosa. En el centro estructura filamentosa dentada mostrando deshilado inicial (100x a 100µm), y, a la derecha, paquetes típicos (200x a 100µm) con estructuras estriadas en forma de cresta obtenidas de la cascarilla de arroz, después del pretratamiento con HCL 0.65%.
Fuente: Elaboración de los autores.
Figura 2 Procedimiento llevado a cabo en el Dpto. DEPI del Instituto Tecnológico Zacatepec (ITZ), para caracterizar la cascarilla de arroz Var. “Morelos A-2010 con la que se obtuvo la celulosa.
En la placa Petri, se mostró la calidad de la celulosa y su color blanco, indicativo de que se removieron los componentes no celulósicos como describieron algunos autores (Battegazzore et al., 2014).
Obsérvese que los paquetes de fibras de la cascarilla de arroz se separan en fibras individuales y reducen su diámetro considerablemente. Esto se debe al tratamiento previo, que hizo posible remover los componentes no celulósicos de la cascarilla de arroz. La eliminación de estos componentes permite que las fibras se aíslen de manera individual, por la separación de la pared celular primaria, eliminándose fundamentalmente la hemicelulosa y lignina, lo cual coincide con varios autores cuando aplicaron el tratamiento alcalino con NaOH y luego el pretratamiento ácido con HCL (Johar et al., 2012 y Onoja et al., 2019). Otros autores aseguran que la epidermis interior de la cáscara de arroz tiene una superficie lisa, mientras que la superficie exterior de la cáscara de arroz es muy rugosa y presenta estructuras estriadas dispuestas en crestas lineales, puntuadas con cúpulas prominentes (Ludueña et al., 2011), principalmente esta estructura se observó en la variedad de arroz “Morelos A-2010”, típica de grano muy largo y fino (Álvarez et al., 2018).
Cinética de la reacción del proceso de obtención de celulosa
La cinética de la reacción, con la hidrólisis básica para la obtención de celulosa, siguiendo el método diferencial, permitió la obtención del orden de la reacción mediante la representación pendiente resultante (Figura 3) a 45 ºC. La línea de ajuste y tendencia (0.9867), muy próximo a n = 1, implica una pendiente de descenso entre los 60-80 min, lo cual coincide en las tres etapas, cocción con NaOH, blanqueado (Clor), y pretratamiento con HCL. Lo anterior coincide con Santos y Silva (2019) en orden de reacción, difiriendo solo en que estos aplicaron una línea de tendencia exponencial, porque sus valores fueron constantes.
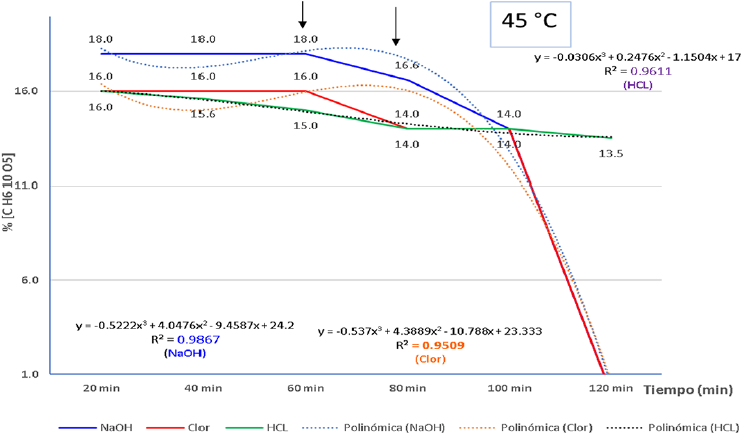
Nota: La figura muestra la pendiente con línea de ajuste y tendencia polinómica grado 2. Aplicación de la fórmula: (Ln m = ln mo- kt), para un orden de reacción cercano (n=1). Las curvas representan la velocidad instantánea de reacción respecto a la concentración de cada reactante, donde la pendiente resultante correspondió al orden de la reacción que tuvo un desempeño óptimo entre los 60-80 min, con el mejor porcentaje de celulosa.
Fuente: Elaboración de los autores.
Figura 3 Cinética del proceso de obtención de celulosa por tratamiento alcalino con NaOH al 5% a 45 ºC, blanqueado con hipoclorito de sodio (comercial) 1% y pre tratamiento con HCL a 0.64%.
Caracterización de celulosa y grupos funcionales
Espectroscopía infrarroja con transformada de Fourier (FTIR)
En la Figura 4, se comparan algunas muestras de celulosa después de ser procesadas con tratamiento alcalino y pretratamiento ácido, visualizándose las señales emitidas en la espectroscopía con transformada de Fourier (FTIR). Estos componentes presentan principalmente alcanos, aromáticos, con diferentes grupos funcionales como éster, cetona y alcohol en sus estructuras.

Nota: Patrón de microcelulosa comercial y tres muestras de celulosa procesadas con tratamiento alcalino (NaOH) y luego pre tratamiento acido (HCL).
Fuente: Elaboración de los autores.
Figura 4 Comparación de celulosa extraída de cascarilla de arroz Var. “Morelos A-2010” mediante espectroscopía de infrarrojo por transformadas de Fourier (FTIR).
En el estudio con celulosa, se observaron bandas desde 3450 cm-1 a 2900 cm-1, tramos relacionados con los enlaces OAH y CAH, respectivamente (Halal et al., 2015).
Algunos grupos funcionales presentes contienen oxígeno, estiramiento OH (3650 a 3200 cm-1) y C = O hemicelulosas estiramiento (1732 cm-1). También están presentes algunos picos característicos de celulosa a 1640 cm-1 (flexión OH del agua adsorbida), en 1420 cm-1 (deformación CH2) y 1375 y 1270 cm-1 (flexión CH). Similares grupos funcionales han sido reportados por Rashid y Duttab (2020). Otros picos registrados a 897 cm-1, C-H vibraciones de flexión y vibraciones de estiramiento C-O-C de enlaces β-glicosídicos en celulosa, integridad cristalina en la estructura (Bano y Negi, 2017). Banda a 1028 cm-1 C-O-C anillo piranoso de celulosa. Banda a 1106 cm-1 C-O-C estiramiento del enlace éter glicosídico de celulosa (De Oliveira et al., 2017; Ditzel et al., 2017). Banda 1372 cm-1, unión de H en celulosa, y banda 1432 -CH2 vibraciones de tijera integridad cristalina en la estructura de celulosa (Bano y Negi, 2017). Banda a los 1640 cm-1, -OH vibraciones en modo de flexión de agua en celulosa y también estiramiento C = C de lignina y hemicelulosa (Ditzel et al., 2017; Johar et al., 2012; Wang et al., 2017). Banda en 2897 cm-1 estiramiento C-H simétrico de hemicelulosa y lignina (Tang et al., 2015; Zhang et al., 2016) y banda a 3326 cm-1 O-H vibraciones de estiramiento de enlaces de hidrógeno intra e intermoleculares de celulosa I (Leite et al., 2017; Naduparambath et al., 2018).
Caracterización de nanocelulosa, grupos funcionales
Los espectros FTIR correspondientes a nanocelulosa, celulosa de origen obtenida y patrón de celulosa cristalino se muestran en la Figura 5. La banda ancha en la región de los 3500-3100 cm-1, indica la vibración de estiramiento de los grupos OH en moléculas de celulosa (Maiti et al., 2013). Este incremento se puede atribuir a una cantidad mayor de grupos OH expuestos por el tratamiento en la obtención de la nanocelulosa (Maiti et al., 2013).

Fuente: Elaboración de los autores.
Figura 5 La figura representa una comparación mediante espectroscopía de infrarrojo por transformadas de Fourier (FTIR), de una muestra de nanocelulosa del tratamiento 4 después de hidrólisis ácida con H2SO4, así como celulosa original, obtenida previamente a partir de la cascarilla de arroz Var. “Morelos A-2010”, junto a un patrón estándar comercial de celulosa.
Se observaron flexiones entre 1604-1632 cm-1 de los grupos OH del agua adsorbida (puentes de hidrógeno) como lo señalaron (Mandal y Chakrabarty, 2011). Coincidiendo con el análisis anterior, los tratamientos 2 y 3 con tamaño de grano intermedio, 10 y 30 mallas, respectivamente, y que también ofrecieron los mejores resultados en el rendimiento de celulosa, también tienen un mejor resultado de la hidrólisis con H2SO4.
Comparación calorimetría diferencial de barrido (DSC) de nanoceluosa
En la Figura 6, se muestran las propiedades del consumo de energía de los nanocristales de celulosa y sus precursores durante la pirólisis, medido en DSC entre rangos de 38 a 298 ºC, donde se observa un punto de fusión para los tratamientos con celulosa y nanocelulosa, pero no para el patrón. Las muestras tratadas después de la hidrólisis con H2SO4 mostraron un comportamiento similar a las celulosas que sirvieron como materia prima en cada tratamiento para formar nanocelulosa (Soares et al., 1995). Cuando la temperatura aumenta por encima de 200 ºC se muestran los picos endotérmicos desde 226 a 273 ºC (Morán et al., 2008).

Fuente: Elaboración de los autores.
Figura 6 Resumen del análisis de los cuatro tratamientos procesados finalmente con hidrólisis ácida: muestran su comportamiento: nanocelulosa, celulosa de origen y patrón. Todos comparados y evaluados por calorimetría diferencial de barrido (DSC).
En el caso del tratamiento 1 (5 mallas), la cristalización ocurre desde los 226.49 ºC con valores de (-0.3042 W/g) para celulosa y a los 240.93 ºC para nanocelulosa con valor de (-0.0411 W/g).
En el tratamiento 2 (10 mallas), la celulosa tiene flexión a los 259.03 ºC con valores de (-0.2938 W/g), en el tercer tratamiento (30 mallas), la celulosa tiene flexión a 271.36 ºC con (-1.101 W/g) y la nanocelulosa a 238 oC (-.0.26 W/g), mientras en el tratamiento 4 (50 mallas), el valor alcanzado por la celulosa fue de 257.5 ºC con (-0.289 W/g), en la nanocelulosa a los 273.08 ºC con valores de (-0.2675 W/g). Lo anterior demuestra que el procedimiento empleado con pretratamiento ácido logra que la celulosa comience a cristalizar antes, para finalmente obtener nanocelulosa posterior al efecto ultrasónico y la hidrólisis ácida.
Caracterización morfológica por microscopía electrónica de barrido (SEM)
En la Figura 7, se aprecia la morfología y estructura de los nanocristales obtenidos mediante hidrólisis ácida (H2SO4) al 64%, adicional al efecto del tratamiento ultrasónico

Nota: Estructura granular a la izquierda (1,200x a 10 µm), a la derecha nanopartículas (7000x a 2 µm) entre (100-300 nm), y, debajo, microtubos (1,200 x a 10 µm), obtenidos mediante hidrólisis ácida y tratamiento ultrasónico.
Fuente: Elaboración de los autores.
Figura 7 Imágenes al microscopio eletrónico de barrido (SEM) de nanocelulosa, extraída de cascarilla de arroz Var. “Morelos A-2010”.
Las microfibras tubulares obtenidas también como subproducto presentan una morfología alargada y filiforme, con tamaño variable, se logran separar gracias al baño ultrasónico, y se diferencian en dos fases que separan la cristalina de la amorfa por completo, corroborándose lo informado por Santos y Silva (2019). Al respecto, Kargarzadeh et al. (2017) informaron de la formación de nanofibrillas de celulosa (CNF) con un diámetro entre 20-50 nm y una longitud entre los 500 a 2000 nm.
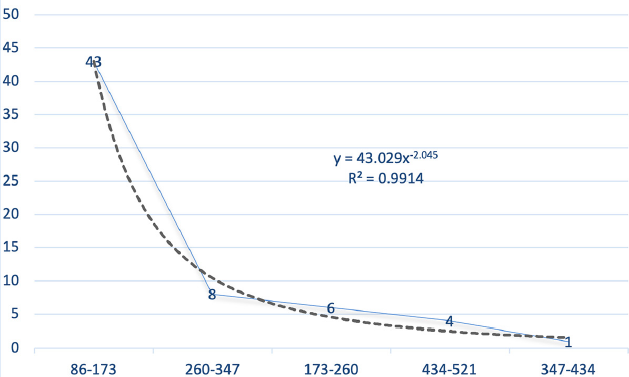
Las mediciones de partículas en (SEM) (Figura 8) permiten diferenciar cinco tipos de longitudes, que van desde los 86 a 521 nm, prevaleciendo una longitud promedio entre 86-173 nm. La línea de tendencia mostrada con (R² = 0.921) indica el decrecimiento en el tamaño de las nanopartículas a partir de 260 nm.
Conclusiones
Se obtuvo celulosa con calidad aceptable, lo cual cumple con los requerimientos de pureza que son necesarios para procesar las muestras y poder continuar hacia la producción de nanocelulosa industrial. Los resultados obtenidos con un pretratamiento con HCL lograron rendimientos potenciales del 29 al 41% de celulosa, usando, preferiblemente, entre 10 y 30 mallas, con una pureza similar al patrón comercial de celulosa microcristalina. Se muestran flexiones de los grupos OH del agua adsorbida (puentes de hidrógeno) con picos entre 1604-1632 cm-1, cristalización óptima 298 ºC, y formación de nanocristales con longitud promedio entre 86-173 nm. Lo anterior evidencia la posibilidad de utilizar este subproducto agroindustrial del arroz Var. “Morelos A -2010”, como fuente para la obtención de nanocelulosa de calidad mediante hidrólisis ácida y asistencia ultrasónica.
Al reconocer la contaminación generada por este residuo en el estado de Morelos, México, se recomienda trabajar en función de comercializar este subproducto agroindustrial y establecer una planta piloto para el manejo del contaminante como fuente de ingresos, empleos y un producto final como la nanocelulosa.











 nueva página del texto (beta)
nueva página del texto (beta)