Introducción
El trasplante renal es la modalidad de terapia de reemplazo renal más costo-efectiva y que confiere mejor sobrevida y calidad de vida a los pacientes, tanto adultos como pediátricos, en comparación con la diálisis1. Según datos del Centro Nacional de Trasplantes (CENATRA), en 2019 y 2020 se trasplantaron en México 2986 y 914 enfermos renales, respectivamente, y a finales de junio de 2021 había 16,801 pacientes renales en lista de espera. Nuestro hospital trasplantó en 2019, 2020 y el primer semestre de 2021 a 38, 14 y 14 receptores renales, respectivamente. Al completar el protocolo de trasplante, el 30-40% de las parejas tendrán incompatibilidad ABO o HLA2. Rapaport propuso en 1986 que a los pacientes que no pueden recibir un riñón de su donante se les ofrezca la posibilidad de intercambiar donantes, de manera que cada uno de los receptores reciba un riñón compatible y los donantes realicen su deseo de donación3.
El primer procedimiento real de intercambio se realizó en Corea del Sur en 1991, seguido por Europa en 1999 y luego los Estados Unidos de América en 2000. La lenta aceptación se debió principalmente a consideraciones éticas y legales3. En México se publicó la primera cohorte de pacientes trasplantados renales con intercambio de donantes en 19984 y posteriormente no fue hasta 2017 cuando se publicaron otros reportes. Algunos centros de trasplante han realizado esta modalidad de manera anecdótica; nuestro hospital inició este programa formalmente a finales de 2018. Actualmente, la donación «pareada» es una alternativa autorizada por el CENATRA.
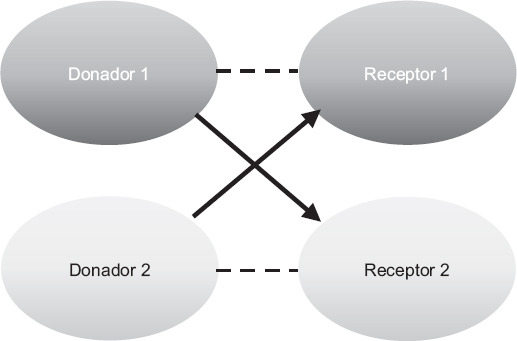
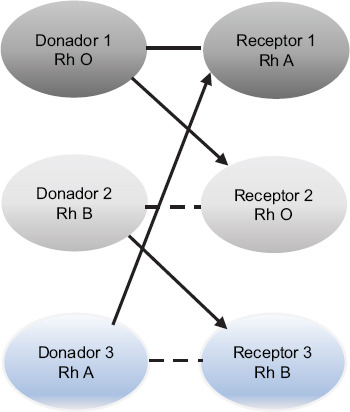
El intercambio de donantes renales se engloba genéricamente bajo el programa de donación renal pareada. Ha habido una evolución en el tiempo de este programa; en sus inicios únicamente se realizó la modalidad más simple, que es un intercambio por pares (cruces sencillos entre dos parejas), introduciendo posteriormente cruces entre tres parejas y los conceptos de cadena de donación renal, donación pareada en dominó, introducción de donantes altruistas en las cadenas, cadenas de donantes altruistas extendidas no simultáneas5, utilización de donantes puente, inicio de cadenas con donantes cadavéricos, intercambio de listas en las cadenas6 (Figs. 1 a 3) y desensibilización dentro del programa. Estas variaciones surgieron para garantizar que los donantes no pudieran retirarse después de que su receptor emparejado recibiera un trasplante renal7.
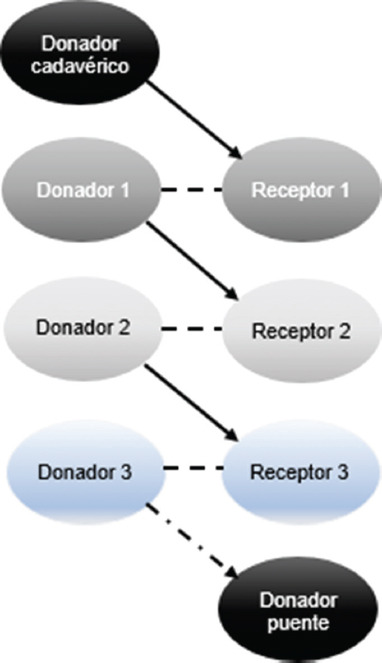
Figura 2 Donante cadavérico iniciando la cadena de trasplante con utilización de donante puente (adaptado de Bahena CL,20186).
Además de facilitar los intercambios entre pares incompatibles, los programas de donación renal pareada ahora fomentan que parejas compatibles ingresen, lo que permite al receptor recibir un riñón de un donante más joven, con mejor pareamiento antropométrico con su donante o con mejor compatibilidad HLA. Agregar pares compatibles a los programas de donación renal pareada también aumenta el número de coincidencias para pares incompatibles o pacientes hipersensibilizados, mejorando así la capacidad de coincidencia del programa en su conjunto8,9.
Para superar los múltiples desafíos de selección, dentro de los programas de donación renal pareada se realizan cálculos matemáticos manuales o bien se utilizan algoritmos informáticos muy eficaces para seleccionar sus intercambios de trasplantes. Siendo n el número total de parejas donante-receptor incompatibles, el número total de combinaciones es igual a (n2 − n)/210.
Los algoritmos matemáticos basados en el tipo de sangre de donante y receptor, el estado de sensibilización y el tamaño del pool de parejas incompatibles pueden determinar la mejor probabilidad de éxito de matching dentro del programa, optimizando el exitoso emparejamiento de donantes y receptores11 de acuerdo con los principios de equidad, utilidad y justicia12.
Independientemente de la complejidad inmunológica y de la búsqueda de un donante compatible entre el pool de donantes de una cadena, también existen desafíos logísticos. En primer lugar, la creación de cadenas lleva tiempo y, por lo general, se realiza de forma electiva, de modo que las operaciones de donantes y receptores se puedan realizar de manera secuencial y en un período razonablemente corto. Por otro lado, los trasplantes de donantes fallecidos se realizan de forma semiurgente y las cadenas que comienzan con donantes fallecidos deben movilizarse de manera urgente y no electiva13.
Método
Este estudio pretende demostrar la experiencia adquirida desde la implementación del programa de trasplante renal bajo donación renal pareada, modalidad que puede aumentar un 25-30% la tasa de donación en los centros hospitalarios sin inferioridad en cuanto a sobrevida del injerto comparado con el trasplante renal de donante vivo dirigido.
Se realizó un estudio observacional, analítico, longitudinal y prospectivo con pacientes trasplantados bajo el programa de donación renal pareada en nuestro hospital, de diciembre de 2018 a julio de 2021. Todas las parejas que ingresaron al programa completaron el protocolo de pretrasplante y fueron evaluadas y autorizadas por el comité interno de trasplante. Se estimó el riesgo de donación para cada donante. Para cada receptor y para cada cruce se calculó la probabilidad de matching-compatibilidad14. Se utilizó el algoritmo de Alvin Roth para realizar los emparejamientos en las cadenas de trasplante. Se solicitó a cada receptor su acta notariada respectiva y se procedió a realizar las nefrectomías simultáneas o secuenciales de los donantes en quirófanos contiguos. La nefrectomía se llevó a cabo con técnica convencional mediante nefrectomía abierta o laparoscópica, los riñones fueron perfundidos ex vivo con solución de preservación y se procedió al implante, el cual fue realizado en la fosa iliaca derecha contralateral al riñón obtenido. Este implante se realizó con anastomosis vasculares término-laterales de vena renal a vena iliaca externa y de arteria renal a arteria iliaca externa (Fig. 4) con surgetes vasculares de Prolene 6-0. Posterior a la reperfusión se realizó la neoureterocistoanastomosis con técnica de Leich-Gregor con surgete de PDS 6-0 y con ferulización sobre un catéter ureteral doble J de 6 Fr.
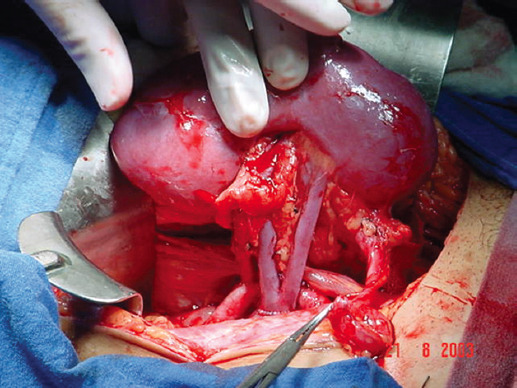
Figura 4 Programa de trasplante renal cruzado. Implante del injerto con anastomosis vasculares término-laterales de vena renal a vena iliaca externa y de arteria renal a arteria iliaca externa.
La inducción a la inmunosupresión se realizó dependiendo del riesgo inmunitario basal mediante basiliximab o timoglobulina, completándose el mantenimiento con ácido micofenólico, tacrolimus y prednisona. Ningún enfermo renal fue desensibilizado previo o posterior al trasplante. Se determinaron basalmente las características demográficas, clínicas y bioquímicas de este grupo de pacientes y mediante valoraciones postrasplante con la periodicidad del protocolo interno del hospital. Se realizó biopsia por protocolo del aloinjerto renal entre los meses 3 y 9, mismas que fueron evaluadas con criterios Banff (2017). Se determinaron la tasa de filtración glomerular (TFG) y la sobrevida del injerto a 1 año postrasplante. También se determinó la TFG a cada donante en el periodo postrasplante.
Análisis estadístico
Las variables manejadas en la base de datos fueron la edad, el sexo, la etiología de la enfermedad renal crónica, el grupo sanguíneo y el Rh, el panel de anticuerpos reactivos, el tipo de inducción a la inmunosupresión, el tipo y el nivel de inmunosupresión de mantenimiento, el índice de masa corporal, la hemoglobina, la creatinina sérica, la TFG en ml/min/1.73 m2 de superficie corporal, las complicaciones y el estatus del injerto a la fecha. Se obtuvieron las variables histológicas de la biopsia por protocolo del aloinjerto renal de acuerdo con la clasificación Banff (2017)15. Se utilizó la prueba t de Student para comparar las medias de la TFG y la sobrevida del injerto en los pacientes trasplantados bajo el programa de donación renal pareada y en una cohorte de pacientes de donador vivo relacionado/no relacionado dirigido en nuestro centro hospitalario. Las medias con desviación estándar y los porcentajes de las variables se calcularon con el programa SPSS 25.
Resultados
Se incluyeron 22 pacientes trasplantados mediante las siguientes modalidades: 1 cadena de 5 parejas, 1 cadena de 4 parejas, 3 cadenas de 3 parejas y 2 cruces de 2 parejas. Dentro de estos, 4 receptores renales fueron trasplantados mediante cadenas que iniciaron con un donante cadavérico. En la cadena de 5 parejas (que ha sido la última realizada) se incluyó el primer trasplante interinstitucional (intercambio de donantes entre dos hospitales) publicado en México.
El 63.6% de los pacientes fueron mujeres (Tabla 1). Se trasplantó preemptive al 9.1% de los pacientes; en la tabla 2 se detallan el nivel de anticuerpos reportado mediante el panel reactivo de anticuerpos (PRA) y el tipo de inmunosupresión de inducción utilizado. La etiología de la enfermedad renal crónica más común fue no determinada, en el 31.8% de los casos, seguida de la hipertensión arterial sistémica en el 27.3%. En el 18.1% de los casos hubo cambio de listas (la cadena inició con un donante cadavérico). La media de la proteinuria postrasplante fue de 150.38 mg/día. El 90.1% de los pacientes se encuentran con el esquema de inmunosupresión de referencia (FK: tacrolimus/MMF: micofenolato de mofetilo/PDN: prednisona) y el 9.1% tienen un esquema minimizado. El 100% de los injertos se encuentran funcionales, incluyendo los receptores hipersensibilizados, con una media de seguimiento postrasplante de 18.0 meses. La media de la TFG fue de 72.5 ± 17 ml/min/1.73 m2. El tiempo de espera medio desde el ingreso al programa cruzado hasta el trasplante fue de 4.8 meses.
Tabla 1 Características clínicas y bioquímicas de los receptores y de los donantes bajo el programa de donación renal pareada
| Variable | Media (± DE) |
|---|---|
| Receptor | |
| Edad (años) | 35.27 (± 12.45) |
| Sexo | |
| Masculino | 8 (36.4%) |
| Femenino | 14 (63.6%) |
| Índice de masa corporal (kg/m2) | 24.77 (± 3.30) |
| Panel reactivo de anticuerpos | |
| Clase I | 25.18% |
| Clase II | 28.68% |
| Donador | |
| Edad (años) | 42.22 (± 10.52) |
| Creatinina posdonación (mg/dl) | 1.18 (± 0.29) |
| TFG posdonación (ml/min/1.73 m2)* | 75.04 (± 15.98) |
DE: desviación estándar; TFG: tasa de filtración glomerular.
*Calculada mediante la fórmula de CKD-EPI
Tabla 2 Características demográficas de los pacientes trasplantados bajo el programa de donación renal pareada
| Receptor | Sexo | Edad (años) | Etiología ERC | Tipo de diálisis | GS y Rh D/R | PRA clase I/II | ADE | XM | HLAmm | CMV | Inducción |
|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | M | 11 | Valvas | HD | O+/O+ | 98/100% | No | Negativa CF | 1A/1B/1DR | D+/R+ | ATG (4 mg/kg/d) |
| 2 | F | 60 | HTAS | DP | O+/O+ | 7/9% | No | Negativa CF | 1A/1B/1DR | D+/R+ | Basiliximab |
| 3 | M | 29 | ND | HD | O+/O+ | 5/8% | No | Negativa CF | 2A/1B/1DR | D-/R+ | Basiliximab |
| 4 | F | 46 | ND | DP | O+/O+ | 68/44% | No | Negativa CF | 1A/1B/1DR | D+/R+ | ATG (1 mg/kg/d) |
| 5 | F | 44 | ND | Preemptive | O+/O+ | 6/0% | No | Negativa CF | 1A/1B/2DR | D+/R+ | Basiliximab |
| 6 | M | 28 | ND | HD | O+/O+ | 10/5% | No | Negativa CF | 1A/1B/2DR | D+/R+ | Basiliximab |
| 7 | F | 37 | IgA | HD | O+/O+ | 6/2% | No | Negativa CF | 1A/1B/1DR | D+/R+ | Basiliximab |
| 8 | M | 28 | ND | HD | A+/A+ | 8/14% | No | Negativa CF | 2A/1B/1DR | D+/R+ | ATG (3.5 mg/kg/d) |
| 9 | F | 24 | ND | Preemptive | O+/O+ | 8/5% | No | Negativa CF | 1A/1B/1DR | D+/R+ | ATG (4 mg/kg/d) |
| 10 | F | 41 | HTAS | HD | O+/O+ | 45/84% | No | Negativa CF | 1A/1B/1DR | D+/R+ | ATG (4.5 mg/kg/d) |
| 11 | M | 31 | HTAS | HD | O+/O+ | 7/10% | No | Negativa CF | 1A/1B/1DR | D+/R+ | Basiliximab |
| 12 | F | 49 | HTAS | HD | O+/O+ | 4/24% | No | Negativa CF | 1A/1B/1DR | D+/R+ | Basiliximab |
| 13 | F | 39 | HTAS | HD | A+/A+ | 30/16% | No | Negativa CF | 1A/1B/0DR | D+/R+ | ATG (3 mg/kg/d) |
| 14 | F | 46 | HTAS | HD | O+/O+ | 100/99% | No | Negativa CF | 1A/0B/0DR | D+/R+ | ATG (5.5 mg/kg/d) |
| 15 | M | 42 | NM | HD | O+/O+ | 68/82% | No | Negativa CF | 1A/2B/1DR | D+/R+ | ATG (4 mg/kg/d) |
| 16 | M | 32 | GNC | DP | O+/O+ | 5/8% | No | Negativa CF | 2A/2B/1DR | D+/R+ | Basiliximab |
| 17 | F | 40 | GNC | HD | O+/O+ | 52/88% | No | Negativa CF | 2A/B/1DR | D+/R+ | ATG (4.5 mg/kg/d) |
| 18 | F | 46 | DM2 | DP | O+/O+ | 2/7% | No | Negativa CF | 1A/1B/1DR | D+/R+ | Basiliximab |
| 19 | F | 30 | LES | DP | O+/O+ | 9/11% | No | Negativa CF | 1A/1B/1DR | D+/R+ | Basiliximab |
| 20 | F | 15 | ND | HD | A+/A+ | 7/5% | No | Negativa CF | 0A/1B/0DR | D+/R+ | Basiliximab |
| 21 | M | 13 | SHUa | HD | A+/A+ | 4/7% | No | Negativa CF | 2A/2B/1DR | D+/R+ | Basiliximab |
| 22 | M | 45 | EPAD | HD | O+/O+ | 5/3% | No | Negativa CF | 1A/1B/1DR | D+/R+ | Basiliximab |
ADE: anticuerpos donantes específicos; ATG: globulina antitimocito; CF: citometría de flujo; CMV: citomegalovirus; D: donante; DM2: diabetes mellitus tipo 2; DP: diálisis peritoneal; EPAD: enfermedad poliquística autosómica dominante; ERC: enfermedad renal crónica; F: femenino; GNC: glomerulonefritis crónica; GS: grupo sanguíneo; HD: hemodiálisis; HLAmm: discordancias de los antígenos leucocitarios humanos; HTAS: hipertensión arterial sistémica; IgA: nefropatía por IgA; LES: lupus eritematoso sistémico; M: masculino; ND: no determinada; NM: nefropatía membranosa; PRA: panel reactivo de anticuerpos; R: receptor; SHUa: síndrome hemolítico urémico atípico; XM: prueba cruzada.
Se incluyeron 2 pacientes sensibilizados (9.1%) con PRA ≥ 25% y 6 pacientes altamente sensibilizados (27.27%) con PRA ≥ 80%.
Hubo dos complicaciones quirúrgicas y una complicación médica, las cuales fueron resueltas de inmediato, con injertos completamente funcionales (Tabla 3).
Tabla 3 Evolución bioquímica e histológica de los pacientes postrasplante renal bajo donación renal pareada
| Receptor | IMC | Hb | Proteinuria (mg/día) | Cr (mg/dl) | TFG (ml/min) | FK (ng/ml) | IS | Criterios histológicos Banff (2017) | Complicaciones | Estatus injerto |
|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 21.3 | 12.9 | 122 | 1.12 | 75 | 5.3 | FK/MMF/PDN | g1, cg0, ci0, ct0, i1, t0, ptc0, ah1, v0 | Ninguna | Funcional |
| 2 | 23.3 | 16.6 | 100 | 1.40 | 40 | 3.9 | FK/MTOR/PDN | g1, cg0, ci2, ct2, i1, t0, ptc1, ah1, v0 | Virus VK | Funcional |
| 3 | 27.4 | 19.8 | 199 | 1.2 | 93 | 6.4 | FK/MMF/PDN | g0, cg0, ci0, ct0, i0, t0, ptc0, ah0, v0 | Ninguna | Funcional |
| 4 | 19.4 | 17.8 | 177 | 1.1 | 59 | 2.7 | FK/MTOR/PDN | g2, cg0, ci1, ct1, i1, t0, ptc3, ah1, v0 | Ninguna | Funcional |
| 5 | 24.7 | 13.6 | 150 | 1.0 | 61 | 5.6 | FK/MMF/PDN | g1, cg0, ci1, ct1, i0, t0, ptc0, ah0, v0 | Ninguna | Funcional |
| 6 | 23.5 | 16.6 | 167 | 1.3 | 77 | 5.3 | FK/MMF/PDN | g1, cg0, ci1, ct1, i1, t0, ptc1, ah2, v0 | Ninguna | Funcional |
| 7 | 25.8 | 14.7 | 248 | 1.1 | 60 | 4.5 | FK/MMF/PDN | g1, cg0, ci1, ct1, i0, t0, ptc0, ah1, v0 | Ninguna | Funcional |
| 8 | 24.2 | 20.6 | 139 | 1.5 | 60 | 6.3 | FK/MMF/PDN | g2, cg0, ci1, ct1, i1, t0, ptc3, ah0, v0 | Ninguna | Funcional |
| 9 | 29.6 | 16.6 | 136 | 0.9 | 91 | 8.2 | FK/MMF/PDN | g0, cg0, ci1, ct1, i0, t0, ptc0, ah0, v0 | Ninguna | Funcional |
| 10 | 23.6 | 19.3 | 229 | 0.8 | 73 | 7.2 | FK/MMF/PDN | g1, cg0, ci0, ct0, i0, t0, ptc0, ah0, v0 | Ninguna | Funcional |
| 11 | 27 | 15 | 102 | 1.2 | 84 | 8 | FK/MMF/PDN | g1, cg0, ci2, ct2, i1, t0, ptc1, ah0, v0 | Ninguna | Funcional |
| 12 | 25.2 | 13.4 | 262 | 0.8 | 89 | 5.6 | FK/MMF/PDN | Ninguna | Funcional | |
| 13 | 25.4 | 10 | 116 | 1.3 | 50 | 4.1 | FK/MMF/PDN | Isquemia ureteral | Funcional | |
| 14 | 27.1 | 13.9 | 232 | 0.9 | 73 | 8.1 | FK/MMF/PDN | Ninguna | Funcional | |
| 15 | 26.4 | 15.4 | 186 | 1.7 | 54 | 12.6 | FK/MMF/PDN | g1, cg0, ci1, ct1, i0, t0, ptc1, ah0, v0 | Ninguna | Funcional |
| 16 | 24.4 | 16 | 192 | 1.33 | 73 | 4.8 | FK/MMF/PDN | g0, cg0, ci1, ct1, i0, t0, ptc0, ah1, v0 | Ninguna | Funcional |
| 17 | 32.4 | 15.6 | 77 | 1.28 | 56 | 5.3 | FK/MMF/PDN | g2, cg0, ci0, ct0, i0, t0, ptc3, ah0, v0 | Ninguna | Funcional |
| 18 | 20.4 | 12.3 | 134 | 0.7 | 102 | 9 | FK/MMF/PDN | Ninguna | Funcional | |
| 19 | 20.1 | 12.3 | 165 | 1 | 64 | 7.7 | FK/MMF/PDN | Ninguna | Funcional | |
| 20 | 23.3 | 11 | 120 | 1 | 65 | 5.3 | FK/MMF/PDN | Ninguna | Funcional | |
| 21 | 21 | 12.8 | 126 | 0.7 | 101 | 5.1 | FK/MMF/PDN | Ninguna | Funcional | |
| 22 | 29.5 | 13.2 | 200 | 1.2 | 95 | 9.5 | FK/MMF/PDN | Linfocele | Funcional |
ah: hialinosis arteriolar; cg: glomerulitis crónica; ci: fibrosis intersticial; Cr: creatinina; ct: atrofia tubular; FK: tacrolimus; g: glomerulitis; Hb: hemoglobina; i: inflamación intersticial; IMC: índice de masa corporal; IS: inmunosupresión; MMF: micofenolato de mofetilo; MTOR: inhibidor mTOR; PDN: prednisona; ptc: capilaritis peritubular; t: tubulitis; TGF: tasa de filtración glomerular; v: arteritis intimal; VK: poliomavirus.
En nuestro hospital se trasplantaron en el periodo de estudio 66 pacientes, de los cuales 40 fueron de donador vivo relacionado/no relacionado pero dirigido, 4 de donador cadavérico y 22 bajo el programa de donación renal pareada, lo que representa un aumento de la tasa de trasplante del 33.33% con la utilización de este novedoso programa (Fig. 5)16.
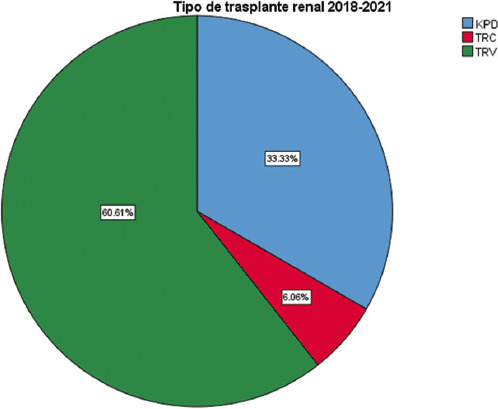
Figura 5 Tipos de trasplante renal realizados en nuestro hospital de diciembre de 2018 a julio de 2021. KPD: donación renal pareada; TRC: trasplante renal cadavérico; TRV: trasplante renal de donador vivo relacionado/no relacionado dirigido (adaptado de Bahena et al., 202216).
Discusión
Según datos del CENATRA, entre 2017 y 2020, en México, el tiempo promedio de espera para recibir un riñón de donante cadavérico fue de 30.2 meses17, y para un trasplante renal de donante vivo fue de 3.38 meses18. En nuestra cohorte de pacientes trasplantados bajo programa cruzado, la media del tiempo de espera fue de 4.9 meses, siendo menor que en lista de espera de donante cadavérico.
Pese a que nuestra experiencia bajo el programa cruzado se limita a 22 pacientes trasplantados renales, nuestro hospital se clasifica, según Massie et al.19, como un centro con muy alta utilización del programa de donación renal pareada.
En el registro canadiense, la media de días desde la participación de un candidato en un ciclo de compatibilidad bajo trasplante renal pareado hasta el trasplante fue de 182 días (rango: 47-1741; media ± DE: 275 ± 17)20, y en la Mayo Clinic (Estados Unidos de América) el tiempo medio de espera desde la inscripción al programa hasta el trasplante fue de 330 días (rango: 178-539)21. Nuestro hospital tiene una media de 147 días desde el ingreso hasta el trasplante bajo este programa, la cual es menor que la reportada en la literatura.
En nuestra experiencia ya realizamos trasplantes renales con cadenas de 4 y 5 parejas, aunque un estudio holandés recomienda que la longitud máxima de una cadena óptima para todos los propósitos prácticos es de 3 parejas, especialmente para los programas de intercambio recién iniciados, puesto que varias cirugías simultáneas pueden limitar las capacidades técnicas y de recursos de varios centros, ya que se requiere una coordinación importante11.
Al comparar la TFG de los pacientes trasplantados bajo el programa de intercambio de donantes, esta fue de 72.5 ml/min/1.73 m2, mayor que la encontrada en una cohorte de 44 pacientes trasplantados en nuestro hospital en el mismo periodo de estudio, pero de donantes vivos relacionados/no relacionados dirigidos (66.56 ml/min/1.73 m2; p = 0.123).
Al analizar la TFG y la sobrevida del injerto libre de rechazo de nuestros receptores pediátricos bajo programa cruzado, son similares a las reportadas por Sypek et al.22 en el registro australiano del programa de intercambio renal pareado pediátrico.
Respecto a la sobrevida del injerto en nuestro centro hospitalario durante el periodo de seguimiento, esta fue del 100% en los pacientes trasplantados bajo programa renal pareado, frente al 97.7% con donantes vivos dirigidos (p = 0.489). Estos datos son semejantes a los reportados por Kute et al.23, quienes demostraron que la sobrevida del injerto es similar al utilizar donación viva relacionada en comparación con la donación bajo programa pareado. Por otro lado, en los 135 receptores renales con 1 año de seguimiento del registro canadiense de donación renal pareada, lass sobrevida del paciente y del aloinjerto fueron del 99% y el 96%, respectivamente. En esa misma cohorte canadiense, la biopsia confirmó una tasa de rechazo agudo del 8%20, comparado con el 9.1% en nuestros pacientes bajo programa pareado (todos estos rechazos fueron únicamente subclínicos).
Cuando se analiza la sobrevida ajustada del injerto renal a 1 año postrasplante, esta fue del 97.3%, el 98.1% y el 97.7% para los receptores sensibilizados con PRA en los grupos de 0-79%, > 80% y > 99.9%, respectivamente24. La sobrevida global del injerto en nuestra cohorte fue del 100% a 1 año de seguimiento.
La deserción de los donantes de nuestra cohorte fue del 0% debido a que solo en el 13.6% de los casos se utilizaron donantes puente y estos fueron asesorados con anticipación sobre el tiempo máximo de espera de 3 semanas para donar su órgano, tal como recomiendan Kher y Kumar25.
Conclusiones
El trasplante renal bajo programa de intercambio de donantes es una opción más para aumentar la tasa de trasplante renal, pero debe realizarse bajo estrictos protocolos intrahospitalarios médicos-éticos y la regulación legal nacional para estar en concordancia con la Declaración de Estambul26. Se debe alentar a los grupos de trasplante a impulsar esta modalidad para integrar programas regionales o nacionales de intercambio de donantes que permitan abatir la lista de espera nacional de enfermos renales y aumentar la tasa de trasplantes renales en México.











 text new page (beta)
text new page (beta)