Introducción
Los tumores fibrosos solitarios son un grupo de neoplasias poco frecuentes de origen mesenquimal que representan el 2% de todas las tumoraciones de tejidos blandos1. Su localización más frecuente es en la pleura, las meninges o las extremidades; sin embargo, pueden encontrarse en cualquier región anatómica asociados a tejidos blandos y vísceras. Del total de estos tumores, únicamente menos del 5% se manifiestan con episodios de hipoglucemia2,3, síndrome paraneoplásico descrito por primera vez por Doege y Potter en 19304,5.
Presentamos un caso de tumor fibroso solitario dependiente de la glándula suprarrenal izquierda asociado a síndrome de Doege-Potter.
Caso clínico
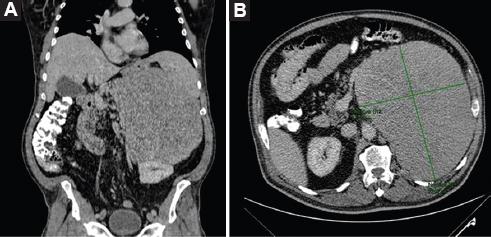
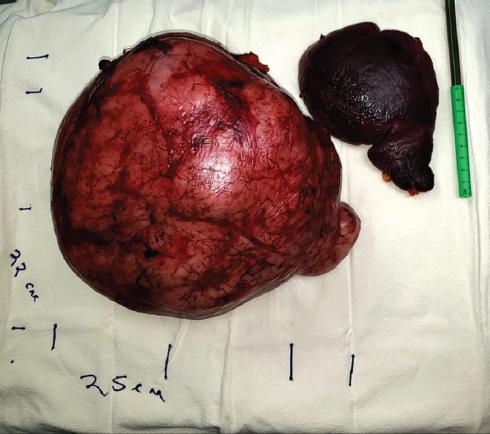
Varón de 71 años con antecedente de hipertensión arterial sistémica de 15 años de evolución, controlado con valsartán y amlodipino, y diabetes mellitus tipo 2 de 15 años de evolución, manejada con sitagliptina y metformina, que fueron suspendidas debido a los episodios de síncope y diaforesis atribuidos a hipoglucemia. Debido a esto acude con su médico por presentar, desde hace 2 meses, episodios de pérdida del estado de alerta en múltiples ocasiones, acompañados de diaforesis, polidipsia, ansiedad y sudoraciones nocturnas. Durante los episodios se documentaron cifras de glucemia de alrededor de 40 mg/dl que respondieron al consumo de alimentos hipercalóricos. Aunado a esto, manifestó disnea de pequeños esfuerzos, distensión y dolor abdominal, mareos, debilidad muscular y pérdida involuntaria de peso de aproximadamente 12 kg en el año previo. Se realizó una tomografía computarizada de abdomen con contraste intravenoso, en la que se observó una tumoración dependiente de la glándula suprarrenal izquierda de 22 × 17 × 20 cm, de aspecto sólido, ejerciendo desplazamiento del bazo, el estómago y el páncreas, así como sobre el riñón correspondiente (Fig. 1). No se observaron datos sugestivos de infiltración periférica. Las pruebas de laboratorio realizadas antes de la intervención quirúrgica mostraron glucemia 44 mg/dl (76-106), insulina sérica < 1.0 UI/ml (2.3-26), péptido C 0.2 mg/ml (0.78-5.19), factor de crecimiento similar a la insulina tipo I (IGF-I) 52.80 ng/ml (35.1-216), factor de crecimiento similar a la insulina tipo II (IGF-II) 220 ng/ml (267-616) y proteína 3 de unión al factor de crecimiento similar a la insulina (IGFBP3) 1.1 mg/l (2.5-5-7). Se realizó la resección del tumor mediante abordaje abierto, con una incisión subcostal izquierda amplia. No se encontró infiltración de las estructuras circundantes, como la cola del páncreas y el colon transverso. Fue necesario realizar una esplenectomía como parte de la resección en bloque. El tumor extraído pesó 3943 g y midió 23.7 × 20.2 × 13 cm (Fig. 2). El diagnóstico de tumor solitario fibroso dependiente de la glándula suprarrenal izquierda fue confirmado mediante inmunohistoquímica, resultando con tinciones intensamente positivas para vimentina, CD99, BCL-2, STAT6 y CD34. El paciente evolucionó de manera favorable en el posoperatorio sin presentar incidentes, con remisión completa de los episodios de hipoglucemia desde el primer día posterior a la intervención. Fue dado de alta al quinto día de posoperatorio, sin complicaciones.
Discusión
Los tumores fibrosos solitarios son un grupo de tumores poco frecuentes de tipo mesenquimal originados en los fibroblastos y miofibroblastos que comúnmente se localizan en la pleura visceral, y representan menos del 2% de todas las masas de tejidos blandos1. Su descripción inicial fue realizada en un tumor de origen pleural por Klemperer y Rabin en 19316. Estos tumores están categorizados con un potencial biológico intermedio, con bajo riesgo de metástasis y un curso clínico relativamente indolente según la Clasificación de la Organización Mundial de la Salud (OMS) de 20027.
Estas lesiones tienen unas características histológicas que se superponen con las de otros tumores de tejidos blandos. Típicamente se componen de células fusiformes bipolares o células de forma ovoide en un estroma de abundante colágeno y alta vascularización, en un patrón similar al de los hemangiopericitomas8. En el estudio inmunohistoquímico son positivos para vimentina, CD34, CD99 y BCL-28-10. Adicionalmente se ha demostrado que los tumores fibrosos solitarios se caracterizan por una mutación de reordenamiento de tipo inversión en 12q13-15, generando así la fusión de los genes NAB2-STAT6, y por lo tanto llevando a la sobreexpresión de la proteína STAT611,12. Actualmente, la OMS los clasifica como tumores de partes blandas7.
Los tumores fibrosos solitarios se pueden encontrar en cualquier región anatómica, siendo la localización intratorácica la más común, seguida por la intraabdominal13,14; sin embargo, se ha descrito en otros lugares, como la cabeza, el cuello, el mediastino, la pelvis y la localización retroperitoneal, que es la más infrecuente10,15,16. Los tumores fibrosos solitarios en el mediastino, el abdomen, el retroperitoneo y la pelvis suelen comportarse de forma más agresiva14.
Su distribución es similar entre hombres y mujeres, aparecen en adultos de todas las edades (en general entre la quinta y la sexta décadas de la vida) y son más frecuentes en población caucásica, seguida de la hispánica, la asiática y finalmente la afroamericana17.
En ocasiones, los tumores fibrosos solitarios se pueden manifestar en primera instancia con síndromes paraneoplásicos, siendo la hipoglucemia refractaria al tratamiento lo más común. Este fenómeno se describe como hipoglucemia de tumores de células no insulares (NICTH, non-islet cell tumor hypoglycemia)18. Cuando el tumor fibroso solitario se acompaña de hipoglucemias constituye el síndrome de Doege-Potter, descrito por primera vez en 19304,5. Ocurre en menos del 5% de todos los casos y se ve principalmente en tumores pleurales y retroperitoneales de grandes dimensiones2,3. El síndrome de Doege-Potter se caracteriza por hipoglucemias refractarias, con valores séricos disminuidos de insulina, péptido C y hormona del crecimiento, además de unas bajas concentraciones séricas de IGF-I frente a unas cifras de IGF-II que pueden ser normales o elevadas19.
La principal causa de este tipo de hipoglucemia es la producción tumoral de IGF-II, un péptido de 7.5 kDa20-22, lo cual resulta en la estimulación de los receptores de insulina (IR-A) y el aumento del uso celular de glucosa. En condiciones normales, el IGF-II circula en un complejo de 150 kDa conformado por IGF-I, IGF-II e IGFBP3, y puede estar asociado a la subunidad ácida lábil23. Los IGF son una familia de hormonas peptídicas y factores de crecimiento que incluyen a la insulina, el IGF-I y el IGF-II, y tienen por lo menos un 50% de los aminoácidos en común con la insulina24. La relación entre el IGF-II y la NICTH fue identificada por Daughaday en 198825 en una paciente con hipoglucemia y con un fibrosarcoma, cuyos valores expresados de ARNm de IGF-II y de péptido IGF-II eran muy elevados.
En la NICTH, los valores elevados de IGF-II son consecuencia de la sobreexpresión tumoral de ARNm de IGF-II, que además da a lugar a precursores inmaduros de IGF-II, big IGF-II y pro-IGF-II, los cuales también pueden interactuar con los receptores de insulina tisulares26. Se ha descrito que la fisiopatología de la NICTH sigue un mecanismo dual: incremento del uso de glucosa celular mediado por IGF-II, big IGF-II o pro-IGF-II, e inhibición de la hormona de crecimiento, disminuyendo la contrarregulación de la hipoglucemia por esta19,26,27. No obstante, se ha descrito que el IGF-II se expresa en el 80% de los tumores fibrosos solitarios aun con valores elevados de ARNm de IGF-II19. Aunque es posible que en estos pacientes las concentraciones séricas de IGF-II estén elevadas, a menudo son normales en cantidad, tal como sucedía en nuestro paciente; sin embargo, los valores de big IGF-II y pro-IGF-II medidos por ensayo de inmunotransferencia son elevados en casos de NICTH, lo que explicaría el origen de la hipoglucemia en los pacientes con valores bajos o normales de IGF-II, o simplemente podría atribuirse al consumo de glucosa por parte del tumor26,28.
El tratamiento inicial debe consistir en aumentar el aporte de glucosa oral e intravenosa para evitar la hipoglucemia. Se ha reportado el uso de glucagón, hormona de crecimiento y glucocorticoides19,29. El tratamiento quirúrgico continúa siendo el manejo definitivo para esta enfermedad, pero se ha reportado la recurrencia hasta 20 años después de la cirugía30; en general, la progresión sin metástasis a 5 y 10 años es del 74% y el 55%, respectivamente, mientras que las tasas de supervivencia específicas de la enfermedad a 5 y 10 años son del 89% y el 73%. La edad del paciente, el tamaño del tumor y el índice mitótico son predictores tanto del tiempo para la metástasis como para la mortalidad específica por enfermedad, mientras que la necrosis pronosticó solo la metástasis17. A pesar de que la mayoría de los tumores fibrosos solitarios suelen ser benignos, entre el 15% y el 20% son agresivos y eventualmente recurrentes31.
Conclusiones
El síndrome de Doege-Potter es un síndrome paraneoplásico poco frecuente que se caracteriza por hipoglucemias graves refractarias al tratamiento, acompañado de un tumor fibroso solitario. Se debe tener la sospecha clínica ante un paciente con antecedente de hipoglucemias de difícil control, ya que dicha sospecha nos puede llevar a encontrar la causa subyacente. El tratamiento curativo de los tumores fibrosos solitarios y del síndrome de Doege-Potter continúa siendo la resección quirúrgica, aunque se puede apoyar de manera inicial aumentando la ingesta oral de glucosa o por vía intravenosa.











 text new page (beta)
text new page (beta)