Introducción
El grupo de los coronavirus pertenece a la familia Coronaviridae, del orden de los Nidovirales, virus compuestos por una estructura de RNA. Existen dos subfamilias que infectan al ser humano: alfa y beta1. La subfamilia alfa infecta las vías aéreas superiores y provoca síntomas leves, mientras que los virus beta, como el SARS-Co-V y el MERS-Co-V, son altamente patógenos y capaces de provocar un síndrome respiratorio agudo grave (SARS, por sus siglas en inglés)2. En diciembre de 2019, en Wuhan, Hubei, China, se identificó un nuevo beta coronavirus, el SARS-CoV-2, asociado a un brote de neumonía grave que posteriormente la Organización Mundial de Salud (OMS) denominó COVID-19 (Coronavirus Disease 2019)3.
El espectro clínico de la COVID-19 puede ir desde leve, definido por la OMS por la ausencia de neumonía o hipoxia, hasta grave, cuando se presenta como neumonía con hipoxemia, la cual en ocasiones puede progresar a síndrome de insuficiencia respiratoria aguda4-6.
Desde el comienzo de la pandemia, un tema de cuestionamiento frecuente ha sido el papel de la inmunosupresión en los pacientes receptores de trasplantes en cuanto a la influencia sobre la gravedad o el desenlace de la COVID-197,8. Un estudio demostró que los pacientes con inmunosupresión crónica por el trasplante tienen una mayor probabilidad de adquirir el virus, pero una menor probabilidad de desarrollar enfermedad grave9. El objetivo de este trabajo es realizar una revisión de la evidencia existente hasta el momento sobre el trasplante hepático durante la pandemia por COVID-19, tomando en cuenta el efecto de la inmunosupresión sobre el curso de la enfermedad, el ajuste de esta en caso de adquirir la infección, el protocolo a seguir con los pacientes en lista de espera y el futuro cercano de la reactivación del programa de trasplante.
Método
Se buscaron en PubMed los siguientes términos MeSH: “SARS-CoV-2”, “COVID-19”, “trasplante hepático” y “tratamiento”, y posteriormente se identificaron y seleccionaron los artículos considerados más relevantes desde enero hasta agosto de 2020. No se realizó ningún tipo de análisis de datos.
Manejo de la inmunosupresión en los pacientes receptores de trasplante hepático
La población con trasplante hepático en general es considerada de alto riesgo para el desarrollo de enfermedades infecciosas graves, debido al uso de inmunosupresores de forma crónica, ya sea de anticuerpos monoclonales como el basiliximab, o de esteroides y antiproliferativos como el micofenolato de mofetilo y los inhibidores de la calcineurina; todo esto, dependiendo del tiempo transcurrido desde el trasplante y del grado de inmunosupresión necesario5,10. De inicio, en los pacientes asintomáticos no está recomendada la reducción de la inmunosupresión de manera profiláctica. Esto puede incrementar el riesgo de rechazo del injerto y no necesariamente traducirse en una menor gravedad si llegasen a contraer COVID-1911. En la actualidad, los datos sobre la COVID-19 en pacientes receptores de trasplantes es escasa, pero se sabe que la inmunosupresión prolongada incrementa la vulnerabilidad a adquirir la enfermedad y lleva a presentar una carga viral elevada en el momento del diagnóstico y una probabilidad mayor de desenlaces fatales12. Esto contrasta con la imposibilidad de suspender la inmunosupresión debido al riesgo de rechazo del injerto5,8,13. En un estudio de una cohorte multicéntrica de 151 pacientes receptores de trasplante hepático infectados por COVID-19, los cuales se compararon con 627 pacientes también infectados pero sin antecedente de trasplante, el desenlace principal evaluado, la mortalidad, no fue diferente entre ambos grupos, pero en el análisis de regresión lógistica multivariada se identificó un incremento de la mortalidad en el grupo de pacientes receptores de trasplante conforme se incrementaba la edad (odds ratio [OR]: 1.6 por cada año), y lo mismo con el incremento de la creatinina (OR: 1.57 por cada 1 mg/dl) y la presencia de cáncer no hepático (OR: 18.3). Otros de los hallazgos en contra de los pacientes receptores de trasplante hepático fueron el mayor número de ingresos a las unidades de cuidados intensivos y la mayor necesidad de ventilación mecánica invasiva14. Tomando en cuenta los estudios publicados hasta el momento, los reportes de casos y la experiencia de cada centro, vemos que el comportamiento y el pronóstico de la COVID-19 en la población con trasplante hepático son similares a los de la población general15,16. En caso de adquirir la COVID-19 y tener antecedente de trasplante hepático, las recomendaciones dependerán de la gravedad del cuadro infeccioso. El primer cambio sugerido es reducir o suspender el micofenolato de mofetilo y mantener solo los inhibidores de la calcineurina en dosis tan bajas como sea posible. En los pacientes que reciben prednisona de manera crónica se deberá continuar con la dosis previa al ingreso, por vía oral o su equivalente por vía intravenosa, y al mismo tiempo evaluar el riesgo de insuficiencia suprarrenal secundaria y, en caso necesario, iniciar dosis de estrés con esteroides que tengan efecto mineralocorticoide11. Independientemente del manejo sobre la inmunosupresión, es importante saber que un 14-53% de los pacientes con COVID-19 pueden presentar alteraciones en la química hepática, especialmente con un patrón hepatocelular. La elevación suele ser transitoria, menor de cinco veces el valor superior normal y autolimitada. Esto no contraindica el inicio de tratamientos experimentales específicos para el virus17, pero sí obliga a una monitorización frecuente de la química hepática y a vigilar posibles interacciones farmacológicas, en particular con los inhibidores de la calcineurina y los inhibidores de m-TOR (mammalian target of rapamycin)11.
Tratamiento de la COVID-19 en los pacientes receptores de trasplante hepático
MEDIDAS GENERALES
La OMS recomienda que los pacientes con COVID-19 leve sean aislados y solo reciban tratamiento sintomático y de soporte, sin prescribir antibióticos profilácticos, y lo mismo para los pacientes con enfermedad moderada, pero en estos con vigilancia estrecha. Para los pacientes con enfermedad grave se recomienda hospitalizarlos, monitorizarlos continuamente, administrarles oxígeno suplementario y anticoagulación profiláctica, intermedia o terapéutica, según ameriten, e iniciar antibióticos profilácticos, desescalando o escalando diariamente de acuerdo con la evolución y el resultado de los cultivos4.
En cuanto al tratamiento específico, existen muchos medicamentos en investigación para el tratamiento de la COVID-19, todos con evidencia limitada y la gran mayoría aún considerados como experimentales.
CORTICOSTEROIDES
Aunque en un principio fue controversial el uso de esteroides para los pacientes con COVID-19 grave, debido a un probable retraso en el aclaramiento del virus y una prolongación de la estancia hospitalaria18, actualmente se sabe que en los pacientes graves tienen un impacto en la disminución de la mortalidad a 28 días. El corticosteroide recomendado es la dexametasona a dosis de 6 mg/día por 10 días19, pero puede utilizarse su equivalente en metilprednisolona o hidrocortisona20.
REMDESIVIR
El remdesivir es un antiviral con acción directa, con efecto inhibitorio in vitro sobre la ARN polimerasa de los SARS-CoV 1 y 2, así como del MERS-CoV21,22. Aunque aún no se encuentra aprobado por la Food and Drug Administration (FDA) de los Estados Unidos de América, existe permiso de emergencia para su uso en pacientes con COVID-19 grave23,24. En los pacientes con enfermedad hepática o receptores de trasplante hepático se debe vigilar diariamente la química hepática durante la administración de remdesivir debido a que pueden elevar las transaminasas, y si estas se incrementa más de cinco veces sobre su valor normal se recomienda suspender el fármaco25.
PLASMA DE PACIENTES CONVALECIENTES
Este tipo de tratamiento no está recomendado por la OMS4. La Infectious Diseases Society of America solo lo recomienda para pacientes con COVID-19 grave y que se encuentren incluidos en un estudio clínico. Hasta el momento únicamente existe un ensayo clínico controlado que ha demostrado una probable mejoría clínica en pacientes graves26; las series de casos no han demostrado evidencia suficiente para evaluar un efecto en la mortalidad27.
HIDROXICLOROQUINA Y AZITROMICINA
El uso de hidroxicloroquina o cloroquina no ha demostrado reducir el riesgo de intubación o de muerte en los pacientes hospitalizados28, y tampoco la tasa de negativización de la carga viral29. La asociación con azitromicina no ha demostrado disminuir la mortalidad, pero sí un incremento en el riesgo de paro cardiaco secundario a una prolongación del QT30, y la FDA ha retirado el permiso para su utilización31.
TOCILIZUMAB
El tocilizumab es un anticuerpo monoclonal que inhibe a la interleucina 6, la cual es uno de los principales mediadores de la inflamación provocada por la COVID-19. Al bloquear esta cascada de la inflamación en los pacientes con enfermedad grave y fiebre persistente, pudiera disminuir el daño orgánico secundario, pero hasta el momento la evidencia no es contundente y los estudios reportados son series de casos que, si bien en algunas de ellas se ha demostrado una mejoría en el patrón radiológico, disminución de la fiebre y de los marcadores inflamatorios, y de la probabilidad de requerir ventilación mecánica invasiva32, en otras ocasiones no se ha observado ningún beneficio en la supervivencia a 14 días33.
Trasplante hepático durante la pandemia de COVID-19
En este momento, la mayoría de los centros de trasplante en el mundo han cerrado sus programas debido a la pandemia de COVID-1934. Esto implica la muerte de muchos pacientes en lista de espera, la pérdida del seguimiento a los ya trasplantados y, en caso de reapertura del programa, el riesgo de contagio del personal de salud y su círculo cercano35. Podemos anticipar que los receptores de trasplante hepático se van a infectar, pero se sabe poco acerca de la transmisión del SARS-CoV-2 del donante al receptor y al personal médico36.Haga clic o pulse aquí para escribir texto. Las probabilidades de que el donante sea una potencial fuente de transmisión dependen no solo de los factores de exposición y del periodo de incubación (2-14 días), sino también de la viremia y de la viabilidad del virus en la sangre y en determinados órganos37,38. Durante la pandemia de SARS en 2002 se identificaron casos de infección en receptores de trasplante hepático y en los integrantes del equipo quirúrgico39.
TRANSFUSIÓN DE HEMODERIVADOS DURANTE EL TRASPLANTE
No se ha identificado que el coronavirus se transmita mediante la transfusión de hemoderivados, pero la FDA recomienda no recibir transfusiones de pacientes con síntomas respiratorios y el European Centre for Disease Prevention and Control recomienda esperar de 21 a 28 días para donar sangre tras haber tenido contacto con pacientes infectados o haber viajado a zonas de riesgo37.
PACIENTES EN LISTA DE ESPERA
Debido a que se desconoce la cinética del virus y existe la posibilidad de resultados falsos negativos del hisopado nasal40, se deben limitar los trasplantes hepáticos para los casos más urgentes (MELD [Model for End-stage Liver Disease] > 35, falla hepática aguda o carcinoma hepatocelular cercano a salir de los criterios de Milán)41. Todos los receptores deben ser tamizados para COVID-19, se les debe realizar una tomografía computada de pulmón y no se realizará el trasplante en los que estén infectados. En caso de que el donante haya estado en riesgo de exposición, pero sin presentar síntomas respiratorios ni fiebre previamente al deceso, pueden utilizarse sus órganos siempre y cuando no sean los pulmones o el intestino37 (Fig. 1).
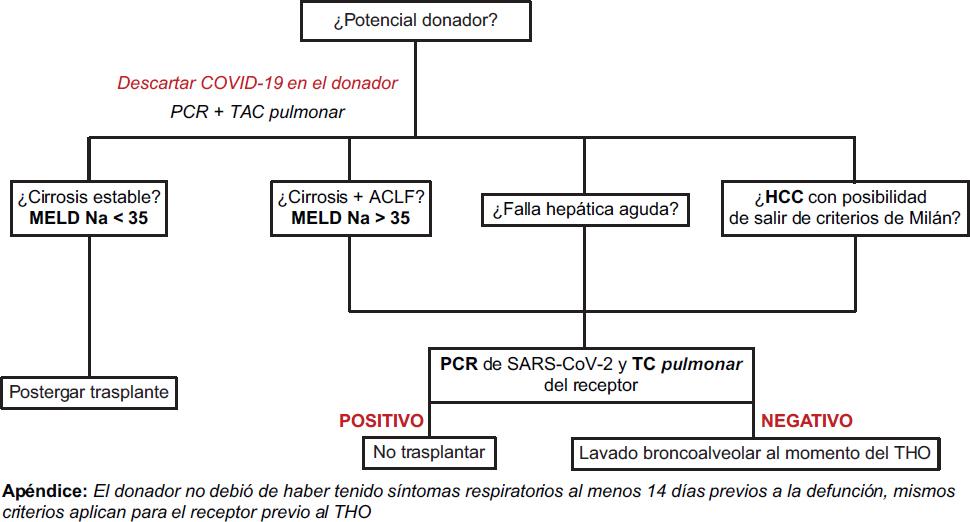
Figura 1 Algoritmo de trasplante hepático durante la pandemia de COVID-19. El donador no debió haber tenido síntomas respiratorios al menos en los 14 días previos a la defunción; mismos criterios aplican para el receptor. ACLF: Acute-on-Chronic Liver Failure; HCC: hepatocarcinoma; MELD Na: Model for End-Stage Liver Disease considerando la natremia; PCR: reacción en cadena de la polimerasa; TC: tomografía computada; THO: trasplante hepático ortotópico.











 text new page (beta)
text new page (beta)


