Antecedentes
Los teratomas quísticos benignos se componen de estructuras histológicas maduras de origen ectodérmico, mesodérmico y endodérmico. Generalmente cuentan con un contenido de material sebáceo, células escamosas y cabello, y además pueden contener una variedad importante de otros componentes histológicos, como tejido conectivo, neural, adiposo y óseo, y epitelio respiratorio1. Aunque en el transcurrir de los últimos años han surgido varias teorías en torno a su origen, se sigue considerando la partenogénesis como la teoría más aceptada, es decir, que su origen radica exclusivamente en el material genético del ovocito2.
Los tumores ováricos son una de las patologías oncoginecológicas más frecuentes, y entre ellos los más frecuentes son los tumores epiteliales de ovario, aunque es bien sabido que en mujeres jóvenes, en edad reproductiva como la paciente de este caso, suelen ser mucho más frecuentes los tumores de células germinales, en particular el teratoma maduro, coloquialmente conocido como quiste dermoide, que abarca hasta el 95% de esta clase de tumores. En general su comportamiento es benigno, por lo que varios autores han sugerido el manejo expectante de estas pacientes, aunque, por otro lado, el riesgo de torsión y de malignización con necesidad posterior de ooforectomía total son una realidad, por lo que debe plantearse la necesidad de una intervención adecuada y oportuna3,4.
Caso clínico
Mujer de 22 años que acude a la Clínica de Fertilidad del Hospital Santa Rosa de Lima en búsqueda de alternativas terapéuticas por diagnóstico presuntivo de teratoma ovárico bilateral en febrero de 2019, ya que el manejo que se le sugirió consistía en ooforectomía bilateral, a lo cual la paciente se negó.
Como antecedentes heredofamiliares de relevancia, la paciente menciona abuelas paterna y materna con cáncer de mama; madre con diagnóstico de hipotiroidismo; dos hermanas con síndrome de ovario poliquístico, quienes requirieron tratamiento de fertilidad para lograr un embarazo, una de ellas con hipotiroidismo; y prima (por vía materna) diagnosticada con teratoma ovárico derecho a los 24 años, sin especificar la estirpe, manejado con ooforectomía unilateral.
Antecedentes ginecoobstétricos: menarca a los 15 años, con ciclos menstruales de 90 × 6, nuligesta. Menciona diagnóstico de síndrome de ovario poliquístico a los 18 años de edad, por lo que recibió tratamiento con valerato de estradiol/dienogest por irregularidad menstrual, usado hasta la fecha de la valoración. No presenta antecedentes quirúrgicos ni alérgicos.
En febrero de 2019 la paciente solicitó atención médica por primera ocasión refiriendo como único síntoma dolor ocasional de tipo punzante en la fosa iliaca izquierda. En el abordaje se llegó al diagnóstico de teratoma ovárico bilateral, por lo que le fue sugerido el manejo con ooforectomía bilateral. Acude por primera vez a nuestra consulta en marzo de 2019 solicitando una segunda opinión.
En la exploración física se encuentra: frecuencia cardiaca 80 l.p.m., frecuencia respiratoria 19 r.p.m., presión arterial 120/70 mmHg, temperatura 36.5 °C, índice de masa corporal 29.4 kg/m2, cabeza normal, piel y tegumentos con buena coloración e hidratación, cuello cilíndrico, sin adenomegalias palpables, tórax con mamas Tanner IV, abdomen globoso, distendido, peristalsis presente, no doloroso, sin visceromegalias ni tumoraciones palpables. Colposcopia sin datos relevantes. Resto de la exploración sin alteraciones.
Los exámenes preoperatorios (biometría hemática, tiempos de coagulación, química sanguínea y electrolitos séricos) fueron reportados dentro de los límites normales.
El perfil hormonal muestra: hormona estimulante del folículo 12.4 mUI/ml, hormona luteinizante 4.01 mUI/ml, progesterona 0.17 ng/ml y estradiol 34 pg/ml.
Los marcadores tumorales indican: alfafetoproteína 4.2 ng/ml, fracción beta de la gonadotropina coriónica humana 0.9 mUI/ml, deshidrogenasa láctica 125 U/l, antígeno Ca-125 45.13 U/ml, antígeno Ca-19.9 553.17 U/ml y antígeno carcinoembrionario 3.3 ng/ml.
En la evaluación con ultrasonido endovaginal de 5 a 10 MHz Voluson E10 GE® se encontró el útero de morfología y dimensiones normales, el ovario derecho con una tumoración de 3.98 × 5.79 cm y el ovario izquierdo con una tumoración de 11.4 × 10 cm (Fig. 1).

Figura 1 Tumoraciones observadas mediante ultrasonido endovaginal. A: teratoma de ovario derecho. B: teratoma mixto de ovario izquierdo.
La paciente fue intervenida por laparotomía en mayo de 2019. En la exploración quirúrgica, el útero y las trompas de Falopio se encontraron íntegros. Se logró la enucleación de ambas tumoraciones y se preservó el tejido ovárico en su totalidad (Figs. 2 y 3).

Figura 2 Visualización transoperatoria de ambos eratomas. A: teratoma izquierdo. B: teratoma derecho.

Figura 3 A-B: Imagen transoperatoria en la que se observa que se preservan íntegramente los ovarios.
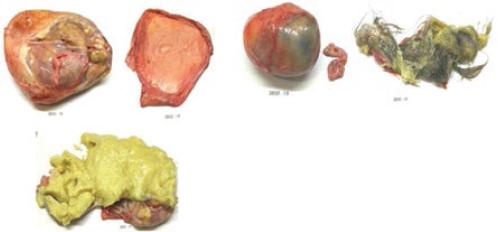
Se enviaron ambas piezas para su estudio histopatológico, siendo la tumoración izquierda de 11 × 10 × 5 cm y la tumoración derecha de 6 × 4 × 4 cm (Fig. 4). Se confirmó el diagnóstico de tumor de células germinales benigno (teratoma quístico maduro bilateral) (Fig. 5).

Figura 5 Histología del teratoma maduro benigno. Se observa la composición tumoral por diferentes tipos de epitelios maduros, epitelio cilíndrico, alternado con lesiones quísticas, cubiertos en la superficie por un epitelio plano estratificado con áreas de queratinización, folículos pilosos y glándulas sebáceas. En algunas zonas estas lesiones están cubiertas de células cúbicas, glándulas cubiertas de un epitelio cilíndrico, rodeadas de un estroma compacto y de tejido adiposo maduro.
La paciente fue dada de alta 24 horas después de la cirugía, tras un posquirúrgico sin ninguna anormalidad, y fue citada 7 días después, mostrando una evolución favorable.
Después de 30 días, la paciente volvió a su segunda cita de control, refiriéndose asintomática. Se le solicitaron nuevos estudios de control, principalmente perfil hormonal y un nuevo panel de marcadores tumorales, los cuales reportaron: alfafetoproteína 3.9 ng/ml, antígeno carcinoembrionario 2.8 ng/ml, fracción beta de la gonadotropina coriónica humana 0.05 mUI/ml, deshidrogenasa láctica 110 U/l, antígeno Ca-19.9 323.6 U/ml, antígeno Ca-125 23.2 U/ml, hormona luteinizante 5.16 mUI/ml, hormona estimulante del folículo 8.10 mUI/ml, estradiol 66.12 pg/ml y progesterona 1.04 pg/ml.
Fue citada nuevamente en diciembre de 2019 para una tercera cita de control, en la que vuelve a manifestarse asintomática. Se le solicita un tercer perfil hormonal, en el que ningún parámetro estuvo fuera de rango y los marcadores tumorales permanecieron sin cambios significativos: alfafetoproteína 3.2 ng/ml, antígeno carcinoembrionario 2.2 ng/ml, fracción beta de la gonadotropina coriónica humana 0.0 mUI/ml, deshidrogenasa láctica 111 U/l, antígeno Ca-19.9 20.5 U/ml, antígeno Ca-125 22.1 U/ml, hormona luteinizante 4.1 mUI/ml, hormona estimulante del folículo 8.6 mUI/ml, estradiol 53.01 pg/ml y progesterona 0.99 pg/ml.
Se le sugirió control anual mediante exploración física y ultrasonido pélvico, por el importante riesgo de recurrencia, además de tener cita abierta en caso de nueva sintomatología.
Discusión
Los tumores de células germinales, en contraste con otros tumores de ovario, se originan de células germinales primitivas que migran a la cresta gonadal hacia la sexta semana de vida del embrión, y por tanto este tipo de tumor puede exhibir un espectro de diferenciación histológica que imita el desarrollo primitivo embrionario5.
En la evaluación genética, las células que lo componen tienen un cariotipo normal (46, XX), por lo que se considera que la diversidad de tejidos de su contenido no es producto de la fecundación; más bien se ha planteado el hecho de que su origen radica en el material genético propio del ovocito1. En estudios más recientes, Wang et al.6, mediante análisis de perfiles de ADN y estatus de metilación, plantean con sus resultados que el origen del teratoma maduro es más compatible con el concepto de la célula madre pluripotencial o de la célula germinal primitiva antes de la meiosis I.
Los tumores ováricos representan aproximadamente el 27% de las patologías oncoginecológicas, siendo la mayoría de ellos de origen epitelial (85-90%). Los tumores no epiteliales abarcan el 10-15% restante, dividiéndose en dos grupos: tumores de células germinales y tumores del estroma de los cordones sexuales7 (Tabla 1).
Tabla 1 Clasificación histológica internacional de los tumores ováricos (Organización Mundial de la Salud)8
| Tumores del estroma de los cordones sexuales | Tumores de células germinales | Tumores epiteliales |
|---|---|---|
| − Células de la granulosa | − Disgerminoma | − Seroso |
| − Células de Sertoli-Leydig (androblastoma) | − Teratoma | − Mucinoso |
| − Tecoma | − Coriocarcinoma | − Endometrioide |
| − Fibroma | − Carcinoma embrionario | − Células claras |
| − De células esteroideas | − Del saco vitelino (seno endodérmico) | − Brenner (células transicionales) |
| − Epiteliales mixtos | ||
| − Indiferenciados | ||
| − No clasificables |
El cáncer epitelial de ovario por lo general ocurre en mujeres en la perimenopausia, mientras que los tumores de células germinales tienden a presentarse en mujeres jóvenes entre la segunda y la tercera décadas de la vida, etapa cumbre de su vida fértil, lo cual le confiere una complejidad extra cuando se considera que la gran mayoría de estas pacientes tendrá deseos de fertilidad, haciendo de esto otra prioridad dentro del abordaje y el tratamiento de esta clase de tumores8.
La presentación de las pacientes con tumores de células germinales ováricos resulta bastante similar en lesiones benignas y malignas, siendo el dolor abdominal (70-80%) y la sensación de masa en el abdomen inferior los síntomas más frecuentes. La asociación de dolor abdominal y masa abdominopélvica palpable se encuentra en el 85% de los casos9. Esta clase de tumores suelen ser asintomáticos hasta que alcanzan grandes dimensiones, y más aún cuando llegan a comprimir estructuras vecinas9.
Para el diagnóstico, el abordaje adecuado es de vital importancia. Una anamnesis minuciosa, con particular énfasis en los antecedentes ginecoobstétricos de la paciente y en sus síntomas, es crucial en la evaluación. De igual forma, los antecedentes familiares no deben pasar desapercibidos. Los datos clínicos obtenidos del interrogatorio podrán ser de gran utilidad y orientar inicialmente el diagnóstico10.
En el abordaje de una masa anexial en estudio, la exploración deberá incluir palpación de las cadenas de ganglios linfáticos, auscultación pulmonar, palpación y auscultación abdominal.
El examen pélvico consistirá en inspeccionar visualmente el perineo, la vagina y el cérvix, además de complementar con tacto bimanual y examen recto-vaginal. Es importante mencionar que el examen pélvico puede tener bastantes limitantes, pero aun así se considera rentable, ya que existen hallazgos a la exploración que pueden orientar al médico a sospechar malignidad, como irregularidad de la masa, firmeza, nodularidad o presencia de ascitis11.
El ultrasonido transvaginal es el estudio inicial recomendado ante la sospecha o el hallazgo de una masa pélvica. Ningún otro método de imagen ha demostrado una superioridad sustancial que justifique su uso sistemático11. Las ventajas del ultrasonido transvaginal incluyen alta disponibilidad, buena tolerancia y molestias mínimas para la paciente, y costos accesibles. El ultrasonido Doppler permite un aumento en la especificidad diagnóstica, aunque siempre es recomendable ser cauteloso, ya que de cualquier forma no es posible tener certeza del tipo histológico del tumor por métodos de imagen12.
Los datos que se consideran sugestivos de malignidad en la evaluación de una masa por ultrasonido son: quiste > 10 cm, componentes sólidos o papilares, irregularidad, presencia de ascitis y Doppler color que demuestre un alto flujo. Las características ultrasonográficas compatibles con lesiones benignas incluyen: quiste pequeño, paredes lisas, ausencia de componentes sólidos, septos y Doppler que demuestra un bajo flujo sanguíneo13.
Los marcadores tumorales desempeñan un papel muy importante en el diagnóstico (principalmente diferencial) y el manejo del teratoma ovárico. Es necesario recalcar que, por definición, el teratoma maduro no tendrá producción hormonal de ninguna clase, pues por las características de su composición este evento resulta sumamente inusual, por lo que la negatividad en esta clase de parámetros jamás descartará la presencia de un teratoma14,15.
En lo que respecta al tratamiento, la única opción para los tumores de células germinales es la extirpación quirúrgica completa. Si no se logra obtener unos bordes quirúrgicos limpios en el estudio histopatológico, se debe plantear la reintervención. El procedimiento consistirá en ooforectomía en buena parte de las ocasiones, debido principalmente al tamaño del tumor o por no contar con la certeza diagnóstica de su tipo histológico. Solo en algunos casos selectos en los que el tumor en cuestión sea de proporciones menores, o se encuentre muy bien delimitado, podrá plantearse la enucleación de la lesión en búsqueda de preservar las funciones tanto hormonales como reproductivas de la paciente, en particular en casos excepcionales como la presentación bilateral del tumor16, que representa una situación particularmente difícil, en especial en una mujer joven con deseos genésicos aún no cumplidos.
Algunos teratomas pueden tener componentes mixtos en su estructura; elementos inmaduros y malignos pueden coexistir aun sin haber elevación de los marcadores séricos. La mayoría de las veces no resulta posible contar con la certeza del tipo histológico del tumor, y por ello se recomienda una gran cautela en el abordaje quirúrgico y si surgieran nuevas dudas (principalmente a causa de las características del tumor) se recomienda también la realización de procedimientos de estadificación durante el transoperatorio17.
Dadas las características de esta clase de tumores y su predominancia en mujeres jóvenes, en edad reproductiva, será indispensable tener en cuenta sus deseos genésicos en todo momento, en especial en el planteamiento terapéutico y luego como parte integral de su manejo, siempre en aras de proporcionarle una mejor calidad de vida.
En caso de que el tratamiento de una tumoración ovárica implique una cirugía radical, existen varias opciones que se le pueden ofrecer a la paciente, según sea el caso (criopreservación de embriones, de ovocitos o de ovario)18,19.
La cirugía de conservación de ovario es posible gracias la existencia de un plano de disección entre los márgenes tumorales y el tejido ovárico sano20,21. En este caso, el tejido ovárico restante se evaluó macroscópicamente para detectar lesiones residuales, y el equipo médico que intervino a la paciente determinó la integridad y la viabilidad del tejido.
Conclusión
Existen algunos factores que pueden orientar al ginecólogo a plantear una ooforectomía en esta clase de casos, principalmente cuando se sospecha malignidad, si el tumor es grande o ante una torsión anexial, aunque siempre quedarán a criterio del médico tratante el abordaje y el plan terapéutico que se realizarán a la paciente.
Cuando el pronóstico de la paciente sea favorable (como en este caso), la preservación de la fertilidad y de la función gonadal deberá ser un objetivo prioritario en el tratamiento quirúrgico de los tumores de ovario. Es recomendable la cirugía conservadora como tratamiento de primera línea para todos los tumores ováricos, con excepción de aquellos que hayan sido catalogados como malignos y aquellos en los que la intervención quirúrgica urgente está indicada debido a la sospecha de torsión ovárica.











 text new page (beta)
text new page (beta)