Introducción
La pancreatitis aguda es la complicación más frecuente después de una colangiopancreatografía retrograda endoscópica (CPRE). Su frecuencia de presentación es muy variable, pero habitualmente se reporta entre el 3 y el 10%1.
El mecanismo por el que se presenta la pancreatitis pos-CPRE (PPCPRE) no está del todo comprendido, pero se sugiere que podría ser multifactorial2,3. Se piensa que podría representar una pancreatitis aguda diferente de la ocasionada por otras etiologías, con base en el patrón de la elevación de las enzimas pancreáticas, las manifestaciones clínicas y el peor pronóstico cuando se presenta en su forma grave3,4.
Los grandes estudios han identificado factores de riesgo que se relacionan con la presencia de PPCPRE, que pueden clasificarse como factores relacionados con el paciente, con el procedimiento y con el operador1.
Se describe que la mayoría de los episodios de PPCPRE son leves (alrededor de 90%) y el resto desarrollan pancreatitis moderada o grave (alrededor de 10%)5.
Existen varios métodos que intentan reducir la frecuencia de PPCPRE, como emplear técnicas de canulación que minimicen el trauma ampular, usar stents del conducto pancreático, administración rectal de antiinflamatorios no esteroideos (AINE) o protocolos específicos de hidratación intravenosa1. Sin embargo, aun con el empleo de dichas medidas es difícil prevenir completamente esta complicación en particular6.
Existen escalas de predicción del desarrollo de PPCPRE basadas en los factores de riesgo relacionados con su presentación7-9, pero contemplan demasiadas variables y esto las hace poco prácticas.
Solo hay algunos estudios específicamente en pacientes sometidos a CPRE que evalúan la utilidad de la determinación de la amilasa y la lipasa séricas para predecir la gravedad de la pancreatitis2,6,10-12, los cuales muestran que las elevaciones de sus cifras se correlacionan con la presencia de formas graves de pancreatitis y pueden emplearse como predictores; sin embargo, las cifras de corte, los criterios de clasificación de gravedad y el rendimiento diagnóstico difieren.
La cuantificación de la amilasa y la lipasa puede encontrarse disponible en los hospitales de nuestro país, y llevar a cabo un estudio para evaluar la utilidad de dichas enzimas en la PPCPRE podría ser de gran importancia, ya que, si se demuestra alguna utilidad, contaríamos con una herramienta diagnóstica que podría ser aplicable a nuestra población y que nos daría pauta para la toma de mejores decisiones clínicas.
El objetivo de este estudio es demostrar si los valores de amilasa y de lipasa se correlacionan con la presencia y la gravedad de la PPCPRE.
Método
Realizamos un estudio retrospectivo, observacional y analítico, en el Hospital Juárez de México, de pacientes hospitalizados a quienes se realizó CPRE en el periodo comprendido de marzo de 2016 a febrero de 2019. Los criterios de inclusión fueron los siguientes: pacientes con CPRE programada o urgente en el mismo hospital, aplicación de indometacina, permanencia en hospitalización después de la CPRE, contar con expediente completo y disponer de registros de amilasa o lipasa después del procedimiento. Los criterios de no inclusión fueron: pacientes menores de 18 años, referidos de otro hospital, antecedente de pancreatitis, pacientes oncológicos y aquellos que presentaron otras complicaciones diferentes de la pancreatitis o que se derivan de esta.
La administración de indometacina fue por vía rectal, en dosis única de 100 mg, estando el paciente ya en la sala y al inicio del procedimiento. La toma de la muestra sanguínea para cuantificar la amilasa y la lipasa se lleva a cabo, de forma sistemática, el día en que se realiza el procedimiento a las 18:00 horas; considerando el horario en que habitualmente se hacen los procedimientos, implica que entre la realización de la CPRE y la toma de la muestra sanguínea para su análisis trascurre un tiempo de 4 a 8 horas.
Empleamos la clasificación y las definiciones de Atlanta13 para el diagnóstico y la categorización de la gravedad de la pancreatitis.
Se dividió en dos grupos a la población estudiada, de acuerdo con la presentación de la pancreatitis. Determinamos la frecuencia de PPCPRE. Se clasificó a los pacientes según la pancreatitis en leve, moderadamente grave y grave, y a continuación en dos grupos: uno con los que presentaron la forma leve y otro con los que presentaron las formas graves, es decir, aquellos con pancreatitis moderadamente grave o grave. Comparamos los valores de amilasa y de lipasa entre ambos grupos. Los datos obtenidos los resumimos como porcentajes, medianas, percentiles, medias y desviación estándar. Para el análisis de las variables cualitativas empleamos la prueba de ji al cuadrado, y para las variables continuas empleamos las pruebas t de Student y U de Mann Whitney, dependiendo de su distribución normal o libre. Las pruebas estadísticas empleadas fueron a dos colas y se consideró estadísticamente significativo un valor de p < 0.05.
Empleamos curvas ROC (Receiver Operating Characteristics) para conocer los puntos de corte de los valores de amilasa y de lipasa como predictores de las formas graves de pancreatitis. Determinamos la sensibilidad, la especificidad, el valor predictivo positivo y el valor predictivo negativo de los valores de corte encontrados para cada enzima en la predicción de las formas graves. Para el análisis de los datos empleamos el programa SPSS versión 25 para Windows.
Resultados
Un total de 621 pacientes reunieron los criterios de inclusión del presente estudio, con una proporción de mujeres y hombres de 2.1:1. De todos los pacientes, 567 no presentaron pancreatitis y 54 sí la presentaron, por lo que la frecuencia de esta complicación es del 8.7%. El diagnóstico de PPCPRE se hizo por criterio clínico más criterio de laboratorio en 52 pacientes, y por criterio clínico más complicación local por imagen (tomografía) de manera retrospectiva en dos pacientes.
En la tabla 1 se comparan las principales características de los pacientes con y sin pancreatitis.
Tabla 1 Características de los pacientes con y sin pancreatitis
| PPCPRE | p | ||
|---|---|---|---|
| Sí | No | ||
| Número de pacientes (%) | 54 (8.7) | 567 (91.3) | |
| Edad | 43.5 años* (28† a 59‡) | 45 años* (31† a 61‡) | 0.6 |
| Sexo (%) | 37 mujeres (68.5) 17 hombres (31,5) | 383 mujeres (67.5) 184 hombres (32.5) | |
| Índice de masa corporal | 28§(3.1¶) | 27.37§ (2.94¶) | 0.2 |
| Principales indicaciones de solicitud del procedimiento, número de pacientes (%) | PB Coledocolitiasis, 35 (64.8) Colangitis, 11 (20.3) Fístula biliar, 5 (9.3) | PB Coledocolitiasis, 383 (67.5) Colangitis, 92 (16) Fístula biliar, 31 (5.5) | |
*Mediana.
†Percentil 25.
‡Percentil 75.
§Media.
¶Desviación estándar.
Nota: ambos grupos de pacientes son muy homogéneos en cuanto a edad y sexo, así como en los principales motivos de solicitud de CPRE. Hay una ligera tendencia a un mayor índice de masa corporal en los que presentaron pancreatitis, pero sin significancia estadística.
PB: Probable coledocolitiasis; PPCPRE: pancreatitis poscolangiopancreatografía retrógrada endoscópica.
Al estudiar la variable dolor abdominal encontramos que todos los pacientes con pancreatitis desarrollaron dolor abdominal, definido como dolor epigástrico que se irradia a espalda, de nuevo inicio o exacerbación de dolor previo. Cabe destacar que el 21.3% de los pacientes que no desarrollaron pancreatitis también presentaron dolor abdominal después del procedimiento; con la prueba de ji al cuadrado confirmamos que dichas diferencias observadas son estadísticamente significativas (p < 0.05).
El 100% de las muestras sanguíneas para cuantificación de las enzimas pancreáticas se tomaron entre 4 y 8 horas tras la realización de la CPRE. Del total de los pacientes, el 92.4% contaron con mediciones tanto de amilasa como de lipasa. El 97% de los reportes de los resultados de dichas enzimas se obtiene en un lapso menor de 12 horas a partir de realizada la CPRE, y el 100% antes de las 17 horas.
Las características de las enzimas pancreáticas en los grupos con y sin pancreatitis se muestran en la tabla 2.
Tabla 2 Características de las enzimas pancreáticas en la población de estudio
| Pacientes con PPCPRE (n = 54) | Pacientes sin PPCPRE (n = 567) | |||
|---|---|---|---|---|
| Amilasa (U/l) | Lipasa (U/l) | Amilasa (U/l) | Lipasa (U/l) | |
| Media | 925 | 1253 | 156 | 96 |
| Mediana | 860 | 1180 | 105 | 58 |
| Desviación estándar | 519 | 658 | 171 | 129 |
| Mínimo | 152 | 199 | 7 | 7 |
| Máximo | 2997 | 3190 | 2050 | 1270 |
| Percentil 25 | 593 | 835 | 60 | 35 |
| Percentil 75 | 1063 | 1503 | 188 | 99 |
en el grupo con PPCPRE, 52 pacientes ambas enzimas y 2 solo lipasa; en el grupo sin PPCPRE, 5 solo amilasa, 40 solo lipasa y 522 ambas enzimas. Hubo una tendencia a mayores niveles enzimáticos en el grupo con PPCPRE. Las diferencias observadas en las mediciones de cada enzima entre los dos grupos son estadísticamente significativas, con p < 0.05.
PPCPRE: pancreatitis poscolangiopancreatografía retrógrada endoscópica.
En el grupo de pacientes sin pancreatitis, la elevación enzimática de al menos tres veces el límite superior normal se presentó en el 33.5% y el 14.5% para la amilasa y la lipasa, respectivamente.
Al clasificar a los pacientes con pancreatitis según la gravedad obtuvimos que 43 (79.6%) corresponden a pancreatitis leves, 9 (16.7%) a moderadamente graves y 2 (3.7%) a graves.
Al dividir en dos grupos a los pacientes con pancreatitis, las enzimas presentan mayor elevación en las formas moderadamente grave y grave que en la forma leve (Fig. 1). Al analizar estas diferencias entre ambos grupos se observa que poseen una distribución libre y, por lo tanto, al emplear la prueba U de Mann Whitney se confirma que la diferencia observada para el caso de la amilasa no es estadísticamente significativa (p = 0.052). No obstante, en el caso de la lipasa se comprueba que si existe una correlación: a mayor elevación enzimática, mayor gravedad de la PPCPRE, resultado que es estadísticamente significativo (p < 0.05).

Figura 1 Gráficos que muestran la relación entre las cifras enzimáticas y la gravedad de la pancreatitis poscolangiopancreatografía retrógrada endoscópica. A mayores cifras de amilasa y de lipasa, mayor gravedad de la pancreatitis.
Las curvas ROC de cada enzima para la predicción de pancreatitis grave y moderadamente grave se muestran en las figuras 2 y 3.
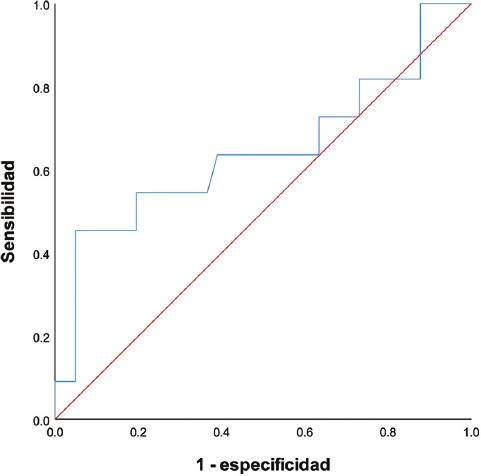
Figura 2 Curva ROC de la amilasa para la predicción de pancreatitis grave y moderadamente grave en pacientes con pancreatitis poscolangiopancreatografía retrógrada endoscópica. Área bajo la curva de 0.65 (intervalo de confianza del 95%: 0.43 - 0.86). Mejor valor de corte con sensibilidad del 63% y especificidad del 67% (p = 0.13).

Figura 3 Curva ROC de la lipasa para la predicción de pancreatitis grave y moderadamente grave en pacientes con pancreatitis poscolangiopancreatografía retrógrada endoscópica. Área bajo la curva de 0.827 (intervalo de confianza del 95%: 0.67-0.98. Mejor valor de corte con sensibilidad del 72.7%, especificidad del 86% y valor predictivo negativo del 92.5% (p < 0.05).
El área bajo la curva (AUC) de la curva ROC de la amilasa es de 0.65, mientras que la de la lipasa es 0.82. Los mejores puntos de corte de las curvas fueron 920 U/l para la amilasa y 1500 U/l para la lipasa (referencia de laboratorio: lipasa 101 U/l y amilasa 51 U/l). Únicamente en el caso de la lipasa el resultado es estadísticamente significativo (p < 0.05). Los valores diagnósticos de los puntos de corte de la amilasa y de la lipasa se muestran en la tabla 3.
Tabla 3 Valores diagnósticos de amilasa 920 U/l y de lipasa 1500 U/l para la predicción de formas graves de pancreatitis poscolangiopancreatografía retrógrada endoscópica
| Amilasa | Lipasa | |||
|---|---|---|---|---|
| % | IC 95% | % | IC95% | |
| Sensibilidad | 63.6 | 35.4 a 84.8 | 72.7 | 43.4 a 90.3 |
| Especificidad | 67.4 | 52.5 a 79.5 | 86 | 72.7 a 93.4 |
| Valor predictivo positivo | 33.4 | 17.2 a 54.6 | 57.1 | 32.6 a 78.6 |
| Valor predictivo negativo | 87.9 | 72.7 a 95.2 | 92.5 | 80.1 a 97.4 |
| Exactitud | 66.7 | 53.4 a 77.8 | 83.3 | 71.3 a 91 |
| Odds ratio | 3.6 | 0.9 a 14 | 16.4 | 3.4 a 80 |
IC 95%: intervalo de confianza del 95%.
Discusión
Actualmente, la pancreatitis continúa siendo la complicación más frecuente y temida de la CPRE14. La frecuencia reportada varía ampliamente, desde el 0.5%15 hasta el 40%1. En la mayoría de los estudios observacionales y retrospectivos, como este, va del 5 al 7%14. En los estudios prospectivos de pacientes no seleccionados se describe del 4 al 8%3. Respecto a lo publicado en México, Montaño, et al.16 y Romero, et al.17 reportan un 9.4% y un 6%, respectivamente. En nuestro estudio, la frecuencia fue del 8.7%.
La mayoría de los estudios que investigan la PPCPRE utilizan la definición de consenso y la clasificación de gravedad de Cotton de 19911; sin embargo, se ha señalado que su uso tiene limitaciones, entre otras porque el grado de gravedad es subjetivo, debido a que en esta clasificación se usa la definición de hospitalización prolongada, que es decidida por el clínico tratante18. En nuestro estudio utilizamos la clasificación de pancreatitis de la revisión de Atlanta13, que aunque no es específica para PPCPRE1 clasifica la gravedad de la pancreatitis de acuerdo con la presencia y la duración de falla orgánica, y las complicaciones locales y sistémicas, en vez de con la duración de la hospitalización19. Los estudios recientes sobre pancreatitis aguda utilizan la revisión de Atlanta para clasificar la gravedad, debido a que sus criterios son fácilmente identificables20; también en la PPCPRE se ha comenzado a emplear18 y es la que mejor refleja su gravedad21.
El porcentaje de pacientes con pancreatitis sin dolor abdominal es bajo: el 2.3%11. Encontramos que la presencia de dolor abdominal es altamente sugestiva de diagnóstico de PPCPRE, pero observamos que se llega a presentar en al menos uno de cada cinco pacientes sometidos a CPRE que no desarrollan pancreatitis.
La hiperamilasemia, definida como una elevación de la amilasa de al menos tres veces el límite superior normal sin síntomas de pancreatitis11, se presentó en nuestro estudio en el 33.5%; en la literatura se reporta del 25 al 75%1,11. La mayor utilidad de las pruebas de imagen es para la detección de complicaciones, y la mayoría de los pacientes no las requieren para el diagnóstico de pancreatitis aguda22; en nuestro estudio solo se ocupó para el diagnóstico en el 0.3%.
Al clasificar a los pacientes por gravedad encontramos porcentajes parecidos a los del estudio de Kim, et al.18 sobre factores de riesgo de PPCPRE utilizando la clasificación de Atlanta, en el que se reporta un 83, un 12.8 y un 3.5% para las pancreatitis leve, moderadamente grave y grave, respectivamente.
La mayoría de los pacientes con pancreatitis presentan episodios leves que se autolimitan1,14. Aquellos con episodios moderadamente graves y graves podrían llegar a presentar morbilidad considerable y aumentar la mortalidad4,14. Es muy parecido a lo que se reporta para la pancreatitis aguda por otras causas23. Sin embargo, el estudio de Ignatavicius, et al.24 sugiere que se podría considerar a los pacientes con la forma moderadamente grave dentro del grupo de la PPCPRE leve debido a un curso similar de la enfermedad; sin embargo, en dicho estudio, hasta un 26% de los pacientes moderadamente graves se comportaron como los graves.
El uso de las enzimas pancreáticas para predecir la gravedad de la PPCPRE está respaldado por varios estudios. No obstante, los criterios para clasificar la gravedad son diferentes, así como los valores de corte y, evidentemente, los grupos de edad2,6,10-12.
Nuestros resultados confirman que existe correlación entre la elevación enzimática y la presencia y la gravedad de la PPCPRE para el caso de la lipasa sérica, como se reporta en otras publicaciones2,11,25 cuyo valor de corte tiene un valor predictivo negativo del 92.5%, por lo que se podrían utilizar las cifras menores de este valor de corte para descartar PPCPRE moderadamente grave o grave. En el caso de la amilasa también existe una correlación menos importante y sin significancia estadística. Nuestros resultados contrastan con lo reportado por varios autores que han publicado valores superiores, tanto de sensibilidad como de especificidad, para un mismo valor de corte y en ambas enzimas6,12,26.
Es importante haber llevado a cabo el presente estudio porque nos ofrece información que en nuestro medio hospitalario podría emplearse para la toma de decisiones clínicas en los pacientes sometidos a CPRE, basándose en una prueba disponible. Sin embargo, el estudio presenta algunas limitaciones, como su carácter retrospectivo que impide contar con información más precisa; además, la muestra no es tan grande, lo que podría explicar los amplios intervalos de confianza obtenidos, aunque lo anterior también podría ser causado con menor posibilidad por la baja homogeneidad de la población incluida a pesar de los criterios de inclusión. Se requiere una validación externa en otros hospitales de nuestro país o la realización de estudios prospectivos.
Este estudio es el primero en Latinoamérica que evalúa la utilidad de las enzimas pancreáticas como predictores de gravedad de la PPCPRE.
Conclusiones
Un valor de la lipasa sérica > 1500 U/l se correlaciona con la presentación de PPCPRE moderadamente grave y grave, y podría emplearse como herramienta predictiva.
La cuantificación de la lipasa sérica únicamente a los pacientes con presencia de dolor abdominal después de una CPRE parece tener mejor utilidad para predecir formas graves de PPCPRE que la solicitud sistemática de amilasa y lipasa a todos los pacientes sometidos a CPRE. La amilasa sérica muestra una correlación estadísticamente no significativa con las formas graves de PPCPRE.











 text new page (beta)
text new page (beta)


