Introducción
Los pacientes con enfermedad inflamatoria intestinal (EII), sobre todo aquéllos con enfermedad de Crohn (EC), muestran mayor riesgo de sufrir neoplasias gastrointestinales; se calcula que cerca de 2% las desarrollaran durante el curso de la afección, en particular los individuos bajo tratamiento inmunosupresor o que lo han recibido1.
La mayor parte de las neoplasias vinculadas con la EII aparece en los segmentos intestinales inflamados y sigue la secuencia inflamación-displasia-carcinoma. Dentro de los tumores gastrointestinales observados en la EII, el más frecuente es el adenocarcinoma y su nexo con un tumor neuroendocrino (TNE) es un fenómeno menos común2.
Los TNE gastrointestinales (TNEGI) tienen casi siempre una presentación clínica insidiosa, con síntomas poco específicos que pueden confundirse con los de la EII con facilidad por lo que su diagnóstico se establece por lo general tras su resección endoscópica o quirúrgica3.
Se presentan los casos de dos pacientes con EII, en los que se diagnosticó un TNEGI, y se realiza una revisión de los aspectos clínicos, diagnósticos y terapéuticos de esta rara relación.
Casos clínicos
Primer paciente
Varón de 74 años con antecedentes personales de hipertensión arterial, hiperplasia prostática benigna y carcinoma renal de células claras tratado con tumorectomía renal. Padece EC, con afectación del íleon terminal, de larga evolución (bajo seguimiento por el Servicio Digestivo desde seis años antes) con cuadros de oclusión intestinal repetidos que se resuelven con medidas conservadoras. En tratamiento actual incluye mesalazina y había recibido con anterioridad tratamiento con azatioprina (durante cinco meses seis años antes). Ingresa por nuevo episodio de oclusión intestinal. Se solicita tomografía computarizada (TC) que delinea un engrosamiento mural de un segmento de íleon terminal de 6 cm de longitud que causa dilatación retrógrada (Fig. 1A). En la enterorresonancia magnética (RM) se visualiza una estenosis segmentaria del íleon terminal debido a un engrosamiento parietal, en un segmento, a unos 5 cm de la válvula ileocecal (Fig. 1B). Ante la falta de mejoría del cuadro clínico, con el diagnóstico de EC ileal complicada y resistente al tratamiento médico, se decide intervenir de manera quirúrgica. Se practicó un abordaje laparoscópico con cuatro trócares que identifica una zona de estenosis en el íleon terminal (~10 cm de extensión) con paredes engrosadas y adenopatías aumentadas de tamaño (Fig. 2A). Se efectúa una resección ileocecal, con anastomosis manual isoperistáltica intracorpórea. El postoperatorio cursa de modo favorable sin complicaciones y el sujeto recibe el alta médica al quinto día postoperatorio. El estudio anatomopatológico de la pieza quirúrgica revela una EII tipo EC con intensa actividad inflamatoria y en la zona de estenosis tienen un tumor infiltrante casi submucoso en su totalidad de 2.7 cm de diámetro que infiltra la pared intestinal y alcanza la grasa mesentérica, con invasión vascular y linfática de forma extensa (Figs. 2B y C). La actividad mitótica era < 2 mitosis y el Ki-67 < 2% por 10 CGA. En el estudio inmunohistoquímico, las células neoplásicas expresaban positividad para los marcadores cromogranina A, sinaptofisina, CD56 y somatostatina focalmente (Fig. 2D). Los marcadores para insulina, glucagón, gastrina y VIP fueron negativos. El tumor metastatizaba a cinco de 17 ganglios linfáticos. Se estableció el diagnóstico de tumor neuroendocrino grado G1, estadio IIIb (T4N1M0)4. En la revisión a los dos meses del alta se encontraba asintomático y la determinación de CgA en sangre y una gammagrafía con octeótrido fueron normales.
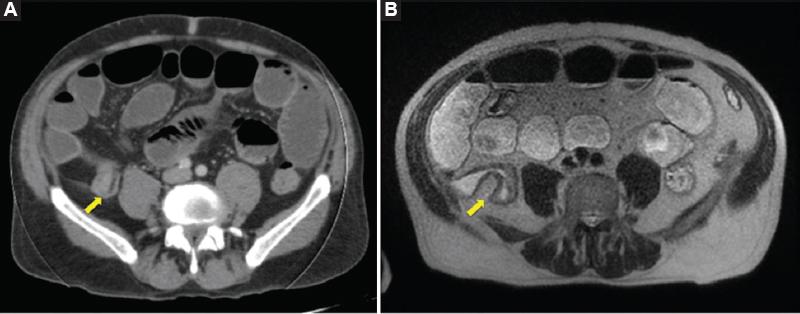
Figura 1 A: TC que revela engrosamiento mural de un segmento del íleon terminal (flecha); B: RM que muestra el mismo engrosamiento parietal en relación con estenosis (flecha).
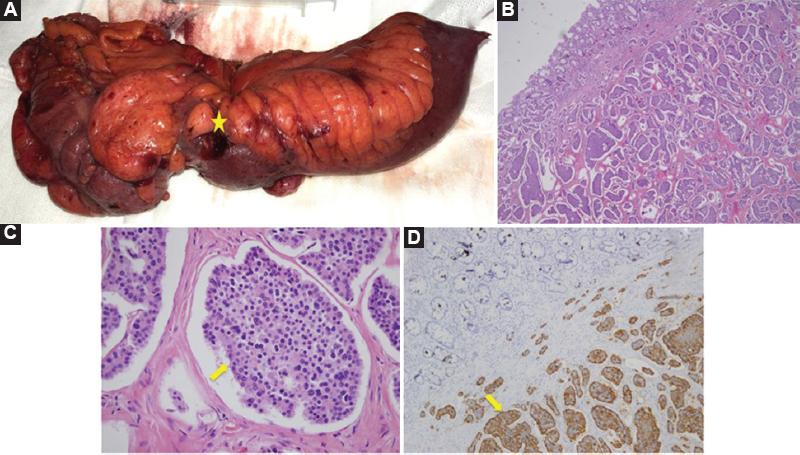
Figura 2 Cirugía: A: Pieza quirúrgica (ciego e íleon terminal) en la que se visualiza una zona de estenosis por la tumoración (★); B: Histología (H-E 4X) se reconoce un patrón organoide separado por tabiques finos; C: Histología (H-E 40X) monomorfismo celular con cromatina fina y granular con patrón de “sal y pimienta” (flecha); D: Inmunohistoquímica: tinción citoplásmica y granular positiva a cromogranina (flecha).
Segundo paciente
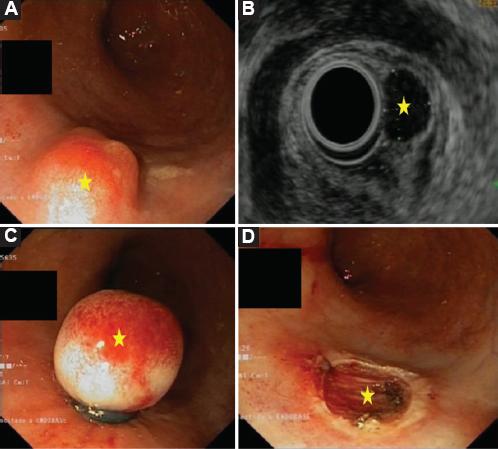
Varón de 52 años con antecedentes personales de fumador y pólipos hiperplásicos en el colon. Sufre CU de larga evolución (24 años) en tratamiento con mesalazina, aunque ha recibido antes tratamiento con azatioprina (un ciclo 22 años antes). En una colonoscopia de control se visualiza una tumoración redondeada submucosa de 5-7 mm en el recto distal con mucosa normal (Fig. 3A). Se practica una ecoendoscopia y se identifica una lesión homogénea unos 6 a 8 cm del margen anal, bien delimitada y circunscrita a la submucosa de 6 x 9 mm (Fig. 3B). Se lleva a cabo resección endoscópica de la tumoración con capuchón y banda elástica (Fig. 3C-D). El informe anatomopatológico reveló un tumor de 0.9 cm de diámetro localizado en el estrato muscular sin invasión linfovascular y con bordes de resección libres. El estudio inmunohistoquímico fue positivo para CgA y sinaptofisina. El índice Ki67 era < 1%. El diagnóstico definitivo fue tumor neuroendocrino G1, estadio I (T1N0M0)4. Con el diagnóstico de TNE rectal se solicitan TC abdominopélvica, gammagrafía con 111In-octeótrido completada con adquisición de SPECT-CT y una determinación de CgA en sangre que fueron normales. Luego de dos años y medio de seguimiento se encuentra asintomático con controles analíticos y endoscópicos sin signos de recidiva tumoral.
Discusión
Existe evidencia acerca de la relación entre pacientes con EII y TNE. West publicó una serie con una incidencia de TNE 14.9 veces mayor en pacientes con EC que en el grupo control5. Hasta la actualidad se han descrito 58 pacientes con un TNE y una EII. Casi todos son hallazgos incidentales en el curso de la operación realizada para el tratamiento de la EII2. Cuando coexisten estas dos anomalías, el TNE tiende a ser más agresivo y tener un peor pronóstico6.
La teoría más aceptada para explicar el nexo entre TNEGI y EII sugiere un papel importante del proceso inflamatorio crónico intestinal, en el que las citocinas proinflamatorias, como TNF, IFNg, IL-2, causan una hiperestimulación e hiperplasia de las células enteroendocrinas7,8. Estas citocinas pueden actuar a distancia, lo que explica la aparición de TNEGI en segmentos no afectados por la EII9.
Los TNE gastrointestinales (TNEGI) provienen de las células enterocromafines de las criptas intestinales, son las neoplasias malignas más comunes del intestino delgado distal y su localización más frecuente es el intestino delgado (45%), seguido del recto (20%). Por lo regular, los TNE situados en el intestino delgado se encuentran en el íleon terminal2,10.
La tasa de incidencia de los TNE ha aumentado en los últimos años; en la actualidad es de 5.25 por cada 100 000 habitantes/año. No existe diferencia en la incidencia entre hombres y mujeres y la media de edad de presentación es de 66 años11.
Los TNEGI son casi siempre asintomáticos hasta etapas avanzadas de la enfermedad, por lo que pueden tener una progresión local en el momento de la presentación clínica o del diagnóstico12. Cuando son sintomáticos, pueden simular un brote de EII13, lo que dificulta aún más su diagnóstico; Hsu informó que 2.3% de los pacientes con tumor carcinoide ileal se diagnosticó y trató de manera inicial como EC14. Es habitual que se encuentren de forma incidental en intervenciones quirúrgicas o en exploraciones endoscópicas en campañas de cribado o por enfermedad digestiva, como sucedió en el caso de estos pacientes.
Los TNEGI pueden presentarse en clínica de forma aguda como cuadros de oclusión intestinal (90% de los casos) o como episodios de hemorragia gastrointestinal. Dentro de las manifestaciones crónicas figuran el dolor abdominal, que suele diagnosticarse como síndrome de malabsorción o de colon irritable, y la pérdida de peso3. El síndrome carcinoide puede aparecer cuando existen metástasis hepáticas y es raro en los TNE rectales.
Para el diagnóstico bioquímico de los TNEGI se emplea la cromogranina A como marcador y la determinación de 5-HIAA en orina, que muchas veces está alterada en casos de enfermedad avanzada7.
Las características radiológicas de los TNEGI pueden ser similares a las de la EII, en especial la EC, en cuanto a la rigidez y las irregularidades de la pared intestinal12. El estudio de elección inicial en casos de sospecha de TNEGI intestinales es la TC, que tiene una sensibilidad del 73%, y sirve para detectar el tumor primario y las metástasis, y planear el tratamiento quirúrgico. La resonancia magnética es el mejor estudio para definir las metástasis hepáticas con una sensibilidad de 95%15.
La gammagrafía con análogos de la somatostatina (Octreoscan) sirve para el diagnóstico y para predecir la respuesta al tratamiento médico, y posee una sensibilidad de 83% y un valor predictivo positivo de 100%, aunque se han registrado casos en que la EC puede causar falsos positivos2,16.
El tratamiento de elección de los TNEGI es la resección. En los tumores del intestino delgado se debe realizar una exéresis quirúrgica amplia que incluya mesenterio y ganglios linfáticos regionales. En los TNE rectales, el tratamiento depende de su tamaño o factores de riesgo (infiltración de la muscular propia, invasión linfovascular, un índice mitótico > 2/10 HPF o un Ki-67 > 2%) y varía desde la resección endoscópica en los tumores < 1 cm hasta la resección de recto en las malformaciones > 2 cm17,18.
En presencia de invasión retroperitoneal o grandes vasos, la resección quirúrgica citorreductora paliativa puede ser adecuada con el fin de disminuir los síntomas sistémicos y prevenir las complicaciones locales. En la enfermedad metastásica hepática, la resección abarca desde una metastasectomía hasta un trasplante hepático. Como tratamientos alternativos o adjuntos pueden emplearse la ablación con radiofrecuencia, la crioterapia y la quimioembolización transarterial2,19.
En el tratamiento sistémico de los TNEGI metastásicos, localmente avanzados o G3 con mal pronóstico se administran los ASS, el interferón y diversos regímenes de quimioterapia convencional2,20. La radioterapia está indicada en las metástasis óseas o del sistema nervioso central3.
Conclusión
Como conclusión puede señalarse que, debido a la relación entre los TNEGI y la EII, y dado que la clínica de las dos entidades puede ser similar, hay que sospechar la presencia de estos tumores en pacientes con EII de larga evolución, que cursen con síntomas inespecíficos y que recibieron tratamiento inmunosupresor, como ocurrió en los casos presentados.











 text new page (beta)
text new page (beta)