Introducción
La artrosis de rodilla es una enfermedad degenerativa que se produce al alterarse las propiedades mecánicas del cartílago y que se acompaña de afectación de otras estructuras de la articulación como son el hueso subcondral, la cápsula articular y la membrana sinovial, entre otras. La pérdida del cartílago origina cambios en el hueso adyacente, cuya respuesta produce deformaciones e intentos de regeneración.1
Es entonces cuando se desencadenan fenómenos inflamatorios secundarios, que son muchas veces la causa de que la artrosis produzca síntomas como el dolor, alteraciones de la movilidad y del funcionamiento de la articulación, conduciendo al enfermo a una discapacidad progresiva para las actividades cotidianas.2
Antecedentes
En 1934 Meyer y Palmer aislaron el humor vítreo bovino, un polisacárido que denominaron ácido hialurónico, el cual es un polímero lineal de alta viscosidad formado por unidades alternas de ácido glucurónico y N-acetil-D glucosamina unidos por enlaces glucosídicos, sustancia que normalmente se encuentra en ciertos tejidos como líquido sinovial, humor vítreo, entre otros, y tiene la propiedad de ser responsable de la visco elasticidad que proporciona a dichos tejidos por su peso molecular así como su concentración.3
Hoy en día es utilizado en el área médica en diversas especialidades, en el área ortopédica es de mayor relevancia para el manejo de la osteoartrosis temprana, como uno de los tratamientos específicos para este tipo de padecimiento.
Hasta hoy en día, no se conoce el período más ideal de la colocación para el manejo de estos pacientes, la mayor parte de su aplicación se basa en la experiencia personal del cirujano.4
A partir de los 50 años, la mayor parte de la población puede presentar manifestaciones radiológicas de esta enfermedad. Sin embargo, sólo una porción de las personas que tienen5 manifestaciones artrósicas en las radiografías presentan síntomas de artrosis. Determinados factores etiológicos (ya sean de tipo mecánico, químico, inmunológico, genético o ambiental) influyen negativamente sobre el condrocito, produciendo un5 desequilibrio metabólico, donde desencadena mediadores proinflamatorios que originan la degradación del cartílago y alteran el tejido sinovial (Tabla 1).
Tabla 1: Factores de riesgo asociados con artrosis.
| Riesgo fuerte positivo: |
| • Aumento de la edad |
| • Historia familiar positiva |
| • Obesidad |
| Riesgo débil positivo: |
| • Menopausia precoz |
| • Diabetes |
| • Hipertensión |
| Riesgo negativo: |
| • Osteoporosis |
| • Cigarro |
| Locales: |
| • Inestabilidad articular/hipermovilidad |
| • Forma articular anormal (congénita o adquirida) |
| • Traumatismo |
| • Actividades físicas especiales |
Altman RD. Classification of disease: osteoarthritis. Semin Arthritis Rheum. 1991;20(6 Suppl 2): 40-7. doi: 10.1016/0049-0172(91)90026-v.
El conocimiento de factores de riesgo para artrosis (principalmente los factores modificables) son de vital importancia para el freno o desarrollo de las alteraciones del cartílago articular (Tabla 2).
Tabla 2: Criterios de clasificación de la artrosis de rodilla.
| Criterios clínicos | Criterios clínicos, de laboratorio y radiológicos |
|---|---|
| 1. Dolor de rodilla* | 1. Dolor de rodilla |
| 2. Crepitaciones | 2. Osteofitos |
| 3. Rigidez matutina de rodilla ≤ 30 minutos | 3. Líquido sinovial de artrosis‡ |
| 4. Edad ≥ 38 años | 4. Edad ≥ 40 años |
| 5. Deformidad ósea | 5. Rigidez matutina de rodilla ≤ 30 minutos |
| 6. Ausencia de crepitaciones y deformidad ósea | 6. Crepitaciones |
| Artrosis de rodilla si | Artrosis de rodilla si |
| 1, 2, 3, 4 o | 1, 2 o |
| 1, 2, 3, 5 o | 1, 3, 5, 6 o |
| 1, 6 | 1, 4, 5, 6 |
| Sensibilidad: 89% | Sensibilidad: 94% |
| Especificidad: 88% | Especificidad: 88% |
* Muchos días el mes anterior.
‡ Líquido sinovial < 2,000 glóbulos blancos/ml, claro viscoso.
Toquero TF, Rodríguez SJJ. Guía de buena práctica clínica en artrosis. 2a ed. Editorial: IM & C, Madrid, DL, 2008.
Etiopatogenia
Existen varias teorías que intentan explicar por qué se produce este fallo articular. La teoría más generalizada defiende que es en el cartílago articular donde se produce la pérdida del equilibrio entre el catabolismo y anabolismo del condrocito, lo cual origina el desequilibrio entre la síntesis y degradación de la matriz extracelular del cartílago articular.6
El resultado final es una destrucción acelerada de la matriz extracelular, principalmente por las enzimas proteolíticas procedentes de los propios condrocitos y de las células sinoviales, seguida por alteraciones en los sistemas de reparación del cartílago.6 Una vez que la enfermedad o la degeneración articular se encuentra avanzada, suele haber homogeneización de los daños y mecanismos comunes de perpetuación del cuadro.1 El condrocito es el único elemento celular presente en el cartílago articular normal; desempeña un papel fundamental en el mantenimiento de la integridad de la matriz extracelular, así como en la reparación del tejido (Tabla 3).7
Tabla 3: Citocinas catabólicas en la artrosis.
| Cartílago | Tejido sinovial | Función | |
|---|---|---|---|
| IL-1 | +++ | +++ | Induce la destrucción e inhibe la síntesis de la MEC |
| IL-1 Ra | ++ | +++ | Inhibe la acción de la IL-1 |
| TNF-α | ++ | +++ | Igual efecto que IL-1, pero menos potente |
| LIF | ++ | ++ | Involucrado en la inhibición de la síntesis de los componentes de la MEC |
| IL-6 | ++ | ++ | Mediador de algunos efectos de la IL-1 y TNF |
| IL-8 | + | + | Atrae a las células inflamatorias a la articulación |
| IL-17* | +++ | + | Induce síntesis de IL-1, PGE2 y MMP |
Se gradúa la importancia de la citocina con +.
IL: interleucina. MEC = matriz extracelular. Ra = antagonista receptor de la IL-1. TNF-α = factor de necrosis tumoral alfa. PGE2 = prostaglandina E2. MMP = metaloproteasas.
Rev Esp Reumatol, 2004.
Es un proceso activo bajo control molecular y por ello requiere un consumo de energía, que se emplea en desmantelar de forma ordenada las estructuras celulares, impidiendo de este modo el daño tisular. Al existir una respuesta ineficaz se producen condrocitos8 inmaduros, inapropiados para soportar las funciones de una articulación.1,8 Esa respuesta compensadora por sí misma, además de ser insuficiente para contrarrestar los daños articulares, es la causa de la generación de osteofitos y la invasión de zonas de cartílago calcificado dentro del cartílago normal.8 Al aumentar sus concentraciones de las citocinas, empiezan a presentarse efectos catabólicos, debido a la activación de metaloproteinasas, esta activación induce destrucción de las fibras de colágeno y de los proteoglicanos (Figura 1).1,6
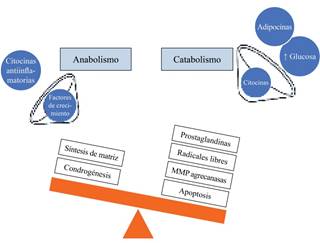
Figura 1: Esquema general del desequilibrio en el metabolismo de la matriz durante el proceso fisiopatológico de la OA y los mecanismos implicados que ocasionan el predominio del catabolismo. IATREIA 2011; 24.
Las respuestas electrofisiológicas y de regulación del volumen intracelular a los cambios de osmolaridad también están alteradas, al parecer por causa de la IL-1β; este hecho es inductor de cascadas apoptóticas en el condrocito y además entorpece la respuesta celular a los cambios dinámicos de la articulación, lo que provoca un círculo vicioso que empeora el proceso fisiopatológico.1
La artrosis se puede clasificar radiográficamente de acuerdo con la escala de Kellgren/Lawrence, así como la relación en el proceso patogénico. En un estudio realizado por J. H. Kellgren y J. S. Lawrence en 1956, se realizó un análisis entre las diferencias y las interpretaciones radiológicas para llegar a determinar grados, y estadificar el tipo de desgaste articular en la artrosis. Este proceso tendría evolutivamente cinco fases:
Fase 0: ausencia de osteofitos, estrechamiento o quistes; fase 1: osteofitos únicamente; fase 2: osteofitos pequeños, estrechamiento de la interlínea moderado, puede haber quistes y esclerosis; fase 3: osteofitos claros de tamaño moderado y estrechamiento de la interlínea; fase 4: osteofitos grandes y pérdida de la interlínea articular y presencia de geodas mismas fases que hasta hoy en la actualidad se han utilizado para determinar el diagnóstico radiológico del desgaste articular, así como la base inicial para el tratamiento de dicha patología (Figura 2).

Figura 2: Escala Kellgren-Lawrence. A: Rx AP. Estado 1: incipiente formación de osteofito, en el cóndilo femoral medial. B: Rx AP. Estado 2: osteofito femoral, con leve disminución del espacio femorotibial. C: Rx AP. Estado 3: osteofitos con pérdida del espacio femorotibial. D: Rx AP. Estado 4: osteofitos con pérdida del espacio y esclerosis asociada. Scott WN. Insall & Scott: Cirugía de la rodilla, 4ª ed. Elsevier España, 2006.
El ácido hialurónico como parte del tratamiento en gonartrosis temprana
El ácido hialurónico es una macromolécula única, que tiene un número biofísico distinto de los bioquímicos y regulación celular en sinovial, así como otros tejidos. Los sinoviocitos tipo B son los encargados de sintetizarlo y secretarlo en la cavidad articular; su mayor parte se encuentra en la articulación.
Una rodilla sana contiene 2 ml de líquido sinovial con una concentración de ácido hialurónico de 2.5 a 4.0 mg/dl; en la artrosis dicha concentración se reduce de la mitad a un tercio del valor normal, esto se traduce en una pérdida de las propiedades mecánicas, una de menor densidad dinámica, una alteración de las propiedades elásticas y una disminución del efecto de filtro y de la barrera del líquido sinovial que afecta la nutrición del cartílago; esta pérdida de lubricación produce un aumento de las fuerzas de tensión y ocasiona una disrupción de la distribución de fibras de colágeno, esencial para la integridad de la superficie articular9 (Tabla 4).
Tabla 4: Propiedades del ácido hialurónico.7),13
| Viscoelasticidad |
| Efecto antiinflamatorio |
| Efecto anabólico |
| Efecto antiálgico |
| Condroprotector |
Fuente. Disponible en: http://www.synviscone.com/~/media/SynviscOneUS/Files/Synvisc-OnePI-70240104.pdf
Bioquímicamente el ácido hialurónico se encuentra enrollado en un estado de reposo, de manera que, cuando se aplica una fuerza a la molécula, no se puede desenrollar y actúa en este caso como un cuerpo elástico; sin embargo, si se aplica una fuerza directa de forma lenta, por ejemplo, como ocurriría al caminar, la molécula se desenrolla y actúa como un lubricante viscoso.
La combinación de estas dos propiedades es fundamental para resistir las fuerzas de compresión y de reducción de la fricción entre las superficies de cartílago opuestas, y depende de la presencia de una concentración fisiológica de ácido hialurónico en el líquido sinovial. Por lo general tiende a ser importante en la homeostasis articular actuando como amortiguador en la transmisión de cargas, como se ha expresado anteriormente, así como otorgar propiedades antinflamatorias y antinociceptivas del líquido sinovial. Inicialmente, estas propiedades mecánicas que presenta son el mecanismo principal, por lo cual la terapia de ácido hialurónico es beneficiosa en el tratamiento de artrosis.
El ácido hialurónico regula diferentes actividades celulares a través de receptores específicos e interacciones con otras moléculas de la matriz extracelular. Se ha identificado un receptor específico de membrana para el ácido hialurónico perteneciente a la familia de glicoproteínas de adhesión CD44, este receptor permite la unión del ácido hialurónico con otras células y que se anclen los agregados de proteoglicanos a la membrana del condrocito y juega además un papel importante en el metabolismo del ácido hialurónico.
En un estudio realizado por Smith y Ghosh se evaluó el efecto de varios preparados comerciales de ácido hialurónico en las articulaciones de pacientes con artrosis. La concentración de los preparados, así como el peso molecular son importantes para estimular de Novo la producción de ácido hialurónico intraarticular. Un peso molecular de 5 x 105 daltons es más efectivo; sin embargo es importante tener en cuenta que una administración excesiva de ácido hialurónico extracelular podría inhibir a los fibroblastos sinoviales. Ghosh ha demostrado a partir de estudios en animales otras propiedades del ácido hialurónico; el efecto analgésico que este proporciona es equiparable a la indometacina en cuanto a la disminución del dolor ocasionado por la administración de bradiquininas, esto ha concluido que el efecto intraarticular del ácido hialurónico disminuye el dolor mediante dos mecanismos: uno de forma directa mediante disminución de nociceptores y otro efecto indirecto a través de la disminución de la sustancia P (péptido involucrado en la transmisión de la señal dolorosa).
La viscosuplementación consiste en la aplicación de inyecciones intraarticulares de soluciones visco elásticas de ácido hialurónico o sus derivados con el objetivo de reestablecer las propiedades reológicas del líquido sinovial alterado en la articulación artrósica. Sin embargo, se han observado diversos resultados en pacientes dependiendo de su peso corporal, tomando en cuenta que, en pacientes con sobrepeso u obesidad, el resultado en muchas ocasiones no es favorable (Tabla 5).
Tabla 5: Requisitos para que una sustancia pueda ser empleada en la viscosuplementación.
| Ausencia de inmunogenicidad |
| Capacidad para difundir de forma pasiva dentro del líquido sinovial |
| Propiedades reológicas nativas |
| Vida media prolongada |
Fuente: Caro AI, Molina CMA. Material de sutura en la farmacia hospitalaria. El Farmacéutico Hospitales. 2012; 199: 5-17.
Pocas son las reacciones adversas con el uso de ácido hialurónico intraarticular y deben de considerarse importantes las propiedades que debe presentar una sustancia para considerarse viscosuplementable.
El hilano G-F20 (Synvics) es una mezcla de hílanos, que son biopolímeros obtenidos a partir del ácido hialurónico por una serie de enlaces cruzados; un fluido elastoviscoso, estéril apirógeno, que contiene hilano A, e hilano B (8.0 mg + 2.0 mg por ml) en solución fisiológica tamponada de cloruro sódico (pH 7.2 + 0.3), biológicamente similar al ácido hialurónico. Es considerado un producto sanitario, es decir, un instrumento, equipo, dispositivo, material u artículo incluidos los accesorios y programas lógicos que intervengan en su buen funcionamiento destinados por el fabricante a ser utilizados en seres humanos o sólo en combinación con otros para fines de diagnóstico, prevención, control, tratamiento o alivio de una enfermedad o lesión. Por su acción mecánica debe considerarse un implante y no medicamento (Tabla 6).
Escalas funcionales para la valoración de artrosis de rodilla
El cuestionario específico global de la extremidad inferior WOMAC (Western Ontario and McMaster University Osteoartritis Index) es uno de los cuestionarios más utilizados para la valoración de resultados en la extremidad inferior, ya que permite evaluar dos de los principales procedimientos realizados en ortopedia, las prótesis de rodilla y cadera en pacientes con artrosis. Consta de 24 preguntas de respuesta múltiple que permiten evaluar diferentes aspectos como el dolor, la rigidez y la capacidad física para realizar actividades cotidianas.10
Tratamientos quirúrgicos por artroscopia en el estadio tres de la escala De Kellgren y Lawrence.
El tratamiento de la artrosis debe ser eficaz y seguro, la finalidad u objetivo es aliviar el dolor, mejorar la capacidad funcional y retrasar la evolución de la enfermedad. El nivel de seguridad de cualquier tratamiento debe garantizar la seguridad, tanto sistémica como articular. El tratamiento de la artrosis debe ser individualizado. Debe tenerse en cuenta el estadio evolutivo de la enfermedad, la afectación clínica, y el grado de desgaste articular.
David Waddell en un artículo de la revista The Journal of arthroscopic and Related Surgery en el 2010 realizó una revisión de literatura sobre la relevancia que tiene la aplicación del ácido hialurónico. En él se dieron a conocer dos publicaciones relevantes para este estudio, ambos estudios realizados en 2002, donde se estudiaron 77 pacientes quienes recibieron tratamiento con ácido hialurónico después de la artroscopía de rodilla. El ácido hialurónico se aplicó en un grupo; mientras que el segundo grupo no recibió inyecciones. Se valoró fuerza muscular y la puntuación de dolor mediante escala visual análoga (EVA) encontrándose estadísticamente mejoría en el grupo que se aplicó ácido hialurónico. Este estudio concluyó al ácido hialurónico como factor positivo en la rehabilitación de estos pacientes con artrosis de rodilla después de una artroscopía.11
Material y métodos
Se diseñó un estudio de tipo ensayo clínico, no aleatorizado longitudinal, prospectivo, analítico, en donde se incluyen 16 pacientes por cada grupo con un rango de edad de 45 a 60 años que tienen gonartrosis grado II-III de acuerdo a los criterios radiográficos de Kellgren y Lawrence, seleccionados de acuerdo a los criterios de inclusión para este estudio, a quienes se les realizará una artroscopía de rodilla y posteriormente serán sometidos a una aplicación de dosis única de ácido hialurónico (6 ml) de acuerdo a lo siguiente: se dividirán en tres grupos para la realización de este estudio, siendo así, el primer grupo será sometido a una evaluación prequirúrgica usando un cuestionario de satisfacción del paciente denominado WOMAC, posteriormente será sometido a la aplicación de 6 ml de ácido hialurónico intraarticular transquirúrgico; se realizarán nuevamente las evaluaciones con base en el cuestionario de satisfacción a los quince días, al mes y a los tres meses de su evolución postquirúrgica.
El segundo grupo será sometido a una evaluación prequirúrgica usando un cuestionario de WOMAC, posteriormente se aplicará ácido hialurónico intraarticular al mes del evento quirúrgico; se realizarán nuevamente las evaluaciones con base en el cuestionario de satisfacción a los quince días, al mes y a los tres meses de su evolución postquirúrgica.
El tercer grupo (grupo control) se someterá a una evaluación prequirúrgica usando misma escala funcional (WOMAC), se realizará la intervención quirúrgica (artroscopía de rodilla), sin colocación de ácido hialurónico intraarticular, se realizarán nuevamente las evaluaciones con base en el cuestionario de satisfacción a los quince días, al mes y a los tres meses de su evolución postquirúrgica. En todos los pacientes sometidos a este estudio se realizaron valoraciones del índice de masa corporal previo al evento quirúrgico.
Los criterios de inclusión fueron: pacientes de ambos sexos, con una edad media de 45 a 60 años de edad quienes mostraron diagnóstico radiográfico de gonartrosis grado II-III y en quienes se haya realizado artroscopía de rodilla.
Los criterios de exclusión: pacientes con antecedentes de importancia como osteotomías de alineación, fracturas de meseta tibial, con enfermedades inmunológicas de tipo artritis reumatoide, con antecedentes de lesiones ligamentarias o que presenten diagnóstico radiográfico de gonartrosis grado IV.
Los criterios de eliminación: paciente que en procedimiento quirúrgico se estadifique en gonartrosis III, que tengan efecto adverso a la aplicación de ácido hialurónico o que durante el desarrollo del protocolo no se apeguen al tratamiento.
En todos los casos sometidos a este estudio se realizó la valoración del índice de masa corporal previo al evento quirúrgico.
Resultados
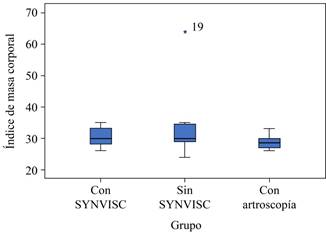
Se estudió un total de 48 pacientes, de los cuales se dividieron 16 por cada grupo con una edad promedio de 50.46 años, tomando en cuenta como edad mínima 20 años y máxima 60 años, así como un índice de masa corporal de 24 y máximo de 34. Al comparar la edad y el índice de masa corporal (IMC) en los tres grupos (con ácido hialurónico, sin ácido hialurónico y con artroscopía). La edad fue mayor para el grupo de sin ácido hialurónico, así como el IMC; aunque esta diferencia no fue estadísticamente significativa entre grupos (Figuras 3 y 4).
La evaluación de la escala de dolor mostró una estos grupos disminución en los tres grupos de forma paulatina y cercana a la mitad para los tres grupos al final del seguimiento. No se encontró diferencia estadísticamente significativa entre grupos (Figura 5).
Para la evaluación de escala de rigidez mediante cuestionario WOMAC se mostró una disminución en los tres grupos de forma paulatina y cercana a la mitad. Sin embargo, en el grupo al que no se aplicó ácido hialurónico se mostró una mejoría mayor para el día 30 y los tres meses, mientras que en los otros grupos no hay cambios ni mejoría en el mismo tiempo (Figura 6).
En escala de capacidad funcional se muestra una disminución en los tres grupos de forma paulatina. Sin embargo, en el grupo al que no se aplicó ácido hialurónico mostró una mejoría mayor para el día 30 y los tres meses, mientras que en los otros grupos la mejoría es menor; esta diferencia no fue estadísticamente significativa entre grupos (Figura 7).
Discusión
La edad promedio muestra un rango amplio de edades entre el grupo de participantes el cual fue desde 20 hasta 60 años de edad, ello implica limitantes en nuestro estudio al valorar pacientes de edad mayor y pacientes jóvenes, puesto que la recuperación no es la misma para ambos grupos de pacientes.
En cuanto al índice de masa corporal y en artículos basados en investigación se muestra que a mayor índice de masa corporal menor capacidad de mejoría en el tratamiento de la gonartrosis, he aquí un punto y rol importante que juega el sobrepeso y la obesidad como punto fundamental en la fisiopatología, en cuanto a las cargas mecánicas que soportan las articulaciones generando un cambio importante a nivel fisiológico e histológico, demostrándose en este estudio enfocado a la clínica y capacidad funcional del paciente, al valorar el rango de índice de masa corporal y el incremento de esfuerzo y recuperación tardía para algunos pacientes durante su evolución. No se encontró diferencia significativa entre estos grupos, lo que hace a estos mismos comparables desde el punto de vista estadístico.
Al valorar el grupo de participantes sin ácido hialurónico se observó a sujetos de mayor edad y mayor índice de masa corporal lo que podría repercutir en los resultados del cuestionario WOMAC en sus diferentes escalas. Sin embargo, la diferencia no fue significativa, por lo que, para fines estadísticos, los grupos fueron iguales al ser comparados en estos parámetros.
En cuanto a la escala de dolor, se muestra que los tres tratamientos son eficaces en la disminución del dolor. Reduciendo hasta 50% los valores basales, a los tres meses de evolución. Lo que coincide con la literatura propuesta por Waddel en 2010.
En la escala de rigidez se muestra eficacia en los tres tratamientos disminuyendo 50% a los tres meses de tratamiento. En el grupo al cual no se aplicó ácido hialurónico de forma inmediata se observó una mejoría a los 30 días y a los tres meses de evolución, disminuyendo la rigidez que, en comparación con los otros grupos, fue mayor.
En escala funcional los tres tratamientos mostraron excelentes resultados, sin embargo, en el grupo que no se aplicó ácido hialurónico de forma inmediata, se observó una mejoría a los treinta días y a los tres meses de evolución, disminuyendo de mejor forma que en comparación con los otros grupos, en quienes su curso fue lento y limitado.
Con estos datos y con esta muestra se determina que los tres procedimientos realizados en este grupo de pacientes han sido eficaces tanto para escala de dolor, escala de rigidez y capacidad funcional.
Por lo tanto, no es concluyente si algún procedimiento es mejor que el otro; aunque existen ciertos datos que sugieren que el utilizar ácido hialurónico durante la artroscopía mejora de cierto modo la rigidez y la funcionalidad, sin embargo, esta observación, no puede compararse ni valorarse en este estudio.
Conclusión
En este estudio se observó que la aplicación de ácido hialurónico al mes de evolución es mejor que la aplicación durante la intervención, objetivo fundamental de este estudio. A pesar de esto y de contar con una muestra de personas de mayor edad y con mayor índice de masa corporal, existe cierta diferencia a los 30 días y a los tres meses de evolución con tendencia a la mejoría, sin embargo, no se consideró representativo para cada uno de nuestros grupos, ya que los cambios graficados y valorados, no muestran un valor importante para nuestra investigación.
Es importante tomar en cuenta que aún no se considera concluyente si el uso de ácido hialurónico transquirúrgico, muestra un papel protagónico para esta patología, sin embargo, se considera útil como coadyuvante al aplicarse en un tiempo mediato a la intervención quirúrgica y no durante la misma.











 text new page (beta)
text new page (beta)