Introducción
En los últimos años se han incrementado las emisiones de CO2 al ambiente; al respecto, la Organización Meteorológica Mundial (OMM) reportó que entre los años 2019-2020, los niveles de CO2 en la atmósfera alcanzaron niveles récord de 410 ppm, que equivale a un 148% más, comparados con los niveles preindustriales (OMM 2021). Este aumento se debe principalmente a diversas actividades humanas, como el uso de combustible para el sistema de transporte vehicular, deforestación e incendios (Montero et al. 2005), además de grandes cantidades de dióxido de carbono, que se liberan por la degradación de los humedales, lo que contribuye al aumento de la temperatura mundial (Palomino-Contreras y Cabrera-Carranza 2007), dado que el CO2 es un gas de efecto invernadero que contribuye con el calentamiento global (Díaz-Franco et al. 2016).
En contraparte los bosques tienen gran capacidad de almacenamiento de carbono. Al respecto, un estudio realizado en bosques naturales de Honduras, reportan un secuestro anual de CO2 de 105 989.86 t (Alberto y Elvir 2008); pero estos, no son los únicos ecosistemas que proveen ese servicio. También, los humedales juegan un rol importante por su alta capacidad de almacenamiento de carbono, por medio de las macrófitas y el fitoplancton (Medrano et al. 2012, Lolu et al. 2019); así como, los manglares que son muy eficientes en este proceso a largo tiempo, como lo indica Rovai et al. (2021). En los humedales se reportan diversas macrófitas, por ejemplo en la Bahía de Cohana del lago Titicaca, se halló hasta 58 especies (Fontúrbel et al. 2006), las cuales almacenan carbono y contribuyen de forma significativa en la retención de carbono, al mismo tiempo que brinda un servicio ambiental (Palomino-Contreras y Cabrera-Carranza 2007). Aunque dependiendo de la especie de macrófitas, se sabe que algunas contribuyen en mayor porcentaje que otras, como es el caso de las especies emergentes (Maqbool y Khan 2013) teniendo éstas mejores resultados en monocultivos y en zonas controladas (Means et al. 2016).
Los humedales brindan diversos servicios ecosistémicos, como el almacenamiento de carbono (Cejudo y Herrera-Caamal 2019, Lin et al. 2019, Lund y Drake 2020), por lo que algunos autores, las consideran como uno de los principales sumideros de carbono del planeta (Mitsch et al. 2013, Dvoráková-Brezinová y Vymazal 2018). Lo que se debe principalmente a la descomposición incompleta de la biomasa vegetal en los sedimentos, la presencia de macrófitas y fitoplancton, los que contribuyen en el almacenamiento de carbono (Calva Benítez y Torres Alvarado 2011, Dvoráková Brezinová y Vymazal 2018, Mitsch et al. 2013). Dentro de los cuales, las macrófitas emergentes son las que fijan la mayor cantidad de carbono que las sumergidas (Maqbool y Khan 2013), dado que éstas últimas están condicionadas al paso de la luz y al carbono disuelto en el agua (Liu et al. 2020, Madsen et al. 1996). Pero los estudios realizados en humedales y macrófitas fijadoras de carbono en muchos lugares son escasos, por lo que es necesario realizar estudios para entender mejor los beneficios que brindan estos ecosistemas (Lolu et al. 2019).
En el lago Titicaca se encuentra una gran cantidad de macrófitas, esencialmente totorales y llachales, cuya presencia permite mitigar los impactos que provienen de las actividades antropogénicas (Goyzueta et al. 2009), como la emisión de gases por el sistema vehicular y vertimiento de aguas residuales, que afectan el desarrollo de las especies predominantes de la zona. La biomasa de macrófitas es abundante, principalmente en la zona de orilla (Dejouxy Iltis 1991), lo que contribuye con el proceso de captura de CO2; dado que, cierto porcentaje de la biomasa es carbono (PELT y TDPS 2000, PELT y ADESU 2001), aproximadamente el 50% (Dávalos et al. 2008); lo que permite entender, parte de los beneficios ambientales que proporcionan estos ecosistemas. Por lo anterior, el objetivo del estudio fue estimar la concentración de carbono almacenado en la biomasa de cuatro especies de macrófitas predominantes en la Bahía interior de Puno y la variación de almacenamiento de carbono entre ellas, para conocer el aporte de estas macrófitas en la mitigación de CO2 en el ambiente.
Materiales y métodos
Área de estudio
La zona de estudio se encuentra en el lago Titicaca, conocida como; Bahía interior de Puno. Tiene un área de 17.5 km2 (Ocola-Salazar y Laqui-Vilca 2017), profundidad máxima de 7.19 m (Loza del carpio et al. 2016); temperatura entre 12 y 13 °C y precipitación anual de 700 a 1000 mm. Con diversidad de flora y fauna, de las cuales para el estudio se tomó en cuenta las cuatro especies de macrófitas más dominantes del área, que son, Schoenoplectus tatora, Elodea potamogetón, Myriophyllum elatinoides y Potamogeton strictus. La ciudad de Puno está asentada a orillas de la Bahía, con actividades antrópicas, como el vertimiento de aguas residuales y emisión de gases provenientes del conjunto de los automóviles que transitan por la ciudad y de la quema ilegal de totorales. La zona fue elegida de acuerdo a los impactos antrópicos que existen, los cuales influencian el almacenamiento de carbono, principalmente el vertimiento de aguas residuales provenientes de la ciudad de Puno.
Diseño de muestreo
Se seleccionaron cinco puntos de muestreo dentro del área de la Bahía interior de Puno, de acuerdo a la influencia de actividades antrópicas presentes en la zona (Tabla 1). El muestreo se realizó durante los meses de agosto, setiembre, octubre y noviembre del 2011, se colectaron muestras por duplicado, de Schoenoplectus tatora, Elodea potamogeton, Myriophyllum elatinoides y Potamogeton strictus, de las cuales se tomaron muestras de tallos y hojas mediante muestreo directo en cuadrantes de 1 m2, para luego extraer la parte sumergida, así como la parte emergente comprendidos dentro del área del cuadrante (sin rizomas); para luego guardar las muestras en depósitos de plástico y luego trasladarlas al laboratorio para su análisis. La temperatura se registró con un termómetro digital marca thermometer herwowe, el pH con un potenciómetro marca Hanna, la transparencia del agua fue medida con un Disco Secchi, cuya medida es el promedio de la profundidad a la que el ojo humano deja de ver el disco metálico (20 cm de diámetro) al ser introducido en el agua, y la profundidad en la que aparece de nuevo al ojo humano (Lee et al. 2015), las coordenadas se registraron con un GPS marca Garmin etrex 30 y la profundidad se midió con una barra de madera milimétrica, dado que las mayores áreas de esta zona están ocupadas por profundidades menores a 1 m, como máximo 4 m (Loza-Del-Carpio et al. 2016). Todos estos parámetros se midieron en la zona de muestra de la planta, en la columna de agua, antes de tomar las muestras de macrófitas, para no alterar las mediciones.
Tabla 1: Descripción de los puntos de muestreo en la Bahía interior de Puno del lago Titicaca.
| Puntos de muestreo | Coordenadas geográficas | Zonas de muestreo | Descripción | |
|---|---|---|---|---|
| X | Y | |||
| P1 | 8249802 | 393464 | Isla Esteves | Con tránsito de lanchas motorizadas. Además, por esta zona existen hoteles turísticos que vierten sus aguas servidas directamente al lago sin tratamiento alguno, con un pH promedio de 8.08, transparencia de 0.54 m profundidad 0.87 m. |
| P2 | 8248861 | 394276 | Isla Joroba | En esta área existe gran cantidad de totorales, está cerca de la ruta de transito de las embarcaciones que zarpan desde el muelle de Puno con dirección a las islas flotantes de los Uros; con un pH promedio de 8.09, transparencia 0.71 m, profundidad 1.39 m. |
| P3 | 8247028 | 395035 | Cerca de Chimu | Esta zona se halla cerca de la laguna de oxidación de la ciudad de Puno. No es la zona con la transparencia mas alta, hay otros puntos con > transparencia. Tiene un pH promedio de 7.96, transparencia 0.58 m, profundidad 1.47 m. |
| P4 | 8247364 | 393083 | Cercanías de la Isla espinar | Cerca de este punto está el efluente de aguas residuales de la ciudad de Puno; las macrófitas que existen por esa zona son los totorales. Con un pH promedio de 7.97, transparencia 0.42 m, profundidad 1.19 m. |
| P5 | 8249257 | 396947 | Malecón Eco-turístico | Es una zona recreativa, en el cual se emplea cayacs. También en esta zona se realizó un tratamiento con microorganismos eficientes, cuyos resultados hasta la fecha son positivos, pues a la observación directa el agua se muestra transparente, así como la presencia de macrófitas e incluso especies de peces. Con un pH promedio de 7.78, transparencia 0.27 m, profundidad 0.27 m. |
Análisis en laboratorio
En el laboratorio se determinó el peso de la biomasa húmeda (Drexler et al. 2021), después se pusieron las muestras en una estufa de convección natural a 75 °C, hasta obtener peso constante para determinar la biomasa seca. Luego se dividió la muestra en cuatro submuestras por especie, las cuales se pulverizaron en un mortero, se tomó su peso inicial; para posteriormente llevar las submuestras a una mufla para calcinarlas a 400 °C y determinar el peso de cenizas para calcular la materia orgánica de cada especie, que se calculó como la diferencia entre el peso inicial y final de la muestra dividido entre el peso de la muestra inicial. Determi nada la materia orgánica en la biomasa seca, se determinó la cantidad de carbono almacenado por especie en g m2, con la siguiente fórmula
Dónde: % C = porcentaje de carbono por especie, % M.O.= porcentaje de materia orgánica y 1.724 = constante (Palomino y Cabrera 2007).
Con la cantidad de carbono almacenado, se determina la cantidad de CO2 capturado en unidades de gramos (g m2) con la fórmula:
Donde: CO2 = Dióxido de carbono, C = Carbono, Kr = 3.67, factor de conversión a CO2, resultante del cociente de los pesos moleculares del dióxido de carbono 44 y del carbono 12. Dado que una molécula de Carbono pesa 12 g.mol-1 y una molécula de CO2 pesa 44 g.mol-1, luego 44/12 = 3.67, una tonelada de carbono fijada en un árbol equivale a fijar 3.67 toneladas de CO2.
Análisis estadístico
Se usaron las pruebas de Kolmogorov-Smirnov y el Test de Levene, para comprobar la dis tribución normal y la homogeneidad de varianzas, las cuales indicaron que los datos no cumplían con los criterios para aplicar una prueba paramétrica, por lo que se aplicó el análisis de Kruskal Wallis con un nivel de confianza del 95%, para luego realizar la prueba de contraste de Kruskalmc (Prueba de comparación Múltiple después del Kruskal-Wallis) con un nivel de significancia de P < 0.05. También se realizó una correlación de Pearson para relacionar el carbono almacenado en la biomasa de macrófitas y variables ambientales, como profundidad y trasparencia. Los análisis se realizaron en el software libre R versión 4.0.3.
Resultados
Almacenamiento de carbono en biomasa seca de macrófitas
Para el carbono almacenado en las macrófitas S. tatora es la especie con mayor porcentaje de carbono en su biomasa seca con 55%, seguida de E. Potamogetón con 48%, M. elatinoides con 47.5%, y P. strictus con un 47.4% (Figura 1).
Almacenamiento de carbono en macrófitas
En relación al carbono almacenado por m2, los resultados indican que S. tatora tiene la mayor cantidad y variación, ya que su valor máximo fue de 1 276 g.m2 y su valor mínimo de 44 g.m2, seguida de E. potamogeton con máximo y mínimo de 313.7 y 41.28 g.m2, M. elatinoides con valor máximo y mínimo de 96.9 y 8.07 g.m2, y P. strictus con valor máximo y mínimo de 84.5 y 7.7 g.m2, respectivamente (Figura 2). Estos resultados indican que el contenido de carbono es significativamente superior en S. tatora con media de 629.4 g.m2, seguida de E. Potamogeton con 109.8 g.m2, M. elatinoides con 45.11 g.m2, y P. strictus con 34.5 g.m2. La prueba de Kruskal Wallis; mostró diferencias significativas (Kruskal Wallis = 1.58e-12, P < 0.05); lo que indica que por lo menos una especie es diferente al resto con respecto al contenido de carbono almacenado en su biomasa seca. Para verificar las diferencias y/o similitudes, se realizó la prueba de rango múltiple de Kruskalcm, la cual detectó significancia entre S. tatora con las otras especies (p < 0.05), lo cual se visualiza en la Tabla 2; donde se observa que S. tatora es la que presenta el mayor almacenamiento de carbono; debido a su concentración en la biomasa.
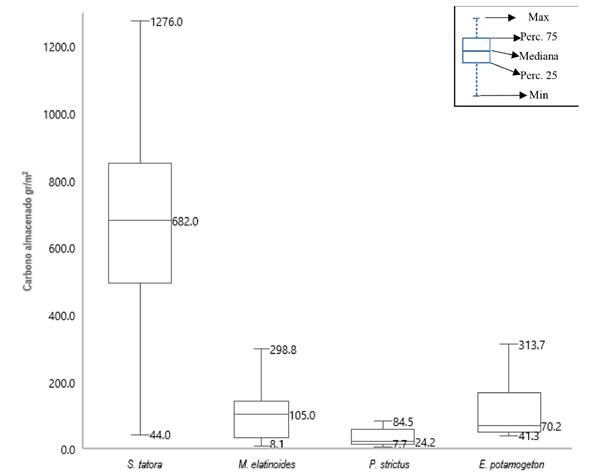
Figura 2: Comparación de almacenamiento de carbono en macrófitas predominantes en la Bahía interior de Puno del lago Titicaca.
Tabla 2: Prueba de comparación múltiple Kruskalmc entre el carbono almacenado por macrófitas.
| Comparaciones | Dif. Obs | Dif. critica | Diferencia |
|---|---|---|---|
| Elodea-Miriophyllum | 14.025 | 27.33282 | False |
| Elodea-Potamogeton | 17.275 | 27.33282 | False |
| Elodea-Schoenoplectus | 87.000 | 27.33282 | True* |
| Miriophyllum-Potamogeton | 3.250 | 27.33282 | False |
| Miriophyllum-Schoenoplectus | 72.975 | 27.33282 | True* |
| Potamogeton-Schoenoplectus | 69.725 | 27.33282 | True * |
Dif. obs. y Dif. critica, representan los valores de diferencias observadas y críticas de la comparación.
Para el CO2 fijado, los resultados muestran una tendencia similar a la del carbono almacenado, observándose que S. tatora es la especie que mayor cantidad de CO2 captura del ambiente, con media de 2 309.97 g.m2, seguida de E. potamogetón con 402.98 g.m2, M. elatinoides con 375.8 g.m2 y P. strictus con media de 126.70 g.m2. Esta variación puede deberse a que la fijación de CO2 se da mejor en plantas acuáticas de tallos emergentes que las sumergidas, ya que las plantas sumergidas están supeditados a factores adversos que pudieran perjudicar su normal desarrollo, como la transparencia, pH, temperatura, nutrientes, contaminación, presión atmosférica, entre otras.
Carbono almacenado en los cinco puntos de estudio
La especie que mayor cantidad de carbono almacenó en los cinco puntos de muestreo fue S. tatora, principalmente en el punto tres se tuvo una media de 825 g.m2, y la menor cantidad en el punto cinco con valor medio de 116.6 g.m2 (Figura 3). Esto puede deberse a que el punto tres está cerca de la laguna de oxidación por lo que hay mayor cantidad de nutrientes necesarios para su desarrollo; además de que tienen profundidades apropiadas para el desarrollo de esta especie, a pesar de la época de estiaje la variación del nivel del agua no es significativa. Pero en el punto cinco, la variación de la profundidad si fue notoria, lo que pudo influir en sus bajos niveles de captación de carbono.
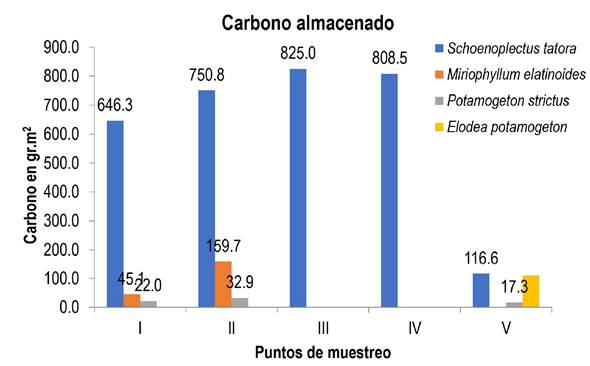
Figura 3: Almacenamiento de carbono en macrófitas, en cinco puntos de muestreo de la Bahía interior de Puno del lago Titicaca.
Con respecto a P estrictus, se aprecia que, en el segundo punto de muestreo tuvo la mayor cantidad de carbono con media de 32.9 g.m2, mientras que en las zonas tres y cuatro no se registra esta especie; lo cual pudiera estar influenciado por el ingreso de aguas residuales a esas zonas. Mientras que, los puntos uno y dos están distantes de este foco contaminante; por lo que, al tener menor influencia, hay mayor transparencia en la columna de agua de 54 cm en el punto uno y 70 cm en el punto dos, lo cual repercute en el mayor paso de la luz; lo que favorece su desarrollo. En tanto, que en las zonas de muestro tres y cuatro la profundidad fue mayor y la transparencia menor por la contaminación de aguas residuales. En lo que respecta a M. elatinoides, solo se encontró en el punto uno y dos, los cuales tienen aguas transparentes, con mayor oxigenación y están alejadas de la laguna de oxidación, lo cual explicaría su presencia, más no en los otros puntos de estudio. Mientras que E. potamogetón, solo se encontró en el punto cinco, lo que se puede deber a que no es una especie exigente en cuanto a nutrientes, pero si con respecto a la transparencia y temperatura, además de que requiere aguas superficiales. Lo que puede explicar que no se encontró en los primeros cuatro puntos de muestreo, ya que la temperatura promedio fue de 13 °C, mientras que en el malecón ecoturístico el promedio de temperatura fue de 15 °C, con poca profundidad, lo que contribuyó a su desarrollo.
Los resultados de la correlación de Pearson para la cantidad de carbono almacenado y parámetros como profundidad, pH, y transparencia (Tabla 3), corroboran la explicación del porqué no se encuentra algunas especies en los puntos de estudio mencionado; como S. tatora, M. elatinoides y P. strictus que presentan correlación positiva con la profundidad de 79, 81 y 80%, respectivamente. Lo que indica, que a mayor profundidad mayor desarrollo de la especie. En tanto que E. potamogeton tiene una relación débil pero inversa, es decir, que a mayor profundidad menor almacenamiento de carbono. El pH no muestra influencia, mientras que la transparencia tiene leve relación positiva con las especies. En lo referente a E. potamogeton no se consideró en este análisis debido a que hubo 100% de transparencia en todas las mediciones realizadas.
Tabla 3: Correlación de Pearson entre la cantidad de carbono almacenado por las macrófitas y variables ambientales.
| Especies | Profundidad | pH | Transparencia |
|---|---|---|---|
| Schoenoplectus tatora | 0.79464 | 0.16059 | 0.51961 |
| p-valor | 9.252e-10 | 0.3222 | 0.0005902 |
| Miriophyllum elatinoides | 0.81481 | 0.04756 | 0.47810 |
| p-valor | 0.0001209 | 0.8611 | 0.06105 |
| Potamogeton strictus | 0.79715 | 0.08181 | 0.19400 |
| p-valor | 0.117e-06 | 0.7039 | 0.3637 |
| Elodea potamogeton | -0.38577 | 0.18596 | - |
| p-valor | 0.3452 | 0.6593 |
Discusión
Almacenamiento de carbono en biomasa seca de macrófitas
El porcentaje de carbono en la biomasa seca de macrófitas, no está lejos de los resultados reportados en vegetales, al respecto el Panel intergubernamental de cambio climático (IPCC) así como otros estudios, reportan que el porcentaje promedio de carbono almacenado en vegetales es el 50% de la biomasa seca (IPCC 2005, Dávalos et al. 2008, Tobías-Baeza et al. 2019). Mientras que Dávalos-Sotelo et al. (2008), reportan que el contenido de carbono a nivel de especie puede variar del 40.27 al 46.29% e incluso puede ser mayor de 50%; en tanto que Mota et al. (2011) indican que el porcentaje de carbono almacenado puede oscilar entre el 45 y 50% del peso seco de la planta. Las diferencias reportadas en este estudio se pueden deber a que las especies estudiadas tienen diferentes características anatómicas y fisiológicas, con necesidades y condiciones a las que deben de adaptarse. Por lo que, el promedio porcentual de conversión de carbono es del 50%, pudiendo oscilar por debajo o por encima de este valor, como se encontró en este estudio.
Almacenamiento de carbono en macrófitas en los cinco puntos de muestreo
En relación a las macrófitas y su capacidad de almacenamiento de carbono, S. tatora fue la especie que mayor cantidad de carbono almacenó en su biomasa por metro cuadrado. Lo que coincide con estudios realizados en humedales, los cuales indican que Schoenoplectus californicus, especie similar a la a S. tatora, es la que mayor carbono almacena en su biomasa, a diferencias de otras macrófitas (Palomino-Contreras y Cabrera-Carranza 2007, Medrano et al. 2012). Por ello diversos estudios consideran a esta especie, debido a su extensa área de crecimiento en el lago Titicaca. Al respecto en el área de la Reserva Nacional del Titicaca existe gran cantidad de biomasa debido a la mayor profundidad y mínimos niveles de fluctuación de agua; con profundidades entre los 2 y 4 m, que son adecuados para el desarrollo de esta especie (PELT y TDPS 2000, Goyzueta et al. 2009); incluso el CIDAB (2003) menciona que esta macrófita puede crecer hasta cinco metros de profundidad. En tanto que P. strictus, prefiere zonas de aguas transparentes, mientras que Potamogetón pectinatum crece hasta 1.5 m de profundidad en zonas con sustrato arenoso o algo limosos (URS-CHE 2010). Tam bién se sabe que esta especie se desarrolla mejor en zonas oligotróficas ubicadas en aguas lénticas como las de la zona de estudio (PELT y TDPS 2000, San Martín et al. 2011). En tanto que M. elatinoides necesita una gran cantidad de luz, y que algunas especies de este género pueden crecer hasta 10 metros de profundidad en condiciones apropiadas (URS-CHE 2010). Al respecto el PELT y TDPS (2000) mencionan que es una especie asociada a S. tatora, que presenta tallos frágiles, difusión limitada por el movimiento de las aguas y por la dureza del substrato. En tanto que, E. potamogeton prefiere zonas someras como en las orillas de la Bahía de Cohana, el lado boliviano del lago Titicaca (Fontúrbel et al. 2006), así como en las orillas y canales de ingreso de los pantanos de Villa-Lima (Ramirez y Cano 2011). Por lo que, las especies P. strictus, M. elatinoides, y E. Potamogeton son de aguas oligotróficas, transparentes, dado que desarrollan su ciclo vegetativo y comportamiento fenológico dentro del agua, por lo que es necesario el paso de la luz (Fontúrbel et al. 2006), y la contaminación de la columna de agua las afectará más que a las especies con tallos emergentes.
Conclusiones
La especie S. tatora fue la de mayor porcentaje de conversión de carbono tuvo en la biomasa seca, mientras que P. strictus fue la de menor porcentaje de carbono. También S. tatora presento la mayor cantidad de almacenamiento de carbono y CO2 por metro cuadrado. Los factores que más influyeron en la captura de carbono fueron la profundidad y turbidez. También las actividades antrópicas repercuten en la captura de carbono de las diferentes especies, debido a que la contaminación de las aguas, se desplazan a zonas de menor influencia antrópica, principalmente en el caso de las plantas sumergidas como E. potemogenton, M. elatinoides y P. strictus. Se encontró capacidad de almacenamiento de carbono en las macrófitas estudiadas; por lo que, su distribución, función y capacidad de almacenamiento son prometedoras y significativamente sostenibles; por ello deberían ser mejor valorados por presentar un servicio ambiental.











 text new page (beta)
text new page (beta)




