Introducción
Las bacterias son microorganismos procariotas que se clasifican según su forma, temperatura y pH en el que se desarrollan, la estructura de su pared y por su requerimiento de oxígeno (Mollinedo y Gonzales 2014). También hay bacterias importantes como agentes de control biológico por su efecto antagónico frente a otros microorganismos (Földes et al. 2000). Las bacterias Gram positivas que forman endosporas se agrupan en el género Bacillus, las cuales se encuentran distribuidas en diversos hábitats tanto marinos como terrestres y a las especies asociadas a plantas; se les conoce como rizobacterias promotoras del crecimiento vegetal (Chen et al. 2006). El término rizobacterias promotoras del crecimiento vegetal, (PGPR o plant growth promoting rhizobacteria), fue propuesto para bacterias que habitan en las raíces de las plantas y que ejercen un efecto positivo sobre los cultivos (Hernández-Rodríguez et al. 2006, Pedraza et al. 2010). En últimos años, el uso de este tipo de bacterias ha tenido una fuerte demanda, ya que esta nueva tecnología promete mejorar la productividad de los sistemas agropecuarios a largo plazo (Cassán y Díaz-Zorita 2016). El Brevibacilus brevis se clasifica de acuerdo a su genotipo y filogenética (Goto et al. 2004) actúa como agente de control biológico, presenta antagonismo frente a otros microorganismos, y producen sustancias antimicrobianas y antifúngicas, y promueven el crecimiento vegetal, debido a la producción de ácido indolacético (AIA), hormona utilizada para el desarrollo radical, vegetativo y producción de frutos (Reinoso-Pozo et al. 2012, Chalé-Carrillo et al. 2016). Estudios previos con Brevibacilus brevis indican que tiene efectos en el control de Botrytis cinerea (Edwards y Seddon 2001) y en Rhizoctonia solani en frijol (Hernández-Pérez y Díaz-Zorita 2018).
La utilización de sábila y melaza para desarrollo de microorganismos es una opción debido a los contenidos de sustancias que son vitales para el desarrollo de estos. Entre los componentes de la sábila (Domínguez-Fernández et al. 2012), se encuentran las antraquinonas, Vitaminas (B1, 2, 3 y 6, E, C, ácido fólico y beta caroteno), minerales (Calcio, magnesio, potasio, zinc, fósforo y hierro), carbohidratos (celulosa, fructosa, glucosa, glucomanosa), enzimas (lipasa, amilasa y catalasa), aminoácidos (alanina, ácido aspártico, glicina, fenilalanina, acido glutámico), lípidos (esteroides, giberelinas, ácido úrico, ácido salicílico, saponinas y triterpenos). Por otro lado, la melaza (Swan y Karalazos 1990) contiene 20% de agua sacarosa, 35%, glucosa 7%, levulosa 9%, sustancias reductoras 3%, carbohidratos estructurales 4%, cenizas 12%, compuestos nitrogenados 4.5%, compuestos no nitrogenados 5%, ceras, esteroides y esterofosfolípidos 0.4%, así como vitaminas en pequeña cantidad. Los medios de cultivo contienen sustancias en las que se desarrollan microorganismos debido a que les brinda de manera artificial las condiciones necesarias para su crecimiento (Negroni 2009), como el C, H, O, N, P, K, S, Ca, Mg y en menor cantidad el Fe, Mn, Zn, Cu y Mo (Pelczar et al. 2010). Además, de que tienen alto costo; como el medio de Luria Bertani (LB), que ha sido utilizado para aislar bacterias promotoras del crecimiento vegetal, otro es el NFb (Nitrogen free broth) el cual no tiene nitrógeno, quien identifica bacterias con capacidad de fijar nitrógeno (Mantilla-Paredes et al. 2009). Por otro lado, los factores como pH y la concentración del sustrato, afectan directamente en los patrones de crecimiento y formación de productos asociados con el metabolismo del microorganismo (Ossa et al. 2010). Por ello, en el presente trabajo se evaluaron los factores físico-químicos del sustrato para el óptimo desarrollo y reproducción in vitro de la bacteria Brevibacilus brevis, hacer eficiente el tiempo e insumos para la preparación de medios de cultivo.
Materiales y métodos
Ubicación del experimento y material biológico
El presente trabajo se realizó en la Universidad Autónoma Agraria Antonio Narro, en el laboratorio de Cultivo de Tejidos del Departamento de Horticultura, en Saltillo, Coahuila, México. Como material biológico se utilizó una cepa extraída de raíces de nopal e identificada mediante la técnica de PCR con la que se obtuvo una secuencia de aminoácidos que se comparó con la base de datos BLAST®, determinando que es Brevibacillus sp. G12, la cual se conservó en congelación a -20 °C
Tratamientos
Se establecieron treinta tratamientos con las combinaciones de medios de cultivo: Sábila y Melaza 1% (SM 1%), Sábila y Melaza 0.5% (SM 0.5%), Sábila y Melaza 0.1% (SM 0.1%), Luria Bertani (LB), Nitrogen Free broth (NFb), tres pHs: 6, 7 y 8, dos tiempos de incubación: 48 y 96h, y cuatro repeticiones por tratamiento.
Reactivación de Brevibacillus sp. G12
La cepa bacteriana contenida en microtubos se descongeló a 32 °C por 1 h, pasado el tiempo se tomaron 160 µL y se inocularon en 80 mL de medio nutritivo líquido Nitrogen Free broth (NFb) a pH 7, para luego incubar por 48 h a 32 °C. Después de dos días se realizaron diluciones seriadas 1 a 10, tomando 1 mL del caldo nutritivo y depositándolo en tubos de ensaye (kimble-KIMAX 16 x 150 mm) con 9 mL de agua destilada. De los tubos con dilución 10-10 y 10-11 se tomaron 500 µL de cada tubo y se depositaron en cajas de Petri (vaciado en placa) con medio NFb sólido a pH 6.8 sembrado en estría, para luego incubar por 48 h a 32 °C. Para cada tubo se utilizó una caja Petri por triplicado.
Tinción de Gram
Se realizó después de 48 h de la reactivación de la bacteria, aplicando los reactivos para teñir y observar la bacteria en el microscopio con objetivo de 100X (López-Jácome et al. 2014).
Preparación de medio de cultivo Sábila y Melaza (SM)
Para este medio SM se prepararon 3 concentraciones: melaza al 1% (10 g L-1), al 0.5% (5 g L-1) y 0.1% (1 g L-1), mezclando para cada concentración con 1% de pulpa de sábila (10 g L -1), los medios de cultivo de cada concentración se prepararon por triplicado. Con el potenciómetro (Hanna Hi-98128), se ajustó el pH a 6, 7 y 8. Se depositaron 80 mL de medio SM en frascos con capacidad de 100mL a 120 °C por 15 min para esterilizar cada medio.
Preparación del medio Luria Bertani (LB)
Para 1 L de medio se pesaron 10 g de peptona de caseína, 5 g de extracto de levadura y 5 g de cloruro de sodio. Una vez disueltos los ingredientes se ajustó el pH por separado a 6, 7 y 8. Se depositaron 80 mL de medio LB en frascos de 100 mL y se esterilizaron en autoclave a 120 °C por 15 min.
Preparación de medio de cultivo Nitrogen Free broth (NFb)
Este medio de cultivo no tiene nitrógeno (N2), por lo que permite el aislamiento y crecimiento de microorganismos que pueden fijar biológicamente nitrógeno. Además, contiene ácido málico, principal fuente de carbono para la bacteria. Para la preparación de un litro de medio de cultivo se pesaron: 0.04 g L-1 Fosfato de potasio dibásico (KH2PO4), 0.5 g L-1 de Fosfato de potasio monobásico (K2HPO4), 0.01 g L-1 de Cloruro férrico (FeCl3), 0.002 g L-1 de Molibdato de sodio (Na2MoO4), 0.002 g L-1 de Sulfato de manganeso (MnSO4), 0.2 g L-1 de Sulfato de magnesio (MgSO4), 0.1 g L-1 de Cloruro de sodio (NaCl), 2 g L-1 de Ácido málico (C4H6O5), 2 g L-1 de Agar bacteriológico, y 6 gotas L-1 de Azul de bromotimol. Posteriormente, con un potenciómetro se reguló el pH a 6, 7 y 8. Para luego depositar 80 mL del medio NFb líquido en frascos con capacidad de 100 mL, los cuales se esterilizaron en autoclave a 120 °C por 15 min.
Inoculación e incubación del microorganismo
Con una micropipeta se midieron 160 µL de la bacteria sembrada en medio NFb líquido pH 7 y se depositaron en los medios nutritivos NFb, LB y SM contenidos en los frascos. Posteriormente, se colocaron en un agitador mecánico oscilatorio (Labnet 211DS), a temperatura de 32°C a 100 RPM, para luego evaluar las rizobacterias a las 48 y 96 h. Por cada medio de cultivo se emplearon cuatro repeticiones.
Diluciones
Para cada tiempo (48 y 96 h) y repeticiones se hicieron diluciones seriadas 1/10 tomando 1 mL del medio nutritivo con la bacteria, para luego depositar en un tubo de ensaye (kimble-KIMAX 16 x 150 mm) con 9 mL de agua destilada previamente esterilizada, el mismo procedimiento se aplicó con el segundo tubo, y así sucesivamente hasta llegar al undécimo tubo. Se tomaron 500 µL de los tubos de la dilución 1011, que se depositaron en placas para su siembra por estría y posterior incubación. Después de 48 h se contabilizaron las UFC mL-1 de cada placa.
Diseño experimental
El diseño experimental utilizado fue completamente al azar con arreglo factorial (5x3x2). Los factores incluyeron medio de cultivo (cinco niveles), pH (tres niveles) y tiempo de incubación (dos niveles). Los datos obtenidos se analizaron con el programa SAS 9.4 utilizando una prueba de comparación de medias de Tukey (p ≤ 0.05).
Resultados y discusión
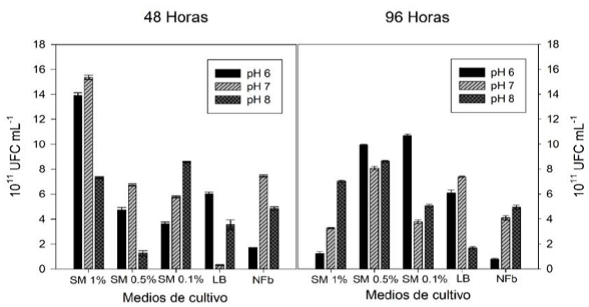
El análisis de varianza (Tabla 1) muestra diferencias altamente significativas entre los factores individuales y las interacciones. En la Figura 1a, se observa que los mayores valores de UFC los tuvieron los medios de cultivo NFb pH 7 y SM 0.1% pH 7 con 9.91 y 9.82 x 1011 UFC mL-1. Mientras que el medio de cultivo para NFb este resultado es 71.64% mayor al obtenido con pH 6 y 48.64% que con pH 8. En tanto que el medio SM 0.1% con pH 7 fue superior un 47.55% al obtenido con pH 6 y 59.98% mayor con pH 8. Al respecto, Sezonov et al. (2007) reportan que el crecimiento de Escherichia coli en medio LB está limitado por la disponibilidad del carbono y no por el pH, aunque considera que el pH alcalino causa la inhibición del crecimiento. Mientras que Jiménez-Delgadillo et al. (2018) encontraron que el pH y no la temperatura influyen en la tasa de crecimiento de Bacillus subtilis en caldo infusión papa. En tanto que Sánchez y Pérez (2018) reporta que al evaluar el crecimiento de Pseudomonas y Azotobacter en medios de cultivo agar triptona de soya y Asbhy a Ph 7, no encontró efecto del pH en el crecimiento, por lo que concluyó que para las rizobacterias el pH 7 es el adecuado, lo que coincide con los resultados de la presente investigación.
Tabla 1 Cuadrados medios del recuento de bacterias con los diferentes factores evaluados.
| Fuente de Variación | Grados de Libertad | CM |
| 1011UFC mL-1 | ||
| Medio de Cultivo | 4 | 73.86*** |
| pH | 2 | 145.55*** |
| Tiempo | 2 | 25.16*** |
| Medio de Cultivo*pH | 8 | 46.93*** |
| Medio de Cultivo*Tiempo | 8 | 33.22*** |
| pH*Tiempo | 4 | 166.14*** |
| Medio de Cultivo*pH*Tiempo | 16 | 49.00*** |
| CV (%) | 10.99 |
Tukey **(p ≤ 0.001), ***(p ≤ 0.0001), CV = coeficiente de variación.
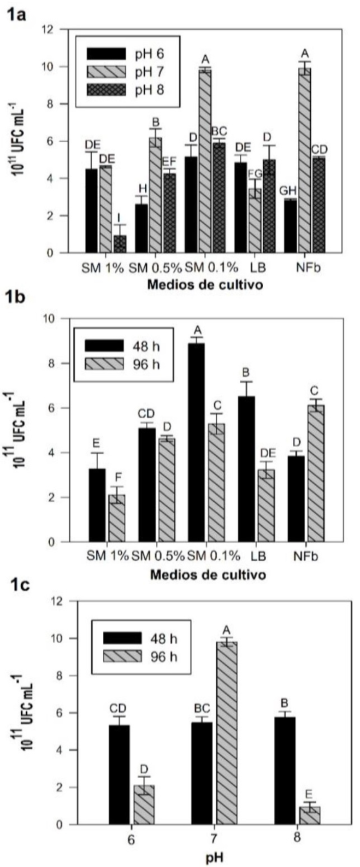
Figura 1 Interacción entre el medio de cultivo y pH (1a); medio de cultivo y tiempo de incubación (1b); pH y tiempo de incubación (1c) en relación a la reproducción de Brevibacilus brevis. (Tukey, p ≤ 0.05).
En la Figura 1b se observa que para el medio SM 0.1% a 48 h de incubación se produce la mayor concentración de bacteria con 8.88 x 1011 UFC mL-1, lo que presenta diferencias significativas sobre los otros tiempos de incubación, teniendo un aumento de 37.05% en relación con el tiempo de 96 h de incubación. Resultados similares fueron encontrados en el desarrollo de Lactobacillus plantarum con melaza como sustrato (Ossa et al. 2010), mientras que en bacterias fijadoras de nitrógeno con tiempos de incubación de 24 y 48 h, se reporta que con 48 h se tiene el mayor crecimiento (Muangthong et al. 2015).
El pH 7 por 96 h de incubación tuvo 9.81 x1011 UFC mL-1, valor que es diferente significativamente con respecto a los otros resultados (Figura 1c). Al respecto, se reporta el rango óptimo de pH para las bacterias fluctuando de 6.0 a 8.5, pero sólo pocas bacterias prefieren un pH de 8.5 o mayor (Cervantes-Martínez et al. 2017). Al respecto, se observa que a las 96 h con pH de 7 se tuvo una diferencia del 78.7% en relación al pH 6 y de 90.52% para pH 8 a las 96 h, respectivamente. Para el medio SM 1%, pH 7 y 48 h de incubación se obtuvo el mayor crecimiento con 15.38 x1011 UFC mL-1 (Figura 2). Este valor es superior en un 9.62% con respecto a lo obtenido con el medio SM 1%, pH 6 y 48 h. Lo que coincide con aislados de la rizósfera de raíz con melaza de caña de azúcar con incubación de 24 h en medio Nfb (Mounthang et al. 2015). En relación al medio SM al 1% (Sábila-melaza) que produjo el mejor resultado, se puede deber a que la bacteria transforma la sacarosa en glucosa y fructosa como fuente de carbono y energía por medio de la enzima invertasa, lo que permite el aumento en la velocidad del crecimiento (Takeshige y Ouchi 1995), aunado a que los minerales presentes como calcio, magnesio, fósforo y potasio ayudan a la reproducción de las bacterias (Ossa et al. 2010). Por otro lado, la sábila (Aloe vera) contiene 20 aminoácidos entre esenciales y no esenciales, enzimas y elementos minerales que son indispensables para el metabolismo y actividad celular (Contreras 2007), siendo complementarios la melaza y sábila al proveer los nutrientes necesarios que la bacteria requiere para su óptimo crecimiento, ya que la viabilidad de las bacterias se determina por la energía que requieren para crecer y mantenerse (Caltaneo et al. 2007). En relación al pH, Brevibacillus brevis es un microorganismo neutrófilo pudiendo ajustar el medio de crecimiento, lo que favorece el movimiento de sustancias a través de la membrana (Pírez y Mota 2000). Sin embargo, cuando el medio de crecimiento alcanza la alcalinidad el desarrollo de la bacteria tiende a disminuir, ya que afecta la permeabilidad de la membrana (Ossa et al. (2010). Mientras que a pH 7 aumenta 1.5 veces la cantidad de compuestos que controlan patógenos producidos por Brevibacilus brevis (Arumugan y Senthil, 2017). Para el tiempo de incubación se encontró que 48 h fue el tiempo de reproducción y desarrollo idóneo para Brevibacillus brevis, comparable con el tiempo utilizado por Sánchez-López et al. (2012), para la reproducción de Pseudomonas sp. y Bacillus sp., ya que a 24 h la bacteria se encuentra en adaptación y el proceso de reproducción es parcial y en Lactobacillus plantarum con melaza al 20% como sustrato, encontraron que a 30 ± 1°C por 24 h, se tuvo el óptimo desarrollo con 43 x 109 UFC mL-1, concentración que fue 100 veces mayor con una dilución de sábila y melaza al 1%. Las mejores condiciones para la reproducción de Brevibacillus brevis fueron con medio de sábila y melaza al 1% con pH 7, 100 RPM y 48 h de incubación.











 text new page (beta)
text new page (beta)