El derrame de petróleo crudo (PC) derivado de su extracción y manejo, representa un grave problema de contaminación para los ecosistemas (Du et al. 2011, Arruda 2014). La consecuencia directa es la contaminación del suelo, e indirectamente del aire, aguas superficiales y subterráneas (Alkio et al. 2005). Cuando el PC llegan al suelo reduce la infiltración y la disponibilidad del agua, la difusión de oxígeno y afecta la relación carbono/nitrógeno (Obire & Nwaubeta 2002, Sari et al. 2018). Esto genera altos niveles de estrés en las plantas que son capaces de sobrevivir a la presencia del contaminante, particularmente durante el periodo de aclimatación (Alkio et al. 2005, Chamovitz 2018). Algunos hidrocarburos presentes en el PC como el fenantreno y pireno pueden reducir el crecimiento foliar y radicular e incluso provocar la muerte de las plantas (Ahammed et al. 2012).
Las especies vegetales que son capaces de aclimatarse a la presencia del PC se clasifican en co-tolerantes y múltiple-tolerantes, es decir, que tienen la capacidad de tolerar algunos o casi todos los contaminantes orgánicos e inorgánicos (González-Mendoza 2013, Tahir et al. 2016). En este sentido, la principal respuesta de las plantas ante la presencia del PC es la reducción de algunos de sus procesos fisiológicos, la intensidad de la respuesta depende de la concentración del contaminante. La Norma Oficial Mexicana (NOM-138-SEMARNAT/SSA1-2012) destaca un máximo permisible de hidrocarburos en el suelo [200 mg/kg (ligera), 1,200 mg/kg (media) y 3,000 mg/kg (pesada)] (DOF 2013), sin embargo, estas fracciones son superadas usualmente en campo, lo que conlleva a distintas respuestas fisiológicas de las plantas en sitios con diferente grado de contaminación (Cossío et al. 2014, Arias-Trinidad et al. 2017, Castro-Mancilla et al. 2019).
Se ha encontrado que especies como Amorpha fruticosa reducen su tasa fotosintética, conductancia estomática, transpiración y contenido de clorofila al encontrarse en suelos contaminados con PC a concentraciones de 5 a 20 g kg-1, mientras que Fraxinus rotundifolia concentraciones de 500 a 2,000 g de PC, alteran significativamente el intercambio de gases provocando una reducción en la fotosíntesis (Han et al. 2016, Haroni et al. 2019). De igual forma, en árboles de Avicennia marina y Bruguiera gymnorrhiza el PC reduce la tasa de transporte de electrones (TTE), así como la eficiencia cuántica del fotosistema II (ΦPSII) en una dosis de 5 l m-2 (Naidoo et al. 2010).
Derivados del petróleo, como el diésel, tuvieron efectos similares en especies como Populus deltoides y Populus euramericana en donde una concentración de 6,667 l por ha-1 en suelo, disminuyó la conductancia estomática y transpiración (Pilipović et al. 2019). Dosis de 6 a 24 g también provocaron una disminución en la concentración de clorofilas a y b, clorofila total y carotenoides en Pinus sylvestris y Fagus sylvatica (Bęś et al. 2019). En suelos contaminados con concentraciones entre el 5 y 15 % de diésel sobre 3 kg de suelo, Quercus oleoides registró una reducción en el intercambio de gases, conductancia estomática y en el contenido de clorofila (Castro-Mancilla et al. 2013, 2019).
La presencia de 13,651 mg kg-1 de PC en suelo, también resultó en modificaciones morfológicas en Mimosa pilulifera, como la reducción en los brotes, en el diámetro de la base y en el ápice de la raíz, además de una alteración en la estructura celular del meristemo apical, lo que afectó el desarrollo vegetal (Inckot et al. 2008). Además, en concentraciones que van de 18,000 a 47,100 mg kg-1 de PC, especies como Cedrela odorata, Haematoxylum campechianum, Swietenia macrophylla y Tabebuia rosea redujeron su altura y biomasa, además, C. odorata y T. rosea presentaron una alta mortalidad en todas las concentraciones (Pérez-Hernández et al. 2013, 2017).
Si bien se puede encontrar información sobre el efecto morfológico y fisiológico de algunas especies bajo condiciones de PC en suelo, existe poca información sobre las estrategias fisiológicas de las especies vegetales capaces de aclimatarse a la presencia de PC. La respuesta de las plantas ante los cambios ambientales se puede analizar a través de la caracterización de su plasticidad (Valladares et al. 2006, Grenier et al. 2016, Cach-Pérez et al. 2018). La plasticidad fenotípica es uno de los medios por los cuales las plantas pueden ajustar su morfología y/o fisiología para enfrentar la heterogeneidad ambiental; este parámetro se mide a través de un índice que va de cero (baja plasticidad) a uno (alta plasticidad; Valladares et al. 2006). En este contexto, la plasticidad puede jugar un papel primordial en la supervivencia de las plantas en suelos contaminados con PC, ya que una alta plasticidad podría permitir enfrentar los desafíos fisiológicos que enfrentan ante las modificaciones en las condiciones del suelo después de un evento de contaminación (Fordyce 2006, Sulmon et al. 2014).
Debido a la urgente necesidad de encontrar especies vegetales con uso potencial en procesos de biorremediación de suelos contaminados con PC, el objetivo del presente trabajo fue identificar las estrategias fisiológicas que adoptan dos especies arbóreas (Haematoxylum campechianum y Tabebuia rosea) ante la presencia de un suelo contaminado con diferentes concentraciones de PC, bajo condiciones de vivero; el monitoreo se realizó desde el momento de la contaminación hasta 292 días después. Lo anterior sirvió para determinar su plasticidad fisiológica en respuesta a la presencia del contaminante. Los resultados de este estudio pueden aportar datos para el uso de estas especies arbóreas para la recuperación y remediación de los sitios afectados. Dado que existen reportes respecto a que ambas especies toleran al PC en suelo (Pérez-Hernández et al. 2017), se espera una plasticidad fisiológica alta en ambas especies. Por otra parte, se espera que el intercambio de gases, transpiración, conductancia estomática, eficiencia de uso del agua, fluorescencia de la clorofila, potencial hídrico y osmótico foliar sean más afectados en plantas de T. rosea respecto a los individuos de H. campechianum.
Materiales y métodos
Se estableció un experimento en un vivero de 133 m2 con techo de lámina plástica transparente que dejó pasar el 90 % del total de la luz solar incidente. El experimento consistió en el establecimiento de plantas de dos especies arbóreas bajo tres tratamientos, cada uno de los cuales contó con diferente concentración de petróleo crudo (PC) en suelo.
Se utilizó un suelo franco arenoso que se contaminó con PC pesado (12.9° API; American Petroleum Institute) que se obtuvo a través de una solicitud hecha a Petróleos Mexicanos (PEMEX). La contaminación del suelo se realizó siguiendo el protocolo de Pérez-Hernández et al. (2013, 2017) bajo condiciones controladas para evitar la contaminación de sustrato fuera del experimento. Para establecer el intervalo de los tratamientos se consideraron como referencia los límites máximos permisibles de hidrocarburos en suelo con uso agrícola, forestal, pecuario y de conservación de la NOM-138-SERMANAT-2012 que varía según su fracción ligera (200 mg/kg), media (1,200 mg/kg) y pesada (3,000 mg/kg) de base seca (DOF 2013).
En el primer tratamiento se mezclaron ocho litros de PC con 40 kg de suelo (concentración baja, CB; 15,170 mg kg-1), en el segundo se mezclaron 10 litros de PC con 40 kg de suelo (concentración media, CM; 15,300 mg kg-1), y en el tercero se mezclaron 12 litros de PC con 40 kg de suelo (concentración alta, CA; 15,600 mg kg-1); además se estableció un tratamiento control (C) con suelo sin contaminar. Se colocaron 2 kg del suelo contaminado en 60 macetas cilíndricas de 3.4 dm3, con 12 cm de diámetro y 30 cm de alto. Las macetas no tenían agujeros en la base, para evitar que el PC se filtrara al suelo fuera de las mismas (Castro-Mancilla et al. 2013, Pérez-Hernández et al. 2017).
Se seleccionaron las especies arbóreas Tabebuia rosea (Bertol.) DC. y Haematoxylum campechianum L., por su capacidad de supervivencia en suelos contaminados con PC, por presentar un rápido crecimiento y por ser consideradas especies multipropósito (maderables, artesanales, leña y carbón, construcción, medicinal, forraje, ornato, melíferas; Ochoa-Gaona et al. 2008, 2011, Cámara-Cabrales et al. 2011, Sánchez-Gutiérrez et al. 2016, Chan-Quijano et al. 2020). Se utilizaron 80 plántulas con el tallo lignificado (40 de T. rosea y 40 de H. campechianum) con alturas de entre 40 y 60 cm. Para cada tratamiento de suelo contaminado se utilizaron 10 plántulas por especie. Las plántulas se obtuvieron del vivero de la Comisión Nacional Forestal delegación Tabasco y el otro de la Secretaría de Energía, Recursos Naturales y Protección Ambiental del estado de Tabasco; todas las plántulas provienen de semillas de árboles adultos de la región.
Las macetas se colocaron en el vivero con una separación de 15 cm entre sí, para reducir los efectos de borde dentro del vivero, los tratamientos se distribuyeron mediante un diseño completamente al azar. Las plantas pasaron por un proceso de aclimatación de 123 días (octubre 2017 - febrero 2018) en el suelo contaminado; durante este periodo (y a lo largo del experimento) las plantas fueron regadas a capacidad de campo con 150 ml de agua una vez cada tercer día.
Durante la aclimatación y el experimento, la temperatura promedio del aire dentro del vivero fue entre 25.90 ± 1.97 y 28.78 ± 4.18 °C, respectivamente; mientras que la humedad relativa promedio del aire fue de 75.85 ± 15.39 a 88.56 ± 8.21 %, respectivamente. Estas mediciones se llevaron a cabo con una estación microclimática portátil con sensores de temperatura y humedad relativa del aire (S-THB-M002), y un cuantómetro para registrar la radiación fotosintéticamente activa (RFA; modelo S-LIB-M003) conectados a un registrador HOBO U30-NRC (Onset Computer Corporation, Bourne, EUA). Durante cada evaluación fisiológica se instaló una estación microclimática dentro del vivero, además de una estación de referencia a cielo abierto, ambas se colocaron una vez al mes por cinco días (antes, durante y después de las mediciones fisiológicas) registrando datos cada 10 minutos, las 24 horas del día. Los datos de RFA se utilizaron para calcular la incidencia lumínica total diaria al interior del vivero (promedio de 17.22 ± 1.12 mol m-2 d-1). Después del periodo de aclimatación se iniciaron las mediciones fisiológicas como se indica a continuación.
Evaluación fisiología de las plantas. El experimento tuvo una duración de 292 días y superó los tiempos experimentales utilizados por Pérez-Hernández et al. (2013) y Pérez-Hernández et al. (2020) en el desarrollo de especies arbóreas en suelos contaminados en invernadero, que duraron entre 70 y 203 días. Durante este tiempo y considerando el tiempo de aclimatación se evaluó el desempeño fisiológico de las plantas al inicio (147 días), intermedio (215 días) y final (292 días) del experimento, mediante la medición del intercambio de gases, conductancia estomática y eficiencia del uso del agua, la fluorescencia de la clorofila, el contenido de clorofila, el potencial hídrico y osmótico.
Intercambio de gases, transpiración y eficiencia del uso del agua. La asimilación de CO2 (A), la transpiración (E) y la conductancia estomática (gsw) se evaluaron entre las 6:00 h y las 18:00 h en la hoja superior de cada planta; se utilizó un analizador de gases en el infrarrojo LI-6400XTR (Li-Cor Inc. Lincoln, Nebraska, EUA) acoplado a una cámara de hojas equipada con una fuente de luz LED (6400-02). La cantidad de luz incidente en las hojas se igualó a la registrada justo antes de cada medición por un cuantómetro conectado al LI-6400XTR; el equipo se calibró a 400 ppm de CO2. En cuanto a los datos de A y E se presentan los datos del total neto diario calculado mediante una integral de los datos registrados durante el día (Pimienta-Barrios et al. 2003, LI-COR Technical Solutions 2015, Pérez-Hernández et al. 2021) como sigue:
Donde
Donde 180 minutos es el tiempo entre mediciones (3 horas). Las integrales (totales diarios) de A y E se usaron para calcular la eficiencia del uso del agua (EUA) como:
Donde A es la asimilación de CO2 total diaria (mol CO2 m-2 d-1) y E es la transpiración total diaria (mol H2O m-2 d-1). También se presenta el curso diario de la EUA calculada a partir de los datos instantáneos de A y E. Para H. campechianum no fue posible realizar la medición de intercambio de gases debido al tamaño de la cámara de medición la cual requería hojas con mayor área foliar.
Fluorescencia de la clorofila. La eficiencia cuántica del fotosistema II en hojas aclimatadas a la obscuridad (Fv/Fm) y en presencia de luz (ΦPSII), así como la tasa de transporte de electrones (TTE) y la disipación no fotoquímica de energía (DNE), se evaluaron mediante un fluorómetro Mini-Pam II (WALZ, Effeltrich, Alemania), inmediatamente después de medir el intercambio de gases, en este caso, en ambas especies. Se presentan únicamente los datos registrados a las 12:00 h para ΦPSII, TTE y DNE, ya que representan el momento de mayor estrés como se observa en los cursos diarios de evaluación (Figuras S1, S2).
Contenido de clorofila. Se determinó en hojas totalmente desarrolladas tomadas de la parte intermedia de la planta para cada especie; se utilizó una técnica no destructiva, empleando un medidor de concentración de clorofila portátil MC-100 (Apogee Instruments, EUA) en todos los casos.
Potencial hídrico y osmótico foliar. Se colectaron cinco hojas por planta para T. rosea y 15 folíolos para H. campechianum; en ambos casos, la colecta se realizó previo al amanecer. Las muestras colectadas fueron envueltas en papel aluminio y colocadas en una hielera, previo a la determinación del potencial hídrico, lo cual se realizó utilizando un higrómetro de punto de rocío WP4 (Decagon Devices, Pullman, WA, EUA). Para el potencial osmótico las muestras se colocaron en nitrógeno líquido hasta su evaluación en cámaras C-52 conectadas a un osmómetro Psypro (Wescor, Inc, EUA); para ello, la muestra de hoja se maceró en un mortero para extraer la savia, con la cual se saturó un disco de papel filtro de 3 mm de diámetro, el cual se incubó dentro de la cámara C-52 por un periodo de 20 min a 25 ºC, después de lo cual, se llevó a cabo la determinación del potencial osmótico. En ambos casos, las muestras se procesaron en el Laboratorio de Ecofisiología Vegetal y Sistemas Agroforestales (LEVSA) de El Colegio de la Frontera Sur unidad Villahermosa.
Índice de plasticidad fisiológica. Se utilizó el índice de plasticidad basado en distancias fenotípicas relativas (RDPI por sus siglas en inglés), que va de cero (sin plasticidad) a uno (alta plasticidad; Valladares et al. 2006). El índice se define como:
donde
Análisis estadísticos. Los análisis para la comparación de los totales diarios A, E y EUA (para T. rosea), así como para el contenido de la clorofila, Fv/Fm, ΦPSII, TTE, potencial hídrico y osmótico (en ambas especies), se realizaron mediante ANOVAs factoriales (Zar 2010) considerando los tratamientos [suelo no contaminado (control, C), suelo contaminado a concentración baja (CB), media (CM) y alta (CA) de PC] y los días transcurridos [inicio (147 días), intermedio (215 días) y final (292 días)] como factores. De igual forma, para analizar los cursos diarios de A, E, EUA (para T. rosea), se realizó un ANOVA factorial por día de medición, con los tratamientos y hora del día como factores. Estos análisis se realizaron en el software Statistica versión 7.0 para Windows (StatSoft 2007). Previo a los análisis se comprobó la normalidad y homogeneidad de varianzas y se utilizó la prueba post hoc de Tukey cuando fue necesario. El índice de plasticidad no presentó normalidad, por lo que se analizó a través de la prueba U de Mann-Whitney, la cual se realizó en R v. 4.0.5 (R Core Team 2021). Para identificar las estrategias fisiológicas de las plantas bajo los diferentes tratamientos, se realizó un análisis no métrico de escala multidimensional (NMDS) utilizando el paquete vegan (Oksanen et al. 2019) en R; para la comparación de rangos de variación en la respuesta fisiológica entre días de medición, se calculó la covarianza de los datos de salida del NMDS por día de medición (este análisis no asume una relación lineal entre las variables). Todas las salidas de los estadísticos se presentan en el (Material suplementario, Tablas S1 a S10).
Resultados
Intercambio de gases, conductancia estomática y uso eficiente del agua. No encontramos interacción significativa entre el tratamiento y días transcurridos sobre la asimilación total diaria de CO2; las plantas de T. rosea presentaron los valores máximos al día 215 en todos los tratamientos, que fue hasta 75.7 % mayor con respecto a las mediciones realizadas al inicio y final del experimento (Tabla 1; F = 129.93, P < 0.05). Las plantas del tratamiento CA presentaron los valores de asimilación total diaria más bajos a lo largo del todo del experimento, con excepción del día 292 donde también las plantas bajo el tratamiento control presentaron valores bajos (F = 8.55, P < 0.05). Por otro lado, las plantas de los tratamientos CB y CM presentaron los valores más altos al final del experimento (día 292; F = 129.93, P < 0.05).
Tabla 1 Asimilación neta diaria de CO2 (A; mol CO2 m-2 d-1), transpiración neta diaria (E; mol H2O m-2 d-1), eficiencia promedio diaria del uso del agua (EUA; mol CO2/mol H2O) de Tabebuia rosea creciendo en suelos contaminados con petróleo crudo bajo cuatro tratamientos: control (C), concentración baja (CB, 15,170 mg kg-1), concentración media (CM, 15,300 mg kg-1) y concentración alta (CA, 15,600 mg kg-1) a los días 147, 215 y 292 después de haber iniciado el experimento. Letras diferentes indican diferencias significativas entre tratamientos, por variable y día de medición (α = 0.05). Los datos son promedios ± EE (error estándar; n = 10 plantas por tratamiento, por especie).
| Día de medición | Tratamiento | A | E | EUA |
|---|---|---|---|---|
| 147 | C | 0.074 ± 0.05a | 28.29 ± 0.89b | 0.0026 ± 0.0001a |
| CB | 0.061 ± 0.004a | 40.78 ± 2.71a | 0.0015 ± 0.0001a | |
| CM | 0.076 ± 0.005a | 39.74 ± 2.61a | 0.0019 ± 0.0001ª | |
| CA | 0.044 ± 0.014b | 23.11 ± 2.15b | 0.0021 ± 0.0001a | |
| 215 | C | 0.150 ± 0.012a | 58.39 ± 2.93b | 0.0025 ± 0.0002b |
| CB | 0.181 ± 0.006ª | 83.97 ± 4.67a | 0.0021 ± 0.0001b | |
| CM | 0.160 ± 0.011a | 82.76 ± 2.70ª | 0.0019 ± 0.0001b | |
| CA | 0.128 ± 0.011b | 29.03 ± 2.22c | 0.0044 ± 0.0002a | |
| 292 | C | 0.068 ± 0.006b | 45.92 ± 1.92b | 0.0014 ± 0.0001a |
| CB | 0.100 ± 0.005a | 132.39 ± 4.25a | 0.0008 ± 0.0001b | |
| CM | 0.072 ± 0.011a | 126.95 ± 3.01a | 0.0005 ± 0.0001b | |
| CA | 0.066 ± 0.005b | 51.40 ± 3.39b | 0.0013 ± 0.0001a |
En cuanto a la transpiración (E) total diaria para plantas de T. rosea encontramos interacción significativa entre la concentración de PC en suelo y los días transcurridos bajo las diferentes concentraciones del contaminante (F = 49.48, P < 0.05); las plantas bajo los tratamientos CB y CM fueron las que presentaron los valores más altos a lo largo del experimento. De igual forma, se encontró un incremento gradual en todos los tratamientos a lo largo del experimento, registrando los valores máximos hacia el día 292 (Tabla 1).
En cuanto a la eficiencia en el uso del agua total diaria (EUA, Tabla 1) también encontramos un efecto combinado de la concentración de PC y los días transcurridos; hubo una disminución a lo largo del experimento, registrando los valores más bajos al final del experimento en todos los casos (F = 5.15, P < 0.05). La EUA más alta a lo largo del experimento se registró en las plantas del tratamiento control (C), con la única excepción de los registros al día 215 donde las plantas en el tratamiento CA presentaron los valores más altos.
El curso diario de asimilación de CO2 mostró que, al intermedio y final del experimento, las plantas bajo el tratamiento CB presentaron una mayor asimilación a las 12:00 h respecto a los otros tratamientos (F = 3.71, P < 0.05, Figura 1D, F = 3.19, P < 0.05, Figura 1G, respectivamente); no se encontraron diferencias significativas entre tratamientos en los demás horarios de medición en los tres días de evaluación.

Figura 1 Curso diario de fijación de CO2 (A), transpiración (E) y eficiencia en el uso del agua (EUA) durante 292 días de medición en Tabebuia rosea creciendo en suelos contaminados con petróleo crudo. A, B y C corresponden al día 147; D, E y F al día 215, y G, H e I al día 292. Tratamientos: control (C), concentración baja (CB, 15,170 mg kg-1), concentración media (CM, 15,300 mg kg-1) y concentración alta (CA, 15,600 mg kg-1) a los días 147, 215 y 292 después de haber iniciado el experimento. Los datos son medias ± EE (error estándar; n = 10 plantas por tratamiento, por especie). Los asteriscos indican diferencias significativas entre los tratamientos para un mismo día y hora de medición (α = 0.05).
En cuanto a la transpiración (E), para el día 147 (Figura 1B), las plantas del tratamiento CA presentaron la mayor tasa de transpiración a lo largo del día con respecto a los otros tratamientos, aunque sólo se registraron diferencias a las 15:00 h (χ2 = 10.43, P < 0.01) en el día 215 (Figura 1E), las plantas de los tratamientos CB y CM presentaron la mayor tasa de transpiración a las 9:00 h y 12:00 h (F = 2.05, P = 0.02); hacia el día 292 (Figura 1H), las plantas bajo el tratamiento CM fueron las que presentaron la mayor tasa de transpiración a lo largo del día, encontrando diferencias significativas entre las 9:00 h y las 15:00 h (F = 7.56, P < 0.05).
Finalmente, en lo que respecta a la eficiencia en el uso del agua (EUA), las plantas del tratamiento control presentaron los valores más altos, mientras que las plantas en el tratamiento CA presentaron los valores más bajos a lo largo del día 147 (F = 2.24, P = 0.08, Figura 1C), para el día 215 las plantas del control presentaron la mayor EUA entre las 9:00 h y 12:00 h (F = 2.05, P = 0.02, Figura 1F); sin embargo, el día 292, no se registraron diferencias significativas entre tratamientos (F = 2.22, P = 0.27, Figura 1I).
Fluorescencia de la clorofila. Los valores del Fv/Fm para T. rosea (Figura 2A) se incrementaron significativamente conforme avanzó el experimento, aunque no se registró un efecto significativo en interacción entre factores sobre esta variable; al día 147 se registraron los valores más bajos, y en la última medición (día 292) se alcanzaron los valores máximos que fueron hasta 12.5 % más altos respecto a la primera medición (F = 119, P < 0.05). Además, en la última medición (día 292), las plantas bajo el tratamiento CA registraron los valores más altos de Fv/Fm, sin embargo, no se encontraron diferencias significativas entre los tratamientos y el tiempo (F = 1.29, P = 0.28, Figura 2A). Por el contrario, en H. campechianum se encontró un efecto combinado (interacción significativa) entre la concentración de PC y los días transcurridos sobre el Fv/Fm (F = 3.50, P < 0.01). Al día 147, las plantas bajo el tratamiento control presentaron los valores más altos (0.76 ± 0.00), mientras que durante la mitad del experimento (día 215), las plantas del tratamiento CA presentaron los valores más altos (0.79 ± 0.00). En general a mitad del experimento se presentaron los valores de Fv/Fm más altos, mientras que a final del experimento los valores habían descendido en todos los casos (Figura 2B).
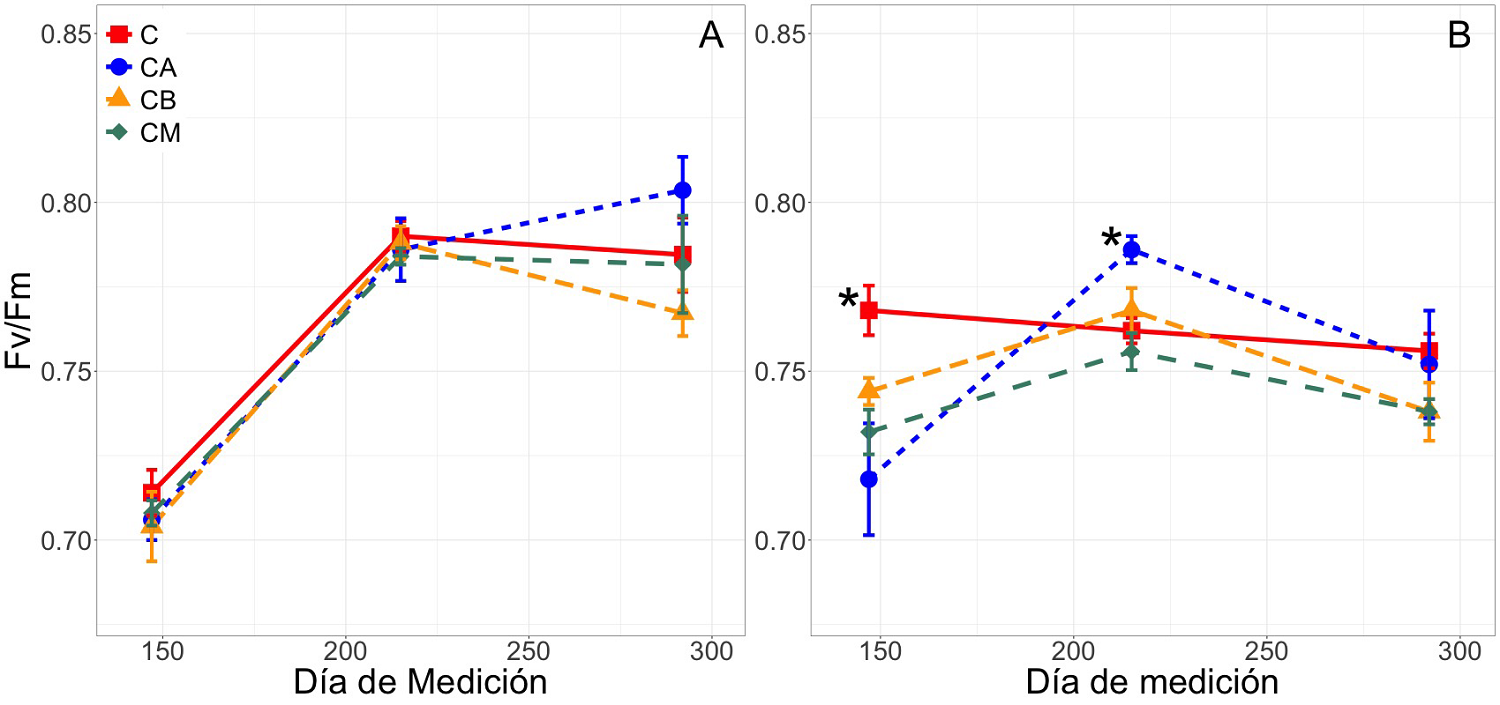
Figura 2 Eficiencia cuántica del fotosistema II en plantas aclimatadas a la obscuridad (Fv/Fm) para platas de Tabebuia rosea (A) y Haematoxylum campechianum (A). Tratamientos: control (C), concentración baja (CB, 15,170 mg kg-1), concentración media (CM, 15,300 mg kg-1) y concentración alta (CA, 15,600 mg kg-1) a los días 147, 215 y 292 después de haber iniciado el experimento. Los datos son medias ± EE (error estándar; n = 10 plantas por tratamiento, por especie). Asteriscos indican diferencias significativas entre tratamientos por día de medición (α = 0.05).
La eficiencia cuántica del fotosistema II (ΦPSII) para plantas tanto de T. rosea, como de H. campechianum presentó los valores más bajos durante la medición del medio día (12:00 h) para todos los tratamientos, a lo largo del experimento (Figura 2, S1, S2); considerando que este punto fue el de mayor estrés para las plantas, los individuos de T. rosea presentaron un incremento en el ΦPSII en este momento del día desde el inició hasta el final del experimento en todos los tratamientos (F = 45.65, P < 0.05, Tabla 2). En el día 147 y 292 del experimento las plantas control presentaron valores hasta 44.6 y 24 % más bajos que en el resto de los tratamientos, respectivamente (F = 10.37, P < 0.05, Tabla 2); no se registraron diferencias entre tratamientos en el día 215. En plantas de H. campechianum se observaron los valores más altos de la ΦPSII a la mitad del experimento (día 215; F = 5.60, P < 0.01, Tabla 2); las plantas bajo el tratamiento CM fueron las que presentaron los valores más bajos al día 215 (F = 7.18, P < 0.01), mientras que el resto de los tratamientos no difirieron entre sí (Tabla 2).
Tabla 2 Párametros de la fluorescencia de la clorofila para Tabebuia rosea y Haematoxylum campechianum registrados a las 12:00 h. ΦPSII. - rendimiento cuántico del fotosistema II, DNE. - disipación no fotoquímica de energía y TTE.- tasa de transporte de electrones (𝜇molm-2s-1). Tratamientos: control (C), concentración baja (CB, 15,170 mg kg-1), concentración media (CM, 15,300 mg kg-1) y concentración alta (CA, 15,600 mg kg-1) a los días 147, 215 y 292 después de haber iniciado el experimento. Letras diferentes indican diferencias significativas entre tratamientos por variable y día de medición (α = 0.05). Los datos son medias ± EE (n = 10).
| Tabebuia rosea | Haematoxylum campechianum | ||||||||
|---|---|---|---|---|---|---|---|---|---|
| Tratamientos | Tratamientos | ||||||||
| ΦPSII | Día | C | CB | CM | CA | C | CB | CM | CA |
| 147 | 0.31 ± 0.06b | 0.52 ± 0.03a | 0.56 ± 0.03a | 0.42 ± 0.06ab | 0.45 ± 0.03a | 0.52 ± 0.06a | 0.43 ± 0.07a | 0.51 ± 0.05a | |
| 215 | 0.47 ± 0.03a | 0.58 ± 0.04a | 0.55 ± 0.04a | 0.56 ± 0.04a | 0.62 ± 0.02a | 0.63 ± 0.01a | 0.45 ± 0.05b | 0.56 ± 0.03ab | |
| 292 | 0.60 ± 0.04b | 0.79 ± 0.02a | 0.77 ± 0.01a | 0.76 ± 0.06a | 0.58 ± 0.05a | 0.61 ± 0.02a | 0.47 ± 0.02b | 0.49 ± 0.04ab | |
| TTE | 147 | 34.22 ± 6.57c | 42.14 ± 4.21b | 78.94 ± 4.30ª | 53.16 ± 3.61b | 46.02 ± 4.59a | 50.32 ± 8.66a | 50.38 ± 7.69a | 38.28 ± 4.45a |
| 215 | 33.36 ± 7.07a | 30.80 ± 4.95a | 37.58 ± 8.69a | 24.86 ± 3.55a | 17.38 ± 2.63a | 15.50 ± 2.83a | 23.48 ± 4.39a | 26.42 ± 2.24a | |
| 292 | 17.00 ± 3.43a | 21.16 ± 4.45a | 23.88 ± 3.76a | 20.76 ± 4.17a | 18.86 ± 3.75a | 14.30 ± 1.58a | 19.78 ± 4.16a | 11.06 ± 1.02a | |
| DNE | 147 | 0.51 ± 0.14b | 1.11 ± 0.13a | 1.33 ± 0.19a | 0.79±0.18ab | 0.84 ± 0.09a | 0.95 ± 0.09a | 0.77 ± 0.17a | 1.14 ± 0.24a |
| 215 | 0.93 ± 0.13a | 1.43 ± 0.18a | 1.27 ± 0.19a | 1.33±0.18a | 1.69 ± 0.16a | 1.68 ± 0.06a | 0.91 ± 0.17b | 1.32 ± 0.14ab | |
| 292 | 1.59 ± 0.23b | 4.00 ± 0.71a | 3.34 ± 0.23ab | 3.90±0.41a | 1.55 ± 0.33a | 1.62 ± 0.12a | 0.91 ± 0.09a | 1.02 ± 0.13a | |
En cuanto a la tasa de transporte de electrones (TTE) a las 12:00 h, para T. rosea se registró un efecto combinado del tiempo trascurrido y el tratamiento aplicado sobre la respuesta de las plantas (F = 3.03, P = 0.01, Tabla 2), el TTE disminuyó del inicio hacia el final del experimento en todos los casos. Particularmente, al día 147 del experimento, las plantas del tratamiento CM presentaron la TTE, mientras que las plantas del tratamiento control presentaron los valores más bajos (F = 16.44, P < 0.05); no se registraron diferencias significativas entre tratamientos en los días 215 y 292 del experimento (Tabla 2). Las plantas de H. campechianum, registraron una reducción de los valores de TTE al final del experimento en todos los casos (F = 51.06, P < 0.05); no se registraron diferencias significativas entre tratamientos por día de medición (Tabla 2).
La disipación no fotoquímica de la energía (DNE) a las 12:00 h en T. rosea presentó un incremento al final del experimento en todos los tratamientos (F = 41.92, P < 0.05; Tabla 2). Al día 147, las plantas del tratamiento control presentaron los valores más bajos respecto a todos los tratamientos, en particular el día 292, las plantas del tratamiento control sólo se encontraron diferencias significativas con los tratamientos CB y CA (F = 5.07, P = 0.01 y F = 6.44, P = 0.04, respectivamente, Tabla 2). En el caso de H. campechianum los valores máximos de DNE se registraron al día 215 del experimento, respecto a los otros dos tiempos evaluados (F = 6.32, P < 0.01); sin embargo, se observaron diferencias significativas entre tratamientos en el día 215, en donde las plantas del tratamiento CM presentaron los valores más bajos de DNE respecto al resto de los tratamientos (F = 7.20, P < 0.01).
Contenido de clorofila. No se registró interacción significativa de los factores sobre el contenido de clorofila foliar en ningún caso; tampoco se registraron diferencias significativas en los individuos de T. rosea (Figura 3A), entre mediciones (F = 2.53, P = 0.08), ni entre tratamientos (F = 0.59, P = 0.62). En el caso de H. campechianum se registró un incremento significativo en el contenido de clorofila al final del experimento (F = 14.66, P < 0.05, Figura 3B); se encontraron diferencias significativas el día 292 entre los tratamientos CB y CM.
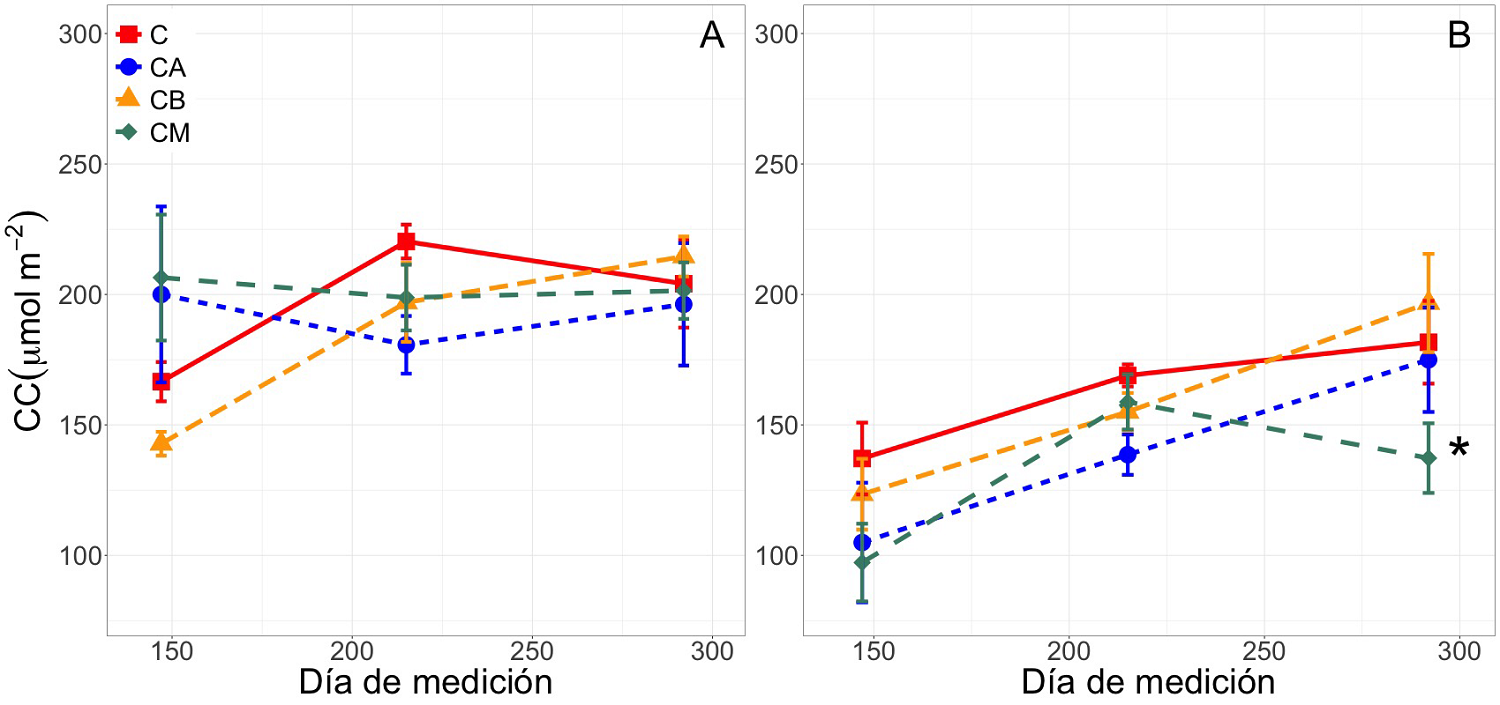
Figura 3 Contenido de la clorofila foliar (CC) para Tabebuia rosea (A) y Haematoxylum campechianum (B). Tratamientos: control (C), concentración baja (CB, 15,170 mg kg-1), concentración media (CM, 15,300 mg kg-1) y concentración alta (CA, 15,600 mg kg-1) a los días 147, 215 y 292 después de haber iniciado el experimento. Los datos son medias ± EE (n = 10 plantas por tratamiento, por especie). Asteriscos indican diferencias significativas entre tratamientos en el mismo día de medición (α = 0.05).
Potencial hídrico y osmótico foliar. El potencial hídrico para T. rosea presentó un efecto significativo en la interacción entre tratamientos y los días transcurridos (F = 2.70, P = 0.02, Tabla 3); el valor más bajo se registró el día 215 en el tratamiento BC, y los valores más altos en los tratamientos BC y CM al final del experimento (día 292; Tabla 3). El potencial hídrico para plantas de H. campechianum más negativo se registró al día 215 del experimento en todos los tratamientos, en donde las plantas de los tratamientos CB y CM presentaron un valor hasta 32.7 % menor que las plantas del tratamiento CA que tuvieron los valores más cercanos a cero (𝜒2 = 9.46, P = 0.02); para el día 292 las plantas de los tratamientos CB y CA presentaron los valores más negativos (F = 5.76, P = 0.00, Tabla 3).
Tabla 3 Valores promedio de potencial hídrico ψ (MPa) y osmótico (ψo; MPa) foliar para Tabebuia rosea y Haematoxylum campechianum. Tratamientos: control (C), concentración baja (CB, 15,170 mg kg-1), concentración media (CM, 15,300 mg kg-1) y concentración alta (CA, 15,600 mg kg-1) a los días 147, 215 y 292 después de haber iniciado el experimento. Letras diferentes indican diferencias significativas entre tratamientos por variable y día de medición (α = 0.05). Los datos son medias ± EE (n = 10 plantas por tratamiento, por especie).
| Tabebuia rosea | Haematoxylum campechianum | ||||||||
|---|---|---|---|---|---|---|---|---|---|
| Tratamientos | Tratamientos | ||||||||
| Día de medición | C | CB | CM | CA | C | CB | CM | CA | |
| ψ | 147 | -1.92 ± 0.14a | -1.63 ± 0.09a | -1.75 ± 0.12a | -1.83 ± 0.19a | -2.33 ± 0.03a | -2.03 ± 0.08b | -2.47 ± 0.11a | -2.25 ± 0.05ab |
| 215 | -2.12 ± 0.20a | -2.53 ± 0.10a | -2.28 ± 0.17a | -2.46 ± 0.21a | -3.06 ± 0.26ab | -4.21 ± 0.54a | -4.12 ± 0.69a | -2.83 ± 0.04b | |
| 292 | -2.13 ± 0.18a | -1.46 ± 0.09a | -1.57 ± 0.15a | -1.46 ± 0.12a | -1.53 ± 0.12b | -2.52 ± 0.19a | -1.78 ± 0.13b | -2.00 ± 0.24ab | |
| ψo | 147 | -1.87 ± 0.15b | -1.78 ± 0.11b | -2.46 ± 0.12ab | -2.80 ± 0.22a | -2.30 ± 0.11a | -2.53 ± 0.10a | -2.21 ± 0.08a | -2.37 ± 0.15a |
| 215 | -1.25 ± 0.03a | -1.34 ± 0.07a | -1.23 ± 0.07a | -1.42 ± 0.21a | -1.53 ± 0.08a | -1.98 ± 0.43a | -1.55 ± 0.07a | -1.69 ± 0.17ab | |
| 292 | -1.91 ± 0.18b | -2.51 ± 0.16a | -2.55 ± 0.18a | -2.47 ± 0.15a | -2.92 ± 0.14a | -1.98 ± 0.28b | -1.95 ± 0.24b | -2.53 ± 0.16ab | |
Por otra parte, el potencial osmótico en los individuos de T. rosea se registraron los valores más negativos al día 215 respecto a los otros dos tiempos de evaluación (F = 58.13, P < 0.05, Tabla 3), sin embargo, sólo se registraron diferencias significativas entre tratamientos al día 147 y 292, donde las plantas del tratamiento control presentaron los valores menos negativos (F = 7.76, P < 0.05, Tabla 3). Del mismo modo, en plantas de H. campechianum el potencial osmótico menos negativo se registró al día 215 del experimento, y fue significativamente diferente del día 147 y 292 (F = 15.41, P < 0.05); para el día 292, las plantas de los tratamientos CB y CM presentaron los valores menos negativos (F = 2.74, P = 0.02, Tabla 3).
Índice de plasticidad. Dada la escala del índice de plasticidad (cero a uno), ambas especies presentaron una baja plasticidad ante los diferentes niveles de contaminación del suelo (Figura 4). No se registraron diferencias significativas entre las especies y cada variable evaluada (U de Mann-Whitney > 6.5, P > 0.46, Figura 4). El índice de plasticidad fisiológica más alto se registró en T. rosea en el potencial hídrico (0.17) y para H. campechianum en el contenido de clorofila (0.22) con respecto a las otras variables (Figura 4).
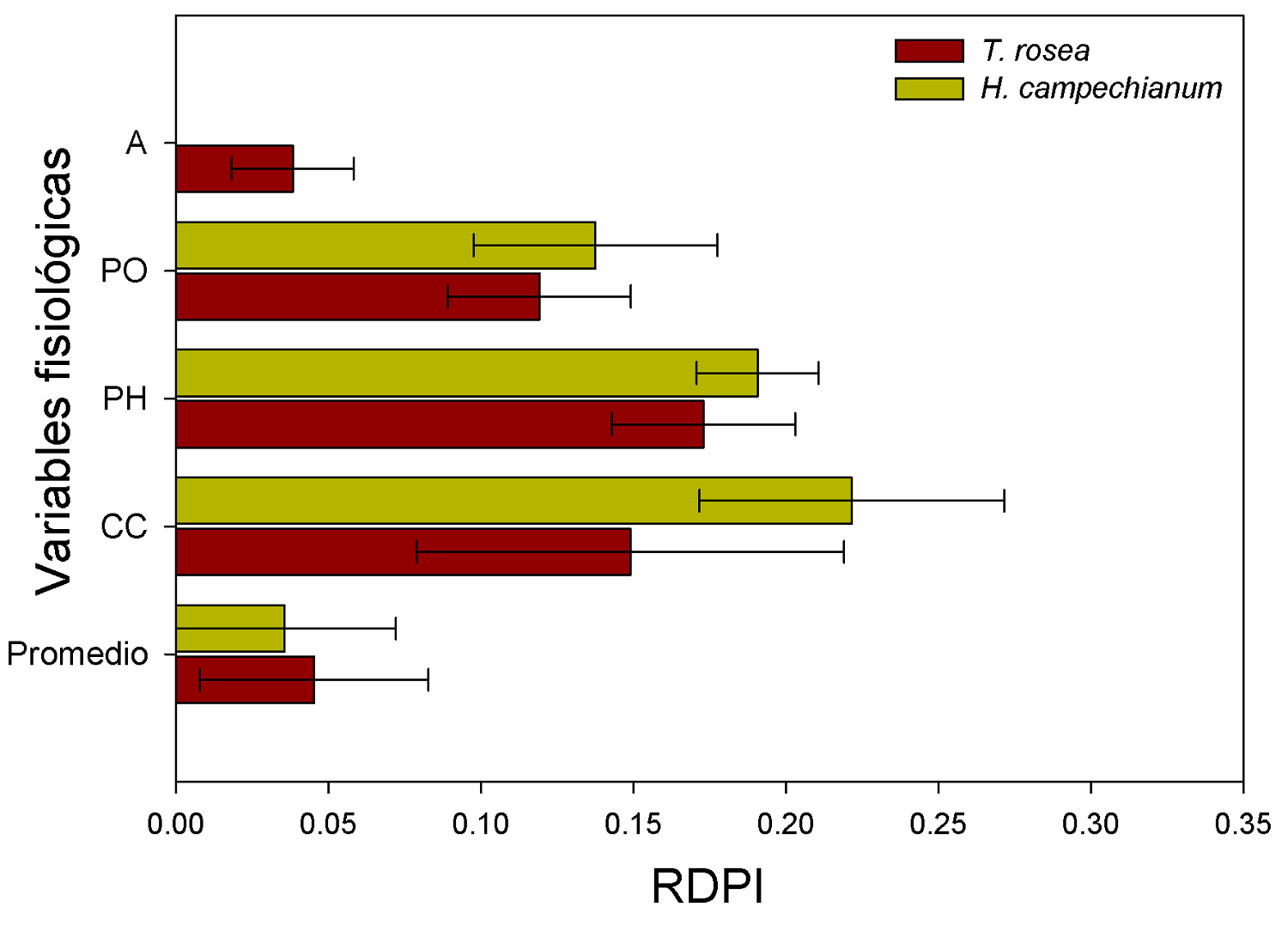
Figura 4 Índice de plasticidad basado en distancias fenotípicas relativas (RDPI). Los datos son medias ± EE (n = 10 plantas por tratamiento, por especie). A: fotosíntesis; PO: potencial osmótico; PH: potencial hídrico; CC: contenido de clorofila.
Análisis no métrico de escala multidimensional (NMDS). El NMDS sugiere que las plantas de T. rosea respondieron de manera similar a la presencia de diferentes concentraciones del PC hacia el final del experimento, en donde las plantas del tratamiento control tuvieron un comportamiento diferente respecto a las que se encontraban en un suelo contaminado (Figura 5A). Por el contrario, las plantas de H. campechianum presentaron una respuesta similar ante la presencia del contaminante al día 147 de evaluación en todos los casos, sin embargo, para el día 292, las plantas bajo cada tratamiento siguieron una estrategia particular para afrontar las diferentes concentraciones de PC de cada tratamiento (Figura 5B). Sin embargo, en todos los casos, las plantas siguieron una estrategia fisiológica particular en cada día de medición, tal como lo sugieren las covarianzas (elipses) en la Figura 5.

Figura 5 Análisis no métrico de escala multidimensional (NMDS) construido a partir de la respuesta fisiológica de plantas de Tabebuia rosea (A) y Haematoxylum campechianum (B) en suelo contaminado con petróleo crudo por día de medición (147, 215, 292) y tratamiento: control (C), concentración baja (CB, 15,170 mg kg-1), concentración media (CM, 15,300 mg kg-1) y concentración alta (CA, 15,600 mg kg-1). Las líneas punteadas indican el grado de dispersión de los datos para cada día de medición; se construyeron a partir de una matriz de covarianza hecha a partir de la salida de datos NMDS.
Discusión
Los resultados muestran que, de manera general, tanto las plantas de T. rosea como las de H. campechianum presentaron una aclimatación a las diferentes concentraciones de petróleo crudo a las que fueron sometidas. Sin embargo, contrario a lo que se esperaba, H. campechianum presentó mayor aclimatación a las diferentes concentraciones de PC en suelo, lo que pudo deberse a una mayor plasticidad fisiológica en comparación con las plantas de T. rosea.
La fisiología de las plantas puede verse afectadas por el PC con concentraciones que van de 18,000 a 76,000 mg kg-1, aunque pueden llegar a ser superiores (Pérez-Hernández et al. 2017, Brutti et al. 2018, González-Moscoso et al. 2019); por ejemplo, en plántulas de Quercus oleiodes la transpiración, conductancia estomática y la fotosíntesis disminuyen a concentraciones de 5 y 15 % de diésel proporcional sobre 3 kg de suelo (Castro-Mancilla et al. 2019). En el caso de Zea mays se ha observado un daño en el PSII, lo que se refleja en una fotoinhibición con distintas concentraciones de PC (2.5 y 5.0 % v/p). Sin embargo, las plantas de Z. mays lograron sobrevivir, modificando su morfología, es decir, perdieron sus hojas y altura e incrementa su diámetro en la base (Athar et al. 2016).
Las concentraciones utilizadas en este trabajo (de 15,170 a 15,600 mg kg-1) no tuvieron un efecto negativo a largo plazo sobre las dos especies utilizadas, ya que no se observaron efectos negativos extremos en la fisiología de las plantas, las especies estudiadas. Después de un aparente efecto negativo al día 215, las plantas regresaron a los niveles registrados en el día 147. Incluso, en algunos casos como en la asimilación de CO2, TTE, DNE, potencial hídrico y osmótico, los valores registrados plantas de ambas especies bajo el tratamiento de concentración baja de PC fueron superiores a los registrados en el tratamiento control, lo que sugiere un mayor desempeño fisiológico en presencia del contaminante a bajas concentraciones. A este fenómeno se le conoce como hormesis, que se caracteriza por una aparente estimulación de los procesos fisiológicos cuando los organismos son expuestos a bajos niveles de agentes tóxicos, y una inhibición de estos procesos a concentraciones altas (Forbes 2000, Roosens et al. 2003, Calabrese 2012, Labra-Cardón et al. 2012, Orocio-Carrillo et al. 2019). Esta capacidad puede conferir una ventaja adaptativa tanto a T. rosea como a H. campechianum para aclimatarse ante eventos de contaminación del suelo con petróleo crudo a concentraciones de entre 15,175 y 15,300 mg kg-1. Sin duda, la exposición a bajas dosis de PC estimuló una modificación en la fisiología de las plantas para hacer frente al contaminante. Dicha respuesta fue diferencial entre especies sugiriendo estrategias particulares (Figura 5), aunque al final del experimento, todas las plantas de ambas especies fueron capaces de tolerar la presencia del contaminante, alcanzado una estabilidad hormética, es decir, un mejor desempeño fisiológico al final del experimento respecto al inicio (Erofeeva 2021) en la mayoría de los parámetros evaluados.
Intercambio de gases, conductancia estomática y eficiencia de uso del agua.Castro-Mancilla et al. (2019) encontraron que plantas de Quercus oleoides de un año reducen de manera significativa su tasa fotosintética, transpiración, conductancia estomática y contenido de clorofila, cuando crecen en suelos contaminados a concentraciones entre el 5 y 15 % de diésel en suelo (proporción peso-suelo y peso-contaminante) en comparación con plantas en suelo sin contaminar; este decremento de los procesos fisiológicos provocó la muerte de las plantas. Sin embargo, a bajas concentraciones de diésel en el suelo (2 % peso/peso), las plantas presentaron un mejor desempeño fisiológico que las plántulas del tratamiento control, lo que comprueba la importancia del proceso de hormesis en especies vegetales sometidas a estrés por contaminación en el suelo.
Acorde a lo anterior, en T. rosea se encontró que la mayor tasa fotosintética se registró en los tratamientos CB y CM de PC en el suelo, particularmente a la mitad y final del experimento. Por su parte, en las plantas en el tratamiento de CA, la tasa fotosintética fue similar al tratamiento control. En plantas de Mirabilis jalapa L. expuestas a 70 días en suelos contaminados con benzo[a]pireno y aceite de motor quemado, presentaron una reducción en la asimilación de CO2, mientras Amaranthus hybridusL. presentó la misma respuesta, después de 20 días de exposición al contaminante (Odjegba & Sadiq 2002, Diao et al. 2011). Algo similar se ha reportado para plantas de dos años de Amorpha fruticosa L. en donde se registró una disminución en la asimilación de CO2, transpiración y conductancia estomática después de un periodo de seis meses bajo concentraciones de PC de hasta 20 g kg-1 (Han et al. 2016). Ninguna de las especies mencionadas pudo recuperarse después del evento de contaminación. En este estudio, las plantas de T. rosea fueron capaces de aclimatarse a condiciones de contaminación por PC después de 292 días, presentando una mayor tasa de intercambio de gases y conductancia estomática a la mitad y final del experimento, respectivamente.
Es probable que al inicio del experimento (día 147), la presencia de PC haya provocado que los estomas se cerraran, reduciendo la tasa fotosintética y de transpiración (Prasch & Sonnewald 2015, Castro-Mancilla et al. 2019, Zhang et al. 2019). Esta disminución de la conductancia estomática podría deberse a que el PC provoca daños en las membranas celulares, pues hay un bloqueo en los espacios intercelulares derivado de la formación de una capa de PC en el suelo que no permite la absorción de agua (Cai & Ma 2002, Rennenberg et al. 2006, González-Mendoza 2013, Tansel et al. 2015). En este sentido, se ha reportado que las raíces envían señales químicas para el cierre estomático cuando entran en un estado de estrés por sequía o salinidad (Chaves et al. 2009). De igual forma, se ha reportado que la presencia del PC provoca una inhibición de la actividad del ácido abscísico en las hojas, lo que provoca el cierre estomático, lo que incluso, puede reflejarse en una reducción del desarrollo y crecimiento de las plantas (Assmann 2010, Brutti et al. 2018).
Sin embargo, la conductancia estomática fue similar entre tratamientos a lo largo de todo el día 147, mientras que al día 292, las plantas del control fueron las que presentaron los valores más bajos, mientras que las plantas del tratamiento CM presentaron los valores más altos (Material suplementario, Figura S3), lo que sugiere una aclimatación de las plantas de ambas especies a la presencia del contaminante en todos los tratamientos, probablemente derivado de un efecto hormesis. Es probable que las plantas, dentro de su proceso metabólico, establecen una comunicación hormonal para ajustar la conductancia estomática de acuerdo con el estado del suelo contaminado con PC, particularmente en lo relativo a la capacidad de absorción de agua y nutrientes. Lo anterior resulta en cambios en la apertura estomática mediados por una regulación en el transporte de iones, biosíntesis de solutos y una reducción en la absorción y transporte de nitratos de la raíz a los tallos y de los tallos a las hojas. Es así como al final del experimento la conductancia estomática se comportó como al inicio del experimento, sugiriendo un proceso de aclimatación (Santelia & Lawson 2016, Brutti et al. 2018, Erofeeva 2022). Reportes previos señalaron que T. rosea fue severamente reducida de su biomasa a concentraciones que desde 18,000 hasta 76,000 mg kg-1 de PC (Pérez-Hernández et al. 2017, Brutti et al. 2018, González-Moscoso et al. 2019), por lo que las concentraciones utilizadas en este trabajo pueden considerarse bajas, lo que favoreció el desempeño fisiológico, en comparación con las plantas que crecieron en suelos sin PC, lo que refuerza la idea de un efecto hormesis en ambas especies, ya que los mecanismos específicos y no específicos de las plantas presentaron una compensación hormética, es decir, que las plantas no solo modificaron su fisiología para lograr sobrevivir en el suelo contaminado, sino que la presencia del contaminante pudo favorecer el desempeño fisiológico de las plantas a las concentraciones manejadas en este trabajo (Erofeeva 2021).
Fluorescencia de la clorofila. La presencia de petróleo crudo y sus derivados también tienen un significativo efecto negativo significativo sobre la fluorescencia de la clorofila; Naidoo et al. (2010) reportan que la exposición por seis meses a este contaminante reduce significativamente el Fv/Fm en Bruguiera gymnorrhiza con valores debajo de 0.75. De igual forma, Bęś et al. (2019) destacan que Fagus sylvatica creciendo en suelos contaminados con diésel, después de cuatro años presentó un Fv/Fm de 0.57 un valor menor al control que osciló entre 0.67 a 0.74, aunque a partir de los 6 años aumento a 0.71; en el caso de Pinus sylvestris se registraron valores de Fv/Fm entre 0.57 a 0.66 en un transcurso de 4 a 5 años al aumentar la concentración de diésel en los tratamientos (0, 3, 6, 12 y 24 g de diésel por 1 g de materia seca del suelo) con respecto al control que osciló entre 0.75 y 0.79 (Bęś et al. 2019), lo que indica que el contaminante afecta negativamente el desempeño fisiológico del aparato fotosintético (PSII).
Los trabajos anteriores se desarrollaron a largo plazo, en nuestro caso, fue posible observar una rápida recuperación, tanto del Fv/Fm como de la ΦPSII en un periodo de tiempo de 292 días. T. rosea que al inicio del experimento (día 147) presentó valores de Fv/Fm de 0.71 en todos los casos, pero al día 292, registró valores entre 0.77 y 0.80; mientras que, H. campechianum presentó valores similares en todo el experimento, sugiriendo que no hubo un efecto negativo sobre el desempeño del aparato fotosintético. Esto probablemente es una respuesta del proceso fotoquímico (qP) que produce una reducción o cierre de los centros de reacción (González-Moreno et al. 2008) para protegerse ante eventos de estrés fisiológico, en este caso recuperarse del estrés provocado por el PC.
A pesar de lo anterior, el TTE presentó un decremento paulatino a lo largo del experimento en ambas especies para los tres tratamientos (Material suplementario, Figura S1 y S2), probablemente debido a la disminución de la tasa de recambio de las reacciones involucradas en la cadena de TTE y fijación de CO2 (Müller et al. 2001, Tomar & Jajoo 2014). Así, tanto el TTE como el incremento de ΦPSII, podría explicar una mayor eficiencia en el uso de la luz como mecanismo de aclimatación a la presencia del contaminante. La disminución en los valores de la TTE afectó también a las plantas del control en el día 292, lo que sugiere que la respuesta observada en ese día pudo deberse a un agente externo a los tratamientos de contaminación con PC; por ejemplo, se registró un incremento 5.8 ºC en la temperatura mínima del aire dentro del vivero entre el día 147 y el 292 del experimento, generando un incremento en la temperatura mínima del suelo de hasta 5.3 ºC, lo que podría ser un estrés adicional sobre la respuesta fisiológica de las plantas. Dicha respuesta fue similar en todos los casos y ambas especies respondieron de igual manera a la variación ambiental, aún con la presencia del contaminante.
Contenido de la clorofila. El contenido de la clorofila puede cambiar como respuesta a factores de estrés, como en la presencia de PC en el suelo (Baruah et al. 2014, Arellano et al. 2015, Han et al. 2016). A pesar de que trabajos previos reportan una reducción en el contenido de clorofila en plantas como el maíz después de 14 días de exposición a PC (Njoku et al. 2012), otros trabajos como el de Castro-Mancilla et al. (2019) no reportan cambios en el contenido de clorofila en plántulas de Quercus oleoides creciendo en suelos contaminados con diésel (entre el 5 y 15 % peso suelo/peso diésel).
En este estudio, las plantas del tratamiento control no presentaron diferencias significativas y tampoco se observaron cambios de contenido de clorofila en los tratamientos, lo que sugiere que la presencia de hidrocarburos en el suelo no tuvo las concentraciones lo suficientemente altas para provocar un efecto significativo en el contenido de clorofila foliar. Por el contrario, la presencia del hidrocarburo a una concentración de 15,170 mg kg-1 sugiere que promueve la producción de clorofila foliar, sustentando el fenómeno de hormesis en las plantas (Orocio-Carrillo et al. 2019, Erofeeva 2022), y favoreciendo el desempeño fotosintético de las plantas.
Potencial hídrico y osmótico foliar. Durante el experimento las raíces y el suelo pudieron estar cubiertas con PC, causando una baja infiltración de agua (Oluwafemi et al. 2008, Tansel et al. 2015, Sari et al. 2018), por lo que podría haber una disminución del potencial hídrico y osmótico foliar. Además, se encontró que el potencial hídrico fue similar al inicio y el final del experimento para ambas especies; sin embargo, el potencial osmótico se disminuyó al día 292, respecto al día 147 en plantas de T. rosea en los tres tratamientos del suelo contaminado.
Esta respuesta sugiere que las plantas de T. rosea presentaron un ajuste osmótico que les permitió la absorción del agua del suelo (Cushman 2001, Rodríguez-Pérez 2006), como se ha observado en otras especies que crecen en suelos contaminados con PC y podría estar relacionada con un incremento en la concentración de prolina, un aminoácido antioxidante que se produce en respuesta a la tolerancia a estrés por sequía o salinidad, y funciona como un osmolito incrementando la permeabilidad de la membrana radical, así como a una actividad elevada del ácido abscísico (ABA) que se ha reportado actúa como regulador de los mecanismos fisiológicos de la planta al reaccionar al estrés provocado por el PC, activando procesos bioquímicos como sustancias húmicas, síntesis de especies reactivas de oxígeno, perfil transcriptómica e hidroxilación de proteínas y aminoácidos, por mencionar algunas, que permiten a las plantas aclimatarse al suelo contaminado (Berbara & García 2014, Calvo et al. 2014, Cevher-Keskin et al. 2018).
Probablemente estas respuestas de regulación osmótica podrían deberse, aunque no se evaluaron, a la producción de prolina (Dodd et al. 2010) o a la posible presencia de inoculantes o hidrocarbonoclastas en el suelo (Aislabie et al. 2006, Chan-Quijano et al. 2020), los cuales, se ha reportado, incrementan la tolerancia de las plantas a través de las raíces a la contaminación por PC.
Índice de plasticidad. Contrario a lo que se esperaba, el índice de plasticidad fue bajo en ambas especies. Si bien existen reportes previos sobre la tolerancia de T. rosea y de H. campechianum a la presencia de PC en el suelo (Pérez-Hernández et al. 2013), los resultados sugieren que concentraciones más altas del contaminante podrían desencadenar una modificación fisiológica significativa. Pérez-Hernández et al. (2017), también encontraron una reducción en el crecimiento y supervivencia en ambas especies, derivado quizá de un efecto negativo sobre sus funciones fisiológicas básicas.
Es probable que el índice de plasticidad para ambas especies se incremente si se consideran parámetros fisiológicos evaluados a mayores concentraciones de PC en suelo; acorde a lo encontrado en el presente trabajo, así como en reportes previos, el rango de tolerancia máximo para estas dos especies podría oscilar entre los 18,000 y los 47,100 mg kg-1, punto donde plantas de ambas especies reducen su altura y su biomasa (Pérez-Hernández et al. 2013, 2017).
Además, dado que el cálculo del índice de plasticidad implica la comparación entre los dos ambientes más extremos en los que se encuentran los individuos (Valladares et al. 2006), el establecimiento de un experimento con concentraciones más altas de PC en suelo probablemente permita tener una mejor aproximación a la plasticidad de ambas especies, y, por tanto, a su umbral de tolerancia ante esta fuente de estrés.
Se concluye que el desempeño fisiológico de Tabebuia rosea y Haematoxylum campechianum indicó que ambas especies presentan mecanismos de respuesta fisiológica, lo suficientemente robustos a concentraciones como las utilizadas en este estudio, para aclimatarse y sobrevivir en suelos contaminados con PC. Si bien la plasticidad fisiológica encontrada en las diferentes variables evaluadas fue baja, fue posible determinar que T. rosea podría ser más sensible a la presencia del contaminante, en comparación con H. campechianum, ya que esta última presentó menor variabilidad en su respuesta fisiológica en todos los tratamientos, lo que hace a esta especie la mejor candidata a procesos de remediación a concentraciones de PC similares a las presentadas en este trabajo. Finalmente, ambas especies presentaron un efecto de hormesis ante la presencia del petróleo crudo a bajas concentraciones; sin embargo, es posible que un mayor estrés derivado de concentraciones más altas podría impactar negativamente sobre su crecimiento y desarrollo, como lo han demostrado trabajos previos (Pérez-Hernández et al. 2013, 2017).
Material suplementario
El material suplementario de este artículo puede ser consultado aquí: https://doi.org/10.17129/botsci.3060











 nueva página del texto (beta)
nueva página del texto (beta)



