En una era definida por las variaciones del cambio climático, cada vez son más frecuentes los desastres naturales. Por este motivo, las investigaciones y estrategias efectivas y económicas que mitiguen el riesgo de los movimientos en masa son necesarias. En este sentido, el uso de la vegetación se ha encontrado como una solución prometedora en atención a la reducción de riesgos relacionados con los deslizamientos de tierra en laderas (Danjon et al. 2008). No obstante, aunque es cierto que la condición climática exacerba estos eventos, Chapa-Guerrero et al. (2016) mencionan que tales efectos se agravan especialmente en áreas con planeaciones urbanas y construcciones sobre taludes escarpados.
El área metropolitana de Monterrey en el noreste de México ha presentado una expansión urbana y demográfica considerable y actualmente se sigue incrementando el desarrollo de nuevos sectores residenciales sobre las laderas de la Sierra Madre Oriental. Este crecimiento incluye la construcción de avenidas sinuosas con altitudes que van de los 550 a 1,350 m snm, presentando una alta vulnerabilidad ante la ocurrencia de desastres naturales y movimientos en masa de laderas (Chapa-Guerrero et al. 2016). La condición climática extremosa agrava esta fragilidad ante desastres. Durante la temporada de lluvias en la región, prevalecen los calores intensos, lo que disminuye la cubierta vegetal del suelo. Con la llegada de la temporada de precipitaciones, se genera un desgaste mecánico y estructural en el suelo causado por la acción de la lluvia al contacto con superficies desprotegidas. Por otro lado, el aumento del nivel freático y saturación de suelo conlleva a la inestabilidad de taludes y pérdida de suelo debido al trasporte y deposición de sedimentos (Alvarado et al. 2014).
El uso de vegetación aplicado en técnicas de bioingeniería se ha convertido en una práctica recurrente para la fijación de suelo en pendientes inestables (Genet et al. 2006). El grado de fijación en el suelo dependerá en gran medida de las propiedades de ingeniería de las plantas, estas propiedades son funciones combinadas de las características mecánicas, anatómicas y morfológicas del sistema radical como longitud, fuerza de tensión, composición química, diámetro, orientación, entre otras (Saifuddin et al. 2015).
Los componentes químicos son los encargados de regular la resistencia al quiebre de una raíz ante un fallo. Genet et al. (2010) atribuyen a la celulosa las variaciones en la fuerza de tensión en las raíces. Un alto contenido de celulosa en la raíz permitirá a la planta mantenerse adherida al suelo y evitar deslizamientos (Saifuddin et al. 2015). La biomasa de las raíces de las plantas consiste principalmente en compuestos celulósicos (holocelulosa y α-celulosa), lignina y extractos. La lignina también puede afectar las propiedades de resistencia de las raíces, principalmente cuando los contenidos de humedad son altos (Genet et al. 2005). La lignina junto con la celulosa constituye los principales polímeros naturales responsables de dar rigidez a la planta (Valenciaga & Chongo, 2004).
A través de la comprensión de estos procesos se pueden implementar soluciones oportunas para la restauración ecológica y prácticas de protección de suelo. El sistema radical de las plantas influye en el éxito de la fijación de suelo en laderas y por tanto se convierten en una alternativa ecológica en soluciones de ingeniería civil cuando se trata de deslizamientos de tierra y erosión (Stokes et al. 2014). Por esta razón el estudio de cómo las características mecánicas, químicas y morfológicas de las especies vegetales influyen en la fijación del suelo es de suma importancia.
El objetivo del presente estudio fue determinar la composición química y caracterización morfológica de raíces de cinco especies nativas que crecen en áreas de ladera en la Sierra Madre Oriental en el noreste de México y su relación con la fijación del suelo. Como hipótesis se planteó que la composición química de las raíces es diferente entre especies y está influenciada por su diámetro, así como las características morfológicas de las raíces también difieren entre las especies.
Materiales y métodos
Área de estudio. El área de estudio se encuentra colindante al Parque Ecológico Chipinque, el cual forma parte del Área Natural Protegida Parque Nacional Cumbres de Monterrey (25° 33' y 25° 35' N, 100° 18' y 100° 24' O), ubicado en el municipio de San Pedro Garza García, al noreste de México. Presenta altitudes que varía de los 750 a 3,000 m snm aproximadamente (Alanís-Rodríguez et al. 2010). De acuerdo con García (2004), el tipo de clima es semiseco semicálido, con marcadas lluvias en verano (BS1hw), con una temperatura media anual de 21.3 °C, y precipitaciones anuales que varían entre 300 y 500 mm. Los tipos de suelo predominantes en el área de estudio corresponden a litosoles y regosoles calcáricos, rendzinas, luvisoles y xerosoles, con clases texturales medias (García-Bastida 2013).
Selección de especies. Se colectaron muestras de raíz de cinco especies [Broussonetia papyrifera (L.) Vent., árbol de hasta 15 m (Flora of North America 1993), Caesalpinia mexicana A. Gray., arbusto o árbol de 1.5-6 m (Alanís et al. 1995), Dalea hospes (Rose) Bullok., arbusto de 1-2 m de altura (Estrada-Castillón 1998), Decatropis bicolor (Zucc.) Radlk., arbusto o árbol de 2-7 m de altura (Alanís et al. 1995) y Zanthoxylum fagara (L.) Sarg. arbusto o árbol de hasta 10 m de altura (Alanís et al.1995)], nativas de la Sierra Madre Oriental, propias del matorral submontano. Se colectaron las especies en función de su distribución y abundancia en el sitio y con presencia en áreas con pendiente (Sánchez-Castillo et al. 2017, Zavala-González et al. 2019). Se consideraron tres clases diamétricas para clasificar las raíces, con rangos de 0.10-10 mm, categorizándose como diámetro grande, medio y chico (Zavala-González et al. 2019). Además, se tomó en cuenta la arquitectura del sistema radical para la caracterización morfológica siguiendo la clasificación de Styczen & Morgan (1994), los contenidos de humedad en la raíz y la altitud del sitio donde se distribuyen las especies estudiadas.
Método de muestreo del sistema radical.Se seleccionó al azar un individuo representativo de cada especie investigada y el sistema radical se extrajo cuidadosamente de forma manual mediante una pala, considerándose una exposición óptima y accesible en la pendiente (Zavala-González et al. 2019). Una vez retirado el sistema radical, se colocaron en bolsas separadas con su etiquetado correspondiente y se almacenaron temporalmente en una hielera para conservar el contenido de humedad. Posteriormente las muestras fueron trasladadas al Laboratorio de Química de la Facultad de Ciencias Forestales de la UANL para su análisis.
Preparación de muestras para caracterización morfológica radical. Para determinar el tipo de morfología cada una de las especies fue caracterizada a partir de fotos y mediciones en el sistema radical extraído. Se consideró visualmente el ángulo de orientación y con ayuda de una cinta métrica se midió la longitud de la raíz. Posterior a ello la densidad del sistema radical se estimó a partir de un conteo visual.
Preparación de las muestras individuales de raíz para su análisis químico. En el laboratorio se descartaron las raíces dañadas (Sánchez-Castillo et al. 2017). Posteriormente, se tomó el sistema radical completo de cada una de las especies y con ayuda del aparato calibrador vernier digital (MITUTOYO) se procedió a separar las raíces respecto a diámetros pequeños, medianos y grandes (Figura 1). Las muestras obtenidas se clasificaron en tres categorías diamétricas: categoría I (0.1 a 2.9 mm), categoría II (2.9 a 6.0 mm) y categoría III (6.1 a 9.9 mm).

Figura 1 A) Sistema radical de individuos de Caesalpinia mexicana; B) Secciones del sistema radical de Broussonetia papyrifera; C) Sistema radical de Broussonetia papyrifera.
Para la determinación de contenidos químicos (% de celulosa, % de lignina y % de hemicelulosa) se utilizó el método desarrollado por Van Soest et al. (1991), el cual permite fraccionar secuencialmente las proporciones correspondientes a la fracción de la pared celular compuesta por celulosa y lignina y refleja la cantidad de hemicelulosas presentes en la pared celular (Segura et al. 2007). Tomando en cuenta el método utilizada por Genet et al. (2010), la corteza fue retirada de las muestras de raíz con ayuda de un bisturí (Categorías II y III). Para la categoría diamétrica I se utilizó un bisturí y una lupa para una mejor visión. Cada muestra se molió utilizado el molino modelo 4 # 3375-E45 Thomas Scientific n/s 101327 (Figura 2). Para facilitar el trabajo de molido, las raíces se sometieron a una temperatura de 60 °C en la estufa (Felisa®, Model FE-292AD, México) durante 24 h, ya que a esta temperatura no se alteran las propiedades químicas de la raíz. Se vertió 0.5 g de cada muestra en una bolsa de filtro de fibra (porosidad de 25 μm) y cada bolsa se marcó cuidadosamente con su número de identificación (Genet et al. 2005).
Análisis químicos. Determinación de lignina.- Se preparó una solución de ácido sulfúrico al 72 % (v/v). Se colocaron las muestras en un litro de solución, agitándose cada 30 min durante 3.5 h. Finalizado este proceso, se realizaron de 3 a 5 lavados con agua destilada a 90 °C hasta que las muestras quedaran libres de ácido. Para conocer el pH de las muestras después de cada lavado se utilizaron tiras de prueba indicadoras de pH (tira de papel Universal Indicator Paper, Ph1-14). Posteriormente, se introdujeron en acetona pura (≥ 99.5 %, v/v) por 5 min, para después introducir a la estufa (Felisa®, Model FE-292AD, México), a 105 °C por 2 h y se registró el peso.
Determinación de celulosa.- El porcentaje de celulosa se calculó sobre una base de materia seca (%) y la diferencia relativa entre el peso inicial y final de cada muestra.
Determinación de hemicelulosa.- El procedimiento de cálculo de hemicelulosa se realizó determinando previamente el porcentaje de fibra detergente neutra (FDN) y fibra detergente ácida (FDA) y por diferencia de estos componentes se obtuvo el porciento de hemicelulosa:
Contenido de humedad.- De acuerdo a Faisal (2010), el contenido de humedad se calculó de la siguiente manera:
Análisis estadísticos. Con el fin de probar los supuestos de normalidad y homocedasticidad de varianzas (Prueba de Levene), las variables lignina, celulosa y hemicelulosa fueron sometidas a pruebas de normalidad de Kolmogorov-Smirnov, cumpliendo con los supuestos únicamente la variable celulosa (trasformación mínimos cuadrados). El análisis de varianza de dos vías se empleó para evaluar diferencias en el contenido de celulosa entre las especies (Factor A), diámetros (Factor B) e interacción especie × diámetro (AB). Se realizó la prueba de Tukey para la comparación de medias de contenido de celulosa para especies y diámetros. Dado que el resto de las variables no cumplieron los supuestos de normalidad, estas se analizaron mediante la prueba no paramétrica de Kruskal-Wallis para la comparación de especies y diámetros para las diferentes variables. Se realizaron modelos de regresión (logarítmica, exponencial y polinómica) para determinar la relación de las variables con el diámetro de las raíces para cada una de las especies. También, se efectuó una correlación de Spearman para conocer la relación entre las variables. Los análisis estadísticos se realizaron utilizando el programa estadístico para ciencias sociales (IBM SPSS Statistics) versión estándar 22.0 para Windows.
Resultados
Composición química. Un total de 75 bolsas con muestra de raíz molida fueron analizadas: 15 para Decatropis bicolor, 15 para Zanthoxylum fagara, 15 para Caesalpinia mexicana, 15 para Broussonetia papyrifera y 15 para Dalea hospes. De acuerdo con los resultados obtenidos del análisis de varianza, se detectaron diferencias altamente significativas (P ≤ 0.01) en la variable contenido de celulosa entre las especies, diámetros y para la interacción especie × diámetro (Tabla 1).
Tabla 1 Resultados del análisis de varianza de acuerdo con un experimento factorial con diseño completamente aleatorio para la variable contenido de celulosa entre las diferentes especies (Factor A), diámetros (Factor B) e interacción especie × diámetro (AB). El valor del R2 ajustado del modelo es: 0.864.
| Fuente variación | g.l. | Suma de cuadrados | Media cuadrática | Valor F | Valor P |
|---|---|---|---|---|---|
| Especies (A) | 4 | 1,399.34 | 349.89 | 27.57 | < 0.001** |
| Diámetro(B) | 2 | 4,305.78 | 2,152.89 | 169.70 | < 0.001** |
| Interacción (A×B) | 8 | 431.85 | 53.98 | 4.25 | < 0.001** |
| Error | 60 | 761.16 | 12.68 | ||
| Total | 74 |
**Diferencia altamente significativa (P ≤ 0.01)
Los valores medios de contenido de celulosa para las especies estudiadas variaron de 28.16 % en Caesalpinia mexicana a 40.70 % en la especie Dalea hospes (Figura 3). La prueba de Tukey (P = 0.05) mostró que los contenidos medios de celulosa en Decatropis bicolor y Zanthoxylum fagara son iguales formando un mismo grupo y son estadísticamente iguales a Caesalpinia mexicana y Broussonetia papyrifera. Dalea hospes es superior y estadísticamente diferente al resto de las especies investigadas.
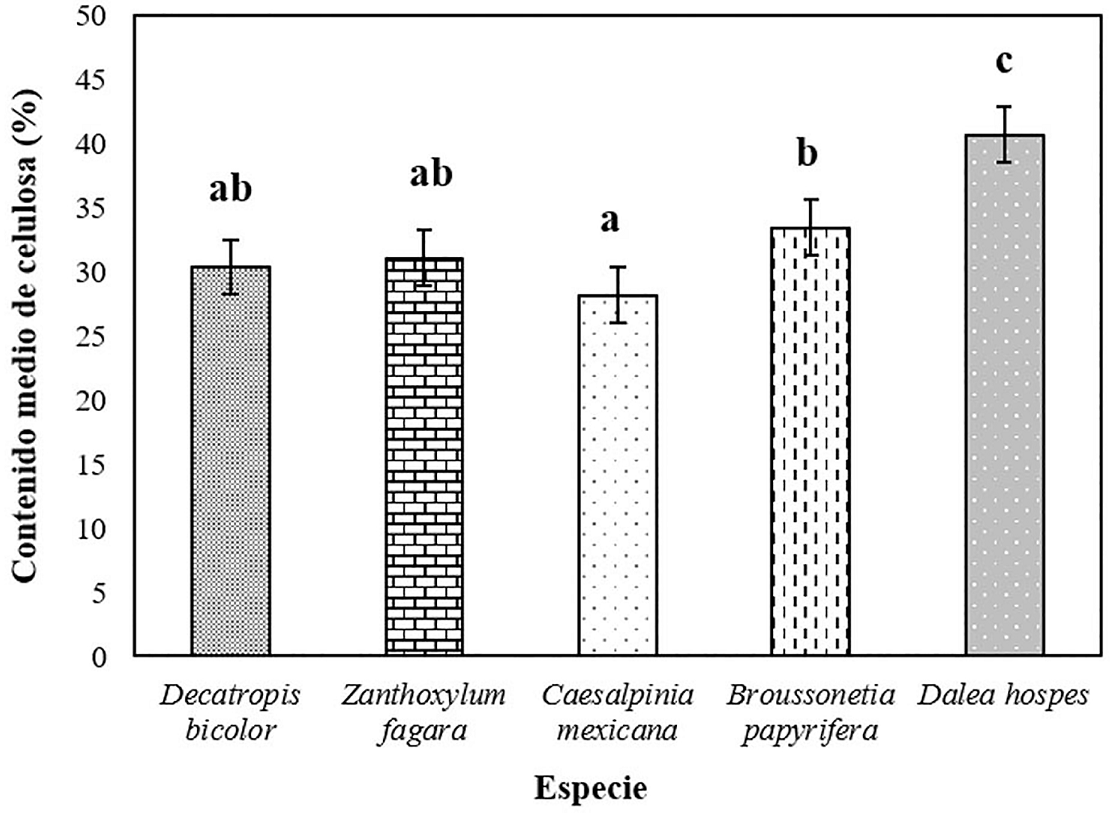
Figura 3 Valores medios del contenido de celulosa en cinco especies nativas. Medias con letras diferentes indican diferencias estadísticas de acuerdo con la prueba de Tukey (P = 0.05). Las barras de error indican la desviación estándar (n = 25).
Los valores medios de contenido de celulosa para las diferentes categorías diamétricas fueron de 23.97 % para la categoría III (6.1 a 9.9 mm), 31.78 % para la categoría II (2.9 a 6.0 mm) y 42.46 % para categoría I (0.1 a 2.9 mm). La categoría I mostró los valores más altos de contenido de celulosa. La prueba de Tukey (P = 0.05) mostró que las categorías diamétricas I, II y III son estadísticamente diferentes entre sí (Figura 4).
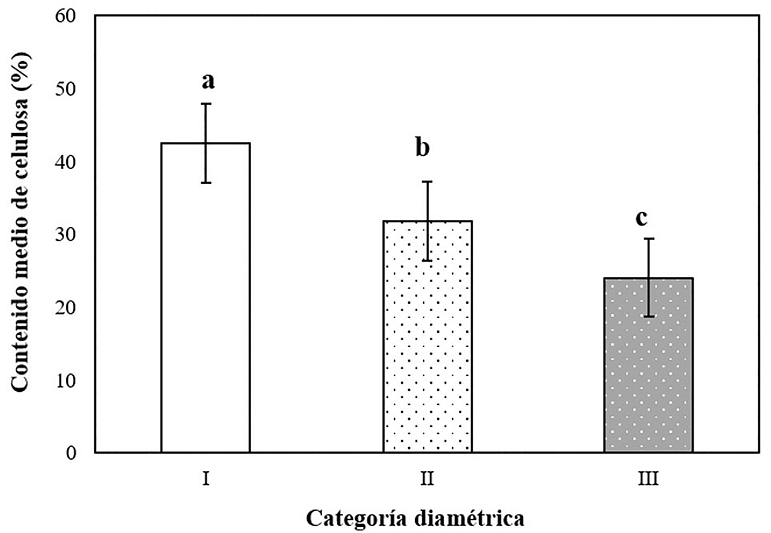
Figura 4 Valores medios del contenido de celulosa para tres categorías diamétricas, categoría III (6.1 a 9.9 mm) categoría II (2.9 a 6.0 mm) y categoría I (0.1 a 2.9 mm). Medias con letras diferentes indican diferencias estadísticas (Tukey P = 0.05). Las barras de error indican la desviación estándar (n = 25).
De acuerdo a los resultados obtenidos mediante la prueba no paramétrica de Kruskal-Wallis, el contenido de hemicelulosa presentó diferencias altamente significativas entre las especies, mientras que el contenido de lignina no presentó diferencias. Para el diámetro de raíz, se detectaron diferencias altamente significativas (P ≤ 0.01) para el contenido de lignina y hemicelulosa, (Tabla 2) y los valores de lignina aumentaron conforme aumento el diámetro.
Tabla 2 Prueba de Kruskal-Wallis para detectar diferencias en los contenidos de lignina y hemicelulosa entre especies y diámetros de la raíz.
| Fuente de variación | Estadístico | Lignina | Hemicelulosa |
|---|---|---|---|
| Especies | χ2 | 9.072 | 14.585 |
| gl | 4 | 4 | |
| Sig. Asintótica (valor P) | 0.059NS | 0.006** | |
| Diámetro | χ2 | 53.137 | 52.107 |
| Gl | 2 | 2 | |
| Sig. Asintótica (valor P) | < 0.001** | < 0.001** |
*(P ≤ 0.05) diferencias significativas; **(P ≤ 0.01) diferencias altamente significativas. NS(P > 0.05) diferencias no significativas.
Modelos de regresión para lignina, hemicelulosa y celulosa. Se observó una relación creciente en los contenidos de lignina respecto al diámetro de la raíz. Esta tendencia se mantuvo presente para todas las especies; a mayor diámetro mayor contenido de lignina. Decatropis bicolor mostró los valores más altos del contenido de lignina (27.73 %) dentro de la categoría diamétrica III (diámetros de 6.1 a 9.9 mm). Los contenidos más bajos de lignina se encontraron dentro de la categoría diamétrica I (0.1 a 2.9 mm). La regresión simple de Decatropis bicolor se ajustó a un modelo exponencial (R 2 = 0.943), Zanthoxylum fagara se ajustó a un modelo logarítmico (R 2 = 0.846). Caesalpinia mexicana presentó un ajuste polinómico (R 2 = 0.877), Broussonetia papyrifera con ajuste polinómico (R 2 = 0.952) y Dalea hospes con ajuste exponencial (R 2 = 0.894), el diámetro explica el contenido de lignina a partir de los coeficientes de determinación (Figura 5).
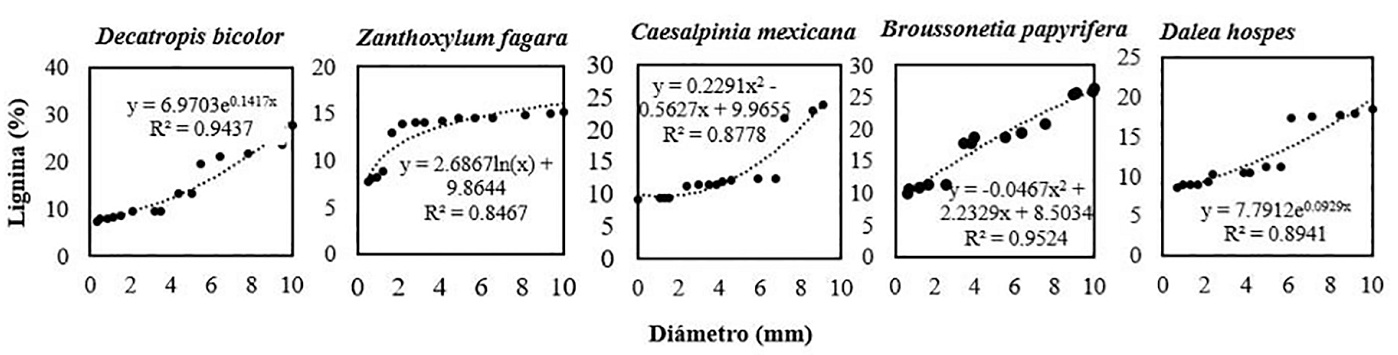
Figura 5 Modelos de regresión para la relación del contenido de lignina como función del diámetro de raíces en diferentes especies arbustivas, n = 25.
Por otro lado, se observó una relación negativa entre los contenidos de hemicelulosa respecto al diámetro de raíces. Caesalpinia mexicana mostró los contenidos más altos con 59.65 % dentro de la categoría dimétrica I (0.1 a 2.9 mm). La regresión de Decatropis bicolor se ajustó logarítmicamente (R 2 = 0.985), Zanthoxylum fagara mostró un ajuste exponencial (R 2 = 0.892), Caesalpinia mexicana se ajustó polinómicamente (R 2 = 0.719), Broussonetia papyrifera se ajustó polinómicamente (R 2=0.906) y Dale hospes mostró un ajuste exponencial (R 2 = 0.904). A partir de los coeficientes de determinación, se interpreta como el diámetro explica en una gran proporción el contenido de hemicelulosa (Figura 6).
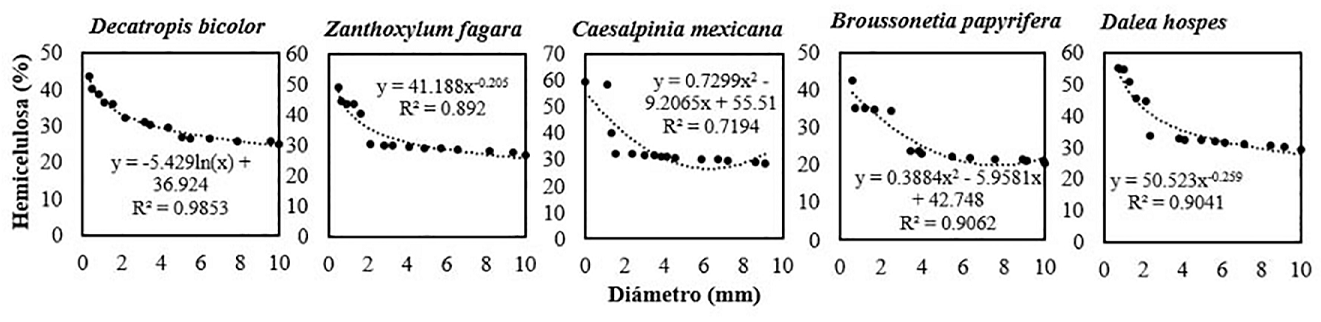
Figura 6 Modelos de regresión entre la hemicelulosa y el diámetro de las raíces en diferentes especies arbustivas, n = 25.
Para todas las especies, los contenidos de celulosa se presentaron en mayores proporciones en las categorías diamétricas I (0.1 a 2.9 mm) y II (2.9 a 6.0 mm). Las ecuaciones de regresión para las especies Decatropis bicolor y Zanthoxylum fagara se ajustaron polinómicamente con coeficientes de determinación de R2 = 0.962 y R2 = 0.934, respectivamente. La especie Caesalpinia mexicana mostró un ajuste exponencial y un valor R2 = 0.736 y las especies Borussonetia papyrifera y Dale hospes se ajustaron logarítmicamente con R2 = 0.925 y R2 =0.954, respectivamente (Figura 7). En todas las especies, a excepción de Caesalpinia mexicana, el diámetro explicó en más de un 90 % el contenido de celulosa.
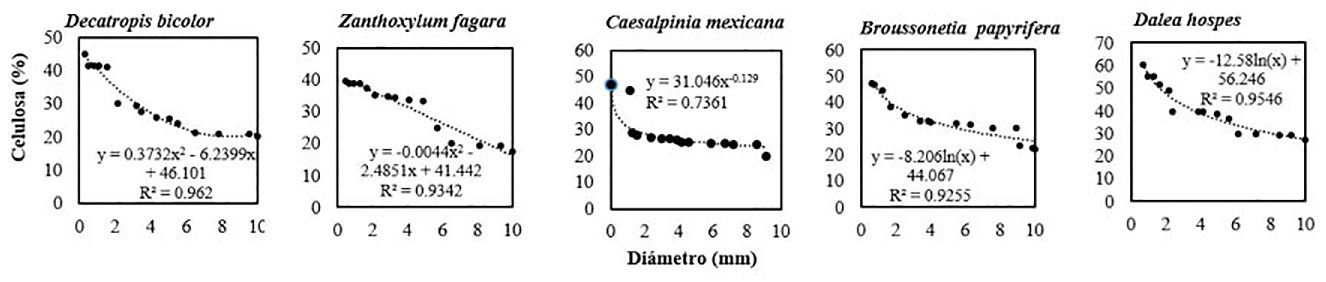
Figura 7 Modelos de regresión entre el contenido de celulosa y el diámetro de las raíces en diferentes especies arbustivas, n = 25
Contenido de humedad en las raíces. Considerando los contenidos de humedad en la raíz para todas las especies, los porcentajes de los contenidos de humedad aumentaron en la categoría diamétrica III (6.1 a 9.9 mm). Decatropis bicolor mostró los valores más bajos de humedad, mientras que Caesalpinia mexicana presentó los valores más altos. Los porcentajes medios para cada clase diamétrica por especie fueron: Decatropis bicolor: I (5.48), II (6.61), III (6.82). Zanthoxylum fagara: I (6.71), II (6.80), III (12.13). Caesalpinia mexicana: I (6.25), II (7.52), III (14.66). Broussonetia papyrifera: I (7.38), II (7.93), III (8.50). Dalea hospes: I (5.91), II (5.90), III (7.37) (Figura 8).
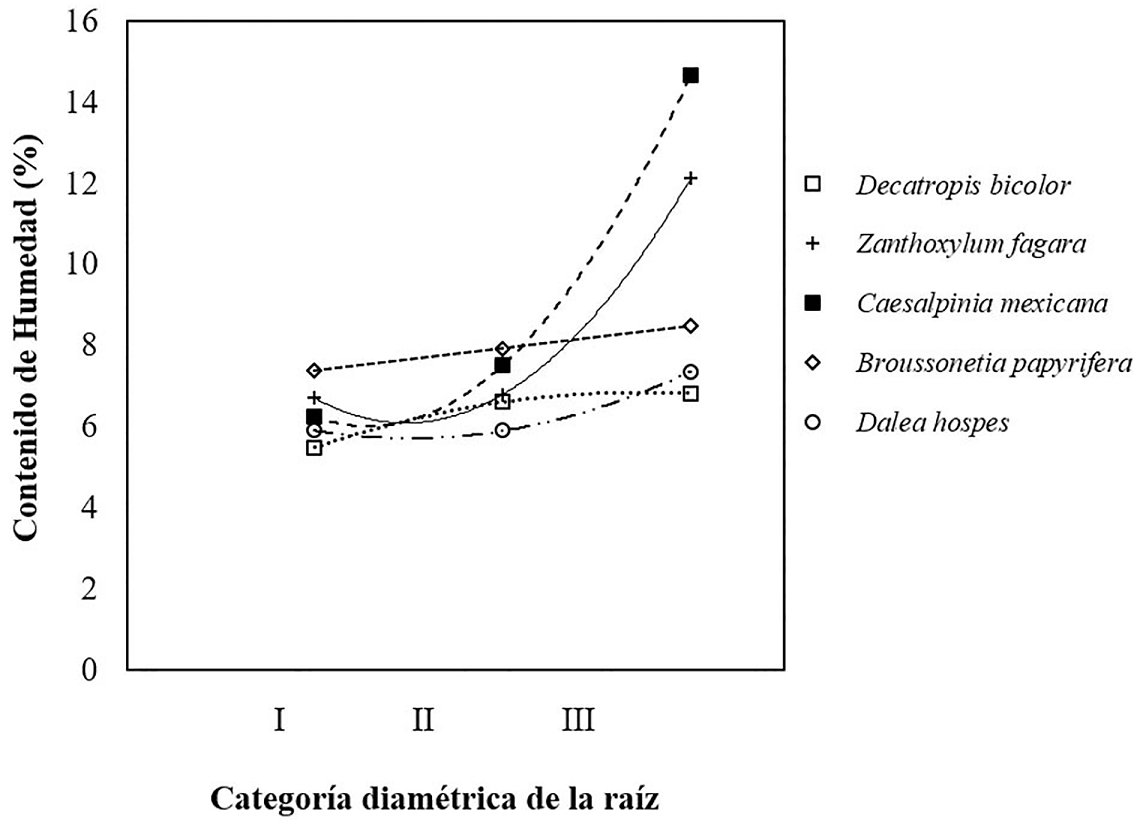
Figura 8 Relación del contenido de humedad de la raíz en cinco especies arbustivas respecto a la clasificación diamétrica de la raíz: categoría III (6.1 a 9.9 mm), categoría II (2.9 a 6.0 mm) y categoría I (0.1 a 2.9 mm).
Correlaciones entre las variables. Las correlaciones de Spearman para las variables lignina, hemicelulosa y celulosa se presentan en el Tabla 3. La lignina presentó una correlación negativa y altamente significativa con hemicelulosa y celulosa. La hemicelulosa se correlacionó positiva y altamente significativa con la celulosa.
Tabla 3 Coeficientes de correlación de Spearman (n = 75) para las variables lignina, hemicelulosa y celulosa.
| Variable | Lignina | Hemicelulosa | Celulosa |
|---|---|---|---|
| Lignina | 1 | ||
| Hemicelulosa | -0.906** | 1 | |
| Celulosa | -0.736** | 0.769** | 1 |
**Correlación altamente significativa (P < 0.01).
Morfología de las raíces. Para entender mejor los procesos que rigen la fijación del suelo, se analizaron tres clases de tipos de raíces dependiendo de su morfología radical. Las raíces fueron clasificadas de acuerdo con la propuesta de Styczen & Morgan (1994). En el Tabla 4, en la columna de morfología, la línea obscura representa la superficie de suelo y la línea punteada representa la profundidad donde la raíz presenta su máximo desarrollo. Decatropis bicolor (Tipo M) mostró una profundidad de 29 cm, Zanthoxylum fagara (Tipo VH) de 36 cm, Caesalpinia mexicana (Tipo VH) de 58 cm, Broussonetia papyrifera (Tipo H) 45 cm y Dalea hospes (Tipo M) 19 cm.
Tabla 4 Descripción y caracterización morfológica radical de cada una de las especies estudiadas bajo la metodología de Styczen & Morgan (1994).
Distribución de las especies nativas en una ladera. De acuerdo con los resultados de la composición química y morfología de raíces de las cinco especies nativas estudiadas, se procedió a diseñar un sistema de revegetación para fijación del suelo en una ladera típica de la Sierra Madre Oriental en el noreste de México (Figura 9).
Discusión
Los resultados mostraron que para el rango de diámetro de 0.1 a 2.9 mm (categoría diamétrica I), los porcentajes de celulosa son mayores. Lo anteriormente expuesto sugiere que para raíces de diámetros menores existe una mayor proporción de tejido primario en sus paredes celulares (Carpita & McCann 2015). Si bien, aunque es cierto que la composición química de la pared celular varía en función del estado de maduración de la célula, autores señalan que la pared primaria está constituida principalmente por celulosa, hemicelulosa y pectina (Höfte & Voxeur 2017, Chuncho et al. 2019).
Dentro de este marco y a partir de los resultados obtenidos, la tendencia fue similar para todas las especies; los porcentajes de celulosa se incrementaron al disminuir el diámetro de la raíz. Genet et al. (2005) y Hales et al. (2009) documentan que las raíces de diámetros finos son altamente resistentes a la tensión. Partiendo de este razonamiento, Genet et al. (2005) sugieren que esta categoría diamétrica presenta altos valores de fuerza de tensión debido a su alto contenido de celulosa. La fuerza de tensión de una raíz es controlada por su composición química (Genet et al. 2005), especialmente por las moléculas celulósicas, por tanto, se espera que raíces que se encuentre dentro de la categoría diamétrica I puedan proveer una óptima fijación al suelo. En tal sentido se propone las especies Dalea hospes (60.34 %), seguida por Broussonetia papyrifera (47.16 %), por sus contenidos de celulosa.
La tendencia de los contenidos de celulosa y lignina observados en la presente investigación fue similar a los encontrados por Genet et al. (2006), pero contrastantes con Thomas et al. (2014) en donde establecen que las raíces finas exhiben bajos porcentajes de celulosa, pero altos valores de lignina. Esta relación encontrada probablemente corresponda a las diferencias en el método aplicado, ya que ellos utilizaron el método modificado conforme a Brendel et al. (2000) para cuantificar los contenidos de celulosa, en donde el proceso de extracción produce celulosa pura y el método de Bromuro de Acetilo (AB) para cuantificar los contenidos de lignina. Además, no retiraron la corteza de las muestras de raíz y probablemente utilizaron una clasificación diamétrica diferente (Thomas et al. 2014). En el presente estudio, se utilizó el método desarrollado por Van Soest et al. (1991). Adicionalmente, se retiró la corteza en cada muestra de raíz, tomando en cuenta la metodología de Genet et al. (2005). Aunque no ha sido bien estudiado si la corteza de la raíz pueda afectar los contenidos químicos en la muestra, Yang et al. (2016) encontraron que las raíces sin corteza tenían mayores proporciones de lignina-celulosa en comparación con raíces con corteza.
El comportamiento de la lignina fue contrario al de la celulosa. La celulosa presentó mayores porcentajes en raíces de diámetro fino (0.1 a 2.9 mm), en cambio los porcentajes de lignina aumentaron a medida que el diámetro se incrementaba. La fijación del suelo por la raíz generalmente se ha correlacionado con los contenidos de celulosa en lugar de los contenidos de lignina. Sin embargo, Klauditz et al. (1947) observaron que la lignina parecía contribuir a la fijación de suelo, pero a altos contenidos de humedad. En el presente estudio, se encontró que las raíces de las especies Caesalpinia mexicana y Zanthoxylum fagara mostraron porcentajes altos de humedad en la categoría diamétrica de 6.0 -9.9 mm. Caesalpinia mexicana presentó el valor más alto de humedad con 14.66 % y Z. fagara con 12.13 %. Decatropis bicolor y Broussonetia papyrifera mostraron mayor homogeneidad en cuanto al contenido de humedad de la raíz para las tres categorías diamétricas. Los porcentajes para Decatropis bicolor variaron de 5.48 % para la categoría I (0.1 a 2.9 mm) a 6.82 % para la categoría III (6.1 a 9.9 mm). Los porcentajes para Broussonetia papyrifera variaron de 7.38 % para la categoría I a 8.50 % para la categoría III (6.1 a 9.9 mm). Cabe mencionar que estas especies fueron también las que mostraron mayores porcentajes de lignina. Todas las especies manifestaron un comportamiento similar; los contenidos de humedad en la raíz parecían aumentar en la categoría diamétrica III (6.1 a 9.9 mm). En este contexto, cabe indicar que los porcentajes más altos de lignina para todas las especies se encontraron también en los diámetros de la categoría III (6.1 a 9.9 mm).
En el presente estudio se encontró que los individuos muestreados a mayor altitud en promedio presentaban mayores porcentajes de lignina. Esta relación se encontró para las especies Broussonetia papyrifera y Decatropis bicolor, siendo las especies que mostraron las mayores proporciones de lignina; D. bicolor con 27.73 % y B. papyrifera con un porcentaje ligeramente menor de 26.41 %. Estas especies se colectaron en los puntos más altos de los sitios de muestreo, a altitudes de 3,304 y 3,296 m snm. El resto de las especies se distribuyeron dentro de un rango de 2,000 m snm, siendo visible el descenso en los contenidos de lignina. Esto puede ser más evidente en Zanthoxylum fagara que a 2,621 m snm, disminuyeron sus contenidos a 15.08 %. Los resultados fueron comparables con otros autores donde demostraron que el resultado de la altitud tiene un efecto importante sobre la lignificación. Gindl et al. (2001) explicaron que los árboles que crecen a mayores altitudes compensan sus paredes celulares delgadas con un contenido mayor de lignina. Dichos autores observaron un mayor contenido de lignina en la madera del abeto de Noruega (Picea abies) a medida que aumentaba la elevación. Scippa et al. (2006), encontraron que las especies que crecen en laderas mostraban proporciones de lignina significativamente mayores en comparación de las que crecen en terreno plano. Este aumento de producción de lignina está asociado a la respuesta de la planta ante el estrés mecánico (Scippa et al. 2006).
La hemicelulosa por otro lado mantuvo una tendencia similar a la celulosa. Esto principalmente porque las hemicelulosas son polisacáridos que se encuentran unidos a la celulosa presente en las paredes celulares. Por tanto, la cantidad obtenida al final del experimento representa tanto celulosa como hemicelulosa. Ambos porcentajes químicos aumentaron al disminuir el diámetro en raíces finas y delgadas (Genet et al. 2010). Respecto al diámetro, Carpita et al. (2015) mencionan que las raíces de diámetros finos proveen una óptima fijación al suelo, debido al crecimiento primario que presenta la pared celular de las raíces, compuesta principalmente por moléculas de celulosa.
La contribución de las raíces a la fijación del suelo depende no solo de las características individuales y de la interacción suelo-raíz, sino también de toda la arquitectura del sistema radical (Reubens et al. 2007). Cada especie desarrolla un patrón de enraizamiento diferente dependiendo de las condiciones del sitio de crecimiento. Aunque, la morfología de la raíz es uno de los factores más importantes que proporcionan anclaje y fijación al suelo (Dupuy et al. 2007), la condición del suelo puede modificar la morfología del sistema radical. De esta manera, la composición química de la raíz se ve ligada a su entorno local y de ahí las variaciones que esta pudiera presentar (Genet et al. 2005). Los principales factores que influyen en la fijación del suelo y que se analizaron en este estudio fueron la forma, tamaño y contenidos químicos de raíces. Como la fuerza de tensión incrementa con el decremento del diámetro de la raíz (Genet et al. 2005), una gran cantidad de raíces finas y delgadas fijarían mejor el suelo que raíces gruesas. Esto principalmente debido al aumento en los contenidos de celulosa en diámetros finos en la raíz.
Las especies donde su sistema radical presentan raíces centrales y largas fijarán el suelo en la parte media de la pendiente, debido a la profundidad que exponen sus raíces (Figura 9) (Stokes et al. 2008). Por otro lado, las especies donde su sistema radical presenta raíces oblicuas, densas y poco profundas, fijará la pendiente tanto en las partes superiores como inferiores de manera efectiva (Danjon et al. 2008). Zanthoxylum fagara y Caesalpinia mexicana presentaron raíces profundas (aproximadamente 60 cm de profundidad desde la superficie de suelo) y verticales. Por tanto, estas especies presentan características que las vuelven potencialmente aptas para ser usadas en la parte media de una pendiente. Estas especies corresponden según la clasificación de Styczen & Morgan (1994), al tipo de raíz VH. Cabe considerar que un menor aporte a la fijación al suelo viene asociado a la falta de raíces laterales.
Por otra parte, Decatropis bicolor, Dalea hospes y Broussonetia papyrifera presentaron raíces de máximo 45 cm de profundidad y la mayor densidad de raíces se encontraba cerca de la superficie de suelo. Por tanto, estas especies tendrían mayor efectividad si se encuentran en las partes superiores e inferiores de la pendiente, que en la parte media. Estas especies corresponden según la clasificación, a los tipos de raíz M y H.
La capacidad de fijación de las raíces al suelo depende de diversos factores, incluyendo la especie, las condiciones ambientales, experimentales y edad (Stokes et al. 2009). Sin embargo, las propiedades químicas de la raíz representan una característica importante en respuesta a la fijación de suelo. Por tanto, a partir de los resultados de composición química y morfología se propone que los tipos de sistemas radicales M y H, desempeñan un papel significativo, principalmente por el refuerzo que viene asociado a sus contenidos de celulosa. A este punto, cabe precisar que la lignina sigue siendo un componente importante al momento de proporcionar fijación al suelo, debido a que representa una característica integral que garantiza la función adecuada de otros tipos de células en los diferentes órganos de la planta (Barros et al. 2015). Además, la lignina se ha considerado como un mecanismo de defensa contra el ingreso de fitopatógenos a la planta, limitando la difusión de toxinas secretadas por el patógeno. El aumento y deposición de material lignificado se produce cuando las plantas son sometidas a tipos de estrés bióticos o abióticos (Zavaleta-Fortiz & Lagunes-Mejía 2016).
La potencialidad del uso de las especies estudiadas para la fijación del suelo está vinculada a sus características morfológicas (orientación y ángulos) y la cantidad de raíces pequeñas que presenta el sistema radical de cada individuo (categoría diamétrica I: 0.1 a 2.9 mm). La arquitectura de un sistema radical con raíces principales y raíces laterales principales largas como horizontales, sería un modelo estratégico para la fijación de suelo en un proyecto de revegetación dependiendo de su ubicación en la ladera. Dalea hospes y Decatropis bicolor (Tipo M) localizadas en la cima de la pendiente, Zanthoxylum fagara y Caesalpinia mexicana (Tipo VH) en la parte media y Broussonetia papyrifera (Tipo H) en la base de la pendiente.
El orden de importancia en cuanto al contenido de celulosa y su uso potencial para la protección de laderas fue: Dalea hospes > Broussonetia papyrifera > Caesalpinia mexicana > Decatropis bicolor > Zanthoxylum fagara. En un sistema radical, que cuente tanto con raíces principales como con raíces laterales propiciaría un mejor anclaje, debido a la relación que existe entre el diámetro respecto a la composición química de la raíz y la fuerza de tensión. Los resultados del presente estudio aportan información referente a que una mayor fijación al suelo estaría asociado a la morfología del sistema radical, diámetro de la raíz y composición química. En general, la morfología del sistema radical es uno de los componentes principales para resistir el desarraigo de una planta en un deslizamiento somero de suelo. El éxito del uso de estas soluciones dependerá en gran medida de las especies seleccionadas y las condiciones específicas del sitio.











 text new page (beta)
text new page (beta)













