Las plantas, animales y microorganismos usan los 20 aminoácidos comunes en la síntesis de proteínas. Existen otros aminoácidos de distribución restringida que son necesarios en procesos metabólicos básicos como la ornitina que es precursor en la síntesis de urea y la sarcopina que es intermediario en la síntesis de lisina. A diferencia de ornitina y sarcopina, la mayoría de los aminoácidos no protéicos aparentemente no tienen funciones reconocidas en procesos metabólicos primarios sin embargo, algunas evidencias indican que los aminoácidos no protéicos son de gran importancia para asegurar la supervivencia de las especies (Fowden et al., 1967). A la fecha se conocen más de 240 amino ácidos no protéicos (ANP) aislados y caracterizados de plantas (Bell, 1980). El interés en su estudio se centra en un grupo de aminoácidos de estructura particular (tienen menos de diez átomos de carbono), además tienen interés en agricultura y medicina así como en ecología debido a los efectos fisiológicos que producen en otros organismos. Su distribución limitada puede proporcionar a la taxonomía valiosa información sobre las relaciones evolutivas que existen entre las diferentes especies de plantas. En Lonchocarpus, la canavanina es un metabolito característico de las especies africanas y la enduracidina de las especies americanas. En niveles taxonómicos supragenéricos, la presencia de canavanina en miembros de la tribu Mirbelieae (Benth.) Polhill ha determinado que se ubica más cercana a Tephrosoieae (Benth.) Hutch. que a Podalyrieae Benth A nivel de familia, existen relaciones basadas en similitudes morfológicas en las Sapindaceae Juss., Hipppocastanaceae A. Rich. (= Hyppocastanoideae Dumort) y Aceraceae Juss. donde se confirmó que las tres antiguamente familias comparten la síntesis de aminoácidos no protéicos derivados de ciclopropano con residuos de C6 y C7 (Bell y Fellows, 1966; Rosenthal, 1982).
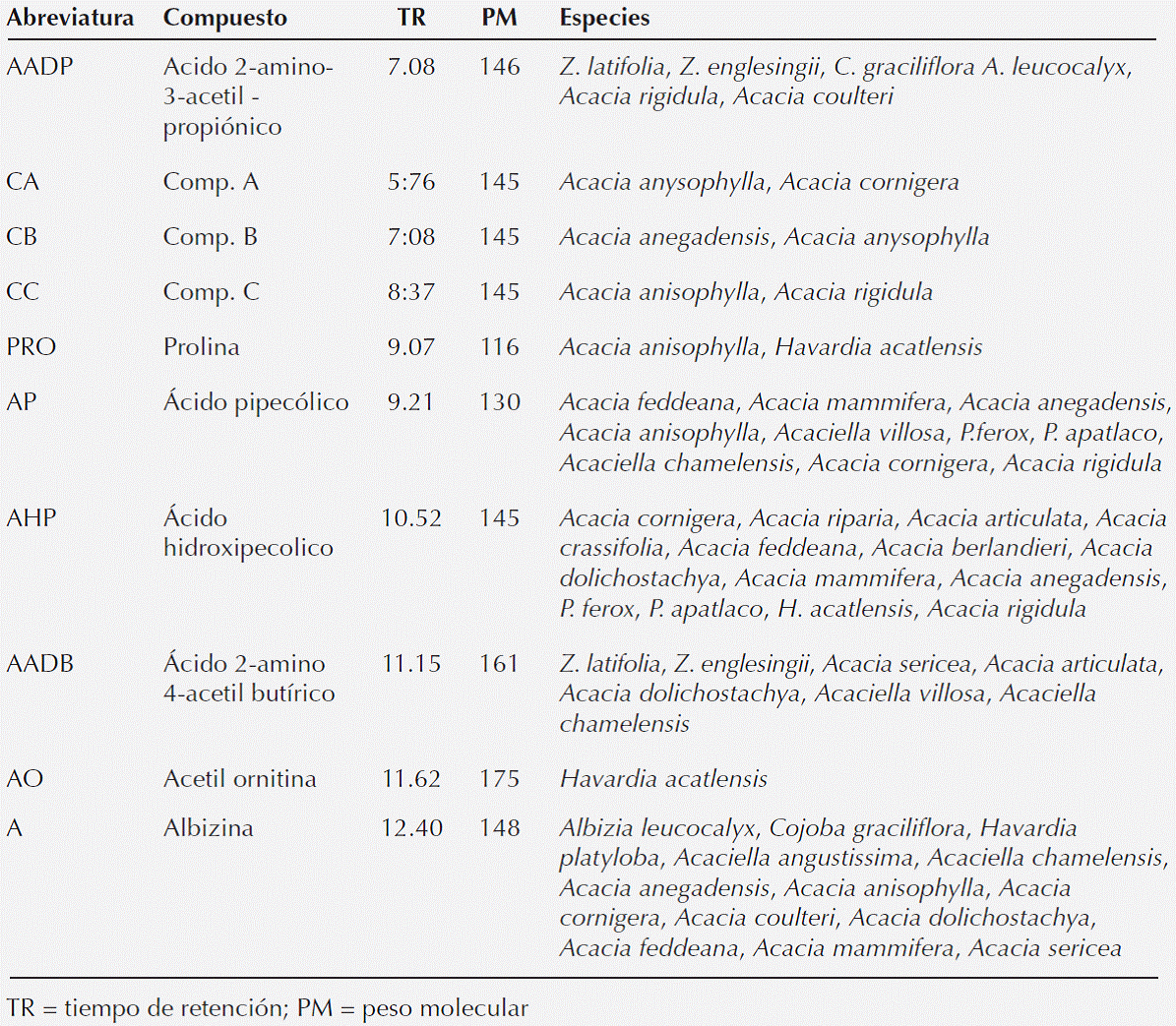
Aproximadamente en 100 especies del género Acacia Mill. sensu lato se han identificado el ácido 2-amino-4-acetil amino butírico, albizina, willardina ó el ácido 4-hidroxi pipecólico (Senevirantne y Fowden, 1968; Evans et al., 1994). En una revisión de la fitoquímica del género, Seigler (2003) reporta que el subgénero Acacia se caracteriza por la presencia de ácido N-acetildjencólico, descrito por primera vez en A. farnesiana (L.) willd. En relación al subgénero Aculeiferum, la mayor parte de sus miembros contiene ácido α-amino-β-oxalil-aminopropionico y ácido α,β-diamino propiónico, además de los mismos compuestos que los encontrados en el subgénero Phyllodineae (Evans et al., 1977). Compuestos como el ácido 2-amino-4-acetil amino butírico, albizina o el ácido 4-hidroxi pipecólico son también característicos de las especies de este subgénero.
Investigaciones recientes muestran que el género Acacia s.l. es polifilético (Luckow et al., 2003, Gómez-Acevedo et al., 2010). Seigler et al. (2006) propusieron que el grupo A. coultieri puede ser considerado como género con 12 especies asignándole el nombre de Mariosousa. Acacia coulteri no presenta ácido N-acetildjencólico, dos de las especies de este grupo A. willardiana y A. millefolia presentan otros aminoácidos willardina y S-[β-carboxiisopropil]-L-cisteina. Este último también se encuentra presente en las especies que pertenecen al subgénero Phyllodineae (Evans et al., 1977).
Las investigaciones realizadas hasta ahora originan preguntas que se abordan en este trabajo: ¿Son todas las especies de Acaciella formadoras de ácido acetildiamino butírico (AADB)?, ¿es éste el único género que lo presenta? ¿Es todo el grupo Acacia coulteri (= Mariosousa) sintetizador de willardina y/o S-[β-carboxiisopropil]-L-cisteina? ¿Existe algún metabolito en especial que caracterice a este último grupo? El objetivo de este trabajo fue aplicar la técnica de cromatografía de líquidos acoplado a espectrometría de masas a un bloque de 24 especies en tres tribus de la subfamilia Mimosoideae analizando las relaciones de acuerdo al contenido de ANP para tratar de contestar las preguntas planteadas.
Materiales y métodos
Se usaron muestras de herbario (K y MEXU) de hojas o semillas de tres especies del subgénero Acacia del nuevo mundo, diez especies del subgénero Aculeiferum (que incluyó a cuatro especies del grupo Acacia coulteri), tres especies del género Acaciella, seis especies de la tribu Ingeae y dos especies de la tribu Mimoseae (Tabla 1). La preparación de los extractos se basó en el método descrito por Kite e Ireland (2002). De cada muestra se trituró en un mortero con arena una cantidad mínima de 20-30 mg con 1.5 ml de metanol acuoso al 70 % (v/v), se dejó con el disolvente a temperatura ambiente durante la noche (laboratorio de fitoquímica, condiciones de laboratorio). Después de la eliminación del residuo por centrifugación, se añadieron 50 mg de una resina de intercambio iónico Dowex 50(H+) de 100-200 mallas y se mezcló suavemente. El disolvente se evaporó a sequedad y la resina impregnada con los aminoácidos no protéicos se lavó repetidamente con agua y luego al añadir 0.5 ml de amoníaco 2M se eluyeron los amino ácidos no protéicos. El filtrado se liofilizó y la muestra se re suspendió en agua destilada para tener una concentración 1 mg100 μl-1 Las muestras se filtraron antes de inyectar al cromatógrafo de líquidos. Para la Cromatografía de líquidos-Espectrometría de masas de los ANP, se utilizó un cromatógrafo de líquidos (Waters 600E) acoplado a un espectrómetro de masas con trampa iónica (Thermo-Finnigan LCQ) vía una fuente de ionización química (APCI por sus siglas en inglés) y se siguió el método reportado por Kite e Ireland, (2002). La separación de los ANP se hizo sin derivatización en una columna C18 Phenomenex HILIC de 5 μm de 250 mm × 4.6 mm (d.i.). La fase móvil consistió en una mezcla de acetonitrilo/formiato de amonio 10 mM, pH 3.2 para producir un gradiente lineal de acetonitrilo de: t = 0 min 95:5, t = 20 min 70:30, t = 27 min 95:5 y t = 35 min 95:5. La columna se dejó equilibrar por 10 min en la condición inicial (formiato de amonio 10 mM) antes de que se inyectaran las muestras. Se inyectaron volúmenes de 10 μl a una velocidad de flujo de 1 ml/min La fuente iónica se operó en modo positivo con las siguientes condiciones: 450 °C en el tubo vaporizador; 80 y 20 psi en el filamento y nitrógeno auxiliar respectivamente; 5 μA en la corriente de aguja; 150 °C en el capilar. En el espectrómetro de masas se monitorearon iones en el rango de 70 a 500 m/c alternando con datos de MS/MS scans de los tres o cuatro iones más intensos usando una abertura de aislamiento de iones de 3 ums y una energía de colisión del 35 %.
Resultados
Análisis de los ANP por cromatografía de líquidos. Los cromatogramas mostraron para cada una de las muestras analizadas un perfil de los compuestos que el equipo es capaz de detectar basado principalmente en la alta sensibilidad del detector de masas. Los ANP reportados para Acacia y para las especies que se usaron como contraste (Inga spp. y Prosopis spp.) se observaron fácilmente a través del análisis de cromatografía de líquidos-espectrometría de masas del extracto de hoja y semillas (Tabla 2). En este análisis se detectó que no todas las especies de Acaciella acumulan ácido 2-acetildiamino butírico; por ejemplo A. angustissima no acumula este compuesto, mientras que A. villosa sólo presentó ácido 2-amino-4-acetil amino butírico y ácido t-4-OH pipecólico y en A. chamelensis el patrón de estos compuestos resultó muy diferente al resto de las especies del género Acaciella.
Tabla 2 Perfil de los aminoácidos no proteicos en las muestras de 24 especies en tres tribus de la subfamilia Mimosideae
Respecto al grupo de Acacia coulteri se encontró que no todas las especies estudiadas de este grupo contienen willardina ni S-[β-carboxiisopropil]-L-cisteina, no se registró ningún compuesto con el peso molecular de estos aminoácidos, 199 y 207 respectivamente. Además la albizina se encontró en las cuatro especies analizadas (Tabla 2).
Discusión
Contribución a la sistemática. Gómez-Acevedo et al. (2010) analizaron molecularmente siete especies de Acaciella, encontrando que A. chamelensis es la única que se anida en un clado diferente a las otras seis especies analizadas y se ubica en un linaje cercano a las especies del género Inga. Es decir, sugieren que A. chamelensis no está filogenéticamente relacionada a las otras especies de Acaciella. En este estudio, A. chamelensis presentó AP, AADB y A, los cuales no la caracterizaron para apoyar la clasificación molecular, pero sí a la morfológica. Contestando la pregunta inicial, ¿Son todas las especies de Acaciella formadoras de ácido acetildiamino butírico (AADB), es éste el único género que lo presenta? resulta que NO todas las especies de Acaciella lo presentaron, este no se detectó en A. angustissima.
Kite (1997) no detectó ácido 2-amino-4-acetil amino butírico (AADB) en A. angustissima, cabe aclarar que los instrumentos de análisis no eran tan específicos como los de este trabajo.
En cuanto a los ácidos pipecolicos, estos se encuentran presentes en varios géneros de la tribu Ingeae y en Monopetalanthus (Kite, 1997), género actualmente llamado Bikinia (ambas especies en la subfamilia Caesalpinioideae, de acuerdo a Wieringa 1999), de tal manera que no caracterizara ni a la tribu Ingeae ni a los géneros de ésta.
La segunda pregunta que nos hicimos fue ¿Es todo el grupo Acacia coulteri (= Mariosousa) sintetizador de willardina y/o S-[β-carboxiisopropil]-L-cisteina? Los resultados que encontramos indican que no están presentes estos compuestos en este grupo de Acacia.
La tercera pregunta de nuestros objetivos fue ¿Existe algún metabolito en especial que caracterice a este último grupo? No se encontró, no obstante, tres de las especies (A. coulteri, A. dolichostachya y A. sericea presentaron principalmente AADP y AADB, lo cual puede sugerir que A. sericea y A. dolichostachya (adquiriendo AADB esta última) fueron precursoras de A. mammifera (metabolizando AP) y de A. coulteri (metabolizando AADP). Es decir que el AADP y el AADB son los compuestos clave para la formación de AP y AHP presentes sólo en A. mammifera.Figura 1

Figura 1 AADP y el AADB son los compuestos clave para la formación de AP y AHP presentes sólo en A. mammifera
Gómez-Acevedo et al. (2010) hacen notar que especies del grupo Acacia coulteri son parafiléticas y esta divergencia puede en parte apoyar los resultados de estos autores, cabe aclarar que este grupo consiste en 12 especies y sólo se estudiaron cuatro. Sin embargo no existe un aminoácido en particular que se encuentre caracterizando a todas las especies del grupo A. coulteri.
Es interesante notar que sólo Acacia anegadensis, A. cornigera y A. rigidula , pertenecientes al subgénero Acacia presentaron los compuestos con peso molecular de 145 y tiempos de retención de 5:76, 7:08 y 8:37 respectivamente. Los compuestos parecen ser diagnósticos para estas especies, posiblemente estos aminoácidos sean útiles como marcadores químicos específicos para las especies del subgénero Acacia; sin embargo, son compuestos no descritos y se necesita investigar su naturaleza exacta.
En Acaciella chamelensis y en A. villosa se observó la presencia del ácido acetil diamino butírico pero no así en A. angustissima, Gmelin (1961) reportó willardina para Acaciella [como Acacia]. lemmonii. Evans et al. (1985) estudiaron A. angustissima, A. tequilana y A. rosei y observan que especies de esta sección Acaciella [= Filicineae] tienen un patrón muy característico diferente a los otros grupos de Acacia s.l., y sugieren que este grupo perdió la habilidad de sintetizar ácido diamino propiónico y subsecuentemente ácido acetil diamino propiónico, sin embargo mantuvo la síntesis de albizina. El género Acaciella consiste de al menos 15 especies, únicamente seis de ellas han sido analizadas química y molecularmente.
Respecto al grupo de Acacia coulteri, los ácidos acetil diamino propionico y acetil diamino butírico caracterizaron sólo a tres de las especies estudiadas: A. coulteri, A. dolichostachya y A. sericea pero no así a A. mammifera. Sería interesante investigar si este compuesto está presente en las otras ocho especies que forman este grupo y si existe algún patrón de aminoácidos en la mayoría de las 12 especies. Las especies del grupo A. couteri se restringen a las regiones tropicales y subtropicales del suroeste de Estados Unidos, México y América Central. Además, de sus cercanas afinidades geográficas, varios caracteres morfológicos y moleculares, separan a este grupo que algunos llaman género Mariosousa (Seigler et al., 2006).
Posibles rutas metabólicas. Si los compuestos de este tipo (aminoácidos no proteicos) son marcadores bioquímicos de especies en diferentes subgéneros y secciones (por ejemplo en los subgéneros Acacia, Aculeiferum y Acaciella) es importante explicar su origen para las especies que en este trabajo se estudiaron por la presencia o ausencia de una ruta bioquímica específica. En este caso, se observa que casi todas las especies de Acacia s.l. presentaron albizina, que es un ureido derivado del ácido 2,3-diamino propiónico (Figura 2). Compuesto que hipotéticamente se pudo haber formado por la adición de un grupo ureido al ácido diaminopropiónico. Una ruta alterna (Figura 3) pudo haber sido el desdoblamiento de una pirimidina para formar 5-amino uracilo que al hidrolizarse forma la albizina, aunque hasta ahora el 5-amino uracilo no se ha identificado en Acacia (Fowden et al., 1979).
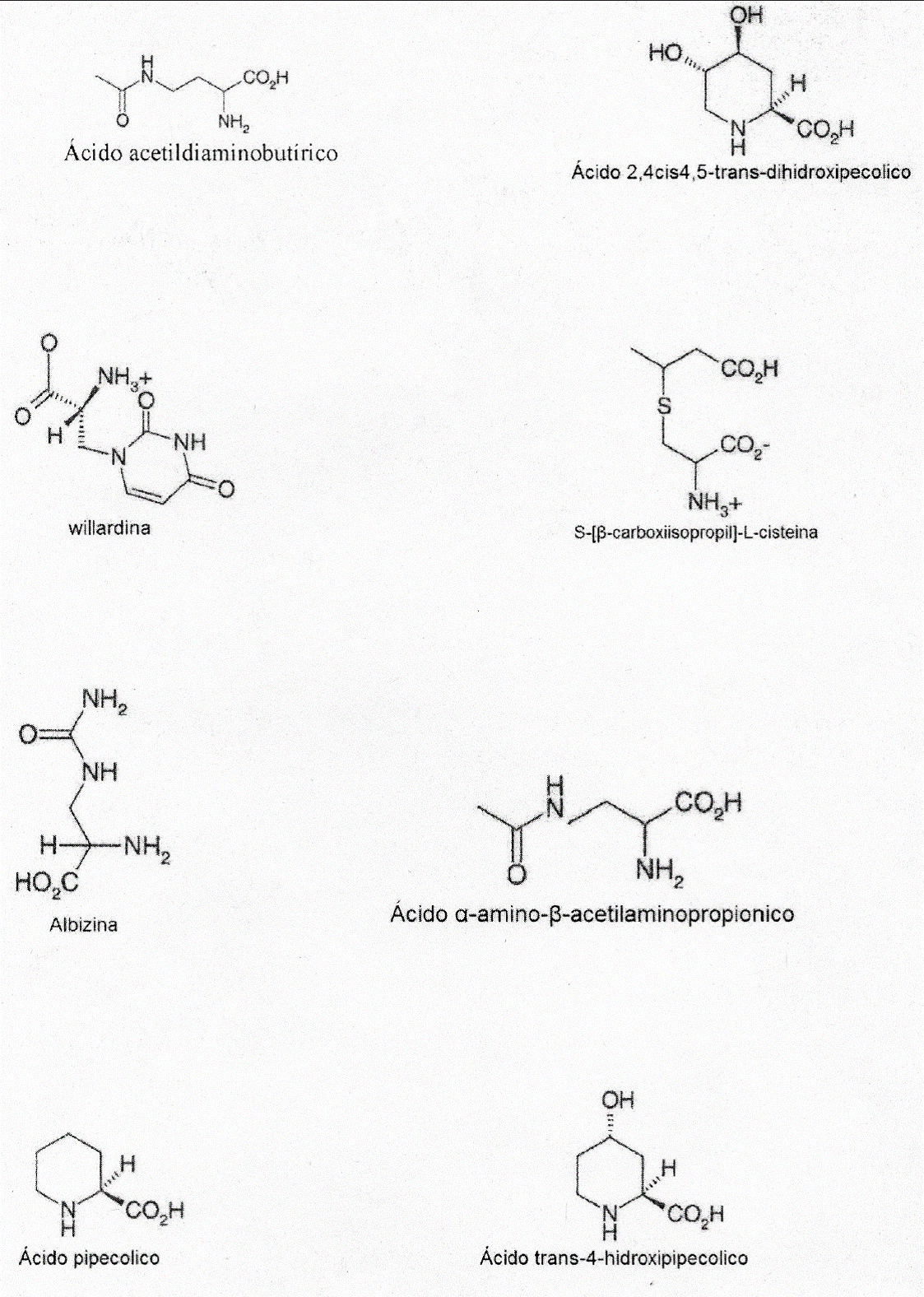
Figura 2 Estructura de algunos aminoácidos no proteicos encontrados en las hojas y/o semillas de Acacia
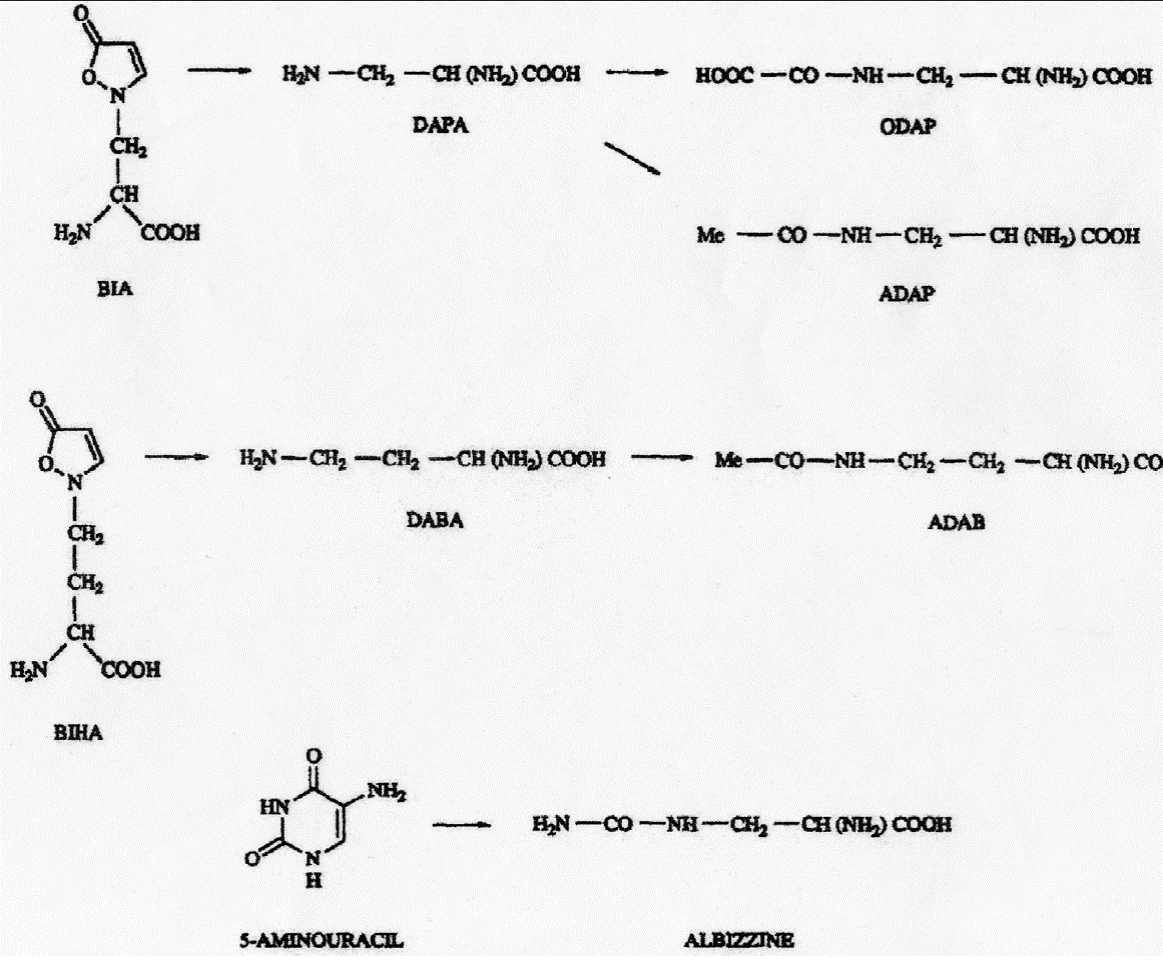
Figura 3 Ruta bioquímica para la formación de algunos aminoácidos no proteicos en las semillas de Acacia (adaptado de Evans, et. al. 1993).
En varias especies de Lathyrus se ha demostrado el origen bioquímico del ácido diamino propiónico, el cual proviene de la degradación de la β-(isoxazolin-5-ona-2-il)-alanina y del derivado oxalilo, es decir del ácido oxalil-diaminopropiónico, al analizarse la enzima que cataliza estos cambios, la oxalil-CoA-sintetasa (Kuo y Lambein, 1991).
En el caso del origen del ácido acetil diamino propiónico ocurre a través de una reacción similar a la anterior seguida de una reacción de acetilación del ácido diamino propiónico con la participación de una acetil-CoA-sintetasa. El origen bioquímico del ácido acetil diamino butírico hasta ahora es desconocido pero se ha sugerido que proviene de una ruta paralela a la que produce el ácido acetil diamino propiónico, con la degradación de la β-(isoxazolin-5-ona-2-il)-homoalanina al ácido diamino butírico y su subsecuente acetilación por una acetil-CoA-sintetasa (Evans et al., 1993).
Con base en los datos generados en esta investigación se puede señalar que en los subgéneros Acacia, Aculeiferum, Acaciella y el grupo Acacia coultieri, el ácido acetil diamino butírico y los compuestos con pesos moleculares de 145 son los más útiles para sugerir grupos de especies químicamente similares.











 text new page (beta)
text new page (beta)



