Introducción
El cáncer de próstata es el cáncer más prevalente e incidente en varones en Europa y España, causando 14 008 casos de muerte en el año 2016 en España.1
La fase de resistencia a la castración (CPRC) se alcanza en los estadios avanzados de la enfermedad, definido como una progresión tumoral demostrada por cifras de antígeno prostático específico (PSA) o por criterios radiológicos, en presencia de unos niveles de testosterona inferiores a 50 ng/dl.
Es en esta fase de la enfermedad donde en los últimos años ha surgido un crisol de tratamientos encaminados a mejorar la supervivencia, así como la calidad de vida. La elección de uno u otro tratamiento depende de factores como la carga tumoral, la presencia de metástasis viscerales, la situación funcional del paciente o la presencia de dolor. En la evaluación de la respuesta al tratamiento se valora la mejoría clínica, la disminución de los niveles de PSA y la mejoría o estabilidad de las lesiones metastásicas en las pruebas de imagen.
Como vemos, el PSA es usado como un marcador tumoral fundamental en las distintas etapas del cáncer de próstata, desde el diagnóstico hasta sus fases finales y el cambio en los niveles de PSA es un criterio de respuesta y progresión a los distintos tratamientos.
En la literatura se describe la importancia de los descensos de PSA como factor predictor de respuesta en situaciones como el inicio del bloqueo hormonal,2 así como en fases de CPRC,3 habiendo sido descrito con más frecuencia en tratamientos con docetaxel. De igual modo se ha descrito previamente que la velocidad de descenso del PSA puede comportarse como un factor de buena respuesta, como es el caso de la braquiterapia, donde el retraso en alcanzar el PSA nadir,4 se relaciona con mejores supervivencias libres de progresión; no habiendo sido descrito previamente la importancia de este comportamiento en los tratamientos en fase de CPRC.
Objetivo
Nuestro objetivo es evaluar si el tiempo a conseguir el PSA nadir se relaciona con una mejoría en los tiempos libres de progresión.
Material y métodos
Realizamos un diseño retrospectivo, incluyendo los pacientes tratados con acetato de abiraterona más prednisona en nuestro centro entre enero de 2014 y mayo de 2018 en fase CPRC M1.
Entre los criterios de inclusión se consideran: pacientes asintomáticos u oligosintomáticos sin uso de mórficos, en fase de CPRC metastásico, sin tratamiento previo con quimioterapia ni enzalutamida, sin metástasis viscerales y con un ECOG de 0-1.
Con estos criterios reclutamos 36 pacientes, con un seguimiento mínimo de 10 meses. Evaluamos los niveles de PSA al inicio del tratamiento, después de 4, 8y 12 semanas, así como en los periodos sucesivos según nuestro protocolo. Consideramos respuesta de PSA como una disminución de ≥30% desde el inicio del tratamiento y la progresión de PSA como un aumento de ≥25% desde el inicio. Diferenciamos entre progresión aislada de PSA y progresión que suponga retirada de tratamiento, definida como aquella que asocie al menos dos de los siguientes criterios: progresión de PSA, progresión clínica y progresión radiológica. Para la progresión clínica y radiológica usamos los criterios establecidos en las guías de la Asociación Europea de Urología.5
Para el análisis estadístico usamos el programa SPSS v23. Realizamos un primer análisis descriptivo de las variables PSA nadir alcanzado; tiempo a obtener ese nadir (TAN) y una variable ad hoc denominada nadir 30, definida como alcanzar un descenso del PSA de al menos el 30%. Tras ello realizamos un análisis univariante con la variable dependiente “tiempo a la progresión que suponga retirada de tratamiento”. Finalmente ejecutamos un análisis de regresión lineal para las variables estadísticamente significativas en el análisis univariante.
Resultados
En nuestra serie, la media de edad de los pacientes era de 77 años, con una desviación estándar D.E. de 5.7 años.
Tabla 1 Características de los pacientes
| Total, n=36 pacientes | |
|---|---|
| Edad (media/DE) | 77.3/5.7 |
| PSA al diagnóstico (mediana/DE) | 27.8/159.8 |
| PSA nadir (mediana/DE) | 2.3/18.3 |
| PSA doubling time (media/DE) | 5.7/4.3 |
| Score de Gleason n (%) | |
| 6 | 2 (5.7) |
| 7 (3+4) | 6 (17.1) |
| 7 (4+3) | 1 (2.9) |
| 8 | 6 (17.1) |
| 9 | 12 (34.3) |
| No se realizó biopsia | 8 (22.9) |
| Perdido | 1 (2.8) |
| Carga metastásica n (%) | |
| M1a | 10 (26.3) |
| M1b <4 lesiones | 10 (26.3) |
| M1b>4 lesiones | 15 (39.5) |
| M1b <4 lesiones, al menos una extraaxial | 3 (7.9) |
La mediana de PSA al inicio del tratamiento era de 27.8 ngr/dl. La mediana de progresión de PSA se producía a los 5.5 meses de tratamiento, y la mediana de progresión que suponía retirar el tratamiento a los 11 meses.
La media de tiempo en alcanzar el nadir 30 fue de 2.2 meses y el 80% lo alcanzo en los primeros 3 meses de tratamiento. Ninguno de los pacientes consiguió un nadir 30 más allá de los 7 meses de tratamiento.
La mediana de PSA nadir entre el grupo de pacientes que lograban un descenso de al menos el 30%, fue de 2.26 ng/dl. La mediana para conseguir el TAN era de 8 meses.
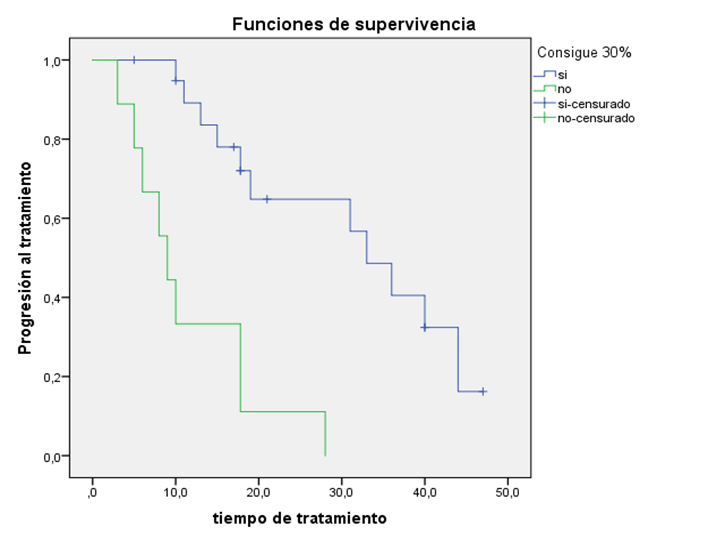
El análisis univariante lo realizamos mediante T de student para la variable nadir 30 respecto al tiempo a la progresión que supusiera la retirada del fármaco. Previo al uso de esta prueba paramétrica, confirmamos la normalidad y la homocedasticidad de la muestra mediante las pruebas de Kolmogorov y Levene respectivamente. En este análisis obtuvimos resultados estadísticamente significativos, existiendo en nuestra serie una diferencia media de 13 meses de respuesta al tratamiento en aquellos pacientes que alcanzan un nadir 30 respecto a aquellos que no lo alcanzan (p<0.02).
Para las variables PSA nadir y TAN, respecto a la variable dependiente tiempo a la progresión, realizamos una regresión lineal simple, siendo significativa la regresión lineal en el caso del TAN; no así la variable PSA nadir que no alcanzaba la significación en la regresión.
Tras ello realizamos una regresión lineal múltiple con las dos variables descritas previamente, que habían alcanzado la significación en el análisis univariante.
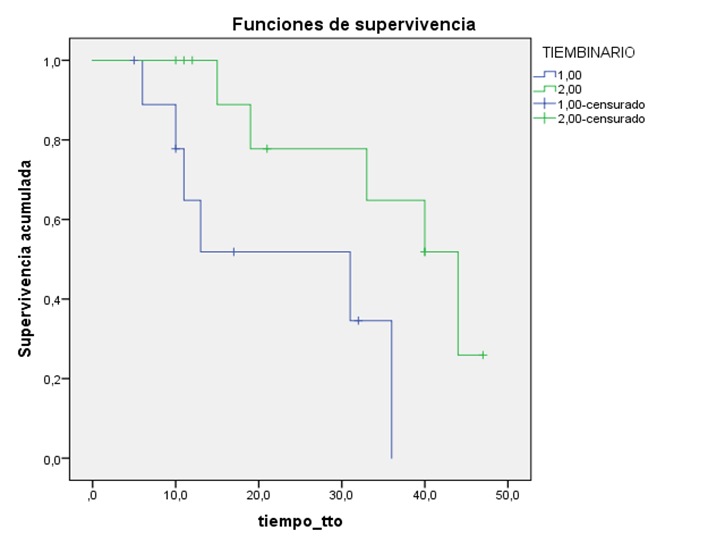
El análisis de regresión lineal múltiple eliminó del modelo a la variable nadir 30, quedando en el mismo como variable significativa el TAN. De esta manera, el tiempo al nadir en la regresión lineal se asocia de manera positiva con la progresión (p<0.018). En esta recta de regresión la ordenada en el origen es de 13 meses y el coeficiente beta de 0.82.
Discusión
La progresión a los tratamientos para el cáncer de próstata en fase de CPRC habitualmente suele constar de dos fases, una primera fase de elevación de PSA tras una respuesta inicial y una segunda fase en la que se asocia una progresión clínica o radiológica. Si bien es cierto que no todos los pacientes desarrollan necesariamente una progresión de PSA previa a la progresión clínica. Por ello, a efectos de cambios de líneas de tratamiento, usamos actualmente la combinación de dos de los tres factores descritos para considerar que se ha producido una progresión.
La respuesta inicial de PSA es un factor importante que parece predecir cómo será la respuesta clínico-radiológica del paciente.6 En nuestro estudio decidimos categorizar a los pacientes en aquellos que logran una disminución de al menos un 30% del PSA con el tratamiento con abiraterona y aquellos que no lo logran. Los pacientes que consiguen un descenso de al menos el 30% del PSA lo consiguen en una amplia mayoría antes de los tres primeros meses de tratamiento; ninguno consiguió un descenso de esta magnitud pasados los primeros 7 meses, asociando en estos casos progresiones clínicas o radiológicas, sin haber descendido el PSA, lo que se traduce en una falta completa de respuesta al fármaco.
Entre los pacientes que lograban el nadir 30, existía una diferencia media de 13 meses de supervivencia libre de progresión respecto a aquellos que no lo alcanzaban. Para su mejor visualización gráfica decidimos realizar tablas de progresión de este parámetro (Figura 1).
El PSA nadir alcanzado es otro factor que parece ser relevante de cara a evaluar la respuesta al fármaco,7 si bien no existe consenso en cuanto a su carácter pronóstico.8-10 En nuestra serie pudimos comprobar que no se comporta como un factor asociado a la progresión en la regresión lineal. Consideramos que este hecho, así como que el modelo de regresión lineal múltiple descarte la variable nadir 30, puede estar asociado al bajo número de pacientes analizados y por ende a la falta de potencia de la prueba.
Por otro lado, el TAN es el factor que alcanza la significación estadística tanto en el análisis univariante como en el multivariante en nuestra serie. De manera que el tiempo al nadir se asocia de manera positiva con la progresión, obteniendo mejores tasas de supervivencias libres de progresión cuando se consigue un PSA nadir a más largo plazo. Su interpretación clínica se resume de la siguiente forma: por cada mes de retraso en alcanzar el nadir se espera un retraso en el tiempo hasta la progresión 0.8 meses. Este tipo de descensos lentos y mantenidos en el tiempo ya eran conocidos en la mayoría de las series,4 como factores de buena respuesta en los pacientes tratados con braquiterapia prostática de baja tasa con intención curativa, y concuerda con los resultados obtenidos en nuestra serie de respuesta al fármaco, en fases más avanzadas de la enfermedad. Para su mejor visualización gráfica hemos expresado este comportamiento en forma de curvas de progresión (Figura 2).
Si bien la variable nadir 30 queda excluida del modelo de regresión lineal múltiple, podríamos aventurar que en futuros análisis con mayor potencia consiga la significación estadística; con lo que posiblemente la respuesta idónea de PSA sería un descenso de al menos el 30 % del valor inicial en los primeros meses de tratamiento y tras ello un descenso lento y mantenido en el tiempo.
La limitación del trabajo viene dada por el bajo número de pacientes analizados y por tratarse de un diseño retrospectivo, de manera que los datos arrojados son de carácter exploratorio. Pensamos que futuros trabajos de diseño aleatorizado y con mayor número de pacientes pueden corroborar estos resultados.
Conclusiones
Nuestro estudio arroja una posible asociación entre el TAN y el tiempo de supervivencia libre de progresión en pacientes tratados con acetato de abiraterona en fase de CPRC M1a-M1b sin uso previo de quimioterapia ni enzalutamida, de manera que estimamos que por cada mes de retraso en alcanzar el nadir se espera una mejoría en el tiempo hasta la progresión de 0.8 meses.











 text new page (beta)
text new page (beta)