Introducción
En el año 2018 se presentaron en el mundo 1 276 106 casos de cáncer de próstata, lo que representa el 7.1% de todas las neoplasias malignas en hombres con tasas de incidencia variables en cada región del mundo. En Asia con una incidencia ajustada por edad de 79.1 por cada 100 000 habitantes, en Norteamérica de 73%, seguido de Europa con 62.1%. África y Asia con tasas de incidencia menores que en los países desarrollados, 26% y 11.5%, respectivamente. En América Latina durante 2018 se diagnosticaron 124 990 casos nuevos, esperándose un aumento de 101% de casos nuevos para el año 2040. Lo anterior explicado en parte por el aumento de la expectativa de vida, estilos de vida occidentales con los factores de obesidad y dietéticos asociados, así como la mejoría en el acceso a los sistemas de salud y los programas de tamizaje a través del antígeno prostático específico.1
En los países desarrollados a pesar de las tasas de incidencia altas, la mayoría de los casos son diagnosticados en etapas confinadas al órgano, con sobrevida global a los 5 años de 98%. Sin embargo, en México constituye un problema de salud pública, ya que a pesar de presentar tasas de incidencia tres veces menor que en los Estados Unidos, la mortalidad por esta causa es casi la misma. Investigadores del Instituto Nacional de Salud Pública encontraron que durante 1980 a 2013 murieron 114 616 hombres y que la mortalidad durante los últimos 13 años registró un aumento sostenido anual de 2.3% principalmente en los estados de muy alta (4.4%) y alta marginación (7.7%), mientras que en los de muy baja hubo una reducción de 5% anual. Cuando la neoplasia no ha rebasado la cápsula prostática y tiene factores pronósticos adecuados el tumor es potencialmente curable y la sobrevida global y cáncer específica, suelen ser similares al promedio de vida de la población.2-4
Billroth efectuó la primera prostatectomía transpúbica en 1887, inicialmente por hiperplasia prostática, y fue hasta 1904 en que Hugh Hampton Young realizó la primera prostatectomía radical por cáncer utilizando la vía perineal. Hasta 1965 se habían efectuado 446 operaciones radicales perineales en los Estados Unidos sin cambios importantes a la técnica original.5
Hacia 1945 Terence Millin popularizó el abordaje retropúbico con lo que se instalaron las bases para el desarrollo de la cirugía moderna.6 Sin embargo, los altos índices de incontinencia urinaria e impotencia postcirugía hicieron que esta cirugía no resultara popular, y prácticamente la radioterapia fue la alternativa mas utilizada para tratar el carcinoma localizado de la próstata.
En 1979 Walsh describió la anatomía venosa de la próstata, y en 1983 la inervación del pene responsable de la erección con lo que se disminuyó considerablemente el sangrado, la incontinencia y disfunción eréctil, por lo que rápidamente se popularizó este abordaje hasta llegar en la década de 1990. Hasta la fecha, es la forma más usual de tratamiento del carcinoma localizado de la próstata.7
En los últimos 10 años la cirugía laparoscópica y la asistida por robot da Vinci han ganado popularidad y en muchos sitios han desplazado a la cirugía abierta, sin embargo, esta última sigue siendo el pilar para el tratamiento del carcinoma de próstata. En 2013 también cambiamos hacia la cirugía robótica y en este trabajo presentamos nuestros resultados con la técnica abierta.
Objetivo
Evaluar los resultado oncológicos y funcionales de la prostatectomía radical retropúbica abierta en una cohorte de 1 420 pacientes con diagnóstico de cáncer localizado de la próstata, operados en la Ciudad de México en el periodo comprendido entre 1991 y 2015 en 3 unidades hospitalarias.
Material y métodos
Se diseñó un estudio de cohorte retrospectiva de 1 420 casos de pacientes con cáncer de próstata sometidos a cirugía radical por un solo cirujano (ATG) en los hospitales: Hospital Santa Fe, Hospital San Angel Inn del Sur, así como en el Hospital Angeles del Pedregal en la ciudad de México, en el período comprendido entre febrero de 1991 y diciembre del 2015.
Se utilizaron curvas de Kaplan-Meier para evaluar la sobrevida libre de progresión bioquímica (SLPB), sobrevida cáncer específica (SCE), SLPB por etapa clínica, SLPB por grados de Gleason, SLPB por cifra de antígeno prostático específico (APE) preoperatorio, SLPB de acuerdo al grupo de riesgo, la SLPB de acuerdo a los hallazgos del análisis histopatológico, así como la evaluación de los diferentes factores de riesgo como etapa de riesgo, grado de Gleason y valor del APE, para lo que se utilizó el modelo de riesgo proporcional multivariado de Cox para determinar los pronósticos independientes perioperatorios relacionados con la progresión de la neoplasia. El límite del APE para definir la progresión bioquímica fue de 0.4 ng/ml.8 Se eligió centrar el análisis en la SLPB por ser el primer indicio de progresión de la enfermedad.
Para evaluar el estado de la función eréctil se utilizó, antes y después de la cirugía, el Índice Internacional para la función eréctil.9
Para la evaluación de la continencia urinaria se utilizó un cuestionario sobre el número de protectores utilizados diariamente en los meses l, 3, 6, 9 y 12 del postoperatorio.
Resultados
La mediana de vigilancia fue de 132 meses (rango de 1 a 180 meses). La mediana de edad al momento de la cirugía fue de 65 años (28-76). Del total de los pacientes, se perdieron del seguimiento el 3.9% a los 5 años, 6.3% a los l0 años y 7.8% a los 15 años. Todos los pacientes que tuvieron progresión bioquímica sin progresión clínica recibieron radioterapia de rescate.
Con relación a la etapa clínica, el 5.7% fueron T1a/b, 37.7% etapa T1c, el 13.4% etapa T2a, el 19.7% T2b/c, el 20% etapa T3. El grupo de M1 con 46 pacientes con una o dos metástasis óseas, fueron transferidos a un protocolo clínico de investigación de prostatectomía radical más bloqueo hormonal, y serán objeto de un análisis especial en otra publicación.
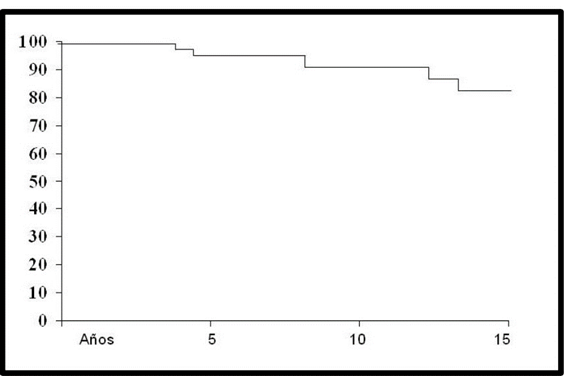
La sobrevida libre de progresión bioquímica de 72.5% (95% IC 73 a 86), 60% (95% IC 65 a 69), y del 51% (95% IC 62 a 66), a 5, 10, 15 años respectivamente (Figura 1).

Sobrevida global libre de progresión bioquímica: el 51% estuvieron libres de elevación del ape a 15 años. El 60% a los 10 años y el 72% a los 5 años. La gran mayoría de los que recurrieron ocurió dentro de los primeros 4 años.
Figura 1 Sobrevida libre de progresión bioquímica
La sobrevida cáncer específica fue de 95% (95% IC 96 a 98), 90% (95% IC 91 a 93) y 83% (95% IC 83 a 86), a 5, 10 y 15 años respectivamente. (Figura 2).
Con relación a la etapa clínica, la sobrevida libre de progresión bioquímica a 15 años fue de 71% (95% IC 67 a 70) para las etapas para los cT1a/b, 73% (95% IC 69 a 72) para la etapa cTiC, 66% (95% IC 59 a 61) para la etapa cT2A 56% (95% IC 54 a 58), 40% para la etapa cT3 ( 95% IC 3 a 13). (Figura 3).
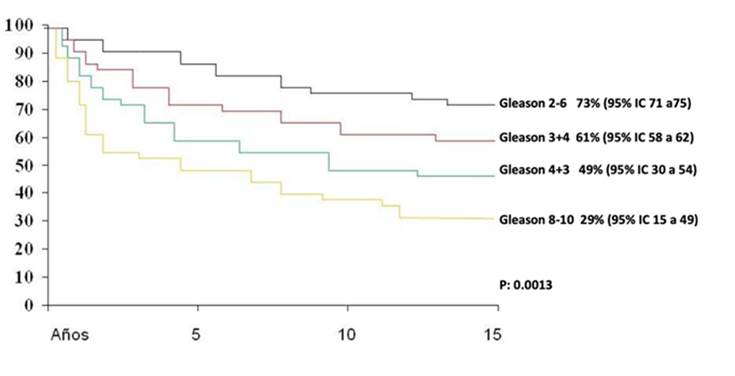
En cuanto al grado de Gleason, la sobrevida libre de progresión bioquímica fue del 73% en el caso de Gleason igual o menor a 6, 61% en Gleason 3+4 y 49% en Gleason 4+3, y 29% cuando el Gleason fue igual o superior a 8. (Fig. 4).
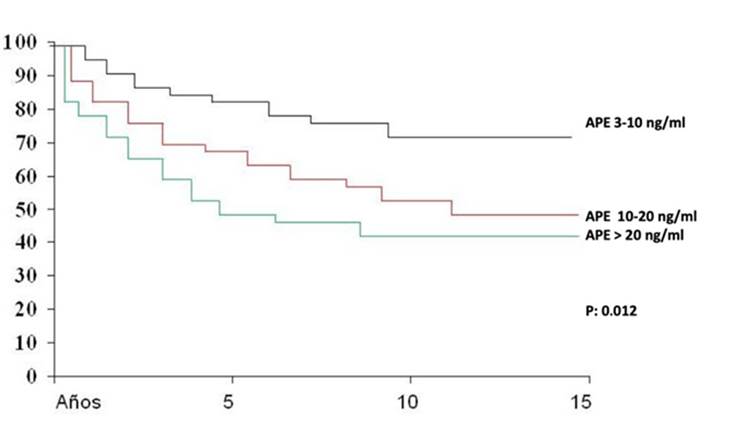
El antígeno prostático específico también fue un factor de impacto en la sobrevida libre de progresión bioquímica ya que el 72% estuvieron libres de progresión bioquímica cuando estuvo entre 3 y 10 ng/ml, del 49% cuando estuvo entre 10 y 20 ng/ml, y del 40% cuando fue mayor de 20 ng/ml. (Figura 5).
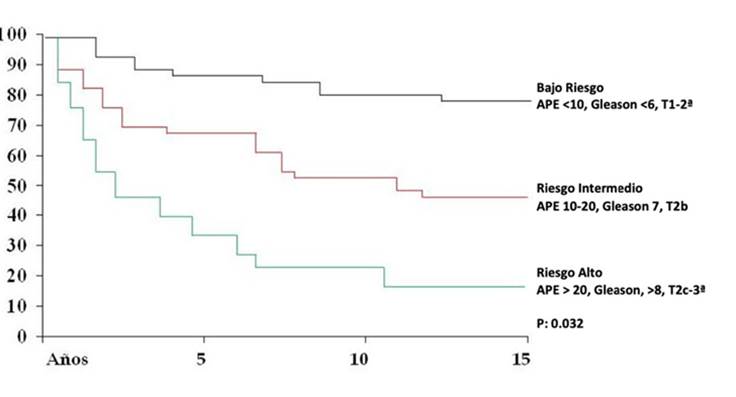
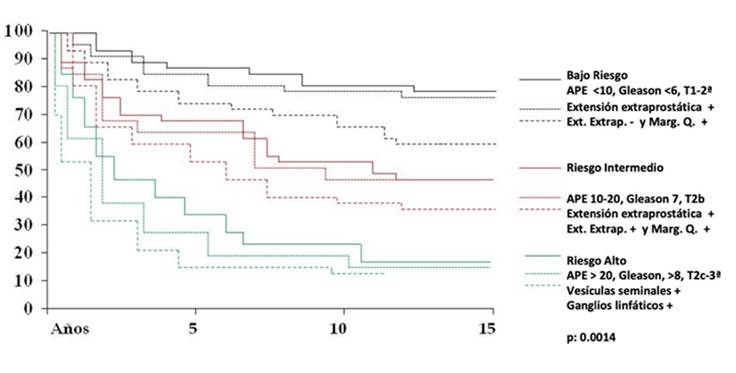
Cuando se analizaron a los pacientes separándolos por los grupos de riesgo de D’Amico,3 los de riesgo bajo tuvieron una SLPB del 80%, 49.5% los de riesgo intermedio, y del 18% los de riesgo alto (Figura 6).
Al analizar los resultados de histopatología del espécimen quirúrgico, se encontró que cuando se compara la curva de SLPB en los pacientes de bajo riesgo se aprecia que no hay diferencia significativa cuando hay un margen positivo, pero sí cuando se añade extensión tumoral fuera de la cápsula prostática. En el caso del riesgo intermedio se observaron los mismos hallazgos. En los pacientes con riesgo alto no hubo ninguna diferencia entre la SLPB por riesgo alto y la presencia de extensión extra prostática y márgenes positivos.(Figura 7).
En cuanto a las complicaciones secundarias a la cirugía se tuvo una morbilidad del 26.3%, siendo las mas frecuentes el linfocele (12.7%), la estenosis de anastomosis uretro vesical (6.4%) y la tromboflebitis (4.9%). La mortalidad fue de 0% (Tabla 1). De acuerdo a la clasificación de Clavien-Dindo,10 fueron grado I el 1.5%, II el 4.9%, III el 19.3% y 4 el 0.58%.
Tabla 1 Morbilidad
| No. | % | |
|---|---|---|
| Infarto cardiaco | 1 | 0.08 |
| Tromboembolia pulmonar | 7 | 0.5 |
| Tomboflebitis | 70 | 4.9 |
| Linfocele | 181 | 12.7 |
| Estenosis uretro-vesical | 90 | 6.4 |
| Apertura de recto | 2 | 0.1 |
| Infección de herida quirúrgica | 20 | 1.4 |
| Dehiscencia de anastomosis vesicouretral | 3 | 0.2 |
| 374 | 26.3 |
La morbilidad fue del 26.3%, siendo las complicaciones más frecuentes el linfocele, la estenosis de anastomosis uretrovesical y la tromboflebitis.
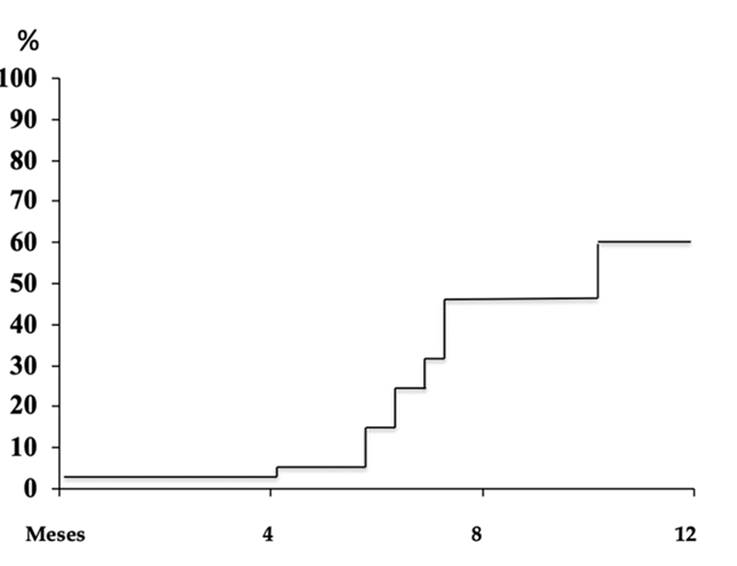
En los pacientes en quienes se preservaron ambos paquetes neurovasculares, solo el 67% tuvieron erecciones normales sin ayuda de ningún medicamento antes de la cirugía. Después de la cirugía, solo el 3% de los pacientes presentaron erecciones normales dentro de los primeros 4 meses. A los 6 meses el 15% y a los 7 el 48% (Figura 8).
Al año de haber sido operados solo el 56% tuvieron erecciones normales sin medicación alguna, 20.5% con ayuda de medicación oral, y el 23.2% con medicamento intracavernoso, sin embargo cuando se analiza por edades, cuando los pacientes fueron menores de 50 años el 80% tuvieron erecciones normales sin medicación oral, 65% entre los 50 y 60 años, 50% entre los 60 y 70 y solo el 30% en mayores de 70 años (Tabla 2).
Tabla 2 Función erectil
| Menores de 50 años % | Entre 50 y 60 años % | Entre 60 y 70 años % | Mayores 70 años % | % | |
|---|---|---|---|---|---|
| Erección competa sin medicación oral | 80 | 65 | 50 | 30 | 56 |
| Erección completa con medicación oral | 12 | 25 | 20 | 25 | 20.5 |
| Erección con medicamento intracavernoso | 8 | 10 | 30 | 45 | 23.2 |
Se evaluaron 965 pacientes con erección normal peroperatoria (67%) y preservación bilateral de paquete neurovascular. En cuanto a las complicaciones, se tuvo una morbilidad del 26.3%, siendo la más frecuente el linfocele (12.7%), la estenosis de anastomosis uretro vesical (6.4%) y la tromboflebitis (4.9%). La mortalidad fue de 0%.
La anastomosis de la unión uretrovesical se realizó con 6 puntos separados en los primeros 600 casos y posteriormente se adoptó la técnica de surgete continuo en los últimos 820 casos con lo que se mejoraron los resultados de continencia urinaria. Con esta ultima técnica, a los 6 meses el 88% estuvieron continentes en forma completa, el 8% con escape de algunas gotas con grandes esfuerzos, y el 4% con la utilización de una toalla protectora al día (Tabla 3).
Tabla 3 Continencia urinaria a los 8 meses de la cirugía
| 6 PUNTOS SEPARADOS 600 pacientes % | SURGENTE CONTINUO 820 pacientes % | |
|---|---|---|
| Continencia total | 80 | 88 |
| Escape ocasional con grandes esfuerzos | 10 | 8 |
| Utiliza un protector pequeño al día | 6 | 4 |
| Utiliza dos protectores al día | 3 | 0 |
| Utiiza un pañal | 1 | 0 |
| Incontinencia total | 0 | 0 |
La anastomosis de la unión uretrovesical se realizó con 6 puntos separados en los primeros 600 casos y posteriormente se adoptó la técnica de surgete continuo en los ultimos 920 casos, con lo que se mejoraron los resultados. Con esta última técnica, el 88% estuvieron continentes en forma completa, el 8% con escape de algunas gotas con grandes esfuerzos, y el 4% con la utilización de una toalla protectora al día.
Cuando se utilizó la técnica de anastomosis con surgete continuo, el 60% de los pacientes tuvieron continencia normal al retirárseles la sonda uretra a las dos semanas de operados, el 75% a los 4 meses, el 82% a los 6 meses y al año el 88% respectivamente, resultados significativamente mejores que cuando se utilizaron puntos separados en la anastomosis uretrovesical, diferencias estadísticamente significativas cuando se les comparó con la técnica habitual de puntos separados. (Figura. 9)

Figura 9 Progresión de la continencia urinaria a 12 meses de acuerdo a la técnica utilizada en la anastomosis uretrovesical
En el modelo de riesgo proporcional de Cox para analizar el APE, la suma de Gleason, la etapa clínica y la etapa patológica como factores de riesgo para la predicción de la progresión del cáncer de próstata, se encontró que los dos únicos factores con validez significativa fueron la suma de Gleason y la etapa clínica preoperatoria. (Tabla 4)
Tabla 4 Modelo de riesgo proporcional de Cox para predicción de progresión del cáncer
| VARIABLES | INDICE DE RIESGO | Z | P | 95% IC |
|---|---|---|---|---|
| APE | 1.72 | 8.30 | 0.076 | 1.60-2.10 |
| Suma de Gleason | 1.39 | 5.21 | 0.003 | 1.19-1.52 |
| Etapa Clinica | 1.20 | 4.65 | 0.029 | 1.14-1.32 |
| Etapa Patologica | 1.90 | 11.93 | 0.064 | 1.75-2.01 |
La etapa clínica y la suma de Gleason fueron los unicos factores independientes con diferencia significativa para predecir la progresión postoperatoria.
Discusión
A pesar de que el manejo del cáncer localizado de la próstata ha experimentado avances importantes en los últimos 30 años, la prostatectomía radical se mantiene como el estándar de oro. Actualmente la cirugía asistida por robot ha ganado popularidad y la cirugía abierta ha quedado relegada a casos en los que no se puede utilizar el robot, o en hospitales en donde no se cuenta con esta facilidad, como en algunos países en donde sigue siendo la cirugía mayormente utilizada en el tratamiento del cáncer localizado de la próstata. Independientes de la técnica que se utilice, varios factores han influido para lograr posicionar la remoción de la próstata como el mejor método de tratamiento par el cáncer localizado, entre ellos el mejor conocimiento anatómico de la vascularidad e inervación de la próstata que han permitido que las consecuencias de incontinencia y disfunción sexual sean menores. Otros factores tales como la introducción del antígeno prostático específico, la biopsia transrectal para clasificar de acuerdo a los grados de Gleason, así como el poder clasificarlos de acuerdo al grupo de riesgo, también han coadyuvado como factores predictivos para la selección adecuada de los pacientes.11,12
En nuestra serie la sobrevida cáncer específica fue de 95% (95% IC 96 a 98), 90% (95% IC 91 a 93) y 83% (95% IC 83 a 86), a 5, 10 y 15 años respectivamente, similares a las obtenidas por el grupo de Zincke et al.,13 de 90 y 82% a 10 y 15 años respectivamente. La diferencia obtenida a los l0 años puede ser explicada por el hecho de que nuestra serie tiene un porcentaje elevado de pacientes en etapas T3 y la de la Clínica Mayo solo son etapas T2c o menores. Al igual que en nuestra serie, a 15 años de vigilancia, la sobre libre de recurrencia fue también del 40%. Los buenos resultados a largo plazo han sido reportados también por otras series que muestran a 25 años de seguimiento, cifras del 68% 84% y 86% para la sobrevida libre de progresión, sobrevida libre de metástasis y sobrevida cáncer específica respectivamente.14
Otras series han mostrado también que el grado de Gleason correlaciona con la evolución de la enfermedad, como la de Lau et al., que encontraron a una vigilancia de 5 años, 75% de SLPB en pacientes con Gleason menor de 8 y solo del 25% en aquellos con Gleason superior a esta cifra.11,15 En nuestros pacientes encontramos los mismos hallazgos, ya que del 73% en el caso de Gleason igual o menor a 6, 61% en Gleason 3+4 y 49% en Gleason 4+3, y 29% cuando el Gleason fue igual o superior a ocho.
La presencia de márgenes positivos también ha sido señalado como un factor que influencia la SLPB. Lau et al., encontraron que en 2 500 pacientes el 39% tuvieron márgenes positivos, la SLPB a 5 años fue de 67% y 84% cuando los márgenes fueron positivos o negativos respectivamente.15. En nuestros pacientes encontramos también que cuando el margen quirúrgico fue positivo pero sin extensión fuera de la cápsula, la SLPB a 5 años fue de 85%, en contraste con aquellos en quienes además del margen positivo había extensión por fuera de la cápsula, en donde fue 58% únicamente.
Cuando evaluamos la sobrevida libre de progresión bioquímica de acuerdo a los grupos de riesgo de D’Amico,16 los de riesgo bajo tuvieron una SLPB del 83%, 49% los de riesgo intermedio, 18% los de riesgo alto. En la serie de la Clínica Mayo, a 10 años de vigilancia, la SLPB fue del 82%, 65% y 55% cuando los grupos fueron de riesgo bajo, mediano y alto respectivamente.16
En nuestra serie, similar a otras reportadas en la literatura, se muestran resultados adecuados a largo plazo tanto en la SLPB, la SLPC , SG y SC. Estos factores se han incorporado a nomogramas para la estratificación de riesgo, y son de gran utilidad en la toma de decisiones al momento de recomendar un tratamiento.
Otro de los aspectos que favorecen a la alternativa de la cirugía como tratamiento es el análisis de la pieza histopatológica, ya que puede brindar información útil para recomendar tratamientos adyuvantes y así lograr mejores sobrevidas. Específicamente el grado de Gleason y la etapa clínica postoperatoria son factores predictivos independientes para la SLRB, como se aprecia en otros reportes.17-22 En nuestra serie encontramos que la presencia de un margen positivo no es un factor adverso que empeore el pronóstico para recurrencia al que confiere la clasificación por riesgo, pero la presencia de extensión tumoral fuera de la cápsula prostática más el margen positivo si añade riesgo a la posibilidad progresión.
En relación a los pacientes de alto riesgo, las curvas de Kaplan-Meier muestran que el pacientes seleccionado adecuadamente puede tener excelente SCE, por lo que en estos casos, la cirugía radical puede ser también una magnífica arma en el tratamiento. Sin embargo, hay que tomar en cuenta las limitaciones de un estudio retrospectivo sin grupo control como lo es el grupo objeto de este reporte.
Conclusión
La prostatectomía radical es hasta el momento un procedimiento que ofrece SCE así como SLPB adecuadas para lograr un control adecuado de la neoplasia prostática. En grupos con volúmenes adecuados de cirugía, tanto la morbilidad como el control de la continencia y función sexual son adecuadas por lo que sigue siendo hasta el momento el tratamiento de elección del cáncer de próstata localizado en centros donde no es posible realizar cirugía por abordaje laparoscópico.











 text new page (beta)
text new page (beta)