Antecedentes
Seminoma es un cáncer de células germinales de los testículos o, más raramente, de localización extragonadal que se origina en el epitelio germinal de los túbulos seminíferos. Aproximadamente la mitad de estos tumores son seminomas. El seminoma metastásico es el paradigma de un cáncer curable y la tasa de curación ha alcanzado el 95%, siendo las metástasis viscerales extrapulmonares el principal factor pronóstico identificado.1
Los avances en los enfoques médicos y quirúrgicos en el cáncer testicular han reducido la mortalidad a menos del 20%.2 Después de la orquiectomía, las guías de la National Cancer Center Network (NCCN) y European Germ Cell Cancer Consortium Group (EGCCCG) recomiendan la quimioterapia de inducción para la etapa IIC o para las grandes masas retroperitoneales tanto en el seminoma como en el no seminoma (NE 1a) o radioterapia (NE 1b).3
En caso de seminoma, las masas retroperitoneales residuales posquimioterapia o radioterapia, según la EGCCCG, no deben necesariamente ser resecadas, sino pueden ser vigiladas con estudios de imagen y marcadores tumorales, la tomografía por emisión de positrones con 18 fluoro-desoxi-D-glucosa (18-FDG-PET) juega un papel muy importante en el seguimiento, debido a que tiene una sensibilidad (S) y especificidad (E) del 80 % y 90% respectivamente, permitiendo distinguir tumor viable de las masas con reacción desmoplasica. Se recomienda solo la vigilancia activa en caso de que el estudio con FDG-PET sea negativo; en caso de ser positivo, se recomienda después de 4-6 semanas posquimioterapia o radioterapia se obtenga una muestra de la masa residual por biopsia o resección para establecer la histología que defina el tratamiento posterior.4
La cirugía de las masas retroperitoneales residuales es todo un “reto” quirúrgico que requiere un conocimiento detallado de la anatomía, técnica quirúrgica y experiencia en el manejo de los pacientes con cáncer testicular.5
Es importante definir viabilidad tumoral en aquellos pacientes que tiene masas residuales mayores a 3 cm de seminoma posquimioterapia para determinar su cirugía de rescate, la cual representa del 55% a 80%.6 El manejo óptimo ha sido ampliamente debatido. De hecho, las lesiones residuales posquimioterapia en la imagen morfológica son frecuentes y la resección quirúrgica de estos hallazgos suele revelar necrosis o fibrosis.7 Algunos centros sugirieron realizar cirugía para todas las lesiones residuales mayores a 3 cm debido a que la probabilidad de tumor viable aumenta, mientras que otras sugirieron observar y usar cirugía de rescate sólo cuando las lesiones no disminuyeron de tamaño, existe recaída claramente documentada, las dificultades técnicas y posible morbilidad de la cirugía.7,8
En las últimas décadas, el manejo posquimioterapia de pacientes con seminoma ha evolucionado debido al uso creciente de 18-FDG-PET, este método solo o combinado con la tomografía computarizada (PET/CT) se ha propuesto como herramienta no invasiva para evaluar la extensión de la enfermedad. Dado que 18-FDG es un análogo de glucosa, radiofármaco que puede ser muy útil en la detección de lesiones malignas que suelen presentar alto metabolismo de la glucosa, cuyo valor se mide mediante el valor estandarizado de captación máxima (SUV Max), la literatura refiere que el nivel de corte aceptado para diferenciar lesiones benignas de malignas es de 2.5 a 3 en tejidos blandos, y 2.0 a 2.5 en tejido óseo.9 El dispositivo PET/CT híbrido permite una mejor detección y caracterización de las lesiones neoplásicas, combinando los datos funcionales y morfológicos respectivamente.10 La incorporación de modalidades de imágenes no invasivas, tales como 18-FDG-PET o PET/CT, en el algoritmo puede permitir una mejor delimitación de la presencia de tumor residual viable y permitir así una mejor estratificación de riesgo en pacientes con seminoma.1
Hasta la fecha existen nueve estudios con el uso del 18-FDG-PET o PET/CT en el manejo posquimioterapia de pacientes con seminoma mostrando resultados contradictorios.11-13 La utilidad del 18-FDG PET/CT son: identificar y discriminar la masa tumoral residual posquimioterapia, contar con una herramienta más fiable que la CT basado en la discriminación del tamaño del tumor residual para predecir la necrosis/fibrosis frente tumor viable, para evitar a los pacientes una cirugía innecesaria, y para el diagnóstico de tumor viable residual temprano.1
El objetivo de nuestro estudio fue conocer la utilidad del 18-FDG-PET/CT para determinar viabilidad tumoral en el manejo de masas residuales retroperitoneales de seminoma posquimioterapia en el Hospital de Oncología “Centro Médico Nacional Siglo XXI”, México. Experiencia 2013-2018.
Material y métodos
Estudio retrospectivo monocéntrico. Se revisaron expedientes clínicos completos de pacientes con tumor residual de seminoma puro (testicular o extragonadal) que se sometieron a 18-FDG-PET/CT después de la sexta semana postquimioterapia. Se excluyeron expedientes de pacientes con masas retroperitoneales residuales intercavoaorticas postquimioterapia no candidatos a cirugía. Las variables registradas fueron: edad, estadio patológico posorquiectomía, tamaño tumoral residual por CT posquimioterapia, valor estandarizado SUV max de PET/CT.
Cabe señalar que el estudio 18-FDG-PET/CT multicorte fue realizada en la Unidad PET/CT Ciclotrón de la Universidad Nacional Autónoma de Mexico, (Biograph 64, PET de alta resolución de cristal LSO y CT de 64 detectores), previa administración vía endovenosa de contraste iodado no iónico y de 370 MBq de 18 FDG con 60 minutos de reposo y obtención de reconstrucciones desde cráneo hasta el tercio proximal de los muslos.
Según resultado del PET/CT para el tratamiento se dividió en grupos, la elección dependía de los factores pronósticos-clínico-patológicos de la enfermedad: vigilancia (grupo 1), cirugía de rescate (grupo 2), radioterapia (grupo 3) y quimioterapia (grupo 4).
Se determino como respuesta a tratamiento mediante los criterios de Recist 1.1, como punto de corte igual o mayor 30% para progresión de enfermedad (PE) y menor a 30% para enfermedad estable (EE) y/o regresión,14 posteriormente se definió el resultado de tumor viable y no viable, clasificándolo en respuesta parcial, respuesta total y enfermedad estable; para luego cruzar el resultado del PET/CT expresado en la escala SUV max. Los estudios de seguimiento fueron realizados a intervalos de 2 meses en los primeros 2 años.
Para determinar la utilidad del 18-FDG-PET/CT como método diagnóstico de tumor residual de seminoma posquimioterapia se comparó con el resultado histopatológico del grupo de cirugía de rescate de la siguiente manera: los resultados de la exploración PET/CT (positiva o negativa) se correlacionaron con la histología de la lesión resecada (necrosis, fibrosis, teratoma y tumor viable).15 Se clasifico como verdadero positivo cuando la PET/CT e histología eran positivos; falso positivo cuando la PET/CT era positivo e histología negativa; falso negativo cuando la PET/CT era negativo e histología positiva; y verdadero negativo cuando la PET/CT e histología eran negativos.
Se uso la curva ROC para definir punto de corte, además de sensibilidad, especificidad, valor predictivo positivo y valor predictivo negativo. Para el análisis estadístico se determinaron frecuencias, porcentajes y medias, utilizando el software SPSS v24.
Resultados
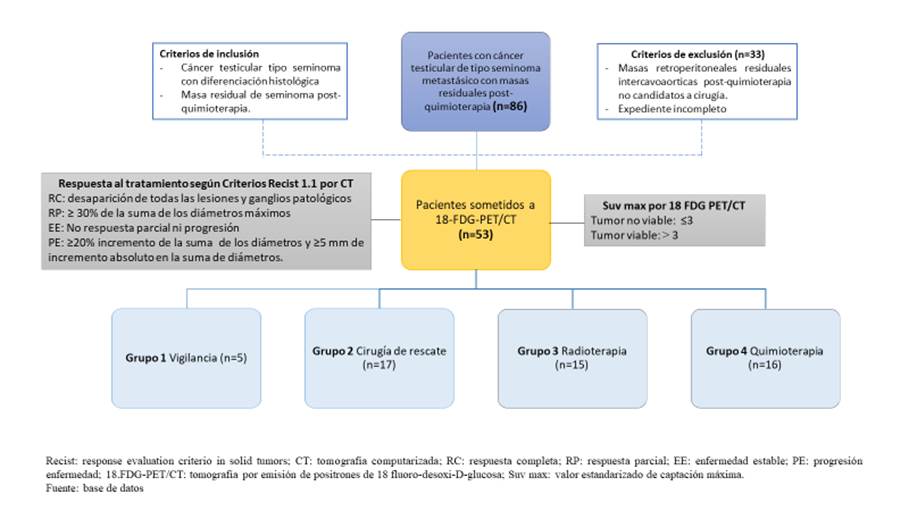
El universo fue de 86 pacientes con cáncer testicular de estirpe seminomatoso en diferente estadio sometidos a quimioterapia primaria, de los cuales 33 fueron excluidos, por lo que la muestra estuvo integrada por 53 pacientes (Figura 1). Las características clínicas de la población estudiada se muestran en la tabla 1.
Tabla 1 Características clínicas de la población de estudio
| Variables | n=53 |
|---|---|
| Edad (años) | 33.7 ± 8.4 |
| Tumor residual posquimioterapia por CT (cm) | 4.8 ± 1.4 |
| SUV Max por 18-FDG-PET/CT | 3.9 ± 1.4 |
| Tratamiento | |
| Vigilancia | 5 (9.4%) |
| Cirugía de rescate | 17 (32.1%) |
| Radioterapia | 15 (28.3%) |
| Quimioterapia | 16 (30.2%) |
| Estadio patológico post orquiectomía | |
| 1 a | 5 (9.4%) |
| 1 b | 3 (5.7%) |
| 2 a | 1 (1.9%) |
| 2 b | 2 (3.8%) |
| 2 c | 20 (37.7%) |
| 3 a | 4 (7.5%) |
| 3 b | 10 (18.9%) |
| 3 c | 8 (15.1 %) |
CT: tomografía computarizada, SUV Max: valor estandarizado de captación máxima, 18-FDG-PET/CT: tomografía por emisión de positrones con 18 fluoro-desoxi-D-glucosa.
Al analizar a todos los pacientes sometidos a PET/CT, sin discriminar por grupos, se encontró una curva de ROC que ronda en toda su trayectoria alrededor de la línea diagonal de referencia (50%), lo cual da un punto de corte de 3.150, con una S de 50% y una E de 60%, valores que no son discriminativos ni útiles para definir viabilidad tumoral (Figura 2).

Punto de corte 3.150, sensibilidad 05 (50%) y especificidad 0,6 (60%)
Figura 2 Curva ROC de análisis general de tratamiento
Al analizar el grupo de cirugía de rescate se encontró que el área bajo la curva fue de 0.7, sin embargo la p=0.206 fue no significativa, IC 95% (0.447-0.953), se obtuvo el punto de corte de 3.250 (Figura 3), con una S 100%, E 25%, VPP 35% y VPN 100%, probabilidad pretest 29%, razón de verosimilitud positiva 1.33 con probabilidad postest + 35%, y razón de verosimilitud negativa 0 con probabilidad postest - 0%.
Discusión
Hasta la fecha existen solo 9 artículos escritos en los últimos 21 años (Tabla 2).1,11,13,16-22 El estudio prospectivo multicéntrico SEMPET (2-18 fluoro-deoxi-D-glucosa Positrón Emission Tomography Is a Reliable Predictor for Viable Tumor in Poschemotherapy Seminoma) incluyó 51 pacientes, la E, S, VPP y VPN para FDG-PET fueron 90%, 82%, 69% y 95% respectivamente.13 Siendo la base de las recomendaciones de varias directrices oncológicas y urológicos internacionales,3,4 la EGCCCG y la NCCN recomienda el uso de PET en el caso de tumor residual mayor a 3 cm después de la quimioterapia para seminoma puro, y vigilancia activa en tumor menor a 3 cm, siendo así la FDG-PET una herramienta valiosa para la toma de decisiones clínicas en comparación con la CT.23 Posteriormente otro estudio prospectivo multicéntrico SEMPECON (2-18 FDG/PET for postchemoteraphy seminoma residual lesions: a restrospective validation of the SEMPET trial) incluyo 127 pacientes, donde comparo la PET antes y después de la quimioterapia reportando S 50%, E 77%, VPP 25 % y VPN 91 % y concluye que la PET sigue siendo una valiosa herramienta para la toma de decisiones clínicas y ahorra la terapia innecesaria, validando de este manera las recomendaciones internacionales;21 sólo dos estudios evaluaron el rendimiento diagnóstico de 18-FDG-PET/CT combinado,20,22 concluyendo un rendimiento diagnóstico superior de PET/CT comparado con PET solo, razón por la cual se realizó el estudio, siendo además el único en el país.
Tabla 2 Comparación de estudios con el uso de 18-FDG-PET/CT o PET/CT en masas residuales de seminoma posquimioterapia
| Estudios | Año | País | Tipo de estudio | Imagen | n | Edad | S | E | VPP | VPN | LR + | LR - | OR |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Ganjoo et al.16 | 1999 | Estados Unidos | Prospectivo monocéntrico | PET | 29 | 38 | 0 | 96 | --- | --- | 1.7 | 0.9 | 1.8 |
| Hain et al.17 | 2000 | Reino Unido | Retrospectivo monocéntrico | PET | 27 | 30 | 79 | 92 | --- | --- | 10.2 | 0.2 | 44 |
| Spermon et al.18 | 2002 | Países Bajos | Monocéntrico | PET | 10 | 30 | 100 | 80 | --- | --- | 5.0 | 0.2 | 17 |
| De Santis et al.13 SEMPET | 2004 | Austria | Prospectivo multicéntrico | PET | 51 | --- | 80 | 100 | 100 | 96 | 72.6 | 0.2 | 316.2 |
| Lewis et al.19 | 2006 | Estados Unidos | Retrospectivo monocéntrico | PET | 24 | --- | 100 | 75 | --- | --- | 3.5 | 0.08 | 47.2 |
| Hinz et al.11 | 2008 | Alemania | Prospectivo multicéntrico | PET | 20 | 42 | 100 | 47 | 25 | 100 | 1.6 | 0.26 | 6.2 |
| Siekiera et al.20 | 2012 | Polonia | Retrospectivo monocéntrico | PET/CT | 37 | --- | 100 | 94 | --- | --- | 11.8 | 0.08 | 153.4 |
| Bachner et al.21 SEMPECON | 2012 | Europa-Israel- Canadá | Retrospectivo multicéntrico | PET | 127 | --- | 50 | 77 | 25 | 91 | 3.7 | 0.41 | 9.16 |
| Ambrosini et al.22 | 2014 | Italia | Retrospectivo monocéntrico | PET/CT | 45 | 37.7 | 90 | 83 | --- | --- | 5.25 | 0.12 | 43.5 |
| Metaanálisis.1 (9 estudios) | 2014 | --- | --- | --- | --- | --- | 78 | 86 | 58 | 94 | 4.59 | 0.26 | 22.7 |
| Nuestro estudio | 2020 | México | Retrospectivo monocéntrico | 18 FDG PET/CT | 17 | 33.3 | 100 | 25 | 35 | 100 | 1.33 | 0 | --- |
S: sensibilidad, E: especificidad, VPP: valor predictivo positivo, VPN: valor predictivo negativo, SEMPET: 2-18 fluoro-deoxi-D-glucosa Positrón Emission Tomography Is a Reliable Predictor for Viable Tumor in Poschemotherapy Seminoma, SEMPECON: 2-18 FDG/PET for postchemoteraphy seminoma residual lesions: a restrospective validation of the SEMPET trial, PET: tomografía por emisión de positrones, CT: tomografía computarizada, 18-FDG-PET/CT: tomografía por emisión de positrones con 18 fluoro-desoxi-D-glucosa.
Las lesiones residuales retroperitoneales en la CT son bastante frecuentes en los pacientes con seminoma después de la quimioterapia y los métodos de imagen convencionales a menudo no discriminan entre lesiones neoplásicas residuales o tejido fibrótico, mientras que 18-FDG-PET puede proporcionar información metabólica complementaria sobre estas lesiones. Además, puede detectar la enfermedad recurrente temprana en pacientes con seminoma y CT normal, debido a anormalidades funcionales pueden preceder a los cambios morfológicos. Por otro lado, las posibles fuentes de falsos negativos (lesiones malignas pequeñas o con bajo índice proliferativo) y falsos positivos (principalmente lesiones inflamatorias) en el manejo posquimioterapia de pacientes con seminoma debe tenerse en cuenta.1
Varios estudios han utilizado 18-FDG-PET o PET/CT en este contexto informando diferentes valores de S y E (tabla 2). Sin embargo, algunos de estos estudios tienen poder limitado, analizando sólo un número relativamente pequeño de pacientes, concluyendo que 18-FDG-PET y PET/CT eran métodos diagnósticos precisos en el tratamiento posquimioterapia de pacientes con seminoma (en particular en pacientes con lesiones recurrentes/residuales> 3 cm). En este contexto, un 18-FDG-PET negativo justifica el seguimiento solo evitando un tratamiento inadecuado posterior (cirugía, quimioterapia o radioterapia). En el caso de un 18-FDG-PET positivo, la posibilidad de seminoma residual es alta, aunque no se puede excluir un resultado falso positivo, como lo demuestra su bajo VPP 1.
En nuestro estudio al encontrar puntos de corte más altos, creemos que falta incrementar tamaño de muestra para que el punto de corte correlacione respecto a la actividad metabólica del tejido expuesto al tratamiento. El análisis de nuestros resultados se basa en una muestra muy pequeña, dando resultados preliminares muy aproximados y poco discriminativos para definir viabilidad tumoral. Encontramos que la utilidad diagnostica de PET/CT tiene alta sensibilidad con baja especificidad y alto VPN. Resultados que son contrarios a las recomendaciones de las guías internacionales según nuestros datos estadísticos, por lo que se requiere estudios de mayor población.
La literatura centrada en el uso de 18-FDG-PET y PET/CT en este contexto sigue siendo limitada y se justifica el análisis de costo-efectividad.











 text new page (beta)
text new page (beta)