ANTECEDENTES
El virus del papiloma humano (VPH) es una de las infecciones de transmisión sexual con mayor prevalencia en todo el mundo. Según las cifras del Centro de Control y Prevención de Enfermedades de Estados Unidos (CDC, por sus siglas en inglés), el VPH es tan común en el mundo que tanto las mujeres como los hombres sexualmente activos contraerán el virus en algún momento de sus vidas.1 En México se ha estimado una prevalencia de VPH en la población masculina de 61.9%, sobre todo en el grupo de 25 a 29 años de edad.2 Sin embargo, las cifras pueden ser mayores si tomamos en cuenta el diagnóstico en el medio público y privado, por parte de médicos generales, familiares, dermatólogos, ginecólogos y urólogos.
El tratamiento de la infección genital por VPH depende del tipo de lesión y síntomas del paciente. La infección subclínica no requiere tratamiento, pues suele curarse de forma espontánea.3 Aún se discuten las opciones de tratamiento en pacientes con parejas diagnosticadas con esta infección. El protocolo actual en sujetos con verrugas anogenitales incluye diversos agentes tópicos como: podofilotoxina, sinacatequinas, ácido tricloroacético e imiquimod y, en términos quirúrgicos, criocirugía, electrodesecación, terapias lumínicas y escisión completa de las lesiones.4 Estos tratamientos se eligen de forma individualizada, caso por caso, de acuerdo con las características de las lesiones, número y localización. Actualmente no existe una terapia de referencia en la población masculina.5
El objetivo de este estudio fue: efectuar una revisión crítica de la bibliografía actualizada de las lesiones genitales provocadas por el virus del papiloma humano en hombres. La revisión se centra, principalmente, en la evidencia del diagnóstico y tratamiento farmacológico, quirúrgico y de consejería a las parejas que sufren este padecimiento. Además, se revisa la evidencia y las recomendaciones del esquema de vacunación disponible contra el VPH.
METODOLOGÍA
Se realizó la búsqueda exhaustiva en las principales bases de datos, de 1995 a la fecha. Se integró información de guías internacionales como: la CDC,1 guías europeas para el tratamiento de verrugas anogenitales,4 guías mexicanas de práctica clínica6 y la NOM-014-SSA2-1994.7 Se utilizaron los metabuscadores PubMed, Up to Date y Scopus y como palabras clave: Papillomaviridae, virus del papiloma humano, infección por papilomavirus, queratinocitos, enfermedades de transmisión sexual, dermoabrasión, lesiones cutáneas, huésped inmunodeprimido, sexo y minorías de género. Para el análisis bibliográfico se revisaron los resúmenes de los artículos (DOP, MDGP) y se seleccionaron los que tuvieron mayor relevancia con el tema, con la intención de revisarse en extenso.
Epidemiología
Se estima que alrededor del mundo existen 660 millones de personas infectadas de VPH.8 De acuerdo con los datos del Sistema Único de Información para la Vigilancia Epidemiológica (SUIVE), el VPH ocupa el segundo lugar en cuanto a infecciones de transmisión sexual en México (4,716 casos por cada 100, 000 habitantes), superada únicamente por la tricomoniasis urogenital (12,144 casos por cada 100,000 habitantes), ambos con elevada prevalencia en el grupo de 25 a 44 años de edad.9
Los hombres que tienen relaciones sexuales con hombres (HSH) y los pacientes infectados con el virus de inmunodeficiencia humana (VIH) tienen mayor riesgo de padecer alteraciones dermatológicas relacionadas con el VPH.10 Además, los pacientes con VIH suelen tener mayor número de lesiones y recurrencias, y deficiente reacción a los tratamientos convencionales, debido a la inmunidad celular alterada.11
Etiología
El papilomavirus es un microorganismo no encapsulado, de 55 nm de diámetro, conformado por ADN circular de doble cadena y nucleocápside icosahédrica.12 Su genoma contiene 9 genes, subdivididos en 7 genes de expresión temprana (E1-E7), necesarios para la replicación del ADN viral y 2 genes de expresión tardía (L1 y L2) que codifican proteínas estructurales para la cápside de la partícula viral (virión). Los genes E6 y E7 son de expresión temprana, implicados en la oncogénesis del virus, que codifican proteínas para inactivar la función de los genes de supresión tumoral p53 y Rb, y de esta forma favorecer la conversión de una célula sana a una cancerígena.12,13
Existen al menos 100 tipos de papilomavirus, clasificados numéricamente con base en su secuencia única del gen L1 y subdivididos en diferentes géneros, principalmente alfa (a), beta (b) y gamma (g).14 El α-VPH se ha aislado de pacientes con lesiones genitales y de las mucosas, asociado con alto riesgo oncogénico; por su parte, γ-VPH y β-VPH se denominan “papilomavirus cutáneos”, porque suelen aislarse de diferentes regiones de la piel, además, cada uno de estos géneros se subdivide en diferentes tipos de forma numérica. Aproximadamente 40 tipos de VPH se encuentran de forma regular en el conducto genital. Estos se subdividen en bajo y alto riesgo de asociación con cáncer cervico-uterino. Los subtipo α-VPH 16 y 18 son de alto riesgo, causan lesiones displásicas y cáncer invasor, mientras que α-VPH 6 y 11 son de bajo riesgo y son los más comunes asociados con las verrugas genitales.14 Además, los subtipos del virus del papiloma humano tipo 16, 18, 31, 33 y 35 están implicados en la mayor parte de las neoplasias peneana, anales, orofaríngeas, vaginales y vulvares, sobretodo el tipo 16, que se ha relacionado con 86% de todas las neoplasias malignas implicadas con el VPH.11,14,15
El virus del papiloma humano es altamente contagioso, se transmite por vía oral, anal, genital y por contacto con la piel de individuos infectados. Los principales factores de riesgo asociados con la infección por VPH son: tabaquismo, relaciones sexuales sin protección, uso de anticonceptivos orales, antecedente de enfermedades de transmisión sexual e inmunodepresión.8
El VPH tiene predilección por los queratinocitos basales de la piel y las mucosas. Su replicación está íntimamente relacionada con la diferenciación de células epiteliales, que al tener un evento de microtraumatismo y microabrasión, permanecen expuesta al virus y permiten su paso al estrato basal, donde ocurre un cambio estructural en la cápside del virión.16 Lo anterior permite la internalización y transferencia del genoma viral al núcleo del queratinocito. En la mayoría de los casos la infección es asintomática y se cura de forma espontánea, sin afectar la estructura de la piel o la mucosa.16 Se estima que más de 80% de los pacientes infectados con VPH no manifiestan lesiones clínicamente significativas.11 Las lesiones se deben a la respuesta de reparación de cada individuo afectado que desencadena la división celular y proliferación de las células infectadas.11
Después de la infección, el ADN del papilomavirus 6 y 11 permanece detectable en la piel, durante dos a nueve meses. Hasta el momento se desconoce si posterior a este periodo el virus se elimina de la piel o persiste latente y se reactive más adelante. Incluso no se ha descrito por qué algunos pacientes manifiestan verrugas y condilomas después del contacto con el virus y otros no.13 Figura 1
Signos y síntomas
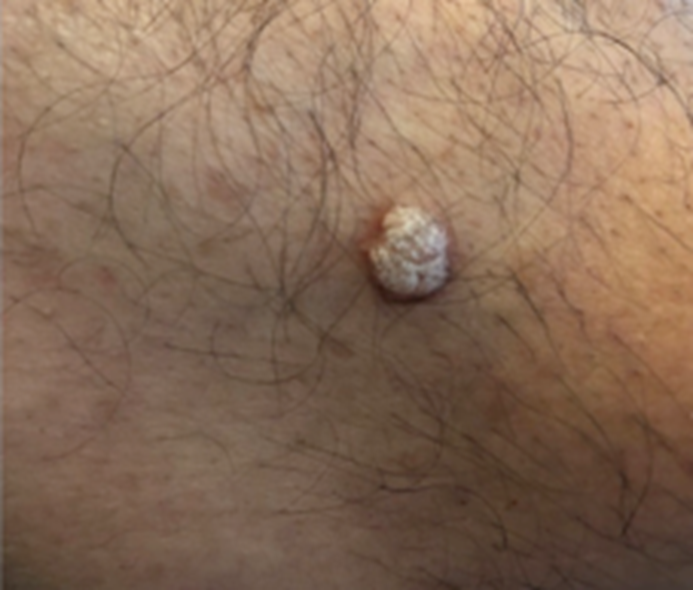
Posterior a la inoculación del virus, las verrugas aparecen entre 2 y 9 meses, como periodo de incubación.13 Las verrugas genitales, o condilomas, son la manifestación clínica más común del papilomavirus no oncogénico,17 incluso 90% de los casos padecen estas lesiones, caracterizadas por vegetaciones: neoformaciones en forma de “coliflor”, de 1 a 5 mm de diámetro (Figura 2), localizadas en el perineo, genitales, pliegues crurales y ano.13 Las lesiones suelen encontrarse en áreas de contacto durante el coito, por lo que no son prevenibles con los medios clásicos de barrera. La morfología de las lesiones varía según la localización afectada, pueden manifestarse como pápulas, condilomas y lesiones de superficie plana o filiforme.13 La mayor parte de las lesiones anogenitales son condilomatosas, es decir, aparecen en forma de “coliflor”, con superficie anfractuosa y consistencia suave.13 Esta morfología se manifiesta en áreas donde el epitelio es húmedo, como el meato uretral o dentro del introito vaginal, a diferencia de las que se localizan en la región perianal o el cuerpo del pene, donde las verrugas son de superficie áspera y queratinizada.18
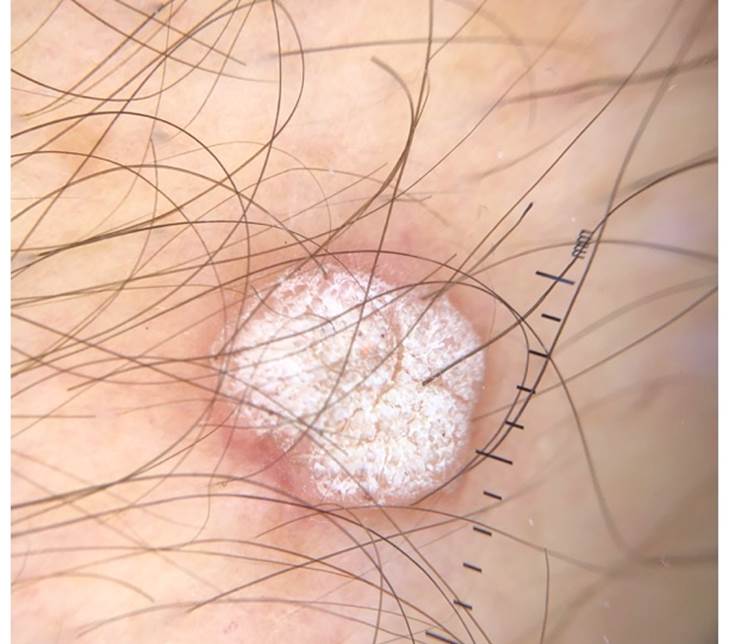
Figura 2 Dermatoscopia de verruga viral. Verrugosidad ovalada, superficie queratósica de 5 mm de diámetro, con vasos puntiformes.
Los sitios más comúnmente afectados en hombres son los más sensibles a microtraumatismos asociados con el coito; igualmente, es muy común observar las lesiones en la piel del pubis y del escroto, que son áreas no protegidas con métodos de barrera.18
Diagnóstico
Es importante efectuar un interrogatorio dirigido para identificar los factores de riesgo implicados en la génesis de las verrugas vulgares (Cuadro 1). Existe una clara relación entre la infección por VPH y pacientes con inmunodepresión; además, se ha demostrado mayor riesgo de padecer estas lesiones en los carniceros, veterinarios y personal de pescaderías, así como en sujetos con hábito de onicofagia y quienes mantienen las manos sumergidas en agua.6 El uso de condón, si bien puede prevenir la aparición de lesiones en el área que cubre, no protege del contacto con otras áreas de la superficie corporal durante el coito.5
Cuadro 1 Diagnóstico diferencial verruga viral y queratosis seborreica
| Lesión | Verruga viral (VPH) | Queratosis seborreica |
|---|---|---|
| Factores de riesgo | Contacto sexual. Adolescentes | Exposición solar. Adultos y ancianos |
| Localización | Mucosas, genitales, palmas, plantas, periungeales, párpados. | Cara y tórax |
| Morfología | Neoformación exofítica, filiforme, de superficie verrucosa | Pápula o placa negra o marrón, bien delimitada con escama superficial |
Se sugiere llevar a cabo la exploración completa de la región genital, con adecuada iluminación y, preferentemente, con un lente de aumento para observar lesiones incipientes.
El diagnóstico de verrugas genitales es eminentemente clínico. En pacientes con lesiones de morfología atípica, curso clínico desfavorable o resistentes al tratamiento se recomienda obtener una biopsia.19 El diagnóstico diferencial de las lesiones se establece con molusco contagioso y queratosis seborreica.20 Cuadro 1
Desde el punto de vista histológico, las lesiones por VPH se caracterizan por coilocitos, que corresponden a queratinocitos morfológicamente atípicos distinguidos por un núcleo excéntrico, picnótico e hipercromático rodeado por un halo perinuclear;21 además, la epidermis tiene acantosis con grados variables de papilomatosis, hiperqueratosis y paraqueratosis (Figura 3). En la dermis pueden observarse capilares trombosados.22
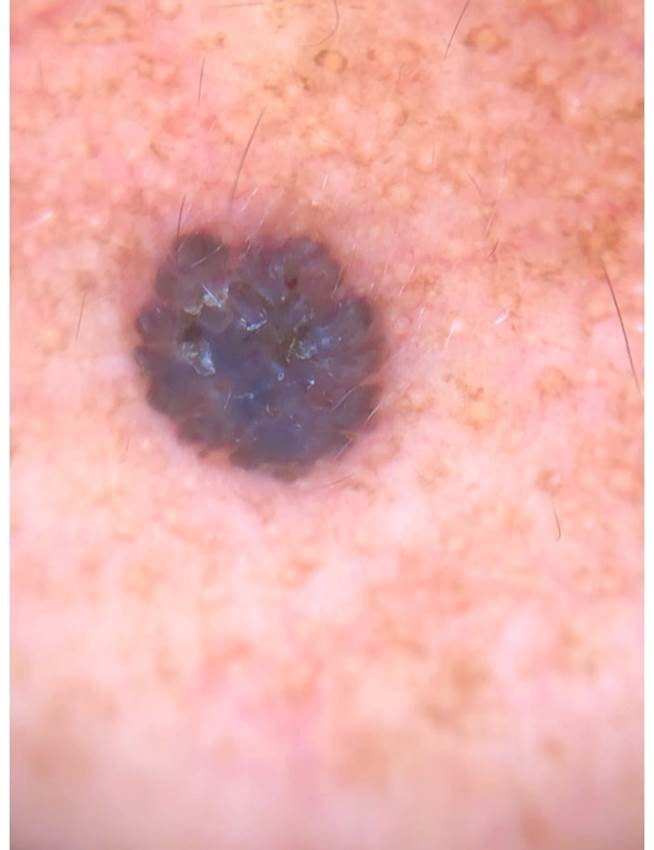
Figura 3 Queratosis seborreica. Neoformación exofítica cupuliforme, de superficie anfractuosa, hiperpigmentada marrón oscuro, con borde apolillado a la dermatoscopía y patrón cerebriforme.
El diagnóstico diferencial de las verrugas anogenitales se establece con queratosis seborreica, fibromas blandos, nevos, pápulas perladas del pene, liquen plano genital, liquen escleroso, angioqueratomas y condilomata lata.13 Deben descartarse diagnósticos como: papulosis bowenoide, eritroplasia de Queyrat, enfermedad de Paget extramamaria y carcinoma epidermoide.23
Tratamiento
Hasta el momento no existe un tratamiento que cure la infección. Los pacientes con condilomas que no reciben tratamiento pueden curarse de forma espontánea, permanecer sin cambios o aumentar de tamaño y número.24 Los protocolos disponibles están dirigidos a remover las lesiones sintomáticas y funcionar con fines cosméticos; sin embargo, debe aclararse a los pacientes que los tratamientos no erradican la infección y existe riesgo de recurrencia de nuevas lesiones.19,24 La remoción de las lesiones disminuye el riesgo de contagio a futuro, por lo que se recomienda eliminarlas de forma médica o quirúrgica.24
No existe evidencia que respalde si algún tratamiento es superior a otro; por tanto, la decisión dependerá de la experiencia del médico tratante, la preferencia del paciente y disponibilidad del tratamiento.24 Tampoco existe un consenso para clasificar las verrugas de acuerdo con su gravedad; sin embargo, se han descrito algunos parámetros que pueden ayudar a establecerla y con ello elegir el tratamiento más adecuado. Se consideran leves las verrugas menores a 3 en cantidad, de superficie suave y plana, en una sola localización, que no producen dolor o ansiedad, con duración menor a 8 semanas y que no se trate de recurrencia.25 La afección grave se considera cuando las lesiones son más de 3, multicéntricas y multifocales, de superficie verrugosa, áspera y dura, con repercusiones psicosociales en el paciente o que provoquen dolor físico, duración mayor a 8 semanas y se trate de una lesión recurrente.25
En función del tamaño y la extensión de la enfermedad, se prefiere la indicación de algunos tratamientos que otros. Para las verrugas menores de 1 cm se indica crioterapia y para las lesiones de mayor tamaño se prefiere escisión quirúrgica.
De manera general, los tratamientos se clasifican en dos modalidades: los aplicados por el paciente y los aplicados por el médico. Los primeros son más cómodos, pero la reacción puede ser lenta; mientras que en los segundos la reacción es rápida, pero la tolerancia es menor y los eventos adversos con más frecuentes. En general, las verrugas localizadas en superficies húmedas o en áreas intertriginosas reaccionan bien a los tratamientos tópicos. Entre las opciones de tratamiento intradomiciliarias se encuentran:
Podofilox o podofilotoxina
Es un fármaco antimitótico, obtenido de las raíces de coníferas Podophyllum pelltatum. La diferencia entre ambos medicamentos radica en que podofilox es el extracto en resina natural, con concentración de 10-40%, y podofilotoxina, como su nombre lo indica, es una toxina obtenida de forma sintética, que se comercializa en solución o gel al 0.5%, o en crema al 0.15%. La resina de podofilina se prepara en una base de alcohol o colodión, se aplica directamente en las lesiones y 4 horas más tarde debe lavarse. La podofilotoxina se aplica dos veces al día, seguido de 4 días de descanso. El área de tratamiento no debe sobrepasar 10 cm2 y el volumen total aplicado debe ser inferior a 0.5 mL/día.24 Se recomienda que el médico aplique el tratamiento durante la consulta por primera vez, para instruir al paciente y lo realice de forma correcta. Este régimen puede repetirse el tiempo necesario hasta por 4 ciclos. El paciente puede experimentar dolor o irritación durante el periodo de tratamiento. Su prescripción está contraindicada durante el embarazo, porque produce efectos teratogénicos. La tasa de curación varía de 45-83%, con recurrencia de 13 a 100%.
Imiquimod en crema al 3.75 y 5%
Es un fármaco inmunomodulador que estimula la producción de citocinas como: interferón alfa, factor de necrosis tumoral e interleucinas 1, 6 y 8. Clínicamente disminuye la inflamación local y cura el condiloma. La crema al 5% se aplica directamente en las lesiones, tres veces por semana (por ejemplo: lunes, miércoles y viernes) hasta su desaparición o al cumplir 16 semanas, mientras que la crema al 3.75% se aplica diariamente, al menos por 8 horas durante 8 semanas.3 Imiquimod se considera un medicamento seguro; los efectos adversos reportados son: irritación, eritema, ulceración e hipopigmentación, incluso se han descrito casos excepcionales con aumento del proceso inflamatorio y exacerbación de trastornos autoinmunitarios preexistentes.26 El cuadro tipo influenza relacionado con la aplicación de imiquimod es poco frecuente. La tasa de curación es de 35-75%, con recurrencia de 6-26% para la crema al 5%. Hasta la fecha no se han efectuado estudios que comparen ambas concentraciones; por tanto, la principal ventaja es el periodo corto de tratamiento con la concentración de 3.75%.24 Durante el tratamiento con imiquimod debe aconsejarse abstinencia sexual, debido a que el fármaco puede debilitar y causar ruptura de condones y diafragmas vaginales.
Sinecatequina en crema al 10 y 15%
Es un extracto de hojas de té verde que contiene, principalmente, polifenoles del tipo catequinas, con actividad antioxidante y antiviral. El mecanismo de acción aún se desconoce, pero se postula que promueve la expresión de genes proapoptósicos. La tasa de curación varía de 50-60% y la de recurrencia de 7%. Se aplica directamente en la lesión, 3 veces al día, hasta completar 16 semanas u observar la curación.
Las modalidades de tratamiento practicadas por los médicos incluyen:
Crioterapia
Esta técnica consiste en la aplicación de nitrógeno líquido, en spray o con hisopo, con la finalidad de destruir los condilomas mediante citólisis térmica, al formar cristales en la pared celular. Los pacientes suelen manifestar dolor durante la aplicación de nitrógeno líquido, posteriormente se necrosa la lesión o pueden aparecer ampollas. El tratamiento puede repetirse cada 1-2 semanas por el tiempo que sea necesario, generalmente de 6 a 10 semanas.24 Los pacientes que no logran curarse al final de este periodo requieren el cambio de estrategia terapéutica.6 La crioterapia se considera efectiva en el tratamiento de verrugas pequeñas. La tasa de curación varía de 44 a 75%, con recidiva de 5%; por tanto, se considera el tratamiento de elección en verrugas vulgares.6 Los eventos adversos más frecuentes incluyen: ampollas, dolor, discromías y cicatrización anómala.
Ácido tricloroacético en solución al 80-90%
El ácido tricloroacético es un agente cáustico que destruye las verrugas mediante coagulación química de las proteínas. Se prefiere su indicación en lesiones pequeñas. Se aplica directamente en la lesión, en cantidad mínima, y se observa blanqueamiento (frosting) de la lesión. El ácido puede dañar la piel sana adyacente si se aplica en exceso, por lo que se recomienda esperar a secarse antes que el paciente se ponga de pie o se vista. Algunos autores sugieren cubrir el área con bicarbonato de sodio para neutralizar el ácido.24 Entre los eventos adversos se encuentran: dolor agudo en el sitio de aplicación e hipopigmentación. Se recomienda su aplicación semanal, durante 3 a 4 semanas.
Escisión quirúrgica
El tratamiento consiste en rasurado con tijeras, curetaje, electrocirugía o láser. Una de sus ventajas es disminuir el número de visitas al médico. Se indica, principalmente, en pacientes con diversos condilomas o de gran tamaño (> 1 cm).24 Los efectos adversos se relacionan con hipo o hiperpigmentación cutánea y, ocasionalmente, dolor crónico. La tasa de curación es de 89-100% y la de recurrencia, incluso de 35%.20
La mayoría de los médicos recomiendan la aplicación de anestesia tópica, en forma de crema, 10 a 30 minutos antes de realizar el procedimiento. En pacientes con lesiones mayores de 5 mm también se indica la aplicación de anestésico subcutáneo para disminuir las molestias al máximo. El sangrado posterior a la escisión puede controlarse con electrocauterio, o la aplicación de nitrato de plata o cloruro de aluminio.
Láser
Esta técnica se ha propuesto como terapia emergente en pacientes con verrugas anogenitales, especialmente el láser CO2 y el láser de colorante pulsado (PDL, por sus siglas en inglés). El Nd:YAG (neodymium-doped yttrium aluminum garnet) se ha utilizado en sujetos con lesiones uretrales.26 El uso de terapias lumínicas se ha elevado en diversas áreas de la medicina. Entre sus desventajas, se trata de una modalidad dolorosa, que requiere anestesia local o general para su realización, sobre con láser CO2. El período de recuperación es rápido.27
Los regímenes recomendados por la CDC para condilomas en el meato urinario son crioterapia o cirugía, y para lesiones intra-anales se recomienda crioterapia, cirugía o solución de ácido tricloroacético o bicloroacético al 80-90%.3
Existe una tendencia creciente de utilizar terapia combinada para tratar las verrugas por VPH, denominada “terapia secuencial proactiva” (PST, por sus siglas en inglés), que promete ser un método efectivo para reducir la tasa de recurrencia de las lesiones y evitar la transmisión sexual.25 Esta terapia consiste en tratar las lesiones de forma ambulatoria con técnicas destructivas, ya sea crioterapia, cirugía o láser; 3 a 5 días posterior al tratamiento se indica al paciente aplicar el tratamiento tópico de mantenimiento, con imiquimod al 5% o sinacatequinas al 15% (ungüento), dos veces al día durante 12 a 16 semanas. Los principales tratamientos tópicos de terapia secuencial proactiva incluyen: sinacatequinas e imiquimod.25 Un estudio efectuado en 27 pacientes, a quienes se indicó terapia secuencial proactiva, reportó excelente reacción del tratamiento y menor tasa de recurrencia de las lesiones versus pacientes a quienes se indicaron terapias convencionales unimodales. El 96.3% de los sujetos que recibieron terapia secuencial proactiva demostró curación completa de la lesión y 7.4% reportó recurrencia versus pacientes tratados con podofilotoxina en monoterapia (curación completa de 45-77% y recurrencia de 38-65%), sinacatequinas (curación de 51-57% y recurrencia de 5-8%) y crioterapia (curación: 79-88%, recurrencia: 25-39%).25 Además, en ese estudio se prefirió indicar sinatequina en ungüento al 15% que imiquimod al 5%, debido al menor riesgo de efectos adversos sistémicos e hipopigmentación local.28
Algunos estudios señalan que la combinación de crioterapia y sinacatequinas tópicas, aplicada por el paciente entre sesiones, tiene mayor eficacia en la reducción del número y tamaño de las verrugas.5
Las lesiones localizadas cerca del meato uretral requieren cistoscopia, con la finalidad de descartar alteraciones uretrales. De igual forma, los pacientes con antecedente de lesiones condilomatosas en los genitales y uretrorragia deben evaluarse endoscópicamente.29 Los condilomas ubicados en el meato uretral deben tratarse con crioterapia, ya que la podofilina y el fluorouracilo están contraindicados en el tratamiento de lesiones internas.30
Vacunación
En México se encuentran disponibles las vacunas tetravalente (Gardasil®) y bivalente (Cervarix®), que contienen los serotipos 6, 11, 16 y 18, y 16 y 18, respectivamente. La vacuna tetravalente está aprobada para hombres y mujeres, mientras que la bivalente solo en mujeres.29 La ventaja de la vacuna tetravalente vs bivalente es que, además de proteger contra los serotipos oncogénicos, protege contra la aparición de condilomas acuminados y verrugas vulgares. La CDC recomienda la vacunación de VPH en todos los pacientes pediátricos de 11 y 12 años.1 En México, la Asociación Mexicana de Vacunología recomienda la aplicación de la vacuna contra VPH en mujeres de entre 9 y 45 años, y en hombres de 9 a 26 años; sin embargo, en la Norma Oficial Mexicana (NOM) el esquema de vacunación para el VPH está dirigido, únicamente, para niñas de 9 años de edad.7
El esquema de vacunación incluye 3 dosis para ambas vacunas: una dosis intramuscular, la segunda dos meses después de haberse aplicado de primera y la tercera seis meses posteriores a la primera dosis.31
En la práctica clínica es común encontrar pacientes interesados en los esquemas de vacunación contra VPH. Se ha comprobado que la vacuna contra VPH previene el cáncer cervicouterino. Se ha estimado que 70% de la población masculina que tiene relaciones sexuales con hombres son portadores del VPH; por tanto, la vacuna tetravalente ha mostrado gran eficacia en la prevención de condilomas acuminados y cáncer anal, que en 95% de los casos son causados por el VPH.10 Ciertas investigaciones señalan mejor beneficio cuando la vacuna se aplica entre los 16 y 24 años en esta población, para la prevención de las neoplasias asociadas con el VPH.32 En México la NOM ofrece la vacuna a mujeres, ya que en relación costo-beneficio protege de forma secundaria a los hombres; sin embargo, permanecen desprotegidos los hombres que tienen sexo con hombres.
La vacuna Gardasil® es efectiva, incluso, en 90.4% de los casos para prevenir los condilomas anogenitales en hombres de entre 16 y 26 años.33 Se recomienda la aplicación de la vacuna después de establecer el diagnóstico de VPH, para la prevención de recurrencia y de transmisión a otros contactos.
Consejería
Las verrugas genitales en hombres repercuten en la calidad de vida, tanto sexual como en la autoestima.34 El estrés psicológico, debido al diagnóstico de condiloma relacionado con VPH, frecuentemente supera las consecuencias médicas del padecimiento. Las principales reacciones psicológicas que experimentan los pacientes son: miedo, vergüenza, ansiedad, incredibilidad y estrés,32 además de la preocupación sobre la fuente de infección, inquietud por la posibilidad de rechazo de la pareja y la falta de tratamientos curativos disponibles para la infección.34 Aunado a esto, los pacientes pueden sufrir de impedimento sexual posterior al tratamiento de las verrugas genitales por dolor durante el coito y miedo de contagiar a su pareja, creando tensión en las relaciones sentimentales, además de sospecha de infidelidad de la pareja afectada.35
Es importante asesorar a la pareja en relación con este padecimiento, aclarando que todos los pacientes pueden tener una vida normal, las verrugas no evolucionan a cáncer y el uso consistente de condones puede auxiliar para prevenir la infección en las parejas sexuales; sin embargo, el contacto de piel con piel es suficiente para que la pareja se exponga al virus, por lo que no es necesario el uso de condón en parejas estables.24 En pacientes que no tienen pareja estable se recomienda abstenerse de relaciones sexuales con periodo mínimo de tres meses posteriores a recibir tratamiento; además, en ese mismo periodo se recomienda a los pacientes abstenerse de afeitarse, con la finalidad de disminuir el riesgo de autoinoculación.3
Otro aspecto importante a discutir con el paciente y su pareja es que la exposición al virus puede preceder meses antes de que aparezca la lesión y no existe forma de confirmar el tiempo en que ocurrió dicha exposición.23 Debido a esto, la infección no debe asociarse con infidelidad en todos los casos, ni existe necesidad de dar seguimiento a todos los contactos del paciente.5
También se requiere interrogar acerca de prácticas sexuales de riesgo y, en su debido momento, solicitar pruebas serológicas para otras enfermedades de transmisión sexual como: ELISA para virus de inmunodeficiencia humana, VDRL y perfil de hepatitis viral.
CONCLUSIONES
Los hombres y mujeres sexualmente activos contraerán la infección por VPH en algún momento de sus vidas. Los sujetos con inmunosupresión tienen mayor riesgo de sufrir lesiones y suelen ser resistentes al tratamiento. Hasta la fecha no existe un tratamiento específico estandarizado para las verrugas genitales; por tanto, el protocolo depende de la experiencia del médico, preferencias del paciente y disponibilidad del medicamento. La terapia secuencial proactiva representa un tratamiento efectivo, relacionado con mayor tasa de curación. En México se encentran disponibles las vacunas Gardasil® y Cervarix® contra VPH; la NOM recomienda su aplicación en niñas de 9 años. Se recomienda la consejería en parejas, pues la infección por VPH puede contraerse por vía sexual y contacto directo (piel con piel); su adquisición no debe de sugerir infidelidad en todos los casos.











 text new page (beta)
text new page (beta)