Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Ingeniería agrícola y biosistemas
On-line version ISSN 2007-4026Print version ISSN 2007-3925
Ing. agric. biosist. vol.15 n.1 Chapingo Jan./Jun. 2023 Epub Mar 08, 2024
https://doi.org/10.5154/r.inagbi.2022.05.045
Article
Pulsos de luz en la cara de hormigas Atta cephalotes para control en frutales
1Universidad Autónoma Chapingo. Carretera México-Texcoco km 38.5. Chapingo, Texcoco, Estado de México, C. P. 56230, MÉXICO.
Introducción: Las hormigas obreras siguen caminos para abastecer su nido y sus ojos necesitan adaptarse a las variaciones en la intensidad de la luz. Objetivo: Estudiar el efecto de diferentes técnicas de iluminación en un trayecto para obligar a las hormigas a cambiar de ruta antes de llegar al árbol. Metodología: Se alumbró de tres formas distintas a hormigas mientras recorren un trayecto: luz emitida por matrices L300 superiores, luz reflejada por un espejo o luz emitida por un sistema de destello ocular preciso. La frecuencia, duración del pulso e intensidad de la luz se evaluaron mediante la colisión, el tiempo de adaptación y el tiempo de recuperación. Resultados: La iluminación a 300 lx no dañó el sistema visual de la hormiga. Al aumentarlo a 900 lx, la hormiga líder chocó, presentó problemas de adaptación hasta por 1169 s y fue empujada por otra hormiga hasta el final del camino. Limitaciones del estudio: El sistema de espejo reflectante es útil a nivel de laboratorio, pero su aplicación depende del tamaño de la hormiga y su velocidad. Originalidad: El estudio permitió determinar un sistema de iluminación para evitar que las hormigas suban a los árboles frutales. Las matrices L300 son económicas y prácticas para optimizar su uso en campo. Conclusiones: La luz afecta a las hormigas en su recorrido. La matriz L300 colocada horizontalmente al final del camino desvió a las hormigas del camino principal en todas las pruebas. La intensidad de la luz, frecuencia y duración del pulso son determinantes.
Palabras clave: control de hormigas de frutales; Atta cephalotes; estimulación LED; adaptación a la oscuridad
Introduction: Worker ants follow paths to fed their nest and their eyes require to adapt themselves under light intensity variations.Objective: Study the effect of different illumination techniques in a trail and force ants to change of trajectory before feeding from a tree. Methodology: Ants walking through a trail were illuminated by one of three different ways: light fed from the top L300 arrays, light reflected by a mirror or by a precise eye flashing system. Frequency, pulse-width and light intensity were controlled studying as variables collision, adaptation time and recovery time. Results: The precise illuminator at 300 lx never damaged the ant visual system. As it was increased to 900 lx the forerunner ant collided and presented adaptation problems up to 1169 s. It was pushed to the trail end by another ant. When two ants collided they finished returning to the trail entrance. Study limitations: The reflected mirror system is useful at laboratory level, but its application is dependent on ant size and speed. Originality: The system was able to determine a lightning system to ensure that ants do not climb fruit trees. L300 arrays are economic and practical to optimize its use in field. Conclusions: Light affects ants as they travel through the trail. A L300 array placed horizontally at the trail-end, diverted ants’ direction from the main path in all the tests. It is dependent on light intensity, frequency and pulse-width.
Keywords: fruit tree ant control; Atta cephalotes; precise-LED stimulation; dark-adaptation
Introducción
Las hormigas obreras siguen caminos hacia el lugar de forrajeo y regresan a su nido con la comida recolectada después de establecer caminos bidireccionales (StrÖmbom & Dussutour, 2018). Las hormigas Atta cephalotes trasladan hojas, capullos y flores a su nido para cultivar hongos simbióticos, lo cual provoca pérdidas en los huertos que ascienden a miles de millones de dólares (Hölldobler & Wilson, 1990). Las hormigas Atta sexdens cortadoras de hojas pueden ocupar un nido durante 6 años, con un peso de 40 000 kg; una colonia de tales dimensiones puede recolectar más de 5 892 kg de hojas (Wilson, 1971). Las hormigas Atta se alimentan de biomasa vegetal a tasas de hasta 500 kg∙colonia-1∙año-1 (Wirth et al., 2003). En Costa Rica, estas defoliaron y acabaron con 20 arbustos de café durante una noche (Varón et al., 2007), y en Brasil, una colonia Atta produjo pérdidas de 3.6 t∙año-1 en caña de azúcar (Della-Lucia, 2003). Las hormigas también se alimentan de las heridas del tallo en los árboles de aguacate, lo cual causa infecciones (El-Hamalawi & Menge, 1996). Las hormigas A. cephalotes aumentan su actividad de forrajeo con temperaturas de hasta 35 °C (Bustamante & Amarillo-Suárez, 2019), pero los cambios climáticos han acabado con la maleza del suelo; por ello, las hormigas se tienen que alimentar de las hojas verdes disponibles en los árboles frutales para poder sobrevivir.
En un experimento realizado en Cali, Colombia, se observó una preferencia destacada de las hormigas por buscar alimento en el follaje del mango, con un índice de herbivoría superior al 90 % (Rodríguez et al., 2008). Las plantas jóvenes suelen quedar totalmente defoliadas, por lo que el daño se asemeja a la poda, mientras que, en plantas maduras, con frecuencia solo se eliminan las hojas jóvenes, y a menudo quedan cicatrices, parecidas a las que se hacen con un cuchillo, en las partes verdes del tallo de la planta.
El tráfico de las hormigas obreras Atta cephalotes se describe mediante el modelo fluidodinámico modificado (Burd et al., 2002). Las reglas de las hormigas forrajeras optimizan su movimiento, y su velocidad disminuye en un 21 % debido al número de colisiones dentro de las líneas de tránsito (Burd et al., 2002). Por la noche, la velocidad de desplazamiento de las hormigas Myrmecia disminuye 55 %, ya que sus puntos de referencia visuales son menos fiables (Narendra et al., 2013). Las condiciones ambientales como la temperatura (Jayatilaka et al., 2011), la lluvia (Farji-Brener et al., 2018) y el viento (Alma et al., 2016) también inciden en la velocidad de desplazamiento de las hormigas.
Los caminos de las hormigas están marcados químicamente con feromonas, con distintos olores, segregadas por sus glándulas. Una concentración elevada de feromonas indica una mejor calidad de los puntos de forrajeo (Wirth et al., 2003). Los fragmentos de hojas transportados por las hormigas pueden ayudarnos a encontrar el montículo principal en un extremo y en el otro el árbol donde cortaron las hojas. Las hormigas Atta suelen cortar y transportar diversos fragmentos de plantas a sus nidos subterráneos para cultivar el hongo Leucoagaricus sp. (Valmir et al., 2004). Debido a que dicho hongo es la única fuente de alimento para las larvas de estas hormigas cortadoras, lo deben cultivar con hojas ricas en agua, nitrógeno y fósforo, pero bajas en fibra y manganeso (Rodríguez et al., 2008). Las hormigas cortadoras tienen la tarea de recolectar y llevar fragmentos de hojas al nido. Este proceso puede ser directo, cuando la hoja pasa de una hormiga a otra inmediatamente, o indirecto, cuando una hormiga deja caer una hoja a lo largo del camino para que otra hormiga la recoja posteriormente (Kwaku et al., 2020). A medida que las hojas se trasladan, las hormigas depositan feromonas, para evitar perderse (Cevallos-Dupuis & Harrison, 2017). Un mayor consumo de energía durante el desplazamiento en el tronco aumenta el traslado directo del forraje, lo cual evita que una hormiga caiga del árbol al transportar una hoja (Norton et al., 2014). A. cephalotes se mueve más rápido sobre las ramas caídas que en el suelo, pero con mayor lentitud al ascender o descender de una rama (Freeman & Chaves-Campos, 2016).
El control de Atta cephalotes se ha estudiado durante muchos años. El método de control más eficaz es el cebo con sulfluramida, el cual presenta baja toxicidad para humanos y otros organismos (Britto et al., 2016). Sin embargo, se ha considerado como un contaminante orgánico persistente (Mota-Filho et al., 2021). El hongo filamentoso, que actúa como virulento del hongo simbiótico de la hormiga, puede mostrar un efecto sinérgico sobre la sulfluramida (Carlos et al., 2010). También, se ha introducido material compostable (hojarasca, gallinaza, melaza y levaduras) en los nidos de las hormigas, y después de tres meses el porcentaje de nidos muertos fue de 26.5 % (Armbrecht et al., 2013).
Las hormigas activas durante el día y la noche necesitan adaptarse a las variaciones de intensidad luminosa. Los ojos de aposición de baja sensibilidad de las hormigas nocturnas (Narendra et al., 2013) tienen lentes más grandes y fotorreceptores más anchos que las hormigas diurnas. Los fotorreceptores de las hormigas diurnas miden 1.3 µm, y son cuatro veces más pequeños que los fotorreceptores de las especies nocturnas (Greiner et al., 2007). Con las pausas de orientación nocturna se captan más fotones gracias a un mayor tiempo de integración (Greiner et al., 2007). Cada ojo de aposición contiene varias unidades de lentes ommatidiales que captan la luz y un cono cristalino que canaliza la luz hacia una estructura fotosensible llamada rabdoma (Narendra et al., 2017). Cada rabdoma contiene el pigmento rodopsina, que absorbe la luz y la convierte en una señal eléctrica (Warrant, 2017). Los pulsos luminosos llegan a los ojos de las hormigas antes de convertirse en potencial de membrana en forma de protuberancias (Frolov, 2016). Los fotorreceptores de la hormiga nocturna M. vindex presentan tres sensibilidades espectrales con picos de 370, 430 y 550 nm (Ogawa et al., 2015). La luz roja aplicada con lámparas frontales durante la observación nocturna no perturba la visión de las hormigas obreras (Röschard & Roces, 2011).
Se ha analizado el movimiento de las hormigas mediante filmaciones con videocámaras digitales sobre el camino principal (Couzin & Franks, 2003; Narendra et al., 2013). En general, los sistemas de vigilancia y trampas para plagas interrumpen la luz LED o láser, y la señal del detector activa un contador (Balla et al, 2020; Eliopoulos et al., 2018). Cuando las hormigas caminan por dos carriles paralelos, el sistema requiere de un sistema láser reflectante con el sensor y el detector en el mismo lado (Brydegaard, 2015). La frecuencia crítica de fusión (FCF) es el umbral en el que un insecto deja de percibir una fuente de luz parpadeante como una serie de destellos, y lo empieza a percibir como un flujo continuo de luz (Inger et al., 2014). La mayoría de los insectos diurnos, como las abejas y las moscas de la fruta, tienen valores de FCF superiores a 100 Hz (Barroso et al., 2015). En este sentido, se sabe que los fotorreceptores se dañan con luces parpadeantes de alta intensidad (Meyer-Rochow, 2002).
Independientemente de la gran cantidad de estudios fisiológicos que se han realizado para comprender cómo se guían las hormigas hacia su lugar de alimentación, este trabajo experimental tiene como objetivo evaluar la posibilidad de utilizar la iluminación LED como control límite para desviar a las hormigas de los árboles frutales. Para ello, se supone que la velocidad de las hormigas cambia bajo la estimulación de la luz LED con diferentes frecuencias. ¿Cómo puede un sistema de control de iluminación aplicar impulsos luminosos a los ojos de las hormigas con una certeza del 100 % y cómo responden las hormigas? En un sendero doble con vías bifurcadas se evaluó si las hormigas cambiaban de carril principal cuando se les aplicaba iluminación pulsada en el extremo del sendero.
Materiales y métodos
Se estudió el tránsito de hormigas Atta cephalotes en un huerto de mango ubicado en Loma Bonita, Guerrero, México (17° 25’ 47’’ LN y -101° 11’ 19’’ LO, a 17 m s. n. m.). Los experimentos se realizaron durante octubre de 2019, justo después de la temporada de lluvias en esta región árida subtropical. Las colonias de hormigas maduras, con 105 obreras aproximadamente, buscaban alimento por la noche en árboles de mango situados a 30 m de su nido.
Se estableció un camino de amplitud variable (10-60 cm) para hormigas bajo el tronco de un árbol y se cubrió con una superficie de tierra lisa. Para iluminar el camino, se utilizaron cuatro matrices lineales de 30 cm de longitud (L300, SmartVisionLight, EUA), con 12 luces LED de alta intensidad cada una. Las matrices lineales L300 de luz LED se instalaron en la parte superior del camino artificial para estudiar la estimulación de las hormigas (Hahn & Bolaños, 2021). Cada matriz lineal iluminó un área elíptica en la superficie del camino donde las hormigas se desplazaron, teniendo una iluminancia máxima de 19 000 lx. La luz continua y pulsada se suministró mediante un sistema integrado, el cual reducía la iluminancia a 350 lx mediante una señal analógica (Hahn & Bolaños, 2021).
La iluminación media continua se genera al modular la duración de los pulsos, y depende de la iluminación fuente (SI, por sus siglas en inglés). Por ejemplo, se puede obtener una iluminación media de 900 lx al usar una iluminación fuente de 4 500 lx con un ciclo de trabajo de 20 %. También se puede conseguir a partir de una SI de 2 500 lx junto con un ciclo de trabajo de 36 %. En el estimulador ocular preciso empleado en este trabajo, un pulso de 4 500 lx es mucho mayor que el de 2 500 lx, y generará mayores pulsaciones a través de la membrana del fotodetector.
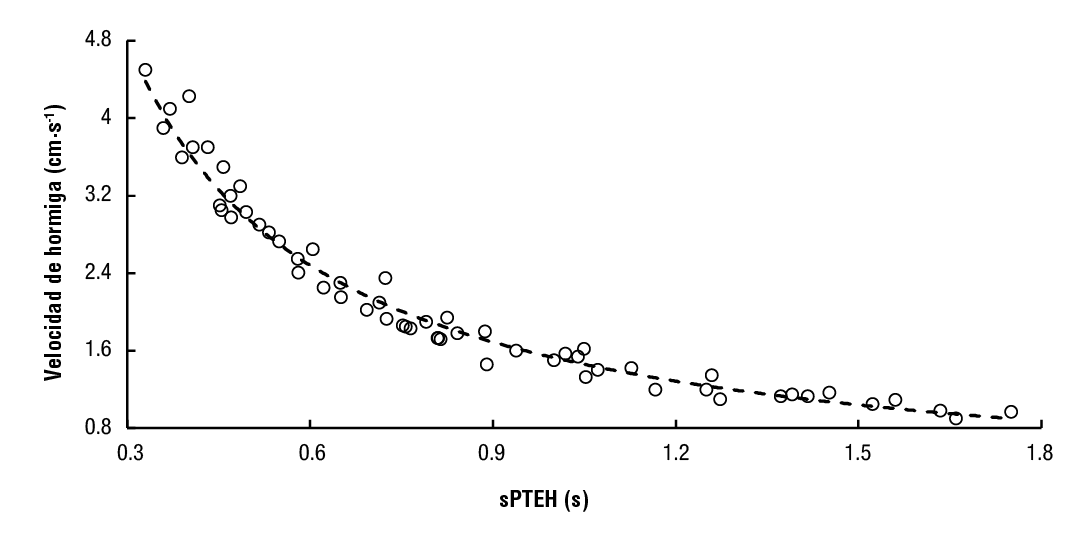
La velocidad de las hormigas se midió con unidades de fotodetector láser que utilizan láseres rojos de 5 mW (D650-51 USLaser, EUA) para proporcionar un haz constante no dispersivo. Los fotodetectores pequeños (KDT00030, Fairchild) presentan una respuesta lineal de corriente-iluminancia. La tira de fotodetectores se fijó a una pared, y los láseres, a la pared opuesta. Las unidades de fotodetectores láser determinan la velocidad de las hormigas al contar con un conjunto de contadores programables (PCA, por sus siglas en inglés). Este periodo es aquel en que el rayo láser se refleja en el cuerpo de la hormiga y el fotodetector se apaga. El período de tiempo hormiga (PTH) se obtiene al contar ciclos de 1 ms durante este período. La velocidad de las hormigas artificiales se correlacionó con el periodo de tiempo entre hormigas (PTEH) mediante un trayecto controlado de franjas de plástico de 30 cm de longitud. Las franjas se desplazaron linealmente con un motor de alta precisión, mientras que los fotodetectores y los láseres en las paredes permanecieron inmóviles. Se hicieron réplicas de hormigas de madera de 25 mm de largo y se pegaron en la tira de plástico, dejando un espacio de 12.5 mm entre ellas. Después de tomar más de cincuenta mediciones, una regresión potencial (Ecuación 1) relaciona el PTEH con la velocidad de las hormigas (R2 = 0.9775, N = 56, P () 0.001). El valor de PTEH es menor para las hormigas que caminan a mayor velocidad (Figura 1).
Recolección de datos
Una vez instalado el camino, se realizaron varios experimentos donde se analizó el PTEH, el número de colisiones y el tiempo de recuperación con diferentes esquemas de iluminación. Para cada experimento, se dispusieron diferentes sistemas de iluminación e intensidades (Cuadro 1).
Los tres niveles del experimento dividen el tipo de iluminación, la amplitud del camino y la intensidad de iluminación. Es importante mencionar que las hormigas depositaron feromonas en el sendero antes de realizar las pruebas. Los experimentos se configuraron de la siguiente manera:
a: PTEH y número de impactos en el camino angosto con diferentes iluminaciones estroboscópicas blancas (STI, por sus siglas en inglés). En el primer experimento, los pulsos luminosos se aplicaron verticalmente hacia la superficie superior de la cabeza de la hormiga (Figura 2a). En el segundo experimento, un espejo de pared reflejó la luz proveniente de una matriz L300 girado por 45° (Figura 2b). El espejo se desvió para poder llegar a la cabeza de la hormiga, y si la altura del espejo era mayor, la pendiente era más pronunciada. Para optimizar la inclinación, un perno de precisión empujó el espejo hasta que el punto luminoso llegó al lugar deseado (cara de la hormiga), simulado por una pieza de madera de 3 cm. Cada experimento se realizó con 100 hormigas y se repitió tres veces.

Figura 2. a) Cabeza de hormiga iluminada desde la parte superior con una matriz L300, b) iluminación reflejada con un espejo, y c) iluminación con control lateral LED.
b: Tiempo de adaptación de la hormiga al iluminar directamente su ojo con el sistema LED lateral (Figura 2c). Se realizaron diez experimentos con 50 hormigas cada uno. En cinco experimentos se utilizaron pulsos de intensidad luminosa de 300 lx, y en el resto la intensidad fue de 900 lx. Ambos experimentos (con 300 y 900 lx) utilizaron pulsos simples de 1, 4, 8, 10 y 60 ms, con lo cual se evaluaron 250 hormigas por intensidad luminosa. Cada hormiga estimulada con luz que se detuvo se levantó cuidadosamente con unas pinzas y se colocó dentro de un recipiente de plástico en un espacio oscuro (Farji-Brener et al., 2010). El tiempo transcurrido antes de que la hormiga mueve la cabeza corresponde al periodo de adaptación a la oscuridad y se contabilizó con un cronómetro de precisión. Media hora después, cada hormiga se colocó en el camino oscuro para evaluar su adecuada orientación.
c: Hormigas que abandonaron el camino (HAC) de 60 mm de ancho al final después de ser iluminadas con pulsos blancos reflejados en el espejo. Se realizaron 12 experimentos con 10 repeticiones cada uno para determinar la cantidad de HAC. Durante cada experimento, 100 hormigas entraron en el camino, y después de que el 25 % de ellas lo abandonaran, se aplicaron pulsos luminosos. Los fotodetectores láser contaron el número de hormigas a la entrada y a la salida de cada recorrido. A lo largo del camino, se aplicaron cuatro pulsos distintos de luz de 10 ms (3, 6, 9 y 12), con una frecuencia de 90 pulsos por minuto, y tres intensidades de luz diferentes (300, 900 y 1800 lx). La segunda matriz L300 proporcionó tres o seis pulsos, y para 12 pulsos, la segunda y la tercera matriz aplicaron seis pulsos cada una. La observación visual ayudó a comprender por qué las hormigas regresaban a la entrada.
d: Estado y trayectoria de las hormigas después del destello lateral de luz LED. Se realizaron dos experimentos diferentes que se repitieron cinco veces, con 100 hormigas cada uno. En el primer experimento, se aplicaron pulsos de luz al 33 % de las hormigas que pasaron por el camino; se contó la cantidad de HAC inmediatamente y al cabo de 7 min. El tiempo de recuperación o de adaptación de las hormigas a la oscuridad determinó su estado. En el segundo experimento, se aplicaron pulsos laterales de luz a cinco hormigas consecutivas, y se contó el número de HAC.
e: Estado y trayectoria de las hormigas después de la iluminación límite L300. El sistema de iluminación en el extremo del camino consistió en un dispositivo L300 horizontal fijo a 3 cm del suelo. Las hormigas entraron por ambos carriles y se construyó una ruta alternativa. El sistema L300 proporcionó pulsos con un ciclo de trabajo del 20 % con diferentes frecuencias durante 12 s para las hormigas lideres. Se obtuvo el umbral de intensidad luminosa que obligó a las hormigas a cambiar de ruta utilizando pulsos de luz de 10 Hz por 20 ms, 30 Hz por 6.6 ms, 100 Hz por 2 ms y 200 Hz por 1 ms. Para cada grupo de hormigas se seleccionó una frecuencia-duración de pulso, comenzando con una fuente de luz L300 de 250 lx. La intensidad se incrementó en 50 lx hasta que las hormigas cambiaron de ruta, con lo cual se obtuvo el umbral de intensidad luminosa (Figura 3). El experimento se repitió cinco veces con dicho umbral para garantizar su eficacia.
Resultados y discusión
Se siguieron 27 hormigas, unas a otras, en el camino de 100 cm, con tamaño promedio de 2.5 cm de longitud y espacio entre ellas de 1.25 cm. Aunque se esperaban cambios de movilidad en los caminos iluminados artificialmente, se comprobó que las hormigas raramente modifican su velocidad con cambios continuos de luz. Las hormigas A. cephalotes avanzaron durante la noche por caminos cercanos al tronco del árbol de mango, con velocidades que oscilaron entre 1.6 y 1.9 cm∙s-1, correspondientes a un PTEH de 0.95 y 0.83 s, respectivamente. Las hormigas que caminaron durante el día a 2.3 cm∙s-1 cruzaron el camino de 100 cm en 43.48 s. Durante la noche, las hormigas presentaron un tiempo de recorrido más prolongado (62.5 s) a una velocidad de 1.6 cm∙s-1. Cuando la líder se adaptó a la luz y cambió su velocidad, las hormigas obreras la siguieron (Hahn & Bolaños, 2021). El número de colisiones demostró que a las hormigas les resultó más fácil adaptarse a los pulsos oscuros durante el día que a los pulsos de luz intensa durante la noche (Hahn & Bolaños, 2021). Los pulsos de luz en el día se disipan a través de la iluminancia natural y los pulsos oscuros no se ven dentro del camino.
Aunque los investigadores utilizan videocámaras para estudiar el movimiento de las hormigas, en este trabajo no se utilizaron porque las matrices L300 bloqueaban el campo de visión de la cámara. En su lugar, se utilizaron unidades fotodetectores-láser fijadas a las paredes del recorrido para registrar la velocidad de las hormigas, ya que los láseres rojos son insensibles a la visión de las hormigas (Ogawa et al., 2015; Röschard & Roces, 2011). Las variaciones en la respuesta de los fotodetectores causadas por las matrices L300 fueron insignificantes después de ser filtradas. La matriz L300 se limpió continuamente para reducir la pérdida de radiación (Harley & Ritzmann, 2010). Únicamente el 20 % de la radiación del L300 llegó al ojo de hormiga, luego de ser absorbida por la base de plástico del camino o la materia orgánica del suelo.
Iluminación LED y L300 lateral
La luz aplicada verticalmente desde la matriz L300 se reflejó en la cabeza de las hormigas, pero nunca llegó a sus ojos (Figura 2a). Las colisiones de hormigas (22.3 ± 0.29; promedio ± error estándar) causadas por el reflejo en el espejo aumentaron durante la noche a medida que el 75 % de la iluminación L300 llegó a sus ojos. En el camino reflejado por el espejo, el tamaño y la velocidad de las hormigas no garantizaron una iluminación perfecta en sus ojos. Después de reflejar el rayo en el sistema de espejos, aumentó el área de cobertura, pero redujo el poder convergente. Además, el filtro de L300 suaviza el rayo LED, lo cual reduce su intensidad. La proyección del rayo en el espejo puede ser útil a nivel de laboratorio, pero es difícil de aplicar sobre el terreno.
La probabilidad de que la luz LED ilumine el ojo de la hormiga depende de su tamaño, velocidad y frecuencia estroboscópica, por lo cual se diseñó un sistema de iluminación controlada para hacer frente a estas variables. Después de que la cabeza de la hormiga bloquea por primera vez el rayo láser rojo, el fotodetector activa un retardo (Figura 2c). Una vez finalizado el tiempo de espera, se enciende una luz LED blanca que ilumina con precisión el ojo de la hormiga. Con un ojo de 0.69 mm de longitud (Moser et al., 2004) y una velocidad de marcha de 1.6 cm∙s-1, el sistema LED lateral debe emitir un pulso luminoso de 43 ms, lo cual se podría implementar mediante nueve pulsos de 1 ms a 200 Hz (20 % de ciclo de trabajo), o dos de 6.6 ms a 30 Hz (20 % de ciclo de trabajo). El sistema de iluminación proporciona periodos de encendido de 13.2 ms a 30 Hz o 9 ms a 200 Hz, lo cual representa menos del 30 % del pulso luminoso necesario de 43 ms. Una frecuencia inferior de 1.5 Hz (20 % de ciclo de trabajo) proporcionaría un pulso de 133 ms.
Como los pulsos de luz solo penetraron un ojo de la hormiga con el sistema LED de precisión lateral, las hormigas nunca perdieron su sistema visual. Después de exponer a las hormigas al estimulador LED dentro de los caminos con una sola vía, las hormigas aturdidas se detuvieron durante 2 a 3 s. Este estímulo permitió determinar el efecto de los pulsos de luz sobre la adaptación de la visión de las hormigas y el tiempo de recuperación de la marcha. Debido al corto periodo de destello (43 ms) con diferentes frecuencias, las hormigas no se quedaron ciegas y, aunque perdieron algunos receptores, pudieron llegar al final del trayecto (Schwarz & Wystrach, 2011).
En el Cuadro 2 se muestran los resultados obtenidos luego de aplicar pulsos luminosos nocturnos con intensidades de 300 y 900 lx durante distintos periodos de tiempo (experimento b). El pulso luminoso aplicado al ojo de la hormiga la alteró, por lo cual requirió un tiempo de recuperación para volver a caminar con normalidad. La duración del destello afecta el tiempo de adaptación, el cual incrementa a medida que aumenta la intensidad de la luz. Con un pulso de 50 ms de 900 lx, la adaptación a la oscuridad aumentó a 1169 ± 6.05 s (promedio ± error estándar). En promedio, el 90 % de las hormigas resistió el pulso de luz de 1.5 Hz por 50 ms, y solo el 11.2 % perdió su buena orientación. Las hormigas que recibieron el destello durante más de 5 ms presentaron problemas de orientación (Cuadro 2).
Cuadro 2. Tiempo de adaptación a la oscuridad, tasa de supervivencia y orientación después de aplicar diferentes pulsos
e intensidades estroboscópicas con el sistema de iluminación.
| Pulso | Intensidad luminosa | ||||||||
|---|---|---|---|---|---|---|---|---|---|
| 300 lx | 900 lx | ||||||||
| TS/BO (%) | APO (s) | EEAO | TS/ BO (%) | APO (s) | EEAO | ||||
| 200 Hz-4 ms | 100/100 | 47.42 | 0.22 | 100/100 | 140.3 | 0.67 | |||
| 200 Hz-1 ms | 100/100 | 28.78 | 0.22 | 100/100 | 44 | 0.41 | |||
| 60 Hz-8 ms | 100/90 | 79.7 | 0.31 | 100/90 | 212.8 | 0.88 | |||
| 60 Hz-1 ms | 100/100 | 26 | 0.2 | 100/100 | 53.7 | 0.36 | |||
| 1.5 Hz-10 ms | 100/90 | 92.42 | 0.45 | 90/93.3 | 272.6 | 0.64 | |||
| 1.5 Hz-50 ms | 90/88.8 | 401.78 | 2.21 | 88.8/88.6 | 1169 | 6.05 | |||
TS = tasa de supervivencia; BO = buena orientación; APO = adaptación promedio a la oscuridad; EEAO = error estándar de adaptación a la oscuridad.
Experimentos en caminos amplios
Para los escenarios experimentales c, d y e se utilizó un camino más ancho de 60 mm entre las paredes. Después del quinto pulso de luz, las hormigas lideres chocaron dentro de la línea de tránsito (Figura 4a). La nueva hormiga líder se desplazó a otro carril, y las demás hormigas la siguieron. Las hormigas regresaron al inicio del camino, luego de producirse dos colisiones y no poder avanzar (Figura 4b). El valor mínimo de las HAC (hormigas que abandonaron el camino) que se obtuvo fue de 25 %, ya que los pulsos blancos se empezaron a emitir después de que 25 hormigas abandonaran el camino. El promedio de HAC nunca estuvo por debajo de 95.3 ± 0.82 % para intensidades de 300 lx. Las hormigas que recibieron tres pulsos de 10 ms con una intensidad de 1 800 lx registraron un valor de HAC mínimo de 99.3 ± 0.67 %. Muchas hormigas abandonaron el camino por donde entraron con 12 pulsos, teniendo promedios de HAC de 62.33 ± 1.26 % y 32.9 ± 2.33 % para intensidades de luz de 900 y 1 800 lx, respectivamente (Figura 4c). Un HAC igual a 32.9 % indica que solo 33 % de las hormigas abandonaron el camino al final y el otro 67 % regreso a la entrada. Las hormigas que recibieron nueve pulsos con una intensidad de 1800 lx también se regresaron (HAC = 61.2 ± 2.53 %). En ambos casos, las elipses rojas señalan a las HAC que salen por la entrada (Figura 4c).
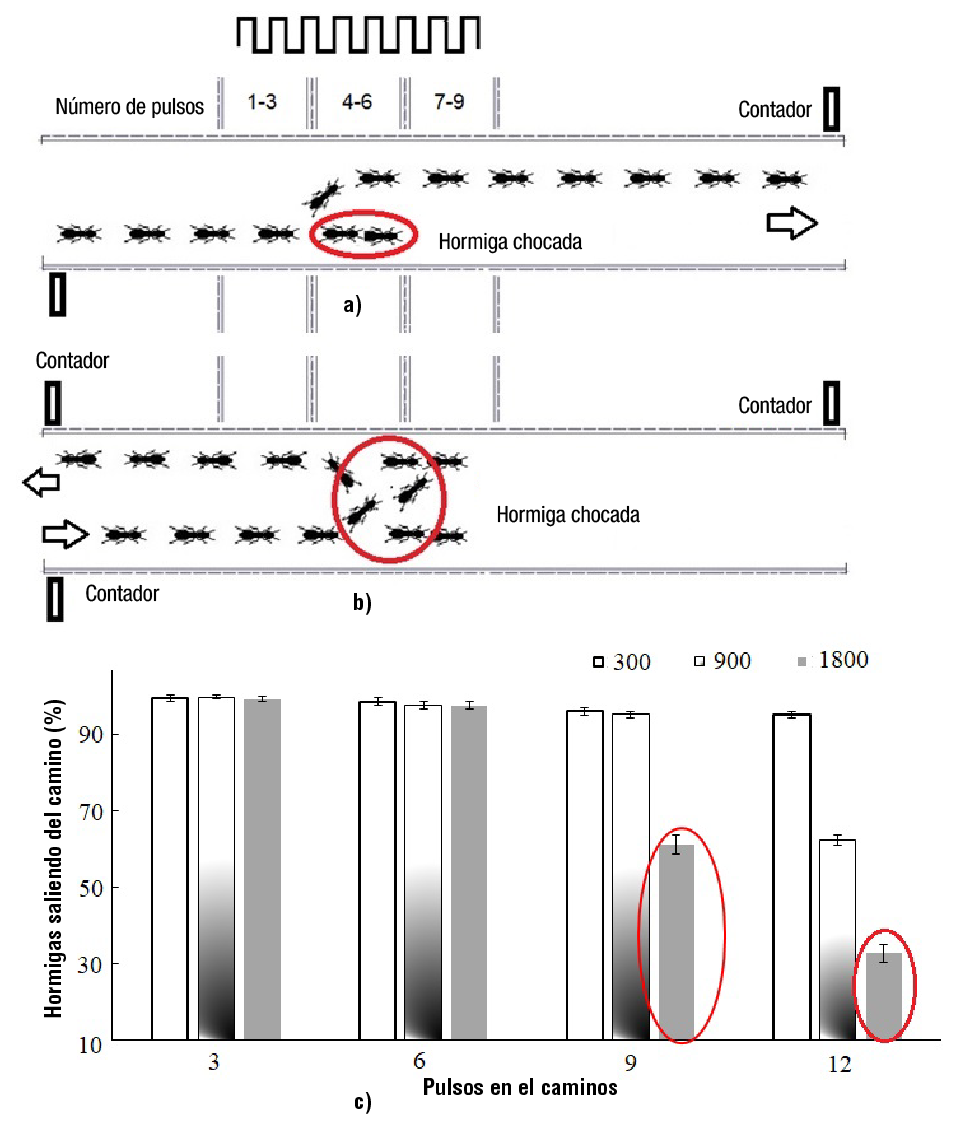
Figura 4. Hormigas saliendo del camino: a) luego de una colisión, b) luego de dos colisiones, y c) de acuerdo con el número de pulsos luminosos de 10 ms y de la intensidad luminosa.
Las hormigas obreras que caminaron en líneas paralelas (Figura 4) recibieron pulsos de luz LED laterales en sus ojos. Cuando las hormigas se movían por el sendero y se seguían unas a otras, la irradiación aplicada llegaba a sus caras. Sin embargo, como las hormigas no tienen el mismo tamaño y la exposición no es continua, algunos ejemplares no recibieron ningún impulso luminoso. Al recibir la irradiación, la hormiga redujo su velocidad y perdió el rumbo. Una hormiga que recibe un pulso de luz de 300 lx, por 50 ms a 1.5 Hz, necesita 6.7 min para recuperarse (Cuadro 2). De cada 100 hormigas, 33 fueron alumbradas por el sistema LED lateral. Después de que 33 % de las hormigas recibieron estímulos luminosos de 900 lx por 35 ms a 1.5 Hz, solo 66.8 ± 0.49 % de las HAC al final. Por otro lado, 82.4 % fueron inmediatamente a la salida cuando recibieron nueve pulsos luminosos de 300 lx por 1 ms a 200 Hz (Cuadro 3), 15.4 % de las hormigas fueron a la salida del camino entre el primer y el séptimo minuto, y el 2.2 % restante seguía en modo de recuperación, pero ninguna murió.
Cuadro 3. Porcentaje de hormigas que abandonaron el camino inmediatamente después de ser irradiadas con pulsos de
alta y baja frecuencia, con intensidades de 300 o 900 lx, y entre el primer y el séptimo minuto.
| Frecuencia | Duración del pulso | Intensidad luminosa | ||||
|---|---|---|---|---|---|---|
| 300 lx | 900 lx | |||||
| PHAC (%) | SE | PHAC (%) | SE | |||
| Inmediatamente | 200 / 9-1 ms | 82.4 | 0.68 | 70.6 | 0.68 | |
| Entre 1 y 7 min | 200 / 9-1 ms | 15.4 | 0.24 | 26.8 | 0.37 | |
| Inmediatamente | 1.5 / 1-35 ms | 69.8 | 0.58 | 66.8 | 0.49 | |
| Entre 1 y 7 min | 1.5 / 1-35 ms | 24.8 | 0.37 | 1.4 | 0.24 | |
PHAC = promedio de hormigas que abandonaron el camino; EE = error estándar.
Un total de 26.8 ± 0.37 % de las hormigas, alcanzadas por pulsos de alta frecuencia de 900 lx, se recuperaron entre el primer y el séptimo minuto. De forma similar, 24.8 ± 0.37 % de las hormigas se recuperaron de la estimulación de baja frecuencia de 300 lx. Estos valores tienen sentido al comprobar los tiempos de adaptación a la oscuridad del Cuadro 3. Cuando se iluminaron cinco hormigas consecutivamente con LED laterales, todas se detuvieron, lo cual obligó a las seguidoras a cambiar de ruta.
Algunos pulsos luminosos precisos alcanzaron los ojos de las hormigas y las detuvieron en los caminos más anchos. Con más espacio en el camino ancho, las hormigas pudieron girar y no se detuvieron al encontrar una hormiga inmóvil. Las hormigas que giraron evitaron chocar y siguieron su camino en línea recta. Después de que dos o tres hormigas se deslumbraron y el camino se bloqueara, las hormigas se comunicaron entre ellas por medio de sus antenas (Gordon, 2019). Las hormigas regresaron a la entrada sin confusión y permanecieron juntas. Sin feromonas depositadas por las hormigas inmóviles (Franks et al., 1991), otras hormigas circularon ocasionalmente por el camino. Algunas hormigas aturdidas fueron empujadas hacia la salida por sus compañeras, pero otras permanecieron dentro del camino, tardando hasta 20 min en recuperarse y adaptarse a la oscuridad (Cuadro 2). Las hormigas se desplazaron dentro del camino sin la orientación adecuada y golpearon a otras hormigas.
Desvío de ruta con iluminación al final del recorrido
Sin encender la matriz horizontal L300 fija al final del camino, las hormigas nunca cambiaron de ruta. Se puede forzar un cambio en la ruta si se supera un umbral de destello ocular de 1 000 lx de iluminación continua (Figura 5). El porcentaje de hormigas que tomó la ruta bifurcada fue siempre del 100 %, pero para distinguir a los umbrales se varió entre 96 y 100 % (Figura 6). La cantidad de luz recibida por las hormigas durante 12 s fue la misma para todas las frecuencias, ya que utilizaron el mismo ciclo de trabajo de 20 %. Al aumentar la distancia entre la matriz L300 y el punto de rotación (ruta bifurcada), se requiere más intensidad luminosa para cambiar la ruta de las hormigas; por lo tanto, se requirió un umbral de 724 lx con destellos de 10 Hz por 20 ms, y solo 500 lx con pulsos de 30 Hz por 6.6 ms. El pulso de adaptación a la oscuridad de 30 Hz fue a 26.7 ms por cada pulso de luz de 6.6 ms. Este periodo no permite que los fotodetectores oculares vuelvan a 0 V. En el caso del destello de 200 Hz por 1 ms, el cambio de ruta se produjo con iluminación de 300 lx, pero el pulso oscuro de 4 ms también fue demasiado corto para que el fotodetector ocular se adaptara a la oscuridad. Si la intensidad luminosa se aplica por menos de 5 s en el límite final, las hormigas continúan su camino con normalidad.

Figura 5. Camino de las hormigas con iluminación LED precisa: a) con iluminación en el límite y b) sin iluminación en el límite.

Figura 6. Umbral de destello e iluminación continua con L300 para que las hormigas tomen una ruta alternativa.
Los pulsos enviados desde el final del camino durante 12 s provocaron que las hormigas cambiaran de ruta sin choques ni embotellamientos. La intensidad de la iluminación L300 se controló mediante el voltaje aplicado, y cuando superó el 75 % de su valor máximo las hormigas se alejaron y no treparon al árbol. Un control activaba las lámparas durante el atardecer cuando las hormigas se trepaban a los árboles (Figura 7). Todas las hormigas cambiaron su ruta cuando se mantuvo la intensidad luminosa, y depositaron feromonas sobre su nuevo camino. En condiciones ambientales, se requiere un manejo adecuado de la iluminación. Los cambios de movimiento durante un evento pueden ser una característica adaptativa del cerebro de las hormigas (Hunt et al., 2016). Esta respuesta se puede observar durante tormentas de lluvia (Farji-Brener et al., 2018), ataques de depredadores o bajo potentes estímulos intensos de iluminación. Gallotti y Chialvo (2017) demostraron que las hormigas pueden determinar su próximo movimiento en su camino y no requieren estar en reposo.
Aplicación como control de plagas
Esta investigación proporciona conceptos básicos de iluminación para el control de plagas, al desviar a las hormigas antes de llegar al tronco del árbol. La instalación del sistema de iluminación juega un papel muy importante, ya que es esencial que los impulsos luminosos lleguen a los ojos de las hormigas. La producción de mango en la siguiente temporada depende de una poda exitosa para estimular la ramificación de los brotes laterales y formar un dosel denso que florezca (Davenport, 2006). Este sistema de iluminación perimetral ecológico y libre de productos químicos puede evitar que Atta cephalotes busque hojas tiernas después de la poda. El sistema de iluminación perimetral dio excelentes resultados a nivel del suelo, ya que es agresivo contra las hormigas y produce cambios de ruta. La luz LED al nivel del suelo es muy susceptible y riesgosa frente a condiciones ambientales como la lluvia, el viento, la materia orgánica, la discontinuidad del suelo y el paso de otros animales. Por ello, se están probando diferentes modalidades de LED. La frecuencia de parpadeo alta (200 Hz) o baja (90 pulsos por minuto) pueden cambiar los recorridos de las hormigas si se utilizan correctamente.
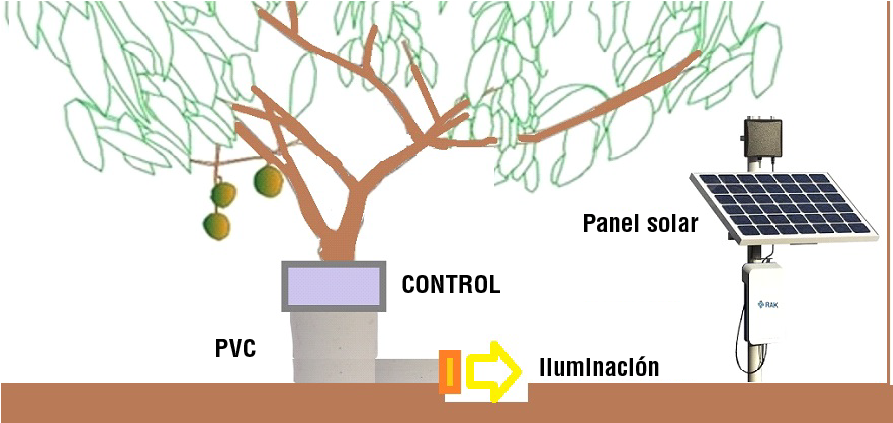
Si se quiere utilizar el sistema en un huerto, se deben instalar 100 sistemas por hectárea (uno por árbol). La energía necesaria por árbol se puede recolectar con un panel solar de 40 W (Figura 7) y guardarse en una batería para poder usarla durante la noche. A nivel del suelo, un tubo de PVC permite que las hormigas caminen hasta el tronco del árbol y un circuito detecta cuando suben las hormigas. En un lado del PVC (Figura 7, bloque naranja), las luces LED están fijas y se encienden cuando un fototransistor (TEPT5700, Vishay, India) se activa mediante un diodo emisor de baja potencia (XZCDGK53W-8VF, SunLED Company Limited, Hong Kong). Esta acción tiene lugar cuando las hormigas circulan. Hahn y Martínez (2023) publicaron el circuito completo, donde utilizan dos MOSFET¨s de baja potencia junto con un microcontrolador CC2541 (Texas Instruments, EUA). El costo por árbol se muestra en el Cuadro 4, y es de $34.20 USD. Si una caja de 30 kg se puede pagar a $10.00 USD, y un panel solar sirve para dos árboles, el sistema puede resultar muy rentable. El sistema está protegido contra erosión hídrica causada por tormentas mediante el cierre del tubo de PVC, lo cual evita daños en los circuitos y las lámparas LED.
En 2018, 60 % de los árboles fueron atacados por hormigas y la producción de los árboles disminuyó 35 %. Los árboles de mango muy maduros, con 30 años de edad, estuvieron menos propensos al ataque de hormigas, ya que las hojas jóvenes estaban muy elevadas, y durante 2019 sólo dos árboles fueron atacados por hormigas. Los árboles de mango de 10 años, con hojas tiernas más bajas, fueron atacados más frecuentemente y se encontraron caminos cubiertos por secciones de hojas en el 55 % de los árboles. En 2019, la producción de mango disminuyó 28 %. El uso del sistema en 30 árboles de 10 años durante la noche evitó que las hormigas se alimentaran del follaje.
Conclusiones
Como la iluminación superior del L300 funcionó mal sobre el camino, se probaron otras alternativas. Con la iluminación superior, sólo un pequeño porcentaje de la luz incidente proveniente del L300 se reflejó desde el suelo hasta la cabeza de las hormigas. Sin embargo, nunca se comprobó el daño en los ojos con un microscopio, solo se observaron efectos indirectos (velocidad, colisiones, pérdida de orientación), por lo cual impactó directamente sobre sus cabezas y cuerpos.
A medida que aumentaba la intensidad de la luz en el camino, incrementaba la velocidad de las hormigas al caminar y disminuía el PTEH. Cuando el sistema visual se vio afectado por pulsos laterales más intensos, las hormigas chocaron y recibieron golpes por parte de sus seguidores, las cuales intentaban adaptarse al parpadeo de la luz. El sistema LED fue muy preciso y las células fotorreceptoras fueron incapaces de cambiar rápidamente. La intensidad de la luz LED que llega al ojo de las hormigas puede dañar algunos fotodetectores, lo cual crea problemas de adaptación y pérdida de orientación.
Las hormigas Atta cephalotes pueden hacer frente a una iluminación continua, pero sufren problemas de adaptación bajo pulsos de luz intermitentes. La frecuencia de parpadeo de 200 Hz puede cambiar las rutas de tránsito de las hormigas al optimizar el uso de la energía.
Agradecimientos
Agradecemos al MI. Ángel Hernández y al Biol. Ruth Pérez por las deliberaciones, y a la Universidad Autónoma Chapingo por apoyar y financiar el proyecto 19008-DTT-65.
REFERENCIAS
Alma, A., Farji-Brener, A., & Elizalde, L. (2016). Gone with the wind: Short- and long-term responses of leaf-cutting ants to the negative effect of wind on their foraging activity. Behavioral Ecology, 27(4), 1017-1024. https://doi.org/10.1093/beheco/arw007 [ Links ]
Armbrecht, I., Montoya-Correa, M., & Montoya-Lerma, J. (2013). Composting to control the leaf-cutting ant Atta cephalotes L. (hymenoptera: formicidae). Revista de Ciencias, 16, 47-56. https://doi.org/10.25100/rc.v16i0.502 [ Links ]
Balla, E., Florian, N., Gergocs, V., Gránicz, L., Toth, F., Nemeth, T., & Dombos, M. (2020). An opto-electronic sensor-ring to detect arthropods of significantly different body sizes. Sensors, 20(4), 982. https://doi.org/10.3390/ s20040982 [ Links ]
Barroso, A., Haifig, I., Janei, V., da Silva, I., Dietrich, C., & Costa, (2015). Effects of flickering light on the attraction of nocturnal insects. Lighting Research and Technology, 49(1), 1-13. https://doi.org/10.1177/1477153515602143 [ Links ]
Britto, J. S., Forti, L. C., Oliveira, M. A., Zanetti, R., Wilcken, C. F., Zanuncio, J. C., Loeck, A. E., Caldato, N., Nagamoto, N. S., Lemes, P. G., & Camargo, R. S. (2016). Use of alternatives to PFOS, its salts and PFOSF for the control of leaf-cutting ants Atta and Acromyrmex. International Journal of Research in Environmental Studies, 3(2), 11-92. https://doi.org/10.33500/ijres.2016.3.002 [ Links ]
Brydegaard, M. (2015). Towards quantitative optical cross sections in entomological laser radar – potential of temporal and spherical parameterizations for identifying atmospheric fauna. PLoS ONE, 10(8), e0135231. https://doi.org/10.1371/journal.pone.0135231 [ Links ]
Burd, M., Archer, D., Aranwela, N., & Stradling, D. J. (2002). Traffic dynamics of the leaf-cutting ant, Atta cephalotes. American Naturalist, 159(3), 283-293. https://doi.org/10.1086/338541 [ Links ]
Bustamante, S., & Amarillo-Suárez, A. (2019). Foraging plasticity of Atta cephalotes (Hymenoptera:Formicidae) in response to temperature differences between forest and pasture. Revista de Biología Tropical, 67(4), 963-974. https://dx.doi.org/10.15517/rbt.v67i4.34951 [ Links ]
Carlos, A. A., Rodrigues, A., Forti, L. C., Passador, M. M., & Sierra, J. F. (2010). Filamentous fungi found in Atta sexdens rubropilosa colonies after treatment with different toxic bait formulations. Journal of Applied Entomology, 135(4), 326-331. https://doi.org/10.1111/j.1439-0418.2010.01551.x [ Links ]
Cevallos-Dupuis, E., & Harrison, J. F. (2017). Trunk trail maintenance in leafcutter ants: caste involvement and effects of obstacle type and size on path clearing in Atta cephalotes. Insectes Sociaux, 64, 189-196. https://doi.org/10.1007/s00040-016-0530-y [ Links ]
Couzin, I., & Franks, N. (2003). Self-organized lane formation and optimized traffic flow in army ants. Proceedings The Royal Society Biological Sciences, 270, 139-46. https://doi.org/10.1098/rspb.2002.2210 [ Links ]
Davenport, T. (2006). Pruning strategies to maximize tropical mango production from the time of planting to restoration of old orchards. HortScience, 41(3), 544-548. https://doi.org/10.21273/HORTSCI.41.3.544 [ Links ]
Della-Lucia, T. (2003). Hormigas de importancia económica en la región Neotropical. In: Fernández, F. (Ed.), Introducción a las hormigas de la región Neotropical(pp. 337-349). Instituto de Investigación de Recursos Biológicos Alexander von Humboldt. chrome-extension://efaidnbmnnnibpcajpcglclefindmkaj/ http://repository.humboldt.org.co/bitstream/handle/20.500.11761/32961/978-958-8151-23-6.pdf? [ Links ]
El-Hamalawi, Z., & Menge, J. (1996). The role of snails and ants in transmitting the avocado stem canker pathogen, Phytophthora citricola. Journal of the American Society for Horticultural Science, 121(5), 973-977. https://doi.org/10.21273/JASHS.121.5.973 [ Links ]
Eliopoulos, P., Tatlas, N., Rigakis, I., & Potamitis, I. (2018). A “smart” trap device for detection of crawling insects and other arthropods in urban environments. Electronics, 7(9), 161. https://doi.org/10.3390/electronics7090161 [ Links ]
Farji-Brener, A., Chinchilla, F., Rifkin, S., Sánchez, A., Triana, E., Quiroga, V., & Giraldo, P. (2010). The ‘truck-driver’ effect in leaf-cutting ants: How individual load influences the walking speed of nest-mates. Physiological Entomology, 36(2), 128-134. https://doi.org/10.1111/j.1365-3032.2010.00771.x [ Links ]
Farji-Brener, A., Dalton, M., Balza, U., Courtis, A., Lemus, I., Fernandez, R., & Caceres, Z. (2018). Working in the rain? Why leaf-cutting ants stop foraging when it’s raining. Insectes Sociaux, 65, 233-239. https://doi.org/10.1007/s00040-018-0605-z [ Links ]
Franks, N., Gomez, N., Goss, S., & Deneubourg, J. (1991). The blind leading the blind in army ant raid patterns: Testing a model of self-organization (Hymenoptera: Formicidae). Journal of Insect Behavior, 4, 583-607. https://doi.org/10.1007/BF01048072 [ Links ]
Freeman, B. M., & Chaves-Campos, J. (2016). Branch width and height influence the incorporation of branches into foraging trails and travel speed in leafcutter ants Atta cephalotes (L.) (Hymenoptera: Formicidae). Neotropical Entomology, 45, 258-264. https://doi.org/10.1007/s13744-016-0362-5 [ Links ]
Frolov, R. V. (2016). Current advances in invertebrate vision: insights from patch- clamp studies of photoreceptors in apposition eyes. Journal Neurophysiology, 116, 709-723. https://doi.org/10.1152/jn.00288.2016 [ Links ]
Gallotti, R., & Chialvo, D. (2017). How ants move: collective versus individual scaling properties. Journal of The Royal Society Interface, 15(143), 1-6. https://doi.org/10.1098/rsif.2018.0223 [ Links ]
Gordon, D. (2019). The ecology of collective behavior in ants. Annual Review of Entomology, 64(3), 1-3.16. https://doi.org/10.1146/annurev-ento-011118-111923 [ Links ]
Greiner, B., Narendra, A., Reid, S., Dacke, M., Ribi, W., & Zeil, J. (2007). Eye structure correlates with distinct foraging-bout timing in primitive ants. Current Biology, 17(20), 879-80. https://doi.org/10.1016/j.cub.2007.08.015 [ Links ]
Hahn, F., & Bolaños, C. (2021). How can blue and white light pulses stimulate Atta cephalotes in trails below fruit trees? Modern Concepts & Developments in Agronomy, 9(5), 000725. https://doi.org/10.31031/MCDA.2021.09.000725 [ Links ]
Hahn, F., & Martínez, F. (2023). WSN system warns “Atta Cephalotes” climbing in mango fruit trees. Proceedings of the Future Technologies Conference, 560(2), 284-296. Springer. https://doi.org/10.1007/978-3-031-18458-1_20 [ Links ]
Harley, C. M., & Ritzmann, R. E. (2010). Electrolytic lesions within central complex neuropils of the cockroach brain affect negotiation of barriers. Journal of Experimental Biology, 213(16), 2851-2864. https://doi.org/10.1242/jeb.042499 [ Links ]
Hölldobler, B., & Wilson, E. (1990). The ants. Belknap Press, Cambridge. [ Links ]
Hunt, E. R., Baddeley, R. J., Worley, A., Sendova, A. B., & Franks, N. R. (2016). Ants determine their next move at rest: motor planning and causality in complex systems. Royal Society Open Science, 3(1), 150534. https://doi.org/10.1098/rsos.150534 [ Links ]
Inger, R., Bennie, J., Davies, T. W., & Gaston, K. J. (2014). Potential biological and ecological effects of flickering artificial light. PLoS ONE, 9(5), e98631. https://doi.org/10.1371/journal.pone.0098631 [ Links ]
Jayatilaka, P., Narendra, A., Reid, S., Cooper, P., & Zeil, J. (2011). Different effects of temperature on foraging activity schedules in sympatric Myrmecia ants. Journal of Experimental Biology, 214(16), 2730-2738. https://doi.org/10.1242/jeb.053710 [ Links ]
Kwaku, K. M., Gonick, E. A., Ostapovich, E. M., & Weinberg, I. P. (2020). The frequency of leaf transfer in Atta cephalotes along horizontal and vertical surfaces near the bases of trees. Insectes Sociaux, 67, 481-486. https://doi.org/10.1007/s00040-020-00784-3 [ Links ]
Meyer-Rochow, V. (2002). The crustacean eye: dark/light adaptation, polarization sensitivity, flicker fusion frequency, and photoreceptor damage. Zoological Science, 18(9), 1175-1197. https://doi.org/10.2108/zsj.18.1175 [ Links ]
Moser, J., Reeve, J., Bento, J., Della-Lucia, T., Cameron, R., & Heck, N. (2004). Eye size and behavior of day- and night-flying leaf cutting ant alates. Journal of Zoology, 264(1), 69-75. https://doi.org/10.1017/S0952836904005527 [ Links ]
Mota-Filho, T. M., Stefanelli, L., Camargo, R., Matos, C., & Forti, L. (2021). Biological control in leaf-cutting ants, Atta sexdens (Hymenoptera:Formicidae), using pathogenic fungi. Revista Árvore, 45, e4516. https://doi.org/10.1590/1806-908820210000016 [ Links ]
Narendra, A., Kamhi, J., & Ogawa, Y. (2017). Moving in dim light: behavioral and visual adaptations in nocturnal ants. Integrative and Comparative Biology, 57(5), 1104-1116. https://doi.org/10.1093/icb/icx096 [ Links ]
Narendra, A., Reid, S., & Raderschall, C. (2013). Navigational efficiency of nocturnal Myrmecia ants suffers at low light levels. PloS ONE, 8. e58801. https://doi.org/10.1371/journal.pone.0058801 [ Links ]
Norton, V., Stevens, B., & Harris, W. (2014). Flexibility of individual load-mass selection in relation to foraging trail gradient in the leaf-cutter ant Acromyrmex octospinosus. Journal of Insect Behavior, 27, 370-384. https://doi.org/10.1007/s10905-013-9435z [ Links ]
Ogawa, Y., Falkowski, M., Narendra, A., Zeil, J., & Hemmi, J. (2015). Three spectrally distinct photoreceptors in diurnal and nocturnal Australian ants. Proceedings of the Royal Society B. Biological Sciences, 282, 1-7. https://doi.org/10.1098/rspb.2015.0673 [ Links ]
Rodríguez, G., Calle, D. Z., & Montoya-Lerma, J. (2008). HerbivoríadeAttacephalotes(Hymenoptera:Myrmicinae) sobre tres sustratos vegetales. Revista Colombiana de Entomología, 34(2), 156-162. https://doi.ord/10.25100/socolen.v34i2.9280 [ Links ]
Röschard, J., & Roces, F. (2011). Sequential load transport in grass-cutting ants (Atta vollenweideri): Maximization of plant delivery rate or improved information transfer? Psyche A Journal of Entomology, 643127, 1-9. https://doi. org/10.1155/2011/643127 [ Links ]
Schwarz, S., & Wystrach, A. (2011). Visual input and path stabilization in walking ants. Communicative Integrative Biology, 4(6), 758-760. https://doi.org/10.4161/cib.17730 [ Links ]
StrÖmbom, D., & Dussutour, A. (2018) Self-organized traffic via priority rules in leaf-cutting ants. PLoS Computer Biology, 14(10), e1006523. https://doi.org/10.1371/journal.pcbi.1006523 [ Links ]
Valmir, S. V., Dillon, B. R., Dillon, B. V., Reynolds, B. S., & Samuel, R. I. (2004). Ocurrence of the antibiotic producing bacterium Burkholderia sp. in colonies of the leaf cutting ant Atta sexdens rubropilosa. Microbiology Letters, 239(2), 319-323. https://doi.org/10.1016/j.femsle.2004.09.005 [ Links ]
Varón, E., Eigenbrode, S., Bosque-Perez, N., & Hilje, L. (2007). Effect of farm diversity on harvesting of coffee leaves by the leaf -cutting ant Atta cephalotes. Agricultural and Forest Entomology, 9(1), 47-55. https://doi.org/10.1111/j.1461-9563.2006.00320.x [ Links ]
Warrant, E. (2017). The remarkable visual capacities of nocturnal insects: Vision at the limits with small eyes and tiny brains. Philosophical Transactions of the Royal Society B: Biological Sciences, 372. 1-13. https://doi.org/10.1098/rstb.2016.0063 [ Links ]
Wilson, E.O. (1971). The insect societies. Belknap Press. [ Links ]
Wirth, R., Herz, H., Ryel, R., Beyschlag, W., & Holldobler, (2003). Herbivory of leaf-cutting ants. Springer, Heidelberg. https://doi.org/10.1007/978-3-662-05259-4 [ Links ]
Recibido: 26 de Abril de 2022; Aprobado: 26 de Junio de 2023











 text in
text in