Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Ingeniería agrícola y biosistemas
On-line version ISSN 2007-4026Print version ISSN 2007-3925
Ing. agric. biosist. vol.12 n.1 Chapingo Jan./Jun. 2020 Epub May 23, 2022
https://doi.org/10.5154/r.inagbi.2019.08.055
Nota científica o tecnológica
Nanopartículas de gelatina cargadas con calcio como fuente de fertilizante agrícola
1Instituto Politécnico Nacional, CICATA-Legaria. Calzada Legaria núm. 694, Ciudad de México, C. P. 11500, MÉXICO.
2Colegio de Postgraduados, Campus Montecillo. Carretera México-Texcoco km 38.5, Texcoco, Estado de México, C. P. 56230, MÉXICO.
3Universidad Autónoma Metropolitana-Iztapalapa, ECOCATAL. Av. San Rafael Atlixco núm. 186, col. Reyes de Reforma, Iztapalapa, C. P. 09340, MÉXICO.
Introducción:
La productividad de las prácticas agrícolas actuales depende en gran medida del uso de fertilizantes. Una limitación importante de los fertilizantes convencionales es su bajo aprovechamiento por parte de los cultivos, por lo que el desarrollo y la aplicación de nuevos tipos de fertilizantes utilizando nanotecnología son una opción potencialmente efectiva para incrementar la producción agrícola.
Objetivo:
Sintetizar y caracterizar nanopartículas de gelatina cargadas con calcio, y evaluar su comportamiento como sistemas de liberación controlada.
Metodología:
Las nanopartículas se obtuvieron mediante secado por aspersión. Las características fisicoquímicas de las partículas se analizaron mediante microscopia electrónica de barrido y espectroscopia FTIR, mientras que su comportamiento como sistemas de liberación controlada se evaluó mediante pruebas in vitro.
Resultados:
Se obtuvieron nanopartículas de gelatina cargadas con calcio, con tamaños promedio menores a 700 nm, morfología principalmente esférica y microestructura lisa. Los espectros FTIR evidenciaron la formación de interacciones electrostáticas entre la carga y la gelatina. Las pruebas in vitro permitieron suponer que la matriz biopolimérica actuó adecuadamente en la liberación controlada de iones de calcio.
Limitaciones del estudio:
Las características fisicoquímicas de los nanomateriales solo aplican para las condiciones de elaboración utilizadas.
Originalidad:
No existen reportes sobre nanomateriales biopoliméricos cargados con calcio con potencial aplicación en la agricultura.
Conclusiones:
Se obtuvieron nanopartículas de gelatina, con morfología y tamaños adecuados, que actúan como sistemas de liberación controlada de calcio.
Palabras clave nanomaterial; nanofertilizante; biopolímero; liberación controlada
Introduction:
The productivity of current agricultural practices depends largely on the use of fertilizers. A major limitation of conventional fertilizers is their low crop yields, so the development and application of new types of fertilizers using nanotechnology are potentially effective options for increasing agricultural production.
Objective:
To synthesize and characterize calcium-loaded gelatin nanoparticles, and evaluate their behavior as controlled-release systems.
Methodology:
The nanoparticles were obtained by spray drying. The physicochemical characteristics of the particles were analyzed by scanning electron microscopy and FTIR spectroscopy, while their behavior as controlled release systems was evaluated by in vitro tests.
Results:
Calcium-loaded gelatin nanoparticles with average sizes below 700 nm, mainly spherical morphology and smooth microstructure were obtained. FTIR spectra showed the formation of electrostatic interactions between the charge and the gelatin. In vitro tests allowed to assume that the biopolymer matrix acted adequately in the controlled release of calcium ions.
Limitations of the study:
The physicochemical characteristics of nanomaterials only apply to the processing conditions used.
Originality:
There are no reports on calcium-loaded biopolymer nanomaterials with potential application in agriculture.
Conclusions:
Gelatin nanoparticles, with adequate morphology and sizes, which act as controlled calcium release systems were obtained.
Keywords nanomaterial; nanofertilizer; biopolymer; controlled release
Introducción
En el contexto de la agricultura sostenible, la incorporación de nanotecnología en el diseño y fabricación de fertilizantes innovadores es una estrategia con potencial para aumentar significativamente la producción de los cultivos y fomentar el desarrollo de una agricultura rentable, para, de esta manera, alimentar a la población mundial, la cual presenta una tasa alta de crecimiento (Guo, White, Wang, & Xing, 2018).
Los avances recientes en la nanotecnología han llevado a la elaboración de nanomateriales de diferentes tamaños y formas. Estos avances son la base para sintetizar partículas con propiedades únicas y dirigidas a aplicaciones específicas; sin embargo, su uso en la agricultura, especialmente en la protección y producción de plantas, es un área poco explorada por la comunidad científica (Khot, Sankaran, Maja, Ehsani, & Schuster, 2012). No obstante, a medida que avanza el estudio de la nanotecnología, el uso potencial de materiales nanoestructurados para generar fertilizantes de liberación controlada y otras estrategias para mejorar la eficiencia en el uso de fertilizantes ha generado un gran interés en la comunidad científica, los gobiernos, la industria y el sector público (Milani, França, Balieiro, & Faez, 2017).
Lee, Heng, Ng, Chan, y Tan (2011) mencionan que la definición de nanopartícula depende de cada disciplina; algunas definen a los nano objetos como aquellos materiales que presentan una, dos o tres dimensiones en el rango de 0.1 a 100 nm. Por su parte, en los fertilizantes la definición parece estar en uso, pues existen patentes y publicaciones que han denominado “nano” a aquellos materiales que presentan propiedades diferentes a las del material a granel y que poseen una, dos o tres dimensiones inferiores a 1 000 nm (Rai, Ribeiro, Mattoso, & Duran, 2015).
De acuerdo con Liu y Lal (2015), se espera que los nanofertilizantes mejoren significativamente el crecimiento y rendimiento de los cultivos, así como la eficiencia en su uso por parte de las plantas; además, que reduzcan las pérdidas de nutrientes, los impactos ambientales adversos, la frecuencia de aplicación y el costo de la mano de obra. Lo anterior debido a que los nanofertilizantes podrían prolongar la longevidad de los nutrientes en el ambiente, lo que mantendría un suministro continuo y efectivo para los cultivos durante un período de crecimiento más largo (Guo et al., 2018).
Los polímeros son una clase de materiales blandos con numerosas y versátiles propiedades mecánicas y químicas que pueden aplicarse en la agricultura. Los suministros agrícolas inteligentes (agroquímicos y súper-absorbentes controlados o de liberación lenta) y bioabsorbentes forman un nicho en expansión que utilizan la tecnología de polímeros (Milani et al., 2017). Estudios recientes hacen referencia al uso de polímeros biodegradables y sus compuestos como materiales para la liberación controlada de agroquímicos. Milani et al. (2017) mencionan algunos polímeros que, debido a su capacidad de aplicación específica, usos, vida útil y viabilidad económica, se han estudiado en los últimos años como matrices para liberación controlada en la agricultura.
Un aspecto clave a considerar al formular nanomateriales de liberación lenta es que sus componentes deben ser biodegradables y no deben formar sustancias tóxicas al momento de su degradación (Kumar, Ashfaq, & Verma, 2018); además, los nanofertilizantes deben liberar los nutrimentos a pedido para evitar que se conviertan prematuramente en formas químicas/gaseosas que las plantas no puedan absorber. Para lograr lo anterior se debe evitar que los nutrimentos interactúen con el suelo, el agua y los microorganismos, y se debe asegurar que los nutrimentos se liberen solo cuando la planta los puede internalizar directamente (de Rosa, Monreal, Schnitzer, Walsh, & Sultan, 2010).
Considerando lo anterior, el objetivo del presente trabajo fue elaborar y caracterizar nanopartículas de gelatina cargadas con calcio, y evaluar su comportamiento como un sistema de liberación controlada.
Materiales y métodos
Sustancias químicas
En la elaboración de las nanopartículas se empleó gelatina tipo A (Sigma-Aldrich, EUA), Ca(NO3)2·4H2O (Meyer, México) y ácido cítrico (Merck, Alemania) como agente entrecruzante. En todos los experimentos y análisis se utilizó agua desionizada (18 MΩ·cm-1).
Síntesis de nanopartículas de gelatina cargadas con calcio
Para sintetizar las nanopartículas se pesaron 3.8 g de Ca(NO3)2·4H2O y se disolvieron en 300 mL de agua desionizada; de manera simultánea, se disolvieron 4.5 g de gelatina en 700 mL de agua desionizada a 80 °C. Previo a ser mezcladas entre sí, ambas soluciones se filtraron a través de membranas de PVC de 0.45 µm (Millipore, Irlanda). La solución resultante se mantuvo en agitación durante 2.5 h a 80 °C y se sonicó por 15 min en un baño ultrasónico (TI-H-5, Elma, Alemania). Posteriormente, se agregaron a la solución 1.2 g de ácido cítrico y se mantuvo en agitación por 12 h a temperatura ambiente. Finalmente, se sonicó la solución durante 15 min y se filtró con una membrana de PVC con diámetro de poro de 0.22 µm (Millipore, Irlanda).
Para generar las nanopartículas se empleó un Nano Spray Dryer B-90 (Büchi, B-90, Suiza) con una rejilla de 4 µm. La temperatura de secado fue de 100 °C a una presión de 3 500 Pa y 100 % de apertura de boquilla. Para obtener las nanopartículas sin carga de calcio (testigo), se utilizó la metodología mencionada anteriormente, pero sin la adición de nitrato de calcio en el proceso.
Microscopia electrónica de barrido
La morfología y tamaño de las partículas se estudiaron con un microscopio electrónico de barrido (JSM-6390LV, JEOL, Japón). Previo al análisis, las muestras se recubrieron con oro-paladio mediante sputtering (Desk IV, Denton Vacuum). Las micrografías se obtuvieron a una magnificación de 10 000 X con un voltaje acelerador de 20 kV. El tamaño promedio se calculó a partir de la medición de 400 partículas con el programa Scandium (Olympus, ResAlta Research Tecnologies, Golden, CO, USA, 2010).
Espectroscopia de infrarrojo con transformada de Fourier
Para evaluar las posibles interacciones entre la carga de calcio y la gelatina dentro de la nanopartícula, se realizaron determinaciones de FTIR con el equipo Cary 630 (Agilent Technologies, Santa Clara, EUA). Para los análisis se utilizó una celda de reflectancia total atenuada (ATR), un intervalo de 4 000 a 600 cm-1 y una resolución de 4 cm-1 a los 32 scans.
Cuantificación de calcio y pruebas de liberación
La cuantificación de calcio total contenido en los nanomateriales se realizó con un equipo de espectroscopia de emisión atómica de inducción por plasma acoplado (ICP-OES 725, Agilent Technologies, EUA). Previo a las determinaciones, las muestras se sometieron al procedimiento de digestión húmeda propuesto por Alcántar-González y Sandoval-Villa (1999).
La liberación de calcio a través del tiempo se determinó siguiendo la metodología propuesta por Miranda-Villagómez et al. (2019), utilizando un espectrómetro de absorción atómica (PinAAcle 900, PerkinElmer, EUA). Para la determinación se prepararon varias soluciones con 0.30 g del material encapsulado y 50 mL de agua desionizada, las cuales se mantuvieron en agitación constante durante 30, 60, 90 y 120 min, 24, 48 y 72 h. Paralelamente, se evaluó la liberación de Ca2+ por parte del Ca(NO3)2·4H2O y de las nanopartículas sin carga (testigo).
Análisis estadístico
Los datos obtenidos, de la cuantificación y liberación de calcio, se sometieron a un análisis de varianza y, posteriormente, a una prueba de comparación de medias de Fisher (P ≤ 0.05), para lo cual se empleó el programa estadístico Design Expert ver. 8.0 (Stat-Ease, Inc. MN, EUA). Los análisis se realizaron por triplicado y los resultados se presentaron como la media ± desviación estándar.
Resultados y discusión
Microscopia electrónica de barrido
El tamaño y la forma de las nanopartículas obtenidas en esta investigación son el resultado de las condiciones de síntesis y de la técnica empleada, ya que estos dos factores proveen los medios para adaptar las propiedades de los materiales a una aplicación específica (Li, Anton, Arpagaus, Belleteix, & Vandamme, 2010).
La Figura 1 muestra la morfología y la distribución de tamaño de las partículas de gelatina con y sin carga de calcio. En las Figuras 1A y 1C se observa que, independientemente de la incorporación de calcio, ambos grupos de partículas presentaron perímetros definidos, con formas mayoritariamente esféricas y superficies lisas. En cuanto al tamaño y su distribución (Figuras 1B y 1D), no se observaron cambios al incorporar iones de Ca2+, ya que los tamaños promedio de las partículas, con y sin carga, fueron de 680 y 698 nm, respectivamente.
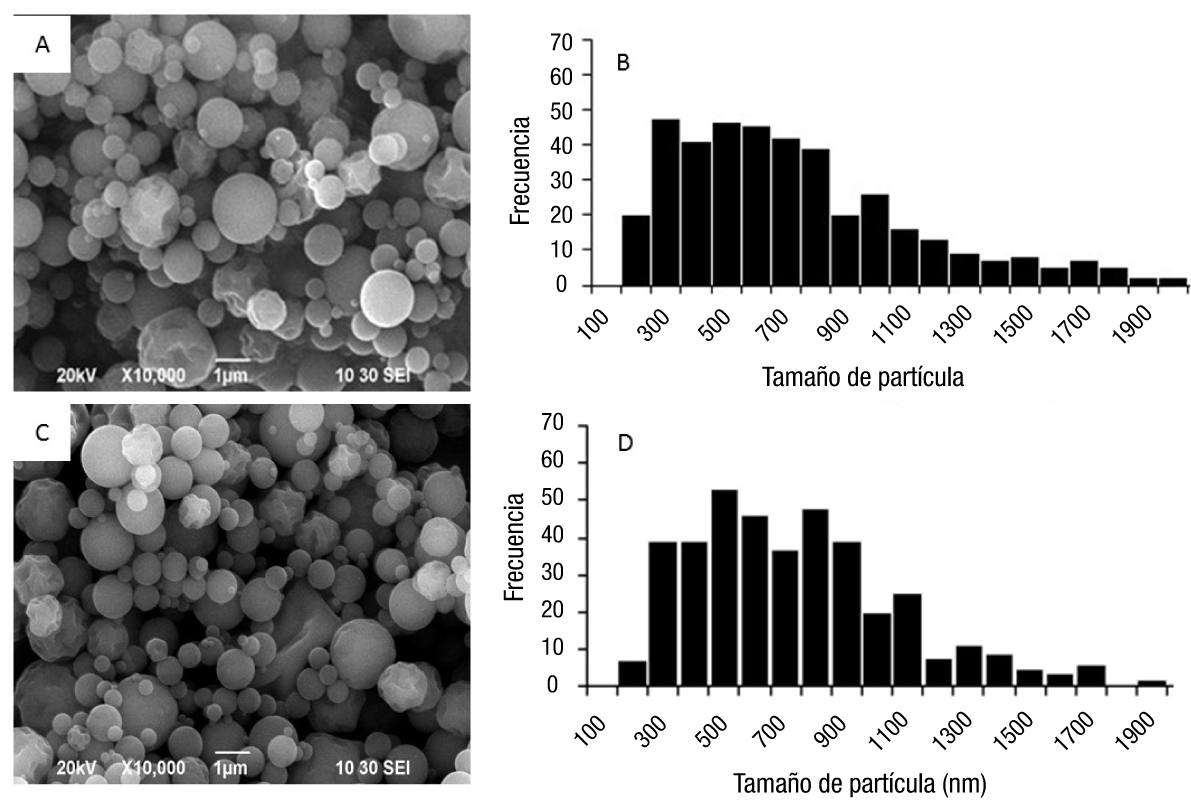
Figura 1 Morfología y distribución de tamaño de nanopartículas de gelatina con y sin carga de calcio. Micrografía de partículas con carga de calcio (A) y sin carga (C). Histograma de distribución de tamaño de partículas con carga de calcio (B) y sin carga (D).
El tamaño y morfología de las partículas se pueden atribuir a factores como la naturaleza del polímero empleado y su concentración, el diámetro del orificio de la rejilla empleada en el equipo Nano Spray Dryer B-90 (Beck-Broichsitter et al., 2012; Schafroth, Arpagaus, Jadhav, Makne, & Douroumis, 2012), la temperatura de secado, el caudal de gas o velocidad de alimentación (Richard & Benoit, 2000) y el contenido de solutos dentro de cada gota formada antes del secado (Kumar, Bhanjana, Sharma, Sidhu, & Dilbaghi, 2014). En esto último, se ha encontrado que existe una correlación estrecha entre el tamaño de la gota a pulverizar y el tamaño de partícula sólida obtenida después del secado, tal como lo reportan Schmid, Arpagaus, y Friess (2011) en trabajos realizados con albumina de suero bovino. Por su parte, Li et al. (2010) mencionan que la distribución del tamaño de partículas de cloruro de sodio, obtenidas con el mismo tipo de equipo, estuvo relacionada con la concentración de la muestra.
Espectroscopia de infrarrojo con transformada de Fourier
La Figura 2 muestra los espectros FTIR del nitrato de calcio y de las nanopartículas, con y sin carga. El espectro de las partículas sin carga (testigo) reveló bandas de absorción características de la gelatina a 1 633 cm-1 (amida I, tensión del enlace C=O) y 1 529 cm-1 (amida II, tijereteo del enlace N-H y tensión del enlace C‒N) (Lai, Chenga, Yang, & Yen, 2018). Por su parte, las bandas de absorción registradas en el intervalo de 1 300 a 1 500 cm-1 en el espectro del Ca(NO3)2·4H2O son atribuidas a tensiones asimétricas de los enlaces N‒O en los iones nitrato (Ofer-Rozovsky et al., 2019).

Figura 2 Espectros de FTIR de la fuente de calcio y de las nanopartículas de gelatina con y sin carga de calcio.
La incorporación del calcio en la gelatina conllevó a cambios identificables en el espectro FTIR del nanofertilizante. El ensanchamiento y desplazamiento de la banda a 1 310 cm-1, y la notable disminución en la intensidad de la banda a 1 415 cm-1 son visibles. Adicionalmente, se observa una disminución en la intensidad de las bandas correspondientes a las amidas I y II de la proteína. Con estos resultados se puede inferir que los iones de Ca2+ fueron adsorbidos por las moléculas de gelatina mediante la coordinación de los iones con los grupos carbonilo (C=O) de la amida.
Cuantificación de calcio y pruebas de liberación
La cuantificación de calcio por ICP arrojó que las nanopartículas cargadas contenían 60.28 g·kg-1 de calcio, valor que resulta semejante al teórico calculado (67.20 g·kg-1), y la concentración en el nitrato de calcio resultó ser la esperada (163.12 g·kg-1 de calcio). Por su parte, las partículas sin carga presentaron una concentración de 0.876 g·kg-1 de calcio, la cual se puede atribuir a la gelatina, ya que en dicho material se obtuvo una concentración 0.840 g·kg-1 de calcio.
La Figura 3 muestra las curvas de liberación de calcio de las nanopartículas, el nitrato de calcio y la gelatina, a través del tiempo. En dicha figura se puede observar que solo las partículas cargadas presentaron un incremento de 97.6 a 154.1 g·kg-1 en la concentración de calcio conforme transcurrió el tiempo. Dichos valores fueron significativamente diferentes (P < 0.05) de los obtenidos con el nitrato de calcio, a excepción de la determinación a las 72 h en donde este compuesto presentó un valor de 164.2 g·kg-1. Lo anterior permite asumir que en este punto se logró la liberación total de la carga de la matriz biopolimérica. Los otros compuestos analizados presentaron una variación pequeña en la concentración de calcio, obteniéndose valores promedio de 3.7 g·kg-1 en las partículas sin carga y de 2.9 g·kg-1 en la gelatina.
Debido al comportamiento observado de las nanopartículas cargadas con calcio, estas se pueden definir como un sistema de control de difusión, más específicamente como un sistema de nanoesfera, ya que el agente activo se encuentra distribuido uniformemente en toda la matriz polimérica y la velocidad de liberación está determinada por la carga o concentración del agente disperso, la naturaleza de los componentes y la forma de la partícula (Lshizawa y Nakamatsu, 2002). Rai et al. (2015) mencionan que la preparación de formulaciones nanométricas de insumos de nutrientes puede tener un efecto sobre la eficiencia del fertilizante, provocando un comportamiento diferente al de un fertilizante convencional. Lo anterior se puede observar en la Figura 3, donde la concentración de calcio en solución presentó un ligero aumento en la primera hora y media de agitación, para después mantenerse casi constante hasta las 48 h e incrementar nuevamente a las 72 h, lo que indica que la formulación polimérica ayudó a retardar la liberación del calcio. Lo anterior implicaría que los iones de calcio cercanos a la superficie de las partículas serán los que se desprenden primero de la matriz, dejando cavidades que se convierten en vías por las cuales el calcio del interior puede liberarse más rápidamente, lo que ocasiona un incremento del elemento en el medio.
Conclusiones
Se obtuvieron nanopartículas de gelatina cargadas con calcio, con morfología esférica, microestructura lisa y tamaños promedio menores a 700 nm, mediante secado por aspersión. Los espectros FTIR confirmaron el establecimiento de interacciones electrostáticas entre los iones Ca2+ y los grupos carbonilo del biopolímero. Los nanomateriales elaborados presentaron la característica de un sistema de liberación controlada, ya que el calcio fue liberado lentamente a través del tiempo. En general, los resultados observados son prometedores y crean una posibilidad real de que el material elaborado pueda ser utilizado como fuente de fertilizante agrícola.
Agradecimientos
San Juan Martínez agradece al CONACYT y a la COFAA-IPN por las becas otorgadas. Aguilar-Méndez agradece a la SIP-IPN por el apoyo económico otorgado para la realización de este proyecto (Clave SIP: 20181062).
REFERENCIAS
Alcántar-González, G., & Sandoval-Villa, M. (1999). Manual de análisis químico de tejido vegetal: guía de muestreo, preparación, análisis e interpretación. Chapingo, México: Sociedad Mexicana de la Ciencia del Suelo, A.C. [ Links ]
Beck-Broichsitter, M., Schweiger, C., Schmehl, T., Gessler, T., Seeger, W., & Kissel, T. (2012). Characterization of novel spray-dried polymeric particles for controlled pulmonary drug delivery. Journal of Controlled Release, 158(2), 329-335. doi: 10.1016/j.jconrel.2011.10.030 [ Links ]
De Rosa, M. C., Monreal, C., Schnitzer, M., Walsh, R., & Sultan, Y. (2010). Nanotechnology in fertilizers. Nature Nanotechnology, 5(2), 91. doi: 10.1038/nnano.2010.2 [ Links ]
Guo, H., White, J. C., Wang, Z., & Xing, B. (2018). Nano-enabled fertilizers to control the release and use efficiency of nutrients. Current Opinion in Environmental Science & Health, 6, 77-83. doi: 10.1016/j.coesh.2018.07.009 [ Links ]
Khot, L. R., Sankaran, S., Maja, J. M., Ehsani, R., & Schuster, E. W. (2012). Applications of nanomaterials in agricultural production and crop protection: A review. Crop Protection, 35, 64-70. doi: 10.1016/j.cropro.2012.01.007 [ Links ]
Kumar, R., Ashfaq, M., & Verma, N. (2018). Synthesis of novel PVA-starch formulation-supported Cu-Zn nanoparticle carrying carbon nanofibers as a nanofertilizer: controlled release of micronutrients. Journal of Materials Science, 53(10), 7150-7164. doi: 10.1007/s10853-018-2107-9 [ Links ]
Kumar, S., Bhanjana, G., Sharma, A., Sidhu, M. C., & Dilbaghi, N. (2014). Synthesis, characterization and on field evaluation of pesticide loaded sodium alginate nanoparticles. Carbohydrate Polymers, 101, 1061-1067. doi: 10.1016/j.carbpol.2013.10.025 [ Links ]
Lai, Y. L., Chenga, P. Y., Yang, C. C., & Yen, S. K. (2018). Electrolytic deposition of hydroxyapatite/calcium phosphate-heparin/gelatin-heparin tri-layer composites on NiTi alloy to enhance drug loading and prolong releasing for biomedical applications. Thin Solid Films, 649, 192-201. doi: 10.1016/j.tsf.2018.01.051 [ Links ]
Lee, S. H., Heng, D., Ng, W. K., Chan, H. K., & Tan, R. B. (2011). Nano spray drying: A novel method for preparing protein nanoparticles for protein therapy. International Journal of Pharmaceutics, 403(1-2), 192-200. doi: 10.1016/j.ijpharm.2010.10.012 [ Links ]
Li, X., Anton, N., Arpagaus, C., Belleteix, F., & Vandamme, T. F. (2010). Nanoparticles by spray drying using innovative new technology: The Büchi Nano Spray Dryer B-90. Journal of Controlled Release , 147(2), 304-310. doi: 10.1016/j.jconrel.2010.07.113 [ Links ]
Liu, R., & Lal, R. (2015). Potentials of engineered nanoparticles as fertilizers for increasing agronomic productions. Science of the Total Environment, 514C, 131-139. doi: 10.1016/j.scitotenv.2015.01.104 [ Links ]
Lshizawa, C., & Nakamatsu, J. (2002). Matrices poliméricas para liberación controlada de sustancias activas. Revista de Química PUCP, 16(1-2), 13-23. Retrieved from http://revistas.pucp.edu.pe/index.php/quimica/article/view/18649/18902 [ Links ]
Milani, P., França, D., Balieiro, A. G., & Faez, R. (2017). Polymers and its applications in agriculture. Polímeros, 27(3), 256-266. doi: 10.1590/0104-1428.09316 [ Links ]
Miranda-Villagómez, E., Aguilar-Méndez, M. Á., Gómez-Merino, F. C., Ronquillo-de Jesús, E., Sandoval-Villa, M., Sánchez-García, P., & Trejo-Téllez, L. I. (2019). Synthesis of biopolymeric particles loaded with phosphorus and potassium: characterisation and release tests. IET Nanobiotechnol, 13(5), 493-497. doi: 10.1049/iet-nbt.2018.5035 [ Links ]
Ofer-Rozovsky, E., Haddad, M. A., Bar-Nes, G., Borojovich, E. J., Binyamini, A., Nikolski, A., & Katz, A. (2019). Cesium immobilization in nitrate-bearing metakaolin-based geopolymers. Journal of Nuclear Materials, 514, 247-254. doi: 10.1016/j.jnucmat.2018.11.003 [ Links ]
Rai, M., Ribeiro, C., Mattoso, L., & Duran, N. (2015). Nanotechnologies in Food and Agriculture. Switzerland: Springer, Cham. [ Links ]
Richard, J., & Benoit, J. P. (2000). Microencapsulation. Francia: Techniques de l’ingénieur Génie Procédés. [ Links ]
Schafroth, N., Arpagaus, C., Jadhav, U. Y., Makne, S., & Douroumis, D. (2012). Nano and microparticle engineering of water insoluble drugs using a novel spray-drying process. Colloids and surfaces B: Biointerfaces, 90(1), 8-15. doi: 10.1016/j.colsurfb.2011.09.038 [ Links ]
Schmid, K., Arpagaus, C., & Friess, W. (2011). Evaluation of the Nano Spray Dryer B-90 for pharmaceutical applications. Pharmaceutical Development and Technology, 16(4), 287-94. doi: 10.3109/10837450.2010.485320 [ Links ]
Recibido: 23 de Agosto de 2019; Aprobado: 20 de Diciembre de 2019











 text in
text in 



