Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista Chapingo serie ciencias forestales y del ambiente
On-line version ISSN 2007-4018Print version ISSN 2007-3828
Rev. Chapingo ser. cienc. for. ambient vol.28 n.3 Chapingo Sep./Dec. 2022 Epub Mar 08, 2024
https://doi.org/10.5154/r.rchscfa.2021.10.060
Artículo científico
Perfil cromatográfico diferencial de triglicéridos en semillas de calabazas (Cucurbita spp.) silvestres y domesticadas
1Universidad de Guadalajara, Centro Universitario de Ciencias Biológicas y Agropecuarias, Departamento de Ecología. Camino Ramón Padilla Sánchez, 2100. C. P. 45200. Nextipac, Zapopan, Jalisco, México.
2Universidad de Guadalajara, Centro Universitario de Ciencias Biológicas y Agropecuarias, Departamento de Botánica y Zoología. Camino Ramón Padilla Sánchez, 2100. C. P. 45200. Nextipac, Zapopan, Jalisco, México.
3Centro de Investigación y de Estudios Avanzados-Instituto Politécnico Nacional (CINVESTAV-IPN), Unidad Irapuato, Departamento de Biotecnología y Bioquímica. km 9.6 Libramiento Norte, Carretera Irapuato-León. C. P. 36824. Irapuato, Guanajuato, México.
Introducción:
Los triglicéridos (TG) representan 98 % de la composición de los aceites vegetales. La evaluación de TG en extractos de semillas de calabazas es importante para detectar efectos ocasionados por la domesticación.
Objetivo:
Comparar el perfil de triglicéridos de calabazas silvestres vs. domesticadas mediante el sistema HPTLC en fase reversa.
Materiales y métodos:
Se recolectaron semillas de calabazas silvestres (Cucurbita foetidissima Kunth y C. radicans Naudin) en estado maduro en tres sitios del Altiplano Mexicano y se adquirieron semillas de calabazas domesticadas (C. pepo L., C. moschata Duchesne, C. argyrosperma K. Koch) y de girasol (Helianthus annuus L.). Las semillas trituradas se sometieron a extracción en equipo Soxhlet con hexano, para obtener los lípidos. Del extracto de lípidos neutros, los TG se separaron en placas de vidrio de 20 x 10 HPTLC Gel de Sílice 60. Se utilizaron TG insaturados como referencia. Las bandas se analizaron con el software de uso libre GelAnalyzer.
Resultados y discusión:
El perfil de TG del extracto de las semillas de calabazas, tanto silvestres como domesticadas, guarda similitud entre sus bandas más abundantes. En ambas muestras predomina el TG 18:2/18:2/18:2. En las calabazas silvestres destacan bandas de TG 18:3/18:3/18:3. Las calabazas domesticadas presentan TG con insaturaciones en la cadena de carbono en menor proporción que las especies silvestres, lo que les confiere a estas un valor nutricional mayor.
Conclusiones:
Las semillas de calabazas silvestres muestran un perfil característico de TG insaturados. El perfil cromatográfico y el análisis de imágenes con GelAnalyzer permitieron la diferenciación de las muestras con base en las bandas obtenidas.
Palabras clave: Cucurbita foetidissima; Cucurbita radicans; triglicéridos insaturados; cromatografía en capa fina; GelAnalyzer
Introduction:
Triglycerides (TG) represent 98 % of the vegetable oils composition. The evaluation of TG in pumpkin seed extracts is valuable to perceive effects caused by domestication.
Objective:
To compare the triglyceride profile of wild versus domesticated pumpkins by reversed-phase HPTLC.
Materials and methods:
Wild pumpkins (Cucurbita foetidissima Kunth and C. radicans Naudin) seeds were collected at mature stage at three sites of the Mexican Plateau and seeds of domesticated pumpkins (C. pepo L., C. moschata Duchesne, C. argyrosperma K. Koch) and sunflower (Helianthus annuus L.) were acquired. Ground seeds were Soxhlet extracted with hexane to obtain the lipids. From the neutral lipid extract, TG were separated on 20 x 10 HPTLC Silica Gel 60 glass plates. Unsaturated TG were used as reference. The bands, in different tracks, were analyzed with the free-to-use GelAnalyzer software.
Results and discussion:
The TG profile of both wild and domesticated pumpkin seed extract shows similarity among their most abundant bands. In both samples, TG 18:2/18:2/18:2 predominates. In wild pumpkins, TG 18:3/18:3/18:3 bands stand out. Domesticated pumpkins have lower TG with higher unsaturation chain, than wild species, which gives them a greater nutritional value.
Conclusions:
Wild pumpkin seeds show a characteristic profile of unsaturated TG. Chromatographic profiling and image analysis with GelAnalyzer led to the sample’s differentiation based on the bands found.
Keywords: Cucurbita foetidissima; Cucurbita radicans; unsaturated triglycerides; thin layer chromatography; GelAnalyzer
Ideas destacadas:
Semillas analizadas: C. foetidissima, C. radicans (silvestres), C. moschata, C. argyrosperma y C. pepo.
El tiglicérido (TG) 18:2/18:2/18:2 predomina en las semillas silvestres y domesticadas.
En las calabazas silvestres destacan bandas de TG 18:3/18:3/18:3.
HPTLC en fase reversa es una alternativa adecuada para obtener perfiles de triglicéridos.
Introducción
Las calabazas pertenecen al género Cucurbita (Cucurbitaceae) que incluye 21 taxones (Barrera et al., 2021) con alrededor de 15 especies (Lira et al., 2016). En México, se encuentran 11 especies silvestres y domesticadas (Ríos, González-Santos, Cadena-Iñiguez, & Mera-Ovando 2018). Entre las especies silvestres se encuentran la calabaza hedionda (Cucurbita foetidissima Kunth) y calabacilla (C. radicans Naudin). Las principales especies domesticadas en México son C. pepo L., C. moschata Duchesne, C. argyrosperma K. Koch y C. ficifolia Bouché. El consumo de semillas de calabazas domesticadas ha merecido interés por ser una fuente nutricional de proteínas (31 a 51 %), lípidos (30 a 51 %), carbohidratos (6 a 37 %), además de esteroles, tocoferoles y minerales (Adepoju & Adebanjo, 2011; Bardaa et al., 2016), lo que resulta en algunas aplicaciones curativas y nutracéuticas.
La mayoría de los estudios de lípidos en semillas, incluyendo las de calabazas, se han enfocado en establecer la composición de ácidos grasos empleando el método de conversión a ésteres de metilo (FAME) por transesterificación o iniciando por saponificación hasta la identificación mediante cromatografía de gases (Bouazzaoui & Mulengi, 2018; Rezig, Chouaibi, Msaada, & Hamdi, 2012). A pesar de ser métodos adecuados de aplicación comercial rutinaria, no muestran información sobre la composición de los triglicéridos (TG) presentes (Eder, 1995). La información de la composición de TG es, por el momento, utilizada para la caracterización de aceites en farmacopeas y es de interés en el estudio de la biosíntesis de estos compuestos. La metodología de caracterización se usa básicamente en estudios de laboratorio; sin embargo, la visualización en forma expedita y económica por HPTLC en fase reversa permite una separación rápida y diferenciación de TG en semillas silvestres y domesticadas.
Los (TG) representan una forma eficiente de almacenamiento de energía que estará disponible al momento de la germinación y desarrollo de la nueva planta, ya que contienen compuestos de alta energía y de fácil degradación. Los ácidos grasos que los conforman pueden presentar varias longitudes de cadena, en general de C12 a C22, insaturaciones y localización de dobles enlaces, todo esto en consecuencia de su mecanismo de biosíntesis. El estudio de los TG merece atención debido a que representan entre 95 a 98 % de la composición de los aceites vegetales (Contreras et al., 2017). Cada aceite tiene un perfil característico de TG y las propiedades físicas y químicas están establecidas en principio por la presencia de diversas especies moleculares de TG (Ruiz, González, & Cuadros, 2015) que tienen efectos fisiológicos importantes como componentes de la dieta humana (Cherif et al., 2014). Por tanto, existe una búsqueda continua de fuentes de los TG, en especial los que presentan constituyentes ricos en ácidos grasos insaturados o polinsaturados (Zeb, 2012), ya que poseen actividad biológica específica e incrementan las propiedades benéficas de los aceites (Gao et al., 2017).
A la fecha se ha establecido el perfil de los TG de especies de calabazas silvestres (Ali et al., 2017; Azimova, Glushenkova, & Vinogradova, 2011; Neđeral et al., 2012; Zeb & Ahmad, 2017), aunque no existe una comparación de la composición de TG en semillas de calabazas domesticadas vs. silvestres. Algunos de los métodos para el estudio del perfil de los TG en calabazas comprenden el uso de placas de gel de sílice impregnadas con nitrato de plata y la evaluación posterior de ésteres de metilo de ácidos grasos resultado de su hidrólisis por cromatografía de gases/espectrometría de masas (GC/MS) (Yoshida et al., 2004); el número de equivalente de carbono (ECN42), el método cromatográfico del Consejo Oleícola Internacional (IOC) (Bardaa et al., 2016); la cromatografía líquida de alta eficiencia (HPLC) en sus modalidades (Ali et al., 2017; Zeb & Ahmad, 2017); así como matrix asistida por láser de desorción - ionización tiempo de vuelo (MALDI-TOF-MS) (Beneito et al., 2020). Hay varios mecanismos para aislamiento y detección de los TG, pero son muy laboriosos; por tanto, no son adecuados para labores de rutina (Cossignani, Pollini, & Blasi, 2019). Estos métodos tienen baja selectividad para los TG que difieren solo en la longitud o posición de la cadena acilo (Cherif et al., 2014) y presentan separación pobre o baja resolución (Gao et al., 2017).
La cromatografía en capa fina de alta resolución (High Performance Thin Layer Chromatography, HPTLC), en su modalidad de fase reversa, puede proporcionar información de los triglicéridos, lípidos polares, esteroles, aceites esenciales y múltiples estructuras orgánicas. En la actualidad, a nivel comercial, esta técnica se utiliza para la evaluación de la calidad de aceites y otros componentes; además, puede detectar la presencia de adulterantes (Cañigueral, Frommenwiler, Reich, & Vila, 2018; Pagliuca et al., 2018). Por esta razón, el empleo de HPTLC ha sido adoptado por las principales farmacopeas del mundo para el análisis y control de calidad de preparaciones herbolarias (Cañigueral et al., 2018). Esta técnica permite la visualización, cuantificación y análisis de los TG y se fundamenta en la separación de los componentes de una muestra de acuerdo con su afinidad diferencial a una fase estacionaria con residuos lipofílicos y el uso de una fase móvil de alta polaridad. La instrumentación de esta técnica permite una aplicación fácil de las muestras en volumen reducido utilizando desde 0.1 µL de la muestra en solución. La obtención de bandas de buena resolución ayuda a la interpretación de valores de factor de retardo (Rf) y perfil fitoquímico de los compuestos en un sistema cromatográfico comparativo (Naik & Sellappan, 2020).
En este trabajo se compararon los TG de aceites extraídos de semillas de calabazas de especies silvestres y domesticadas, mediante el empleo del sistema HPTLC en fase reversa y haciendo uso de un software libre empleado comúnmente para el análisis de proteínas. Este programa permite la comparación de múltiples muestras del desplazamiento de moléculas en forma de bandas de manera fácil, rápida y con resultados similares a los obtenidos con sistemas comerciales de software para cromatografía en capa fina (TLC) de alto precio. El estudio permitirá visualizar características de importancia taxonómica, además de contribuir con la generación del primer perfil de TG de las semillas de calabazas silvestres, a partir de los cuales se puede identificar su uso potencial como recursos naturales silvestres no maderables (Cañigueral et al., 2018) y dar las bases para analizar la razón de tales diferencias.
Materiales y métodos
Los frutos maduros de dos especies del género Cucurbita se recolectaron en octubre del 2019 en tres sitios: Cucurbita foetidissima Kunth en la localidad de Vaquerías, municipio de Ojuelos, Jalisco (21° 47' 28.39" N, 101° 36' 7.03" O, 2 223 m) y Cucurbita radicans Naudin en San José de Gracia, Jalisco (20° 41' 8.16" N y 102° 34' 11.42” O, 1 947 m) y Cañada de Caracheo, Guanajuato (20° 19' 8.78" N y 100° 57' 2.19" O, 1 772 m). La identificación preliminar de las especies silvestres se hizo mediante la revisión de ejemplares en los herbarios de la UNAM (MEXU), Instituto de Ecología (IE-Bajío), Querétaro (QMEX) y de la Universidad de Guadalajara (IBUG). También se consultó el portal de datos SEINet, así como las floras respectivas y material bibliográfico especializado (Lira, 2001). Los ejemplares de referencia se depositaron en el Herbario Luz María Villareal de Puga (IBUG)-CUCBA de la Universidad de Guadalajara.
Referente a las especies domesticadas, C. moschata (calabaza de Castilla o calabaza dulce, Hortaflor, semillas certificadas) se adquirió en Irapuato, Guanajuato, y C. moschata (calabaza tapatía), C. argyrosperma (calabaza tapona) y C. pepo (calabaza india) se adquirieron en el mercado local de la ciudad de Guadalajara. También se utilizaron semillas de girasol (Helianthus annuus L.) del mercado local de la ciudad de Guadalajara, Jalisco.
Los frutos de calabaza se abrieron por la mitad para separar las semillas y el contenido de pulpa fibrosa. La testa de las semillas domesticadas se retiró para trabajar solo con el eje embrionario y cotiledones. El proceso se llevó a cabo en el Laboratorio de Fitobioquímica del CINVESTAV-IPN, Unidad Irapuato.
Extracción de compuestos lipídicos
Se pesaron aproximadamente 6 g de muestras de semillas de cada sitio de colecta, de las calabazas domesticadas y girasol en una balanza analítica Adventurer™ de OHAUS. Se utilizó un extractor Soxhlet de seis plazas (Extraction Unit E-816 SOX-Extraction Solutions, Suiza); en cada uno de los recipientes se colocó una muestra de semillas contenidas en cartuchos de papel filtro de 10 x 10 cm. Para el proceso de extracción se emplearon 100 mL de hexanos (Hexanos 4020-Karal, S. A. de C. V.) como solvente. La fase de extracción fue de 10 ciclos a 70 °C, una fase de lavado de 15 min y secado de 30 min. El tiempo de evaporación-condensación fue 1 hora 15 min. El exceso de solvente se retiró del extracto contenido en el recipiente de la fracción de hexanos por evaporación rotatoria. El contenido total de los lípidos se estimó con relación a la densidad del aceite de girasol (0.920 g∙mL-1). Finalmente, cada extracto se disolvió en cloroformo: metanol (1:1) ajustando a una concentración de 1 mg∙mL-1 y así se conservó en refrigeración para su análisis subsecuente.
Cromatografía en capa fina de alta resolución (HPTLC) en fase reversa
Se empleó el método descrito por la Sociedad de la HPTLC, modificado por la Farmacopea Europea 7.0 sección 2.3.2 (European Pharmacopoeia Commission, 2011). Se disolvieron 20 mg de cada muestra del extracto lipídico en 3 mL de diclorometano. Como referencia se utilizaron triglicéridos adquiridos en Sigma-Aldrich: TG 18:3/18:3/18:3, TG 20:1/20:1/20:1, TG 22:1/22:1/22:1 y una mezcla de TG 16:1/16:1/16:1 + TG 18:2/18:2/18:2.
Las muestras y las referencias se pusieron en insertos colocados en un portaviales del muestreador automático TLC 4 (ATS 4, CAMAG®, Suiza) para su aplicación. Se utilizaron placas de HPTLC de vidrio (20 x 10 cm) cubiertas con gel de sílice 60 (RP-18 F254, MS-grade, Merck, Darmstadt, Alemania). Las condiciones de aplicación mediante microaspersión fueron las siguientes: 2 µL por banda con ancho de 8 mm y separación de 4 mm entre cada una de las 13 pistas, a una distancia de 12 mm de la parte inferior de la placa. Una vez aplicadas las muestras, la placa se transfirió, para su desarrollo, a una cámara de fondo plano (CAMAG®, Suiza) saturada previamente con una mezcla de solventes (diclorometano: ácido acético: acetona; 20:40:50 v/v/v). Para el desarrollo, el solvente ascendió por capilaridad en la placa, alcanzando una distancia de 8 cm arriba de la línea de aplicación de las muestras. La cámara se mantuvo en cuarto frío a 4 °C desde antes de su desarrollo total. La placa desarrollada se retiró de la cámara y se liberó del solvente por calentamiento a 100 °C por 1 min en una placa calefactora digital de CAMAG®, después se llevó a temperatura ambiente. Para la visualización se requirió de derivatización por inmersión en una solución de ácido fosfomolíbdico disuelto al 20 % en etanol y se retiró de inmediato. Posteriormente, la placa se calentó por 3 min a 120 °C. El reactivo ácido fosfomolíbdico produce zonas intensas de color negro azulado y uniformes en presencia de TG con insaturaciones o dobles ligaduras. Esto permite el registro fotográfico digital con el equipo Visualizer de CAMAG®, iluminando con luz blanca. Las bandas se analizan con el software VisionCats (CAMAG®, Suiza), que es parte del Sistema de HPTLC de CAMAG, el cual permite el procesamiento cualitativo, obtención de los valores de Rf de cada una de las bandas y la elaboración de densitogramas; sin embargo, en el presente estudio se utilizó el software GelAnalyzer como una alternativa recomendable para el análisis de imágenes de placas de HPTLC.
Análisis de la placa con GelAnalyzer
Las imágenes de las placas desarrolladas y reveladas se analizaron con el software de uso libre GelAnalyzer 19.1 (Lazar Jr., & Lazar, 2019). Este facilitó la detección de las bandas de corrimiento de los componentes y su intensidad en cada pista, así como la asignación preliminar a partir de la comparación de los TG de referencia. El programa también permitió la corrección de imperfecciones equivalentes a la corrida electroforética a través del ajuste del origen de aplicación y el frente de solvente para obtener los valores Rf. La imagen se importó al programa en la opción oscuro sobre fondo iluminado, se giró de abajo hacia arriba y de izquierda a derecha y se delimitó la región a analizar. Se usó la opción de selección de un área para que el programa detectara los carriles de manera automática. También se puede adicionar uno a uno cada carril de manera manual. Los intervalos de las bandas en las pistas se ubican en función del incremento de los valores de las bandas con Rf entre el sitio de aplicación de la muestra (valor 0.0) y el frente del solvente al final del desarrollo (valor 1.0). Posteriormente, en el modo de calibración de las bandas en función lineal se consideró el principal TG de referencia (18:2/18:2/18:2) en la mayoría de los extractos de semillas de calabazas (Zeb & Ahmad, 2017). La línea base de todas las pistas se definió para mostrarlas en forma de un cromatograma. Finalmente, los valores de Rf, al igual que las áreas bajo la curva, se obtuvieron para cada banda.
Resultados y discusión
La Figura 1 muestra la placa cromatográfica de HPTLC en fase reversa desarrollada con 13 carriles. Los carriles 2 al 10 corresponden a TG en extractos de semillas de calabazas domesticadas y calabazas silvestres. Los carriles 1, 11, 12 y 13 indican las bandas de los TG de referencia. La coloración azul oscura que adquiere cada banda está relacionada con la abundancia de determinados TG; esto ocurre gracias a la aplicación del reactivo derivatizante que mejora la visualización de las diferencias entre muestras. Como resultado se detectó un patrón de similitud y diferenciación particular entre las muestras de semillas de calabazas.
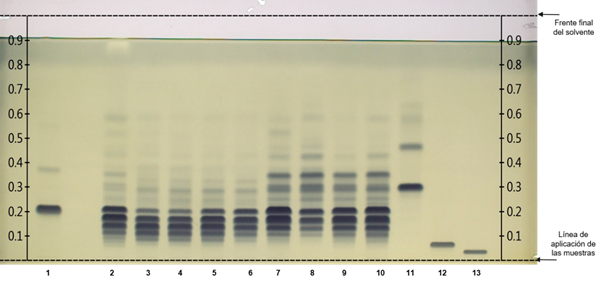
Figura 1 Separación de los triglicéridos (TG) por carriles: 1 = referencia (16:1/16:1/16:1 + 18:2/18:2/18:2); 2 = aceite de girasol; 3 a 6 = semillas de calabazas domesticadas (Cucurbita moschata [calabaza tapatía], C. argyrosperma, C. pepo, C. moschata [calabaza de Castilla]); 7 a 10 = semillas de calabazas silvestres (C. foetidissima, C. foetidissima, C. radicans [Cañada de Caracheo], C. radicans [San José de Gracia]); 11 a 13 = referencias (18:3/18:3/18:3, 20:1/20:1/20:1, 22:1/22:1/22:1). El disolvente de desarrollo fue diclorometano: ácido acético: acetona (20:40:50 v/v/v), como derivatizante se utilizó el reactivo ácido fosfomolíbdico e iluminación con luz blanca.
La Figura 2 ilustra el perfil cromatográfico de integración ubicado a la derecha de las pistas 1 y 11 de dos estándares de TG, así como de las pistas 3 y 8 correspondientes a muestras de extractos lipídicos de calabaza C. moschata y C. foetidissima, domesticada y silvestre, respectivamente. El perfil también incluye los puntos máximos que se utilizan como valores de Rf, los cuales pueden ser comparados entre las muestras. La intensidad en cada banda se puede tomar tentativamente como la abundancia cuantitativa relativa de los componentes de cada muestra.
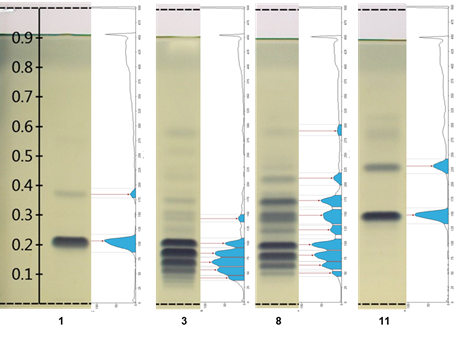
Figura 2 Cromatogramas vs. perfil cromatográfico de las principales diferencias obtenidas con el software Gel Analyzer. Carril 1 = TG 16:1/16:1/16:1 + TG 18:2/18:2/18:2; carril 3 = Cucurbita moschata (calabaza tapatía); carril 8 =Cucurbita foetidissima (silvestre); carril 11 = TG 18:3/18:3/18:3.
Por otra parte, en la Figura 3 se compara todo el perfil cromatográfico de la placa, donde se aprecian las diferencias respecto a los puntos máximos expresados como Rf de cada banda, así como el área que cada banda ocupa entre las muestras. La obtención de estos perfiles con sus respectivos valores de Rf y áreas bajo la curva aportan información que puede ser útil en realizar evaluaciones cuantitativas para una mejor comprensión de los resultados.

Figura 3 Perfil cromatográfico HPTLC en fase reversa para la identificación de extractos lipídicos de semillas de calabazas domesticadas (carriles 3 a 6: Cucurbita moschata [calabaza tapatía], C. argyrosperma, C. pepo, C. moschata [calbaza de Castilla]) y silvestres (carriles 7 a 10: C. foetidissima, C. foetidissima, C. radicans [Cañada de Caracheo], C. radicans [San José de Gracia]), así como de aceite de girasol (carril 2) y triglicéridos de referencia (carriles: 1 = 16:1/16:1/16:1 + 18:2/18:2/18:2; 11 = 18:3/18:3/18:3; 12 = 20:1/20:1/20:1; 13 = 22:1/22:1/22:1).
Báez-Pérez, Quiñones-Galvéz, Santiesteban-Toca, y Molina-Torres (2017) revisaron métodos para el análisis densitométrico de imágenes coloridas de cromatografía planar, incluyendo el software GelAnalyzer. Este, además de estar disponible de forma gratuita, permite un análisis rápido, económico y recomendable para placas de HPTLC con base en la intensidad del color de las bandas, y la obtención de valores máximos de Rf que pueden ser comparados entre las muestras. El empleo de este sistema de análisis de imágenes permite ahorrar costos, ya que, en las grandes compañías de alimentos y fármacos, generalmente, se invierte en la adquisición de equipos más sofisticados.
De acuerdo con el análisis, los puntos máximos o valores de Rf de los TG de referencia fueron los siguientes: carril 1: TG (16:1/16:1/16:1) Rf = 0.38 + TG (18:2/18:2/18:2) Rf = 0.22; carril 11: TG (18:3/18:3/18:3) Rf = 0.31; carril 12: TG (20:1/20:1/20:1) Rf = 0.07; carril 13: TG (22:1/22:1/22:1) Rf = 0.04.
Al comparar los extractos lipídicos de semillas de calabazas silvestres y domesticadas, extracto de girasol y TG de referencia, se puede visualizar que el componente en Rf = 0.22 que corresponde al TG 18:2/18:2/18:2 de referencia (Figura 1, carril 1) también está presente en todas las muestras analizadas. Los TG de las semillas de C. pepo y C. moschata, carriles 5 y 6, confirman lo indicado en reportes previos de calabazas domesticadas, predominando los estudios en C. pepo (Arslan, Gönül, & Yilmaz, 2017; Benalia et al., 2015; Li et al., 2020; Neđeral et al., 2012). La presencia de TG 18:2/18:2/18:2 Rf = 0.22 también es un componente importante en extractos lipídicos de semillas de calabazas silvestres (carriles 7 a 10). Asimismo, dicho TG destaca en las semillas de girasol como lo señalaron Jakab, Heberger, y Forgacs (2002), quienes mencionan que el aceite de las semillas de las calabazas domesticadas tiene características similares al aceite de girasol, aunque no especificaron las especies estudiadas. Salas, Bootello, y Garcés (2015) también indican que el TG 18:2/18:2/18:2 es uno de los más abundantes en el aceite de girasol regular. Hernández et al. (2020) establecen que C. foetidissima presenta una composición de 55.93 % de ácido graso C18:2 y 12.65 % de ácido graso C18:1 en los triglicéridos de sus semillas.
Para C. radicans, este constituye el primer reporte sobre los TG en sus semillas. Esta especie presenta un perfil de TG similar al de C. foetidissima; en dichas muestras también se pueden encontrar los TG 18:2/18:2/18:2 y 18:3/18:3/18:3, entre otros con bandas con valores Rf superiores a 0.31 (correspondiente a TG 18:3/18:3/18:3). Este último presentó una banda adicional con Rf = 0.47; sin embargo, al tratarse de un estándar puro se evidenció degradación tras su tiempo de almacenamiento, lo cual es una característica de los TG insaturados. Se pudo constatar nuevamente que las muestras de calabazas domesticadas presentan TG con insaturaciones en la cadena de carbono en menor proporción a diferencia de las especies silvestres. Una de las diferencias entre las dos especies silvestres es que C. foetidissima presentó valores de Rf más altos (Figura 3; Rf = 0.53 en el carril 7 y Rf = 0.59 en el carril 8) que C. radicans, lo que denota la presencia de más insaturaciones en los TG de C. foetidissima. Por lo anterior se requieren más repeticiones y una evaluación estadística apropiada utilizando los valores de integración del software GelAnalyzer, como se ejemplifica en la Figura 3, lo que implicaría llevar a cabo más estudios para establecer una diferencia estadísticamente significativa entre el perfil de TG de dichas especies.
El TG de referencia 18:3/18:3/18:3 que sobresale en las muestras de calabazas silvestres (Figuras 2 y 3, carril 11) también ha sido identificado en Cucurbita maxima L. (Akintayo, Akintayo, Akinsola, & Ziegler, 2009), pero en otras especies domesticadas no se ha reportado la presencia (Montesano, Blasi, Simonetti, Santini, & Cossignani, 2018; Neđeral et al., 2012).
Como se mencionó, existen algunas bandas que sobresalen por su importancia, ya que pueden ayudar en la discriminación entre tipos de muestras o destacar la composición de los TG con características similares a los aceites comerciales; por ejemplo: C. foetidissima (carril 8) presentó un valor de Rf = 0.59 que también aparece en la muestra de girasol. El valor de Rf = 0.09 está presente en todas las muestras de calabazas domesticadas, pero ausente en las muestras silvestres; la banda correspondiente a dicho valor puede servir como referencia para diferenciar hasta en especies de calabazas domesticadas. Estas presentan bandas alrededor de Rf = 0.12, que es de menor presencia en las silvestres. Dichas bandas deben ser caracterizadas en trabajos subsecuentes. Adewuyi y Oderinde (2012) y Fedko et al. (2020) resaltan que el estudio de los lípidos de semillas ha mostrado que la composición varía según la especie, incluso en variedades de calabazas, lo que conlleva a la obtención de aceites con propiedades diferentes.
El TG de referencia 16:1/16:1/16:1 (Figura 3, carril 1) tuvo un valor Rf = 0.38, presente en las bandas superiores de calabazas silvestres, aunque es una banda ligera en las muestras silvestres está ausente en las domesticadas. Por otra parte, tanto el TG 20:1/20:1/20:1 Rf = 0.07 como el TG 22:1/22:1/22:1 Rf = 0.04 no están presentes en las calabazas, las cuales tienen prevalencia de TG de cadena C16 y C18 con insaturaciones. Es importante destacar que la presencia de TG con insaturaciones en las muestras de calabazas silvestres es deseable en términos de nutrición y podrían ser considerados un sustituto de los aceites altamente polinsaturados como el aceite de soya en las dietas (Nehdi, 2011).
En este estudio, por el uso de ácido fosfomolíbdico que es un derivatizante específico para revelar la presencia de doble ligaduras, únicamente se observaron TG con insaturaciones, pero no los saturados. No obstante, en las semillas analizadas pueden existir TG con tales características como lo mencionan Benalia et al. (2015), quienes establecen que los TG 12:0/12:0/12:0 y TG 14:0/14:0/14:0 están presentes en C. pepo. Estos pueden ser usados como referentes para diferenciar los aceites procedentes de esta especie, por lo que es recomendable emplear otro método de detección y dichos referentes para confirmar bandas discriminantes, que no es la finalidad de este estudio.
En general, esta investigación constituye el primer estudio del perfil comparativo de TG insaturados de calabazas domesticadas (C. moschata, C. argyrosperma y C. pepo) vs. silvestres (C. foetidissima y C. radicans) empleando HPTLC en fase reversa y análisis de las imágenes con GelAnalyzer de manera rápida y fácil. Con este programa se obtuvieron resultados similares que cuando se emplea VisionCats. Como se pudo evidenciar, existen más bandas de TG con insaturaciones en las muestras silvestres respecto a las domesticadas, coincidiendo con lo que plantean Facciotti y Knauf (1998), quienes destacan mayor diversidad en las composiciones de aceite en especies silvestres que en cultivos domesticados.
Se recomienda la evaluación de las intensidades de las bandas y análisis de identificación de TG empleando técnicas como GC-MS para más información de estos resultados. La Farmacopea Europea también ha considerado las intensidades de las bandas como un criterio de discriminación. Adicionalmente se destaca el uso de solvente de hexanos para una extracción adecuada de triglicéridos. Por otra parte, es recomendable hacer análisis con muestras frescas de semillas maduras para evitar la degradación de los TG que contienen principalmente ácidos grasos insaturados.
Para especies diferentes al género Cucurbita se han hecho comparaciones de TG entre especies domesticadas y silvestres; por ejemplo, Kamal-Eldin, Yousif, y Appelqvist (1992) mencionan que, en semillas de Sesamo spp., existe similitud en la composición de ácidos grasos para ambos tipos de extractos, aunque también se observan diferencias como el incremento de TG de doble insaturación en las especies silvestres respecto a una variedad de línea pura de Sesamum indicum L.
Conclusiones
El triglicérido 18:2/18:2/18:2 predomina en los extractos lipídicos de las semillas de las calabazas independiente del origen de la planta, ya sea silvestre o domesticada. Existe diferencia en los triglicéridos insaturados que están ausentes en las calabazas domesticadas, lo que les confiere un valor nutricional mayor a las semillas silvestres. El HPTLC es una herramienta adecuada para la obtención de huellas cromatográficas de extractos lipídicos que permite la diferenciación del contenido y composición lipídica de especies vegetales. Mediante el procesamiento de datos empleando GelAnalyzer fue posible estimar los factores de retardo de los componentes del perfil de triglicéridos, que a su vez hace posible la obtención de gráficas y áreas bajo la curva de cada banda.
Agradecimientos
Agradecemos al Consejo Nacional de Ciencia y Tecnología (CONACYT) por el apoyo otorgado a través de la beca de posgrado número 574902. Al maestro Enrique Ramírez Chaves por su apoyo en el laboratorio y a los doctores Pablo Carrillo y Eduardo Ruiz por su ayuda en la identificación y colecta de material vegetal.
REFERENCIAS
Adepoju, G. K. A., & Adebanjo, A. A. (2011). Effect of consumption of Cucurbita pepo seeds on haematological and biochemical parameters. African Journal of Pharmacy and Pharmacology, 5(1), 18‒22. doi: 10.5897/AJPP10.186 [ Links ]
Adewuyi, A., & Oderinde, R. A. (2012). Analysis of the lipids and molecular speciation of the triacylglycerol of the oils of Luffa cylindrica and Adenopus breviflorus. CyTA-Journal of Food, 10(4), 313‒320. doi: 10.1080/19476337.2012.658870 [ Links ]
Akintayo, C. O., Akintayo, E. T., Akinsola, A., & Ziegler, T. (2009). Matrix-Assisted Laser Desorption Ionization time of flight mass spectrometric analysis of some curcurbita oils for triacylglycerol composition. Rivista Italiana Delle Sostanze Grasse, 86(4), 237‒241. Retrieved from https://www.researchgate.net/publication/236271716 [ Links ]
Ali, M. A., Nargis, A., Othman, N. H., Noor, A. F., Sadik, G., & Hossen, J. (2017). Oxidation stability and compositional characteristics of oils from microwave roasted pumpkin seeds during thermal oxidation. International Journal of Food Properties, 20(11), 2569‒2580. doi: 10.1080/10942912.2016.1244544 [ Links ]
Arslan, F. N., Gönül, A. K., & Yilmaz, İ. (2017). Physicochemical characteristics, pesticide residue and aflatoxin contamination of cold pressed pumpkin seed (Cucurbita pepo l.) oils from central Anatolia region of Turkey. Anadolu University Journal of Science and Technology A-Applied Sciences and Engineering, 18(2), 468‒483. doi: 10.18038/aubtda.286649 [ Links ]
Azimova, S. S., Glushenkova, A. I., & Vinogradova, V. I. (2011). Lipids, lipophilic components, and essential oils from plant sources. London: Springer. doi: 10.1007/978-0-85729-323-7 [ Links ]
Báez-Pérez, E., Quiñones-Gálvez, J., Santiesteban-Toca, C., & Molina-Torres, J. (2017). Sistema de análisis de imágenes de placas de HPTLC. Revista Cubana de Ciencias informáticas, 11(3), 92‒104. Retrieved from http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S2227-18992017000300008&lng=es&tlng=es [ Links ]
Bardaa, S., Halima, N. B., Aloui, F., Mansour, R. B., Jabeur, H., Bouaziz, M., & Sahnoun, Z. (2016). Oil from pumpkin (Cucurbita pepo L.) seeds: evaluation of its functional properties on wound healing in rats. Lipids in Health and Disease, 15(1), 1‒12. doi: 10.1186/s12944-016-0237-0 [ Links ]
Barrera-Redondo, J., Sanchez-de La Vega, G., Aguirre-Liguori, J. A., Castellanos-Morales, G., Gutiérrez-Guerrero, Y. T., Aguirre-Dugua, X.,... Eguiarte, L. E. (2021). The domestication of Cucurbita argyrosperma as revealed by the genome of its wild relative. Horticulture Research, 8, 109. doi: 10.1038/s41438-021-00544-9 [ Links ]
Benalia, M., Djeridane, A., Gourine, N., Nia, S., Ajandouz, E., & Yousfi, M. (2015). Fatty acid profile, tocopherols content and antioxidant activity of algerian pumpkin seeds oil (Cucurbita pepo L.). Mediterranean Journal of Nutrition and Metabolism, 8(1), 9‒25. doi: 10.3233/MNM-140023 [ Links ]
Beneito, C. M., Moreno, G. D., García, R. F., Bouza, M., Gilbert, L. B., & Molina, D. A. (2020). Direct analysis of olive oil and other vegetable oils by mass spectrometry: a review. TrAC Trends in Analytical Chemistry, 132, 116046. doi: 10.1016/j.trac.2020.116046 [ Links ]
Bouazzaoui, N., & Mulengi, J. K. (2018). Fatty acids and mineral composition of melon (Cucumis melo) and pumpkin (Cucurbita moschata) seeds. Journal of Herbs, Spices & Medicinal Plants, 24(4), 315‒322. doi: 10.1080/10496475.2018.1485125 [ Links ]
Cañigueral, S., Frommenwiler, D., Reich, E., & Vila, R. (2018). High performance thin-layer chromatography (HPTLC) in the quality control of herbal products. In D. Muñoz-Torrero, Y. Cajal, & J. Llobet (Eds.), Recent advances in pharmaceutical sciences VIII (pp. 119‒136). Kerala, India: Research Signpost. Retrieved from http://hdl.handle.net/2445/128014 [ Links ]
Cherif, A. O., Leveque, N., Messaouda, M. B., Kallel, H., Tchapla, A., & Moussa, F. (2014). NARP-HPLC/MS5 and silver cationization fingerprinting of triacylglycerols in wild and cultivar Tunisian peanut kernels. LWT-Food Science and Technology, 57(1), 236‒242. doi: 10.1016/j.lwt.2014.01.031 [ Links ]
Contreras-Gallegos, E., Domínguez-Pacheco, F. A., Hernández-Aguilar, C., Salazar-Montoya, J. A., Ramos-Ramírez, E. G., & Cruz-Orea, A. (2017). Calor específico de los aceites vegetales en función de la temperatura obtenido por calorimetría de barrido adiabático. Revista de Análisis Térmico y Calorimetría, 128(1), 523‒531. doi: 10.1007/s10973-016-5864-1 [ Links ]
Cossignani, L., Pollini, L., & Blasi, F. (2019). Invited review: Authentication of milk by direct and indirect analysis of triacylglycerol molecular species. Journal of Dairy Science, 102(7), 5871‒5882. doi: 10.3168/jds.2019-16318 [ Links ]
Eder, K. (1995). Gas chromatographic analysis of fatty acid methyl esters. Journal of Chromatography B, 671(1-2), 113-131. doi: 10.1016/0378-4347(95)00142-6 [ Links ]
Council of Europe, European Pharmacopoeia Commission, European Directorate for the Quality of Medicines & Healthcare. (2010). European Pharmacopoeia (7th ed.). [ Links ]
European Pharmacopoeia Commission. (2011). Identification of fatty oils by thin-layer chromatography. France: Ed. Strasbourg. Retrieved from https://file.wuxuwang.com/yaopinbz/EP8.0_1_00072.pdf [ Links ]
Facciotti, D., & Knauf, V. (1998). Triglycerides as products of photosynthesis. Genetic engineering, fatty acid composition and structure of triglycerides. In P. A. Siegenthaler, & N. Murata (Eds.), Lipids in photosynthesis: structure, function and genetics (pp. 225‒248). Dordrecht: Springer. doi: 10.1007/0-306-48087-5_12 [ Links ]
Fedko, M., Kmiecik, D., Siger, A., Kulczyński, B., Przeor, M., & Kobus-Cisowska, J. (2020). Comparative characteristics of oil composition in seeds of 31 Cucurbita varieties. Journal of Food Measurement and Characterization, 14(2), 894‒904. doi: 10.1007/s11694-019-00339-6 [ Links ]
Gao, B., Luo, Y., Lu, W., Liu, J., Zhang, Y., & Yu, L. L. (2017). Triacylglycerol compositions of sunflower, corn and soybean oils examined with supercritical CO2 ultra-performance convergence chromatography combined with quadrupole time-of-flight mass spectrometry. Food Chemistry, 218, 569‒574. doi: 10.1016/j.foodchem.2016.09.099 [ Links ]
Lazar Jr., I., & Lazar, I. (2019). GelAnalyzer 19.1 Free desktop app for 1D gel electrophoresis evaluation. Retrieved from http://www.gelanalyzer.com [ Links ]
Hernández, C. F., Hernández, G. M., López, H. Y., López, T. R., Zamudio, F. P., Ochoa, R. E.,... Martínez, V. D. (2020). Changes in oxidative stability, composition and physical characteristics of oil from a non-conventional source before and after processing. Revista Mexicana de Ingeniería Química, 19(3), 1389‒1400. doi: 10.24275/rmiq/Alim937 [ Links ]
Jakab, A., Héberger, K., & Forgács, E. (2002). Comparative analysis of different plant oils by high-performance liquid chromatography-atmospheric pressure chemical ionization mass spectrometry. Journal of Chromatography A, 976(1-2), 255‒263. doi: 10.1016/S0021-9673(02)01233-5 [ Links ]
Kamal‐Eldin, A., Yousif, G., Iskander, G. M., & Appelqvist, L. Å. (1992). Seed lipids of Sesamum indicum L. and related wild species in Sudan I: Fatty acids and triacylglycerols. Lipid/Fett, 94(7), 254‒259. doi: 10.1002/lipi.19920940705 [ Links ]
Li, Y., Yuan, F., Wu, Y., Zhang, Y., Gao, B., & Yu, L. (2020). Triacylglycerols and fatty acid compositions of cucumber, tomato, pumpkin, and carrot seed oils by ultra-performance convergence chromatography combined with quadrupole time-of-flight mass spectrometry. Foods, 9(8), 970. doi:10.3390/foods9080970 [ Links ]
Lira, R. (2001). Cucurbitaceae. In G. C. de Rzedowski & J. Rzedowski (Eds.), Flora del Bajío y de regiones adyacentes. Fascículo 92. Pátzcuaro, Michoacán, México: Instituto de Ecología-Centro Regional del Bajío. Consejo Nacional de Ciencia y Tecnología y Comisión Nacional para el Conocimiento y Uso de la Biodiversidad. Retrieved from http://www1.inecol.edu.mx/publicaciones/resumeness/FLOBA/Flora%2092.pdf [ Links ]
Lira, R., Eguiarte, L., Montes, S., Zizumbo-Villarreal, D., Marín, P. C. G., & Quesada, M. (2016). Homo sapiens-Cucurbita interaction in Mesoamerica: Domestication, Dissemination, and Diversification. In R. Lira, A. Casas, & J. Blancas, (Eds.), Ethnobotany of Mexico (pp. 389‒401). New York, USA: Springer. doi: 10.1007/978-1-4614-6669-7_15 [ Links ]
Montesano, D., Blasi, F., Simonetti, M. S., Santini, A., & Cossignani, L. (2018). Chemical and nutritional characterization of seed oil from Cucurbita maxima L. (var. Berrettina) pumpkin. Foods, 7(3), 30. doi: 10.3390/foods7030030 [ Links ]
Naik, A. V., & Sellappan, K. (2020). Chromatographic fingerprint of essential oils in plant organs of Annona muricata L. (Annonaceae) using HPTLC. Analytical Chemistry Letters, 10(2), 214‒226. doi: 10.1080/22297928.2020.1763197 [ Links ]
Neđeral, S., Škevin, D., Kraljić, K., Obranović, M., Papeša, S., & Bataljaku, A. (2012). Chemical composition and oxidative stability of roasted and cold pressed pumpkin seed oils. Journal of the American Oil Chemists' Society, 89(9), 1763‒1770. doi: 10.1007/s11746-012-2076-0 [ Links ]
Nehdi, I. (2011). Characteristics, chemical composition and utilisation of Albizia julibrissin seed oil. Industrial Crops and Products, 33(1), 30‒34. doi: 10.1016/j.indcrop.2010.08.004 [ Links ]
Pagliuca, G., Bozzi, C., Gallo, F. R., Multari, G., Palazzino, G., Porrà, R., & Panusa, A. (2018). Triacylglycerol “hand-shape profile” of Argan oil. Rapid and simple UHPLC-PDA-ESI-TOF/MS and HPTLC methods to detect counterfeit Argan oil and Argan-oil-based products. Journal of Pharmaceutical and Biomedical Analysis, 150, 121‒131. doi: 10.1016/j.jpba.2017.11.059 [ Links ]
Rezig, L., Chouaibi, M., Msaada, K., & Hamdi, S. (2012). Chemical composition and profile characterisation of pumpkin (Cucurbita maxima) seed oil. Industrial Crops and Products, 37(1), 82‒87. doi: 10.1016/j.indcrop.2011.12.004 [ Links ]
Ríos-Santos, E., González-Santos, R., Cadena-Iñiguez, J., & Mera-Ovando, L. (2018). Distribución de las especies cultivadas y parientes silvestres de calabaza (Cucurbita L.) en México. AGROProductividad, 11(9), 21‒28. Retrieved from https://revista-agroproductividad.org/index.php/agroproductividad/article/view/1210/983 [ Links ]
Ruiz, S. C., González, C. A., & Cuadros, R. L., (2015). Triacylglycerols determination by high-temperature gas chromatography in the analysis of vegetable oils and foods: a review of the past 10 years. Critical Reviews in Food Science and Nutrition, 55(11), 1618‒1631. doi: 10.1080/10408398.2012.713045 [ Links ]
Salas, J. J., Bootello, M. A., & Garcés, R. (2015). Food uses of sunflower oils. In E. Martínez-Force, N. T. Dunford, & J. J. Salas (Eds.), Sunflower: Chemistry, production, processing, and utilization (pp. 441‒464). Elsevier. doi: 10.1016/C2015-0-00069-7 [ Links ]
Yoshida, H., Shougaki, Y., Hirakawa, Y., Tomiyama, Y., & Mizushina, Y. (2004). Lipid classes, fatty acid composition and triacylglycerol molecular species in the kernels of pumpkin (Cucurbita spp.) seeds. Journal of the Science of Food and Agriculture, 84(2), 158‒163. doi: 10.1002/jsfa.1623 [ Links ]
Zeb, A. (2012). Triacylglycerols composition, oxidation and oxidation compounds in camellia oil using liquid chromatography-mass spectrometry.Chemistry and Physics of Lipids,165(5), 608‒614. doi: 10.1016/j.chemphyslip.2012.03.004 [ Links ]
Zeb, A., & Ahmad, S. (2017). Changes in acylglycerols composition, quality characteristics and in vivo effects of dietary pumpkin seed oil upon thermal oxidation.Frontiers in Chemistry, 5(55), 1‒9. doi: 10.3389/fchem.2017.00055 [ Links ]
Recibido: 04 de Octubre de 2021; Aprobado: 21 de Junio de 2022











 text in
text in 


